美藤果粕多肽的提取工艺优化
2023-10-24赖玉萍林锦铭安苗青陈颖仪杜冰黎攀
赖玉萍,林锦铭,安苗青,陈颖仪,杜冰,黎攀
(华南农业大学 食品学院,广东 广州 510642)
美藤果(Plukenetia volubilis Linneo) 又名南美油藤、星油藤、印加花生、印奇果,属大戟科多年生木质含油攀援植物,原产于南美洲安第斯山脉的热带雨林地区,长期作为传统食物被土著居民群体以煮熟和烘烤的形式食用[1]。我国云南普洱、西双版纳等地在2006年开始引进种植美藤果,种植规模现已达3 300 多公顷[2-3]。美藤果仁中含有丰富的营养成分,其中含油量30%~60%,蛋白质含量26%~33%,碳水化合物含量12.1%~13.4%,可制得美藤果油和高蛋白食品[4-8]。美藤果粕则是美藤果种仁低温压榨提油后的副产物,其富含亮氨酸、色氨酸、缬氨酸等人体必需氨基酸,营养价值高,但这些蛋白质资源目前多数用于动物饲料加工、肥料加工或者被直接废弃,没有得到有效利用,造成了严重浪费[3,9-10]。
许多研究表明,植物加工的副产物是重要的蛋白来源,但因一些动物源性的蛋白来源易携带病毒或致敏物质,所以植物源性的副产品蛋白来源更有望成为增值成分,添加到食品中[11]。在蛋白提取方法中,酶辅助提取法更受青睐。这是因为在酶辅助提取过程中,其提取的条件较温和、操作较简单[12]。其次,在副产物中蛋白质常与淀粉、纤维素、果胶以及细胞中的脂质共存,而酶辅助提取有利于蛋白质以可溶性形式从内部细胞区室释放出来,提高蛋白质的提取率[11]。此外,该法还可提取因酸/碱水解而被破坏的氨基酸,如谷氨酰胺和天冬酰胺等[13]。有研究发现,采用碱性-中性蛋白酶复合提取的美藤果蛋白水解物具有良好的体外抗氧化和抗高血压特性[14]。但从美藤果粕中提取多肽鲜有研究。因此,本文以美藤果粕为主要原料,采用高温蒸煮结合酶解法优化美藤果粕多肽提取工艺,并对最佳工艺参数下制备的美藤果粕多肽进行氨基酸组成和分子量分析,丰富对美藤果粕多肽的认识,为美藤果粕多肽的酶法制备和应用研究提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
美藤果粕:普洱联众生物资源开发有限公司;碱性蛋白酶(1 600 AU/g)、中性蛋白酶(1 600 AU/g):广州柏棠贸易有限公司;甲醛(分析纯):广州化学试剂厂;茚三酮(分析纯):济宁宏明化学试剂有限公司;柠檬酸钠、氢氧化钠(均为分析纯):天津市大茂化学试剂厂;三氟乙酸(trifluoroacetic acid,TFA)(分析纯):上海安谱实验科技股份有限公司;乙腈(色谱纯):德国默克集团。
1.1.2 仪器与设备
恒温加热磁力搅拌器(DF-101S):郑州长城科工贸有限公司;旋转蒸发仪(RE-5298)、循环真空水泵(SHZ-Ⅲ):上海亚荣生化仪器厂;数显恒温水浴锅(HH-8):金坛市富华仪器有限公司;低速离心机(ANKE TDL-5-A):上海安亭科学仪器有限公司;微量紫外分光光度计(Nano Drop)、高效液相色谱仪(LC-20AT):日本岛津公司;全自动凯氏定氮仪(SDK-1000):上海沛欧分析仪器有限公司;紫外分光光度计(UV759):上海精密科学仪器有限公司;全自动氨基酸测定仪(A300):德国曼默博尔公司;冷冻干燥机(ALPHA 2-4 LDplus):德国CHRIST 公司;低温高速离心机(Microfuge 22R):美国Beckman Coulter 公司。
1.2 试验方法
1.2.1 美藤果粕多肽的制备
称取20.0 g 美藤果粕,按液料比20∶1(mL/g)于95 ℃水浴锅蒸煮6 h,冷却后加入0.75%碱性蛋白酶和0.25%中性蛋白酶,并将pH 值调至8.5 后,置于恒温加热磁力搅拌器中55 ℃酶解6 h,95 ℃高温灭酶15 min,冷却后于离心机4 000 r/min 离心15 min ,取上清液并在55 ℃下真空浓缩,最后经真空冷冻干燥,即得美藤果粕多肽。
1.2.2 高温蒸煮结合酶法制备美藤果多肽工艺优化
1.2.2.1 单因素试验
称取20.0 g 美藤果粕,以液料比15∶1(mL/g)、蒸煮时间9 h、酶添加量1.5%、酶解温度50 ℃和酶解时间6 h 为基准条件,固定其他因素和对应水平条件,以水解度(degree of hydrolysis,DH)为指标,分别考察不同液料比[5∶1、10∶1、15∶1、20∶1、25∶1(mL/g)]、蒸煮时间(3、6、9、12、15 h)、酶添加量(0.5%、1.0%、1.5%、2.0%、2.5%,碱性蛋白酶与中性蛋白酶体积比为3∶1)、酶解时间(2、4、6、8、10 h)和酶解温度(40、45、50、55、60 ℃)对美藤果粕多肽水解度的影响。
1.2.2.2 响应面优化
在单因素结果基础上,采用响应面试验优化制备工艺,响应面法试验因素与水平编码见表1。

表1 响应面优化因素与水平Table 1 Factors and levels of the response surface optimization
1.2.2.3 多肽水解度的测定
参考贾靖霖等[15]的方法,略作修改。吸取10 mL 水解液用容量瓶定容至50 mL,吸取定容后的样液5 mL于烧杯中,加入75 mL 蒸馏水,置于磁力搅拌器不断搅拌,用NaOH 溶液先将其pH 值调至8.2,然后加入10 mL甲醛溶液混匀,再用0.025 mol/L 的NaOH 溶液将pH 值滴定至9.2,记此时消耗的NaOH 溶液体积为V1。空白对照组则直接吸取80 mL 蒸馏水,其余按上述步骤操作,记此时消耗的NaOH 溶液体积为V2。水解度(D,%)计算公式如下。
式中:hNH2为水解后氨基态氮浓度,mmol/g;V1为样品组消耗NaOH 溶液体积,mL;V2为空白对照组消耗NaOH 溶液体积,mL;c 为NaOH 溶液实际摩尔浓度,mol/mL;V 为待测样液体积,mL;m 为样品蛋白质质量,g。
式中:Mt为肽键毫摩尔数,mmol;ma为氨基酸含量,g;Mr为氨基酸相对分子质量,g/mmol;MT为总肽键毫摩尔数,mmol;Mp为蛋白质含量,g;h0为水解前氨基态氮浓度,mmol/g;htot为底物中肽键浓度,mmol/g。
1.2.3 多肽氨基酸组成分析
参考GB 5009.124—2016《食品安全国家标准食品中氨基酸的测定》中方法,略作修改。将多肽酸水解成游离氨基酸,经全自动氨基酸测定仪分离后与茚三酮溶液反应,再经比色法测定氨基酸含量。精确称取20~30 mg 美藤果粕多肽,加入10 mL 6 mol/L 的盐酸并通氮气,持续2 min,然后在110 ℃下水解22 h。放置常温后过滤,取1 mL 于60 ℃水浴烘干,再加入1 mL 蒸馏水继续烘干,重复两次后于4 ℃冰箱保存待测。测定时加入4 mL 上机溶剂充分溶解样品,用0.22 μm 滤膜过滤后,取其中1.5 mL 与1 mL 上机溶剂混匀后即可测定。流动相:柠檬酸钠A(0.12 mol/L,pH3.45);B(0.2 mol/L,pH10.85),色谱柱型号为LCA K06/Na,洗脱泵流速设定为0.45 mL/min,衍生泵流速为0.25 mL/min,进样体积50 μL,采集570 nm 和440 nm 两个波长下的信号,准确定量样品氨基酸。
1.2.4 多肽分子量测定
参考GB/T 22729—2008《海洋鱼低聚肽粉》中描述的方法,稍作改动。利用高效凝胶过滤色谱法进行测定,以标准品重均分子量为纵坐标,相对保留体积为横坐标,绘制标准曲线和回归方程,根据标准曲线y=-0.473 9x+6.966 1,R2=0.998,计算样品相应的分子量。准确称取20 mg 多肽样品于10 mL 容量瓶,用流动相(乙腈∶水∶三氟乙酸体积比为45∶55∶0.1)定容至刻度,充分溶解后,用0.22 μm 滤膜过滤后即可上样,进样体积10 μL,洗脱泵流速设定为0.5 mL/min,色谱柱型号为TSKgel G2000 SWXL 300 mm×7.8 mm,检测波长为220 nm。
1.3 数据处理
每组试验均为3 组平行,用Design-Expert 10.0.7进行响应面试验设计,数据结果采用Origin 9.1、Excel 2016 和GrapPad Primsm 8 等软件进行数据统计分析并作图。
2 结果与分析
2.1 高温蒸煮结合酶法制备美藤果粕多肽工艺优化
2.1.1 液料比对美藤果粕多肽水解度的影响
液料比对美藤果粕多肽水解度的影响如图1 所示。
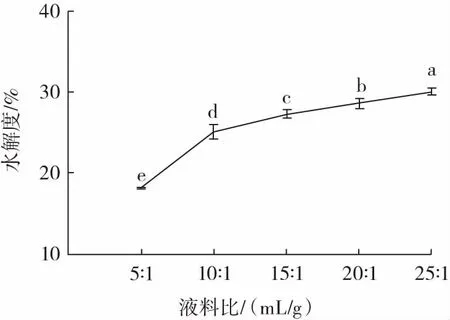
图1 液料比对美藤果粕多肽水解度的影响Fig.1 Effect of feed-to-liquid ratio on the degree of hydrolysis of Plukenetia volubilis Linneo meal peptides
由图1 可知,多肽水解度随溶剂体积的增大而增大,液料比为5∶1~10∶1(mL/g)时,多肽水解度提高了7%,增速最快。随着溶剂体积的继续增加,多肽水解度上升幅度减缓。因为液料比5∶1(mL/g)时,溶液整体较为黏稠,分子扩散速率较低,导致在体系中分散不均匀,美藤果粕蛋白酶切位点与酶的反应不充分,且溶液少,蛋白质易达到饱和状态,不能完全溶解,因此多肽的水解度较低[16]。继续增大溶剂体积,多肽水解度的增幅变小,可能是底物浓度过低,降低了底物与酶的碰撞概率,酶解反应速度降低[17]。因此,基于成本和生产效率的考虑,液料比选择15∶1、20∶1、25∶1(mL/g)进行后续响应面优化试验。
2.1.2 蒸煮时间对美藤果粕多肽水解度的影响
蒸煮时间对美藤果粕多肽水解度的影响如图2所示。
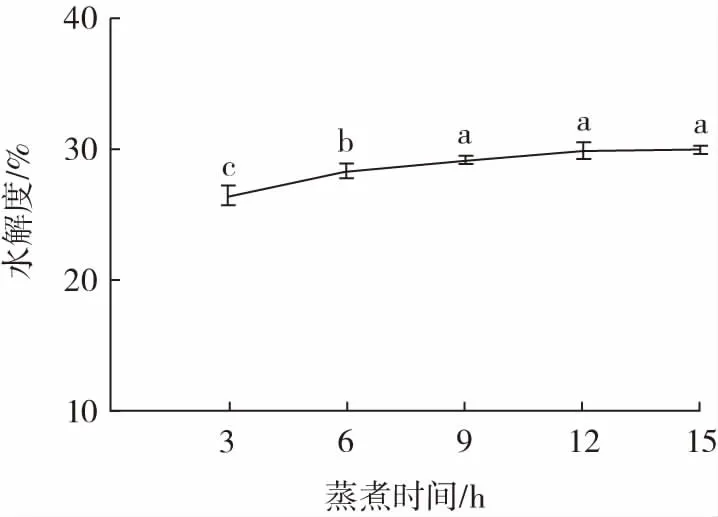
图2 蒸煮时间对美藤果粕多肽水解度的影响Fig.2 Effect of steaming time on the degree of hydrolysis of Plukenetia volubilis Linneo meal peptides
由图2 可知,随着蒸煮时间的延长,多肽水解度逐渐上升。蒸煮时间为6 h 时,美藤果粕蛋白已充分受热变性,暴露出酶切位点,并有利于后续酶解。当蒸煮时间超过6 h 后,多肽水解度趋于稳定。蒸煮会使美藤果粕蛋白发生蛋白质结构变化,天然的三级结构打开,从而暴露出内部的基团,这样有利于后续酶解[18]。综合成本考虑,选择蒸煮时间为6 h。
2.1.3 酶添加量对美藤果粕多肽水解度的影响
酶添加量对美藤果粕多肽水解度的影响如图3所示。
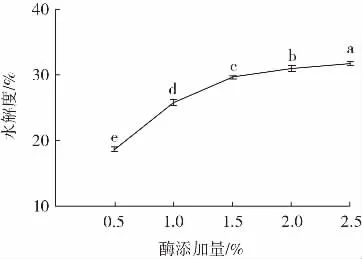
图3 酶添加量对美藤果粕多肽水解度的影响Fig.3 Effect of enzyme addition on the degree of hydrolysis of Plukenetia volubilis Linneo meal peptides
由图3 可知,酶添加量为0.5%~1.5%时,水解度从18%升高到29%,水解度快速升高,而继续增加酶添加量,多肽的水解度上升幅度减缓,最终趋于平缓。碱性蛋白酶和中性蛋白酶均为催化剂,具有不同的酶切位点,而酶添加量增加可提升多肽酶解速率,但酶解底物质量一定,酶切位点是固定的,酶添加量超过一定限度酶的作用达到饱和时,过多的酶不能继续与酶切位点结合,无法提高水解度和水解效率[19]。此外,当酶添加量过高时,可能导致可溶性多肽过度水解,即进一步水解为游离氨基酸;或在有限底物中增加酶添加量导致大分子之间的位阻效应形成了空间障碍抑制了酶促反应的进行[20-21]。综上所述,选择酶添加量为0.5%、1.0%、1.5%进行后续响应面优化试验。
2.1.4 酶解时间对美藤果粕多肽水解度的影响
酶解时间对美藤果粕多肽水解度的影响如图4所示。
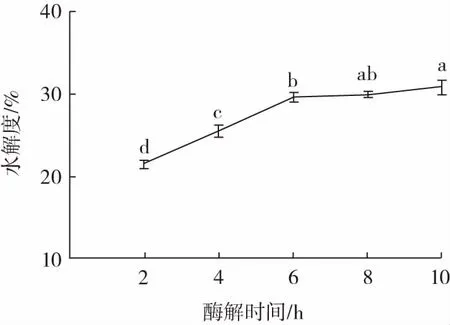
图4 酶解时间对美藤果粕多肽水解度的影响Fig.4 Effect of enzymatic digestion time on the degree of hydrolysis of Plukenetia volubilis Linneo meal peptides
由图4 可知,随着酶解时间延长,水解度逐渐升高。酶解时间为2~6 h 时,水解度从21%升高到30%,其变化速率较快,而继续延长酶解时间,多肽水解度上升幅度减缓。由此表明在酶解6 h 时,酶解已较为充分。当酶解时间继续延长,酶解产物和未酶解蛋白会竞争酶的作用位点,产生竞争性抑制,抑制酶解反应的进行[22-23]。因此,确定酶解时间为6 h。
2.1.5 酶解温度对美藤果粕多肽水解度的影响
酶解温度对美藤果粕多肽水解度的影响如图5所示。
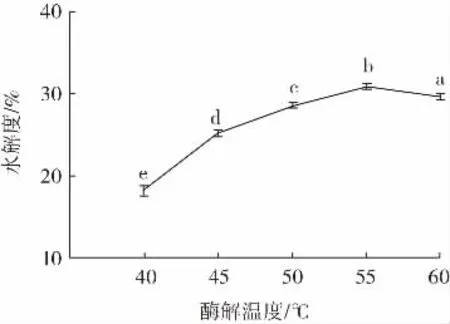
图5 酶解温度对美藤果粕多肽水解度的影响Fig.5 Effect of enzymatic digestion temperature on the degree of hydrolysis of Plukenetia volubilis Linneo meal peptides
由图5 可知,酶解温度对多肽水解度的影响较为明显,随着酶解温度升高,水解度呈现先升高后降低的趋势。酶解温度为40~55 ℃时,水解度从18%升高到31%,差异显著;而酶解温度为60 ℃时,水解度有所降低。原因是温度升高有利于加快体系内分子的扩散运动,而酶有其最佳酶解温度,温度过高和过低都不利于酶解反应。温度从40 ℃逐渐升高到55 ℃,逐渐接近复合酶酶解的最适温度,水解度显著升高,而当温度超过55 ℃时,酶活性受到抑制,酶的二级结构或三级结构遭到破坏,失去活性,不能再作为催化剂以催化反应[24]。因此,选择酶解温度50、55、60 ℃进行后续响应面优化试验。
2.2 响应面试验分析
2.2.1 响应面试验结果
根据单因素试验结果,以水解度为响应值,利用软件Design-Expert 10.0.7 进行三因素三水平响应面设计分析,试验设计和结果如表2 所示。
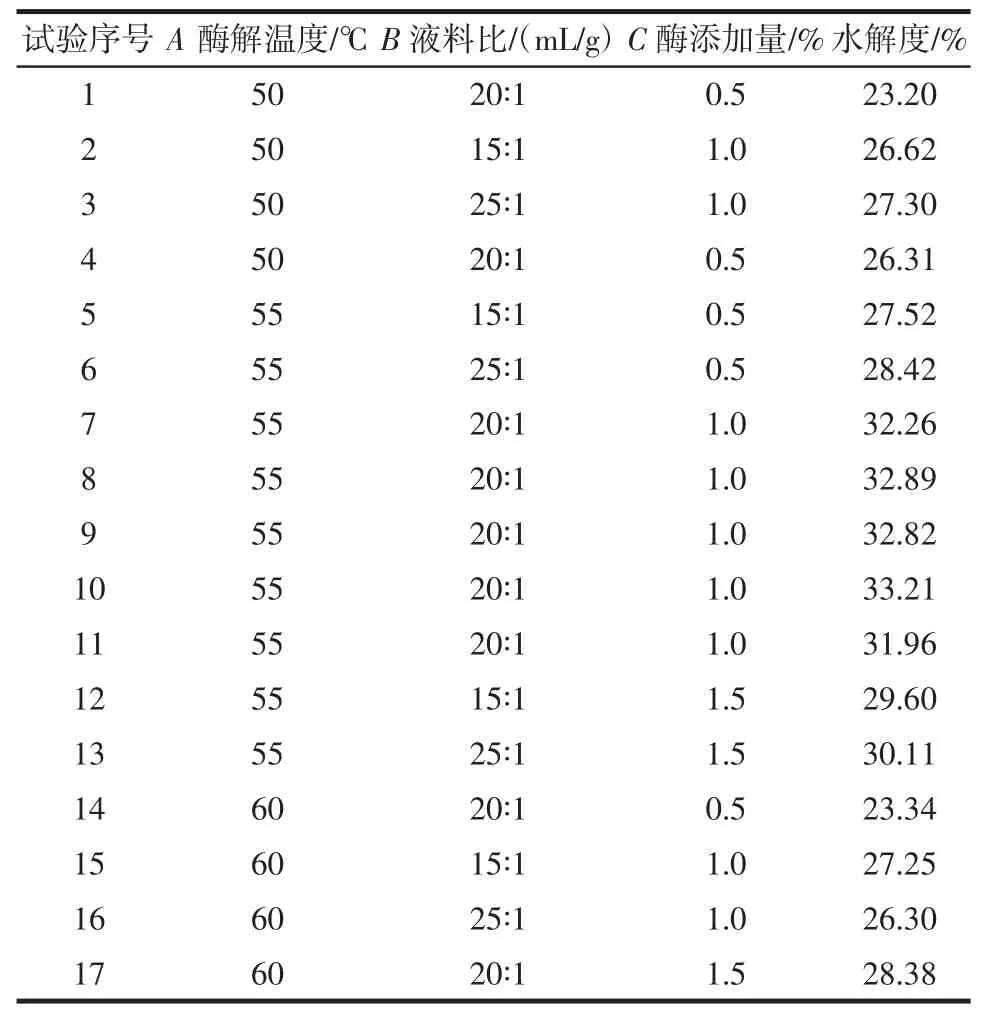
表2 响应面优化试验方案及结果Table 2 Experimental scheme and results of response surface optimization
根据试验结果进行多元拟合回归分析,得到三元二次多项回归方程,模型如下。
Y =32.63 +0.23A +0.14B +1.49C -0.41AB +0.48AC -0.098BC-4.68A2-1.08B2-2.64C2
2.2.2 响应面回归模型方差分析
通过Design-Expert 10.0.7 软件进行方差分析,结果见表3。
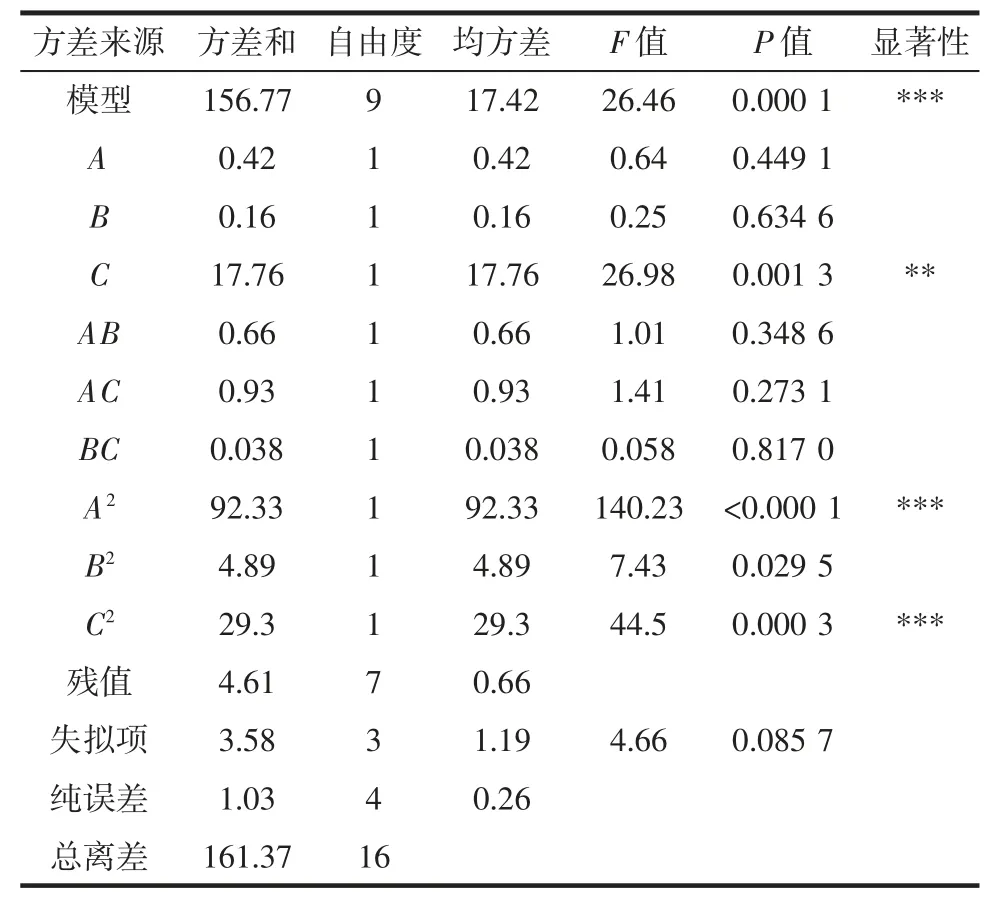
表3 回归模型方差分析Table 3 Analysis of variance of the regression model
由表3 可知,模型F=26.46,P<0.001 表明该回归模型具有统计学意义,可以用该模型分析预测美藤果粕多肽提取方法的结果。失拟项F=4.66,P=0.085 7>0.05,表示失拟项不显著。相关决定系数R2=0.971 4,表明该模型与试验拟合较好,可解释97.14%的响应值变化。酶添加量(C)对多肽水解度有极显著影响(P<0.01);酶解温度(A)、液料比(B)对多肽水解度影响不显著,且三者对多肽水解度影响大小为C>A>B。
2.2.3 响应曲面及等高线分析
根据回归方程绘制各因子交互作用的响应面,所拟合的三维效应图形状能反映因素交互作用对响应值的影响程度,对应的曲线坡度越大、呈椭圆状,且等高线越密集,说明该因素的改变对水解度的影响越大[25]。各因素交互作用响应面图及等高线图见图6~图8。
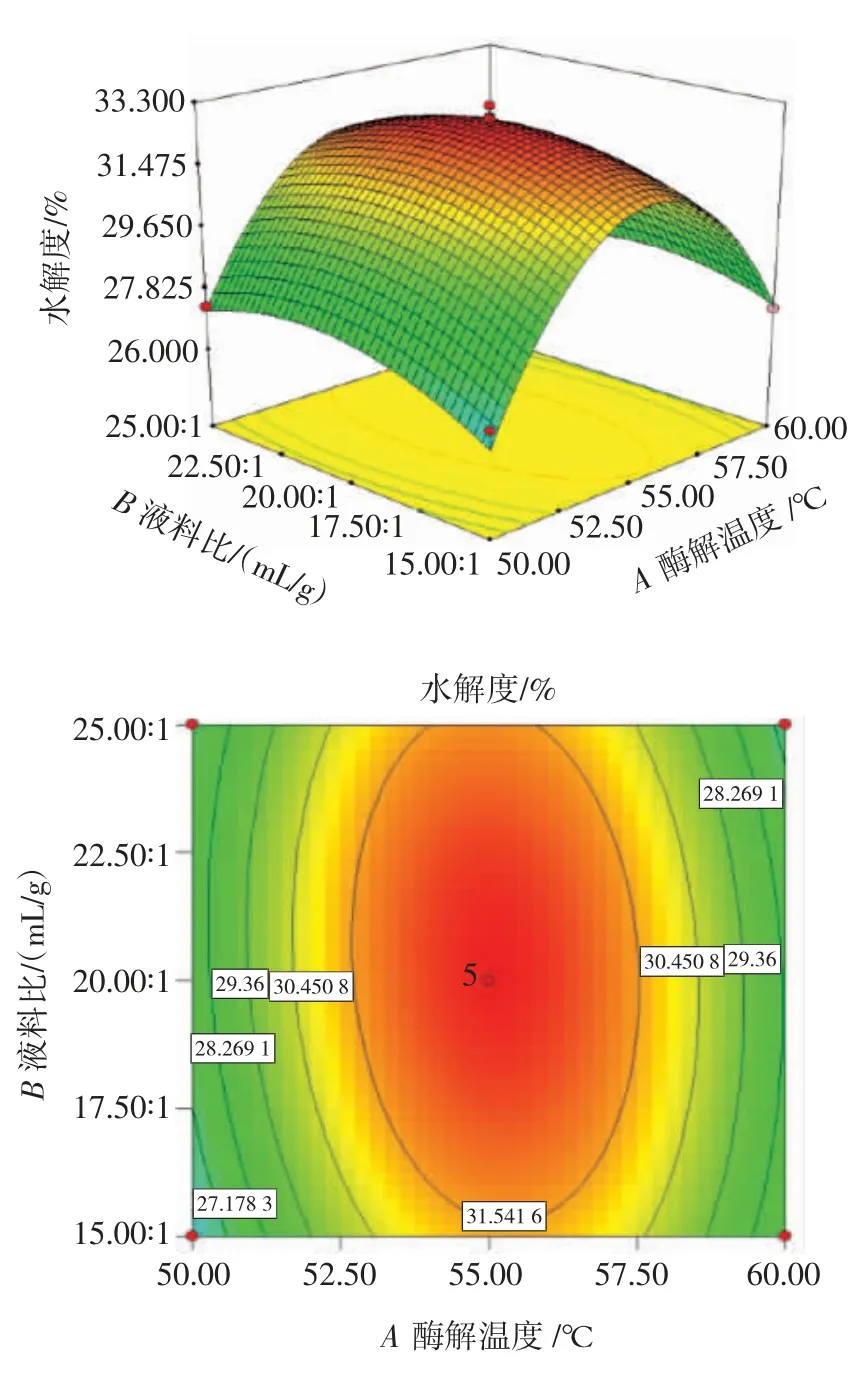
图6 酶解温度和液料比交互作用对水解度的影响Fig.6 Effect of the interaction between enzymolysis temperature and liquid-solid ratio on the degree of hydrolysis
由图6 可知,酶解温度为50~60 ℃,液料比为15∶1~25∶1(mL/g)时,曲面呈椭圆状,且等高线较密集,说明水解度受酶解温度和液料比交互作用影响较显著。由图7 可知,酶解温度和酶添加量交互作用的等高线接近圆形,说明二者交互作用对水解度的影响不显著。由图8 可知,液料比为15∶1~25∶1(mL/g),酶添加量为0.5%~1.5%时,曲面呈现椭圆状,且等高线较为密集,说明水解度受液料比和酶添加量交互作用影响较为显著。
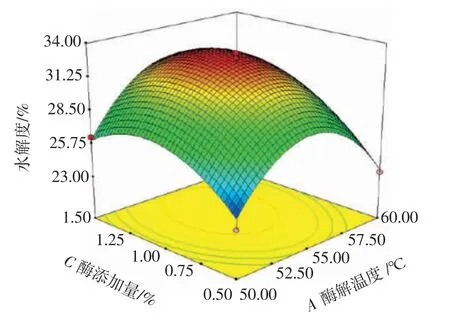
图7 酶添加量和酶解温度交互作用对水解度的影响Fig.7 Effect of interaction between enzyme addition and hydrolysis temperature on the degree of hydrolysis
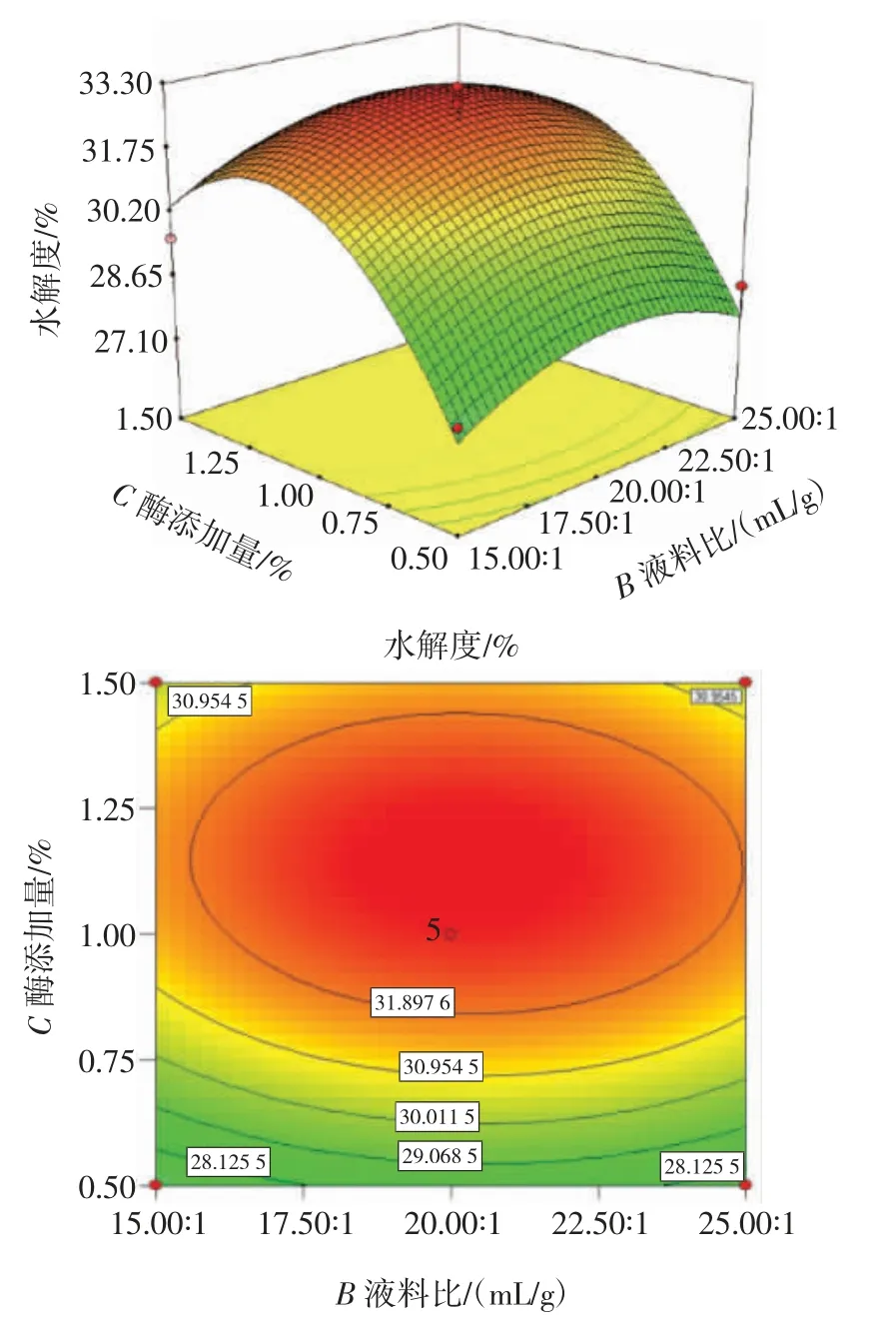
图8 酶添加量和液料比交互作用对水解度的影响Fig.8 Effect of the interaction between enzyme addition and liquid-solid ratio on the degree of hydrolysis
2.2.4 响应面模型验证
经响应面分析,得到美藤果肽酶解最佳工艺为酶解温度55.18 ℃、液料比为20∶1.24(mL/g)、酶添加量为1.14%,此条件下得到最优的水解度为32.8%。考虑到实际操作的可行性,将条件修正为酶解温度55 ℃、液料比为20∶1(mL/g)、酶添加量为1.16%,在此条件下重复试验进行验证,测出的水解度为32.5%,与预期值相差不大,且高于单因素试验中的水解度,说明回归模型拟合度较好,具有可行性。
2.3 美藤果粕多肽氨基酸组成分析
用优化后的工艺参数制备美藤果粕多肽,其氨基酸组成见表4。
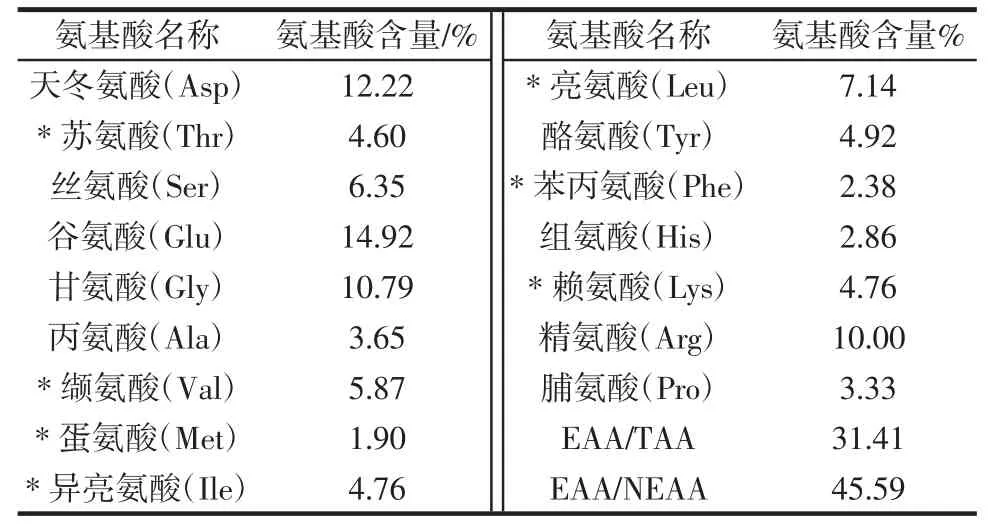
表4 美藤果粕多肽的氨基酸组成Table 4 Amino acid composition of polypeptide from Plukenetia volubilis Linneo meal
由表4 可知,美藤果粕多肽含有16 种氨基酸,其中7 种为人体必需氨基酸。在所测得的16 种氨基酸中,谷氨酸含量最高,达14.92%,其次是天冬氨酸,为12.22%,其中人体必需氨基酸(苏氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、苯丙氨酸和赖氨酸)含量高达31.41%,必需氨基酸与总氨基酸的比值EAA/TAA 为31.41%,必需氨基酸与非必需氨基酸的比值EAA/NEAA 达45.59%,表明生物学价值较高。研究表明,生物活性肽的氨基酸组成与其活性显示一定的相关性,而多肽的抗肿瘤活性与其中的疏水性氨基酸或氨基酸残基有密切联系,比如甘氨酸、脯氨酸、亮氨酸、丙氨酸以及赖氨酸、精氨酸、丝氨酸、谷氨酸、苏氨酸和酪氨酸的一个或多个残基[26]。而美藤果粕多肽中谷氨酸、甘氨酸和精氨酸中含量丰富,分别为14.92%、10.79%和10.00%,且疏水性氨基酸占总氨基酸含量比例较大,由此推测美藤果粕多肽可能具有抗肿瘤活性。
2.4 美藤果粕多肽分子量分布
美藤果粕多肽分子量检测结果如图9 和表5 所示。
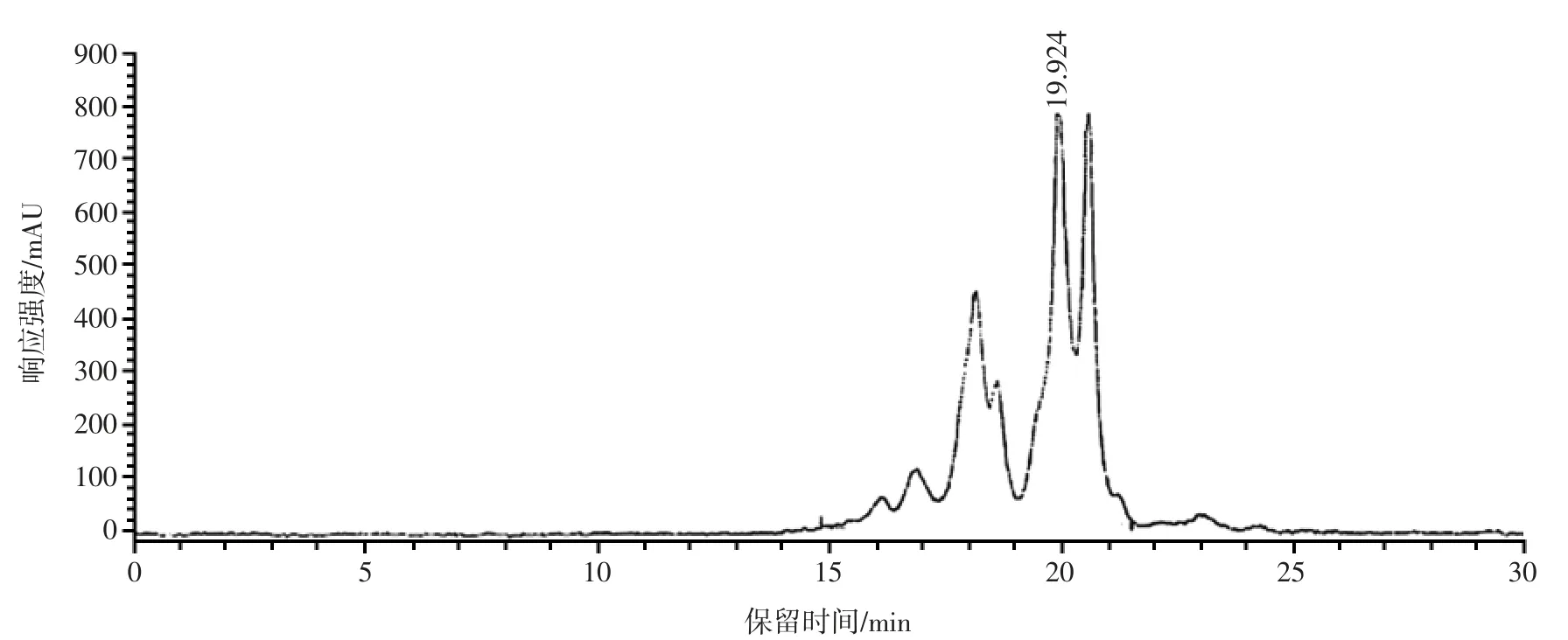
图9 美藤果粕多肽的GPC 图谱Fig.9 GPC map of polypeptide from Plukenetia volubilis Linneo meal
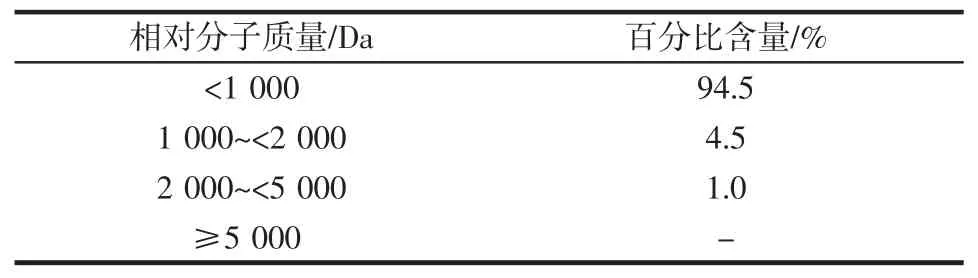
表5 美藤果粕多肽分子量分布Table 5 Molecular weight distribution of polypeptide from Plukenetia volubilis Linneo meal
由图9 和表5 可知,美藤果粕多肽主要由分子量小于1 000 Da 的肽段组成,占比94.5%;而1 000~<2 000 Da和2 000~<5 000 Da 的肽段占比较低,分别为4.5%和1.0%,美藤果粕多肽分子量超过5 000 Da 的肽段未检出。梁钻好等[27]通过超声辅助碱性蛋白酶酶解制备的美藤果肽,其相对分子质量主要集中在小于1 000 Da,占94.64%,与本试验研究结果一致。由此表明,美藤果蛋白经高温蒸煮结合酶解后,大多数被分解成小分子多肽,预测多数肽段为肽链长度小于10 个氨基酸的寡肽。小分子肽能够直接穿过肠道屏障,更容易在消化道中被吸收,发挥生物效应[28]。因此,美藤果粕多肽主要由分子量小于1 000 Da 的肽段组成,属于小分子多肽,可能具有良好的生物活性。
3 结论
本研究通过单因素试验和Box-Behnken 响应面法优化高温蒸煮结合酶法制备美藤果多肽的工艺条件为液料比为20∶1(mL/g)、蒸煮时间6 h、酶解温度55 ℃、酶解时间6 h 和酶添加量1.16%,其水解度为32.5%,其中对多肽水解度的影响程度依次为酶添加量>酶解温度>液料比;制得的多肽94.5%属于小分子肽,其分子量小于1 000 Da,其生理活性和应用还需进一步深入研究。
