水蜜桃多酚的抗氧化、抗菌和抗肿瘤活性评价
2023-10-24张红刚郭尚
张红刚,郭尚
(山西农业大学 山西功能食品研究院,山西 太原 030031)
植物多酚是具有芳香环及羟基取代基的天然化合物的总称,是植物代谢过程中产生的重要的次级产物之一[1-2]。在自然界中许多植物都产生或含有多酚物质,而且多酚的种类非常多。通常将植物多酚分为两大类:类黄酮(如黄酮类、黄酮醇类、异黄酮类、查尔酮类等)和非类黄酮(如芪类、单宁、酚酸类等)[3]。研究发现,植物多酚具有抗氧化、抗菌、抗炎、抗肿瘤、降血脂血糖、改善心脑血管功能等多种生理活性[4-7],在食品、保健、制药等领域得到广泛的应用[8]。
水蜜桃(Pruuus persica) 在我国许多省份都有种植,因其皮薄汁多,鲜甜可口,备受市场欢迎,其花朵、果实、桃仁等都能够入药,在止咳平喘、治疗缺铁性贫血、利尿和抗血凝等方面有疗效[9]。当前关于水蜜桃的研究多集中在采后保鲜技术方面,关于水蜜桃活性功效成分的研究较少。多酚是在植物性食物中发现的,主要存在于蔬果、坚果、大豆、茶、可可、酒类之中。因此开展水蜜桃果实中多酚类物质的研究可以进一步提高水蜜桃综合利用价值和经济附加值。
本研究以水蜜桃为试验材料,研究水蜜桃多酚提取物对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS] 阳离子自由基及O2-自由基的清除能力,并测定水蜜桃多酚的抗菌、抗肿瘤活性,以期为水蜜桃多酚在食品、医药保健领域的应用提供理论基础。
1 材料与方法
1.1 细胞株和菌株
人胃癌细胞SGC-7901:上海弘顺生物科技有限公司;人宫颈癌细胞HeLa:微蒙生物科技(上海)有限公司;金黄色葡萄球菌、链球菌、大肠杆菌、绿脓杆菌、啤酒酵母菌、匍枝根霉菌:中国工业微生物菌种保藏管理中心;改良Eagle 培养基(dulbecco's modification of Eagle's medium,DMEM)、二甲基亚砜(dimethyl sulfoxide,DMSO):孚约生物科技(上海)有限公司;胰蛋白酶(250 U/mg):赛默飞世尔科技(中国)有限公司。
1.2 主要原料、试剂与仪器
新鲜水蜜桃:市售,品种为春蜜。
10%胎牛血清:济南博航生物技术有限公司;RPM-1640 干粉基:赛默飞世尔科技公司;噻唑蓝[3-(4,5 -dimethyl -2 -thiazolyl)-2,5 -diphenyl tetrazolium bromide,MTT]、DPPH、ABTS、三羟甲基氨基甲烷(trometamol,Tris)、盐酸、冰醋酸(均为分析纯):国药集团化学试剂有限公司。
UV755B 分光光度计:上海精密仪器仪表有限公司;HH-S 水浴锅:江苏省金坛市医疗仪器厂;R-200 旋转蒸发仪:步琦实验室设备贸易(上海)有限公司;P190 全温振荡培养箱:北京立信宏达科技有限责任公司;E1x800酶标仪:美国伯腾仪器有限公司;PWT-P75B 恒温培养箱:合肥达斯卡特科学器材有限公司;DW-86L338J 超低温保存箱:青岛海尔生物医疗股份有限公司。
1.3 方法
1.3.1 水蜜桃多酚的提取
将新鲜水蜜桃果实清洗后去核、破碎,用60%乙醇以料液比1:3(g/mL)在55 ℃水浴下提取2 h,再用400 目纱布进行过滤处理,用旋转蒸发仪进行浓缩操作,得到水蜜桃多酚提取液。
1.3.2 DPPH 自由基清除能力测定
按照Chick 等[10]的方法,稍作修改。反应液包括0.2 mL 不同浓度的水蜜桃多酚样品液和0.2 mL 浓度为0.2 mmol/L 的DPPH 溶液,进行有效的搅拌混合后,37 ℃避光状态下持续反应30 min,取反应液并在517 nm 处测定其吸光值。DPPH 自由基清除率(R,%)依据下列公式进行计算。
式中:A样品为待测液与DPPH 溶液的吸光值;A对照为用无水乙醇代替DPPH 溶液的吸光值;A空白为以无水乙醇和DPPH 溶液的吸光值。
1.3.3 ABTS+自由基清除能力测定
依据Sun 等[11]的方法测定ABTS+自由基清除率。ABTS 反应溶液由ABTS 7 mmol/L 和K2S2O82.45 mmol/L配成,在暗处常温下静置16 h 后,在734 nm 调节上述混合液的OD 值为0.7。取0.1 mL 的水蜜桃多酚样品和3.9 mL ABTS 溶液加入试管中,734 nm 处测吸光值记为A样品;对照组是0.1 mL 水蜜桃多酚样品和3.9 mL去离子水混合液,734 nm 处测吸光值记为A对照;空白组是0.1 mL 甲醇溶液和3.9 mL 的ABTS 溶液,734 nm处测吸光值记为A空白。ABTS+自由基清除率(H,%)计算公式如下。
1.3.4 O2-自由基清除能力测定
按照Mvs 等[12]的方法,加3 mL Tris-HCl(50 mmol/L)溶液于试管中,在25 ℃的水浴下静置20 min,加入1 mL 不同浓度的水蜜桃多酚样品溶液和0.2 mL 邻苯三酚溶液(5 mmol/L),搅拌均匀,25 ℃暗处静置5 min,加入1 mL HCl 溶液(8 mmol/L)终止反应,在325 nm 处测定吸光值。超氧阴离子自由基清除率(Q,%)计算公式如下。
式中:A1为蒸馏水取代样品的吸光值;A2为样品的吸光值。
1.3.5 总还原力测定
依据Barreto 等[13]的方法,将1 mL 样品液、2.5 mL 铁氰化钾溶液(0.1 mol/L)、2.5 mL 磷酸盐液(0.2 mol/L),加入同一支试管,然后放入50 ℃水浴锅中持续反应30 min,快速冷却后,加入2.5 mL 三氯乙酸和0.5 mL三氯化铁,测定700 nm 处吸光值。
1.3.6 抗菌活性测定
按照文献[14]的方法,挑取一菌落加入100 mL 营养肉汤中,在全温振荡培养箱中培养12 h,培养后,将菌液浓度调整为105~106CFU/mL。试管编号后,加入3.7 mL营养肉汤,经过20 min、121 ℃高压灭菌后取出冷却,在每支试管中加稀菌液0.3 mL 和样品溶液1 mL,混合均匀,在37 ℃培养24 h,于600 nm 处测定吸光值。空白对照采用1 mL 的无菌水取代对应的多酚。抗菌活性通过抗菌率来反映,抗菌率(B,%)的计算公式如下。
式中:A对照为1 mL 的无菌水取代多酚的待测液吸光值;A样品为样品待测液吸光值。
1.3.7 细胞培养与处理
两类细胞均放入到10%DMEM 中,37 ℃、5% CO2环境下持续培育。选择生长状态较好的人胃癌细胞SGC-7901、人宫颈癌细胞HeLa,对其进行浸泡消化,使用胰蛋白酶完全浸润细胞,直接放入37 ℃的环境中进行消化,消化时间控制在7~10 min,并得到细胞悬液。
1.3.8 MTT 法测定人胃癌细胞SGC-7901、人宫颈癌HeLa 增殖
将培养的细胞浓度调整为1×104个/mL,接种于96 孔培养板,持续培育48 h 之后,加入20 μL 的MTT(5 mg/mL)溶液,培养4 h,然后培养板各孔分别添加150 μL 的DMSO 溶液进行有效溶解。490 nm 波长环境中测试其具体的吸光值,分析获得相应增殖抑制率(Z,%),具体公式如下。
式中:A样品为待测样品吸光值;A对照为未加入细胞液的MTT 和DMSO 的混合液吸光值。
1.4 数据处理
使用IBM SPSS 20.0.0 软件对数据进行统计分析,采用origin 2019b 软件对数据进行处理。
2 结果与分析
2.1 体外自由基清除能力
2.1.1 水蜜桃多酚提取物对DPPH 自由基的清除能力
水蜜桃多酚提取物对DPPH 自由基的清除能力见图1。
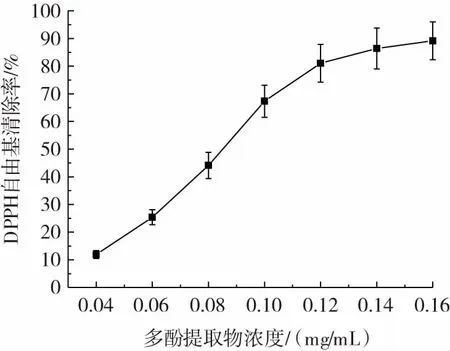
图1 水蜜桃多酚提取物对DPPH 自由基的清除能力Fig.1 DPPH·scavenging rate of polyphenol extract of honey peach
DPPH 在有机溶剂中是一种稳定的自由基,其醇溶液呈紫色,自由基清除剂处理后,DPPH 醇溶液的紫色会逐渐改变为稳定状态的黄色,它的颜色变化程度与接受的电子数量呈正比[15]。
由图1 可知,随着水蜜桃多酚提取物的浓度从0.04 mg/mL 增加至0.12 mg/mL,DPPH 自由基清除率从最初的(11.93±1.42)%提升至(81.04±6.81)%。之后变化趋缓,多酚提取物浓度为0.14 mg/mL 与0.16 mg/mL条件下,DPPH 自由基清除率相差不大。多酚提取物浓度为0.16mg/mL时,DPPH 自由基清除率为(89.14±6.82)%。
2.1.2 水蜜桃多酚提取物对ABTS+自由基的清除率
水蜜桃多酚提取物对ABTS+自由基的清除率见图2。
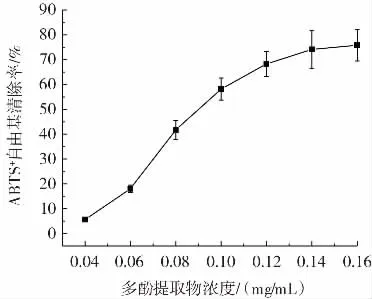
图2 水蜜桃多酚提取物对ABTS+自由基的清除率Fig.2 ABTS+·scavenging rate of polyphenol extract of honey peach
ABTS 法操作简单且有着良好的重复性结果,所以被广泛用于天然抗氧化剂的体外抗氧化活力的评估[16]。从图2 可以看出,随着水蜜桃多酚提取物的浓度从0.04 mg/mL 增加至0.12 mg/mL,ABTS+自由基清除率从(5.63±0.61)%迅速增长至(68.29±5.06)%。之后,ABTS+自由基清除率增加缓慢,在水蜜桃多酚提取物浓度为0.16 mg/mL 时,ABTS+自由基清除率为(75.83±6.36)%。
2.1.3 水蜜桃多酚提取物对O2-自由基的清除率
水蜜桃多酚提取物对O2-自由基的清除率见图3。
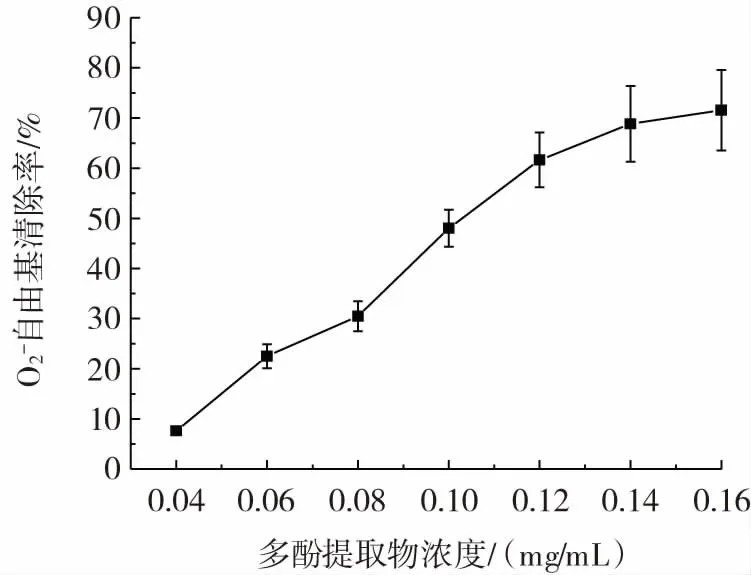
图3 水蜜桃多酚提取物对O2-自由基的清除率Fig.3 O2-·scavenging rate of polyphenol extract of honey peach
O2-自由基能在生物体内产生,过多积聚则会引起生物体内脂质过氧化,从而诱发各种疾病,破坏生物的正常新陈代谢[17]。从图3 能够发现水蜜桃多酚提取物浓度从0.04 mg/mL 增加至0.12 mg/mL 时,对于O2-自由基的清除率,从(7.61±0.69)%增长到(61.64±5.47)%。之后,O2-自由基清除率增加趋势减缓。在多酚提取物浓度为0.16 mg/mL 时,O2-自由基清除率为(71.55±8.04)%。
2.1.4 水蜜桃多酚提取物的总还原力
水蜜桃多酚提取物的总还原力见图4。
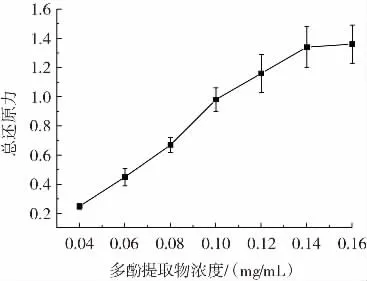
图4 水蜜桃多酚提取物的总还原力Fig.4 Total reducing power of polyphenol extract of honey peach
如图4 所示,水蜜桃多酚提取物的总还原力随浓度的增加而增大,其浓度从0.04 mg/mL 增加至0.14 mg/mL,多酚提取物的还原力从0.25±0.02 迅速增长到1.36±0.13。之后,总还原力增加趋于稳定,在水蜜桃多酚提取物浓度为0.16 mg/mL 时,总还原力为1.36±0.13。
2.2 体外抗菌活性
水蜜桃多酚提取物的体外抗菌活性见表1。
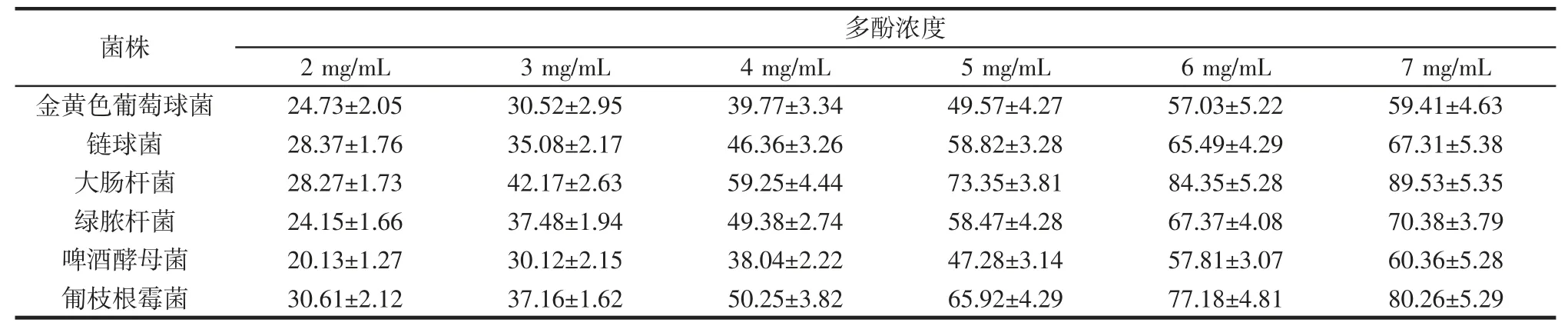
表1 水蜜桃多酚提取物的体外抗菌活性Table 1 In vitro antibacterial activity effect of polyphenol extract of honey peach%
由表1 可以看出,水蜜桃多酚提取物对6 种菌生长都有抑制效果。多酚样品对匍枝根霉菌和大肠杆菌的抑菌活性最高。当多酚浓度为7 mg/mL 时,抗菌活性分别达(80.26±5.29)%和(89.53±5.35)%。其次为绿脓杆菌、链球菌,当多酚浓度为7 mg/mL 时,抗菌率分别达(70.38±3.79)%和(67.31±5.38)%。水蜜桃多酚样品对啤酒酵母菌和金黄色葡萄球菌的抑制率相对较弱,当多酚浓度为7 mg/mL 时,抗菌率分别达(60.36±5.28)%和(59.41±4.63)%。结果表明,水蜜桃多酚提取物有一定的抗菌作用。
2.3 体外抗肿瘤活力
水蜜桃多酚提取物的抗肿瘤活力见图5。
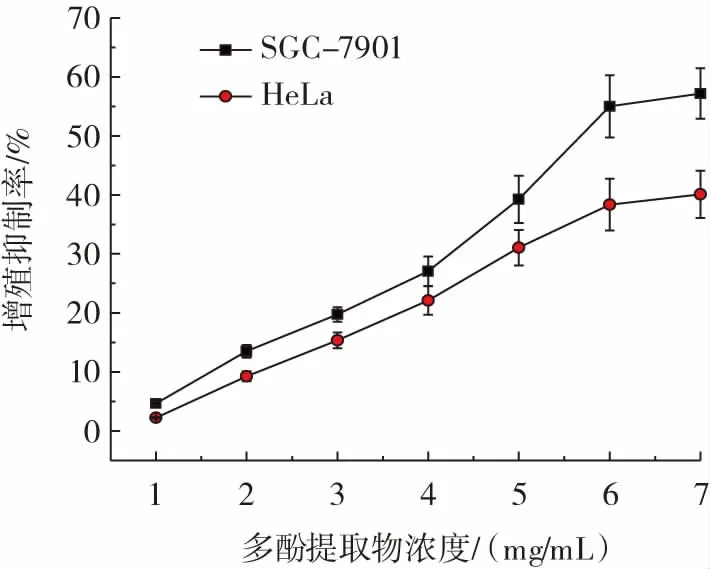
图5 水蜜桃多酚提取物的体外抗肿瘤活力Fig.5 In vitro anti-tumor activity of peach polyphenol samples
由图5 可知,水蜜桃多酚提取物对人胃癌细胞SGC-7901 的增殖抑制率随多酚提取物浓度增加而增强,当多酚提取物浓度为7 mg/mL 时,对人胃癌细胞SGC-7901 的增殖抑制率为(57.20±4.28)%;对于人宫颈癌细胞HeLa 抑制率,同样表现为随着多酚提取物浓度提升而不断增强,当多酚提取物浓度为7 mg/mL时,对人宫颈癌细胞HeLa 增殖抑制率为(40.11±3.99)%。通过对两组数据进行比较,水蜜桃多酚提取物对人胃癌细胞SGC-7901 的增殖抑制效果比对人宫颈癌细胞HeLa 更优。据此水蜜桃多酚可能通过清除自由基以及抑制肿瘤细胞的相关基因表达、增强免疫途径等机制来抑制肿瘤细胞的生长。
3 结论
本文通过对水蜜桃多酚提取物对体外自由基清除活力、抗菌活性和抗肿瘤活力等进行试验评价。发现水蜜桃多酚提取物有一定的抗氧化、抑菌及抗肿瘤效果。其中对体外自由基的清除活力表现出随着多酚提取物浓度从0.04 mg/mL 增加至0.14 mg/mL,其抗氧化性急剧升高,随后趋于平缓。抗菌性方面,对大肠杆菌的抑菌活性最高,当浓度为7 mg/mL 时,抗菌率达到(89.53±5.35)%。抗肿瘤方面则表现为不同浓度下的水蜜桃多酚提取物对人胃癌细胞SGC-7901 和人宫颈癌细胞HeLa 均有一定的抑制效果,尤其是对人胃癌细胞SGC-7901 的抑制效果更好,在多酚提取物浓度为7 mg/mL 时,其增殖抑制率可达(57.20±4.28)%。本研究结果为水蜜桃多酚的综合应用提供了参考依据。
