响应面法优化花生红衣原花青素提取工艺及抗氧化活性
2023-10-24夏宁谢春阳黄威吕呈蔚孙畅李倬林胡济美李铁柱
夏宁,谢春阳,黄威,吕呈蔚,孙畅,李倬林,胡济美,李铁柱*
(1.吉林农业大学 食品科学与工程学院,吉林 长春 130118;2.吉林省农业科学院 农产品加工研究所,吉林 长春 130033;3.中国国际工程咨询有限公司 石化轻纺业务部,北京 100048)
花生是我国重要的经济和油料作物,能提供必不可少的蛋白质和优质植物油脂,在国民经济和社会发展中发挥了重要作用[1]。花生红衣又称花生种皮、红薄皮、落花生衣、红衣,是豆科落花生属植物落花生种皮,常见为红色或粉红色,具有抑制纤维蛋白溶解、增加血小板含量[2]、改善血小板质量、增加毛细血管收缩[3]、纠正凝血因子缺陷、促进骨髓造血功能等功效。花生红衣是花生油及花生制品生产过程中的主要副产物之一,价格低廉且具有多种活性,但是大部分被当作废弃物,只有少数得到利用[4]。花生红衣中含有丰富的多酚类化合物,其含量达到90~125 mg/g[5],包含原花青素、白藜芦醇、酚酸等[6]。原花青素是其主要功能成分之一,其含量高达81.90%。
原花青素(procyanidins,PC)是一种有着特殊分子结构的生物类黄酮混合物[7],由于它们遇到酸性介质加热可产生花青素,因此被称为原花青素,其主要包括原花青素二聚体、儿茶素、表儿茶素,此外还包括三聚体、四聚体直至十聚体等,广泛存在于植物的皮、核、花、壳、籽、叶中,是植物中一种色素成分。原花青素具有优良的生物活性和功能,可以快速清除自由基,减少自由基产生,自由基是导致机体衰老的根本原因,消除体内多余自由基,具有延长寿命的功效,原花青素清除自由基的能力比维生素C 和维生素E 更强,并且低聚原花青素是目前国际上公认的有效天然抗氧化剂,在体内多种器官和组织中有抗氧化应激反应。此外,原花青素还有预防心血管疾病、抗肿瘤[8]、皮肤保健及美容等作用。榨取花生油及花生制品会产生大量花生红衣,目前其主要用于动物饲料,造成了资源的浪费。利用花生红衣可用于多酚类活性物质的提取[9]或研发以原花青素为主要成分的食品[10]和药品[11],用低成本原料创造高经济效益,是近年来研究的热点。但由于国内对于花生红衣原花青素的相关内容较少、技术不成熟、制备成本较高而难以实现[12],需待进一步研究。
本文对花生红衣原花青素的提取工艺参数进行优化,通过比较不同花生红衣样品原花青素含量和DPPH 自由基、羟自由基及ABTS+自由基清除能力对其抗氧化活性进行评价,并利用液相质谱联用法,分析花生红衣中原花青素的组成成分,初步探究花生红衣原花青素的活性特点,为花生红衣中原花青素的研究提供理论和技术支持,也为其作为天然抗氧化剂的应用提供参考,并且在食品开发应用中提供新思路。
1 材料与方法
1.1 材料与仪器
1.1.1 主要试验材料
山东“四粒红”花生:市售;原花青素A1、原花青素A2、原花青素B1、原花青素B2、儿茶素、表儿茶素(均为色谱纯):北京索莱宝科技有限公司;纤维素酶(25 U/mg):上海生工生物工程公司;无水乙醇、甲醇、盐酸(37%)、香草醛(均为分析纯):上海阿拉丁生化科技有限公司。
1.1.2 主要仪器与设备
电子天平(HX1002T):慈溪市天东衡器厂;荧光分光光度计(RF-6000):日本岛津制作所;电热鼓风干燥箱(101-2A 型):天津天泰仪器有限公司;高速万能粉碎机(FW100):天津泰斯特仪器有限公司;超声细胞破碎仪(JY92-Ⅱ):宁波新芝生物科技股份有限公司;恒温水浴锅(HH-2):常州朗越仪器制造有限公司;旋转蒸发仪(XD-2000A):上海贤德实验仪器有限公司;循环水真空泵(SHZ-D):巩义市予华仪器有限责任公司;高速离心机(LXJ-IIB):上海安亭科学仪器有限公司;液相色谱质谱联用仪(Agilent1290-6470B)、色谱柱(ZORBAX Eclipse PlusC18):美国安捷伦科技有限公司。
1.2 试验方法
1.2.1 原花青素提取
1.2.1.1 标准曲线绘制
称取10 mg 原花青素标准品,在10 mL 容量瓶中用乙醇定容,稀释至0.05、0.10、0.15、0.20、0.25 mg/mL的浓度梯度,绘制标准曲线[13]。
1.2.1.2 花生红衣原花青素提取
称取山东“四粒红”花生红衣1 g,加入纤维素酶、10 mL 蒸馏水混合,50 ℃水浴加热酶解,然后加入10 mL乙醇进行超声,超声后3 000 r/min 离心10 min,取上清液定容,为花生红衣原花青素粗提液。取粗体液5 mL,再次定容作为样品溶液。取0.5 mL 样品溶液依次与4%香草醛甲醇溶液3 mL、浓盐酸1.5 mL 混匀,避光静置20 min,于500 nm 波长下测定吸光值[14],代入标准曲线y=0.854x+0.069 1(R2=0.994 9)并计算原花青素提取率(Y,%)。
式中:V 为原花青素提取液定容后的体积,mL;C为原花青素的含量,mg/mL;N 为稀释倍数;m 为花生红衣全粉样品的质量,mg。
1.2.2 单因素试验
固定酶解温度50 ℃、酶解时间90 min、超声温度40 ℃,超声时间30 min,考察酶添加量(2.5%、5.0%、7.5%、10.0%、12.5%)对原花青素提取率的影响;固定酶添加量7.5%、酶解温度50 ℃、超声温度40 ℃、超声时间30 min,考察酶解时间(30、60、90、120、150 min)对原花青素提取率的影响;固定酶添加量7.5%、酶解时间90 min、酶解温度50 ℃、超声时间30 min,考察超声温度(20、30、40、50、60 ℃)对原花青素提取率的影响;固定酶添加量7.5%、酶解时间90 min、酶解温度50 ℃、超声温度40 ℃,考察超声时间(10、20、30、40、50 min)对原花青素提取率的影响。
1.2.3 响应面优化
根据单因素试验结果选取响应面试验参数范围。选取酶添加量A、酶解时间B 及超声时间C 作为变量,-1、0、1 代表试验变量的水平,以山东“四粒红”花生红衣原花青素提取率作为响应值进行响应面分析,得到原花青素提取的最优工艺参数。
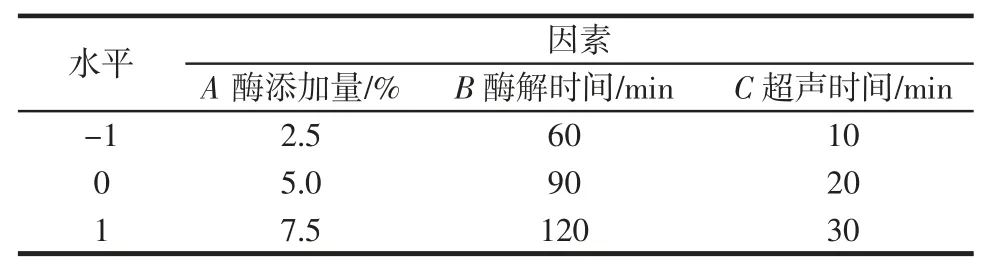
表1 原花青素提取响应面优化试验设计Table 1 Response surface design for optimization of procyanidin extraction
1.2.4 抗氧化活性测定
1.2.4.1 DPPH 自由基清除率的测定
取不同品种的花生红衣原花青素粗提液0.5 mL,加入2 mL 0.04 mg/mL DPPH 溶液,混合摇匀,30 ℃反应30 min。在517 nm 处测定吸光值计算DPPH 自由基清除率(D,%)[15]。
式中:Da为DPPH 与样品反应后的吸光值;Dc为DPPH 与溶剂混合液的吸光值;Db为样品与溶剂混合液的吸光值。
1.2.4.2 羟自由基清除率的测定
取不同品种的花生红衣原花青素粗提液0.5 mL加入0.5 mL 硫酸亚铁溶液和0.5 mL 9 mmol/L 水杨酸,用50%乙醇配制溶液7 mL,混合均匀,加8.8 mmo/L过氧化氢0.5 mL,室温下避光反应30 min 后,在510 nm处测定吸光值。用50%的乙醇分别替代过氧化氢、样品,测吸光值计算羟自由基清除率(O,%)[16]。
式中:Do为样品与FeSO4、H2O2混合液吸光值;Di为样品与FeSO4、乙醇混合液吸光值;Dj为乙醇与Fe-SO4、H2O2混合液吸光值。
1.2.4.3 ABTS+自由基清除率的测定
称取0.192 0 g ABTS 试剂、0.0331 g K2S2O8,用去离子水定容至50 mL,将该溶液于室温下暗处静置过夜。将生成的ABTS 溶液用无水乙醇稀释至734 nm 处吸光值为0.70。反应体系中,取不同品种的花生红衣原花青素粗提液20 μL,加入2 mL ABTS 反应液,振荡摇匀,室温下静置10 min,测定反应液在734 nm 处的吸光值[17],计算ABTS+自由基清除率(A,%)。
式中:D1为样品管的吸光值;D2为对照管的吸光值。
1.2.5 花生红衣原花青素组分分析
色谱条件:ZORBAX Eclipse Plus C18 柱(2.1 mm×100 mm,1.8 μm);流动相A 为0.1%甲酸,B 为甲醇;洗脱条件:0~1 min,12%B;1.0~2.5 min,12%~95%B;2.5~7.0 min,95%B;7.0~7.5 min,95%~12%B;7~10 min,12%B。进样量1 μL、流速0.15 mL/min、柱温30 ℃。
质谱条件:电喷雾离子源(负离子扫描模式)、电喷雾离子源的温度最高至100℃、锥体气体量为0.83L/min。离子质量扫描范围m/z 100~1 200。解吸气体的温度为400 ℃,解吸气体的流量为11.67 L/min[18]。毛细管电压设定为3 kV,锥体电压最高为40 V。
1.3 数据处理与分析
每个样品测定3 次,结果以平均值±标准差表示。使用SPSS 20.0 软件对数据进行分析,并使用Origin 9.0 软件进行绘图。
2 结果与分析
2.1 单因素试验结果
单因素试验结果如图1 所示。
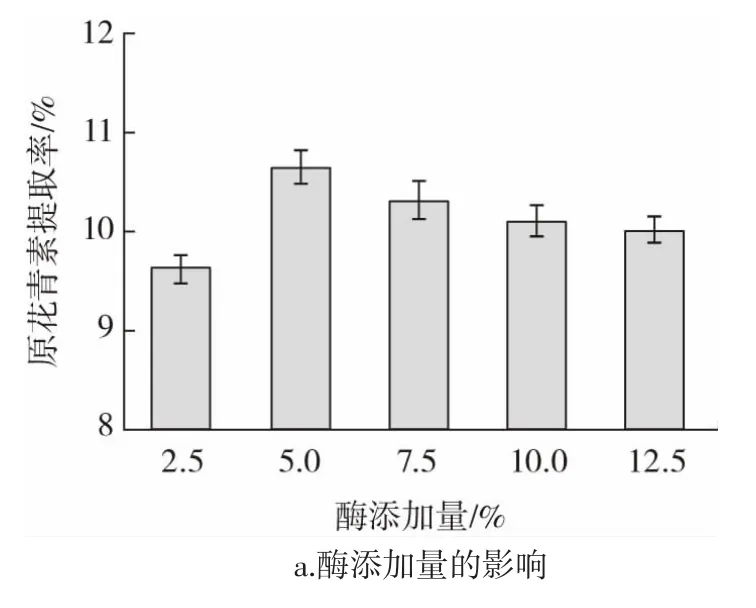
图1 酶添加量、酶解时间、超声温度、超声时间对原花青素提取率的影响Fig.1 Effects of enzyme addition amount,digestion time,ultrasound treatment temperature and time on the yield of procyanidins
如图1a 所示,在山东“四粒红”花生红衣样品中,加入5.0%的纤维素酶明显提高PC 的提取率,最高达到10.68%。这是因为细胞壁中纤维素被纤维素酶催化水解,细胞壁裂解,膜的渗透性增加,细胞内PC 浸出,而且细胞壁破损也为后续超声提取创造有利条件,协同超声介导的提取起到良好的协同作用。但继续添加纤维素酶,PC 提取率下降,这可能是由于纤维素酶催化作用受到抑制,因为纤维素酶添加量增加,底物没有通过纤维素酶的结合达到饱和[19]。
如图1b 所示,当酶解时间至90 min 时PC 提取率达到最高,为8.31%。可能是由于纤维素酶与花生红衣充分接触,膜的渗透性增加[20],促进细胞内PC 的溶出,而当酶解时间过长,超过一定的阈值,大部分花生红衣已与纤维素酶充分反应完全,反而会破坏已经提取出的原花青素稳定性,活性物质被分解,导致提取率降低,同时也造成了资源的浪费。
如图1c 所示,参考黄武等[21]的方法并结合纤维素酶最适温度确定超声温度范围,当超声温度在30 ℃时PC 提取率最高,达到9.03%。这可能是由于分子运动、渗透、扩散和溶解的加速,且高温会引起细胞膜结构的变化,PC 从花生红衣转移到溶剂中,但在超过一定的阈值温度时可能会破坏PC 结构,同时更高的温度会破坏纤维素酶的活性,最终导致提取率下降。
如图1d 所示,超声时间20 min 时提取率达到最高,为12.02%。超声波使分子的运动加剧,与花生红衣粉更充分接触,细胞壁被破坏,花生红衣内的PC 被快速分离浸提出来,再增加超声处理时间,反而会因为大部分原花青素已被浸出而降低提取率,如果还继续超声处理来帮助提取,会破坏已经提取的原花青素的稳定性。
2.2 响应面试验结果分析
2.2.1 响应面试验优化结果
原花青素提取率的大小可以体现出其提取的工艺是否为最优参数条件,在提取过程中能够减少能源的损耗,以最大的效率提取更多物质中的原花青素。选定酶添加量A、酶解时间B 及超声时间C 这3 个因素作为试验变量,以山东“四粒红”花生红衣原花青素提取率为响应值,采用Design Expert 8.0.6 设计三因素三水平的响应面优化试验来获得最佳试验条件。响应面优化试验数据结果见表2。
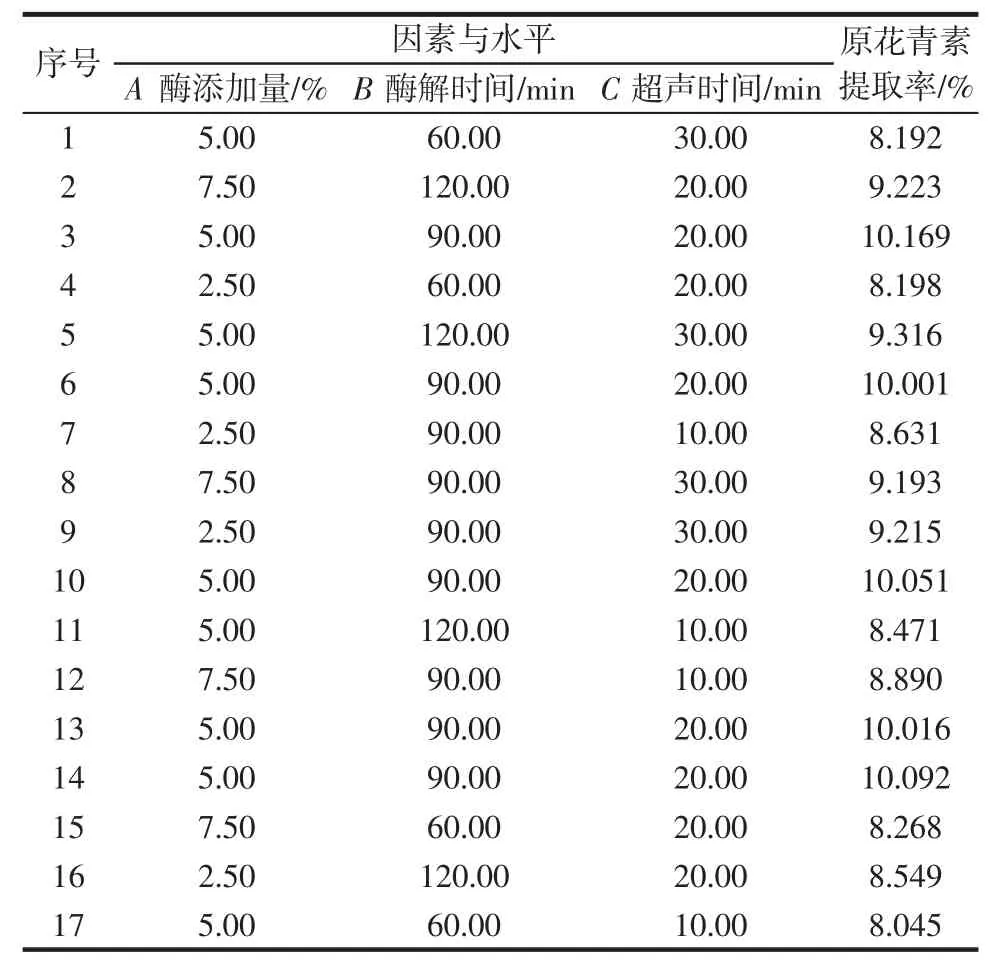
表2 原花青素提取响应面结果分析Table 2 Response surface-optimized extraction results of procyanidins
2.2.2 响应面试验方差分析
响应面方差分析结果如表3 所示。
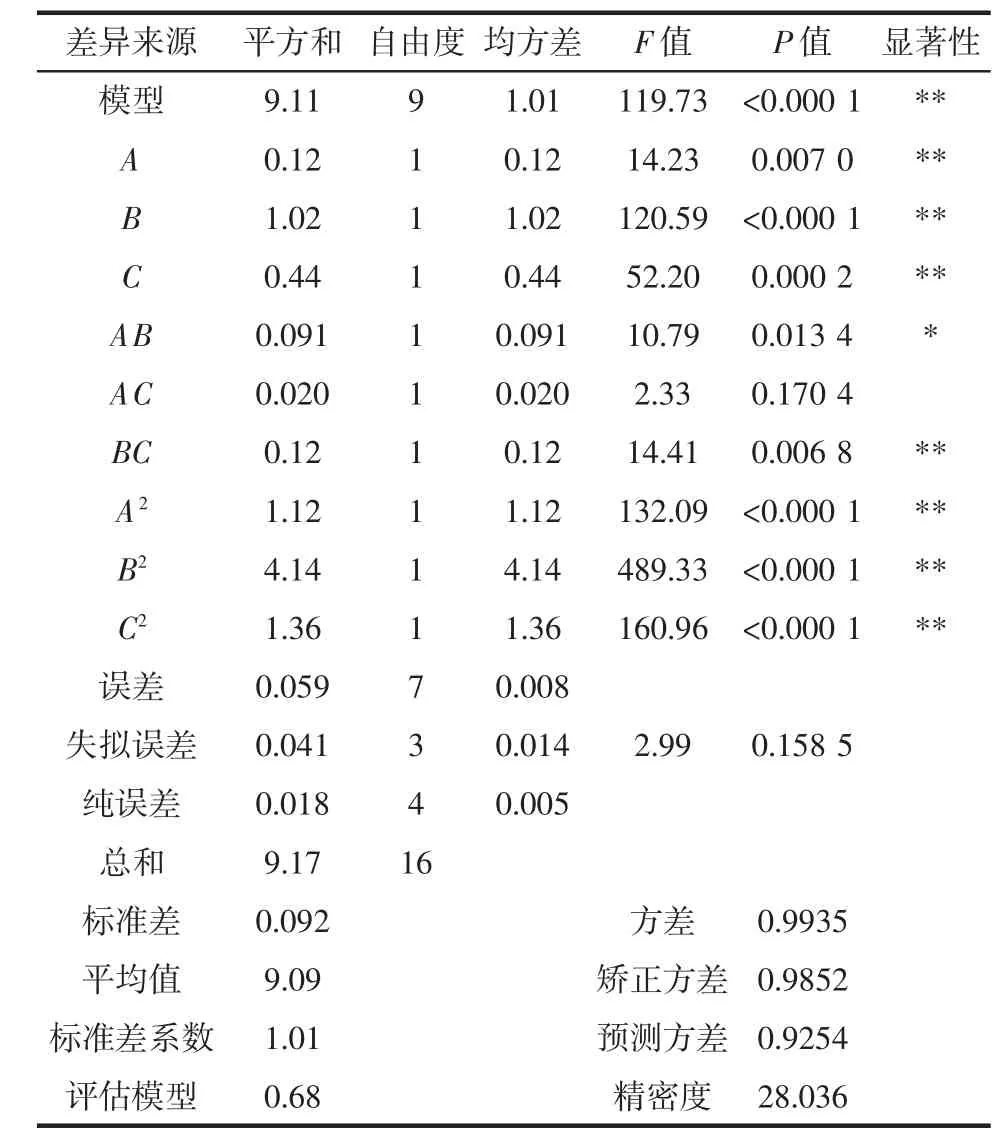
表3 原花青素提取响应面方差分析Table 3 Analysis of variance for the response surface-optimized extraction results of procyanidins
从表3 可知,对于此模型的纯误差来说,失拟误差的F 值为2.99,P>0.05(该模型中的失拟误差为0.158 5)这说明失拟误差小,试验数据与此模型的拟合程度较好。R2为0.993 5,而校正后的R2Adj为0.985 2,这表明该试验模型的误差较小,结果均在合理范围内。因此原花青素提取率的试验结果可以采用此模型进一步分析试验数据。
从该表可以得出,3 个因素对原花青素提取率的影响由大到小排列为B>C>A;根据该试验模型得出的最优条件组合进行试验,其条件为酶添加量5.34%、酶解时间96.30 min 及超声时间22.31 min,原花青素提取率的理论值10.14%。考虑到实际的可操作性,选择酶添加量5.00%、酶解时间90.00 min、超声时间20.00 min验证该工艺参数组合得到的原花青素提取率为10.07%,与此模型得出的预测值接近,证明此提取工艺条件可靠。相比于传统的超声提取方法,纤维素酶法可以使细胞壁及细胞质中的纤维素降解,破坏细胞壁结构,提高有效成分的提取率[22]。
2.2.3 响应面试验模型中两两因素交互的等高线图和3D 图
响应面等高线图和3D 图如图2 所示。
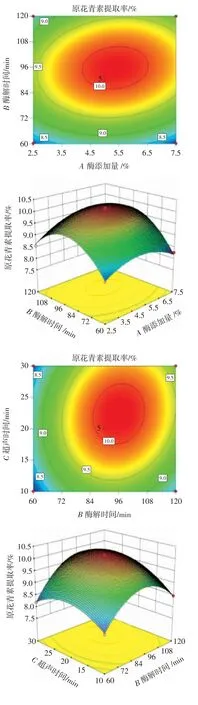
图2 响应面试验模型中两两因素交互的等高线图和3D 图Fig.2 Contour and 3D plots of effects of factor interactions on the yield of procyanidins
由图2 可以看出,随着酶添加量和酶解时间的增加,原花青素的提取率先增加后减少。这表明酶添加量和酶解时间存在交互作用,且作用显著,会影响PC的提取率。酶解时间与超声时间这两个因素之间的交互作用极显著,其坡面幅度较大,随着酶解时间与超声时间的增加,原花青素提取率先上升再下降。根据酶添加量与超声时间的增加,PC 的提取率先平缓上升后下降,由3D 图可以看出其坡面较为平缓,该试验结果与方差分析结果相符。
2.3 抗氧化活性测定结果
由于不同的生长时期对花生红衣原花青素提取率影响较大[23],因此本试验选择5 种产量较高且为同生长时期采摘的吉林本土花生红衣进行抗氧化试验。不同品种花生红衣原花青素的抗氧化活性测定结果如图3 所示。
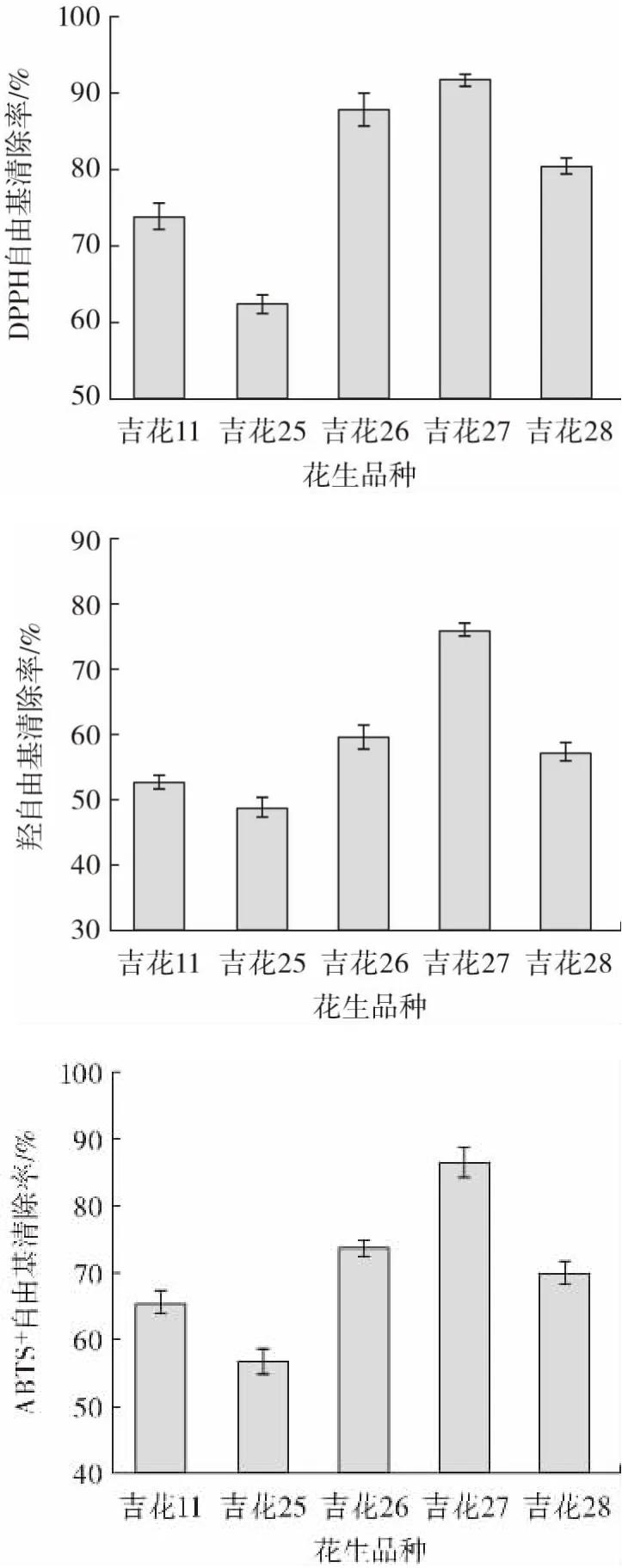
图3 不同品种花生红衣原花青素的抗氧化活性测定Fig.3 Antioxidant activities of procyanidins in red coat samples of different peanut cultivars
由图3 可知,清除DPPH 自由基、羟自由基及ABTS+自由基能力最强的均是“吉花27” 花生红衣PC 提取液,其自由基清除能力分别为91.04%、76.64%、87.11%。最弱的均是“吉花25”花生红衣PC 提取液,其自由基清除能力分别为62.58%、49.30%、57.29%。试验结论与宋昱等[24]对花生红衣原花青素抗氧化活性的研究结论相似。因此,后续选择“吉花27”花生进行HPLC-MS 试验,分析其组成成分。
2.4 液相质谱联用法结果分析
低聚原花青素通常为二聚体到四聚体,由于其分子量小,细胞膜通过性强,生物活性突出,具有广泛的开发价值。本文选用原花青素主要单体及二聚体对花生红衣进行分析。
图4 为7 种主要原花青素标准品的HPLC-MS 色谱图,分别原花青素A1、原花青素A2、原花青素B1、原花青素B2、儿茶素、表儿茶素、表没食子酸儿茶素。
图5 为“吉花27”花生红衣原花青素提取液中各个峰的HPLC-MS 色谱图。
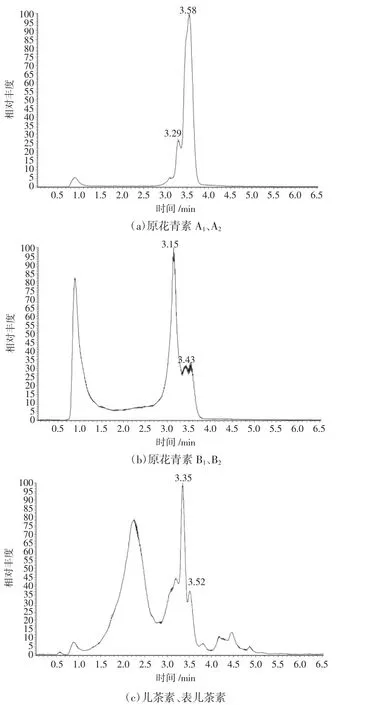
图5 花生红衣中原花青素样品的HPLC-MS 色谱图Fig.5 HPLC-MS chromatograms of procyanidins in peanut red coat samples
由图4、图5 对比发现,其中存在原花青素A1、原花青素A2、原花青素B1、原花青素B2、儿茶素、表儿茶素,未检出表没食子酸儿茶素[25]。根据峰面积计算得出含量分别为1.522、5.333、1.321、0.408、1.515、0.187 mg/g。表明“吉花27”中以原花青素A2为主。
图6 为原花青素提纯样品中各个峰的最强峰离子m/z 质谱分析图。
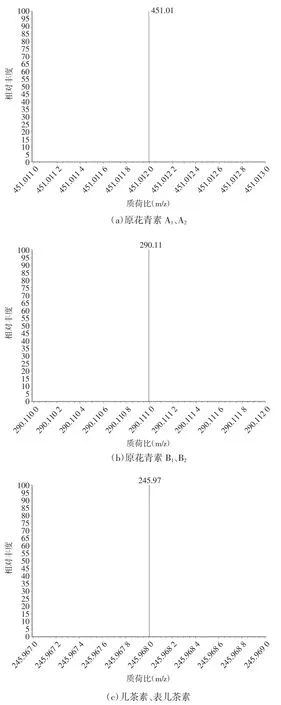
图6 原花青素样品的离子碎片图Fig.6 Ion fragmentation of procyanidin samples
通过与标准品出峰时间和质谱图对比,在3.29 min和3.54 min 峰的母离子m/z 为576,负离子模式下,最强峰离子m/z 为451,可能是原花青素A1,A2在T-unit进行了裂解[26],失去一个间苯三酚分子(C6H6O3),产生m/z 451 碎片离子。在3.15 min 和3.43 min 峰的母离子m/z 为578,子离子为125、245、290、407、425 和451,最强峰离子m/z 为290。这可能是由于母离子Q M cleavage 分子间的一个单位断裂[27],失去C15H12O6而产生的,与原花青素B1和B2相吻合。在3.35、3.52 min 的两个峰,母离子m/z 289,子离子为179、205、245,其中,最强峰离子m/z 为245,为母离子丢掉1 分子CO2后得到的离子[28],分别与儿茶素和表儿茶素吻合。
3 结论
本文采用单因素和响应面法对超声波辅助酶法提取花生红衣原花青素的提取工艺参数进行优化,得到最优工艺为酶添加量5.00%、发酵时间90.00 min、超声时间20.00 min,花生红衣中原花青素的提取率为10.0658%。不同花生红衣原花青素提取液清除自由基的能力比较结果表明,“吉花27”花生红衣原花青素抗氧化活性最强,“吉花25”最弱。通过HPLC-MS 法分析“吉花27”中含有儿茶素、表儿茶素、原花青素A1、原花青素A2、原花青素B1、原花青素B2,其含量分别为1.515、0.187、1.522、5.333、1.321、0.408 mg/g。本研究为花生红衣原花青素的研究提供参考。
