金丝桃苷对小鼠酒精性脂肪肝炎的保护作用
2023-10-24侯惠静吴子健
侯惠静,吴子健
(1.天津市职业大学 生物与环境工程学院,天津 300410;2.天津商业大学 生物技术与食品科学学院,天津 300134)
酒精性肝病(alcoholic liver disease,ALD)是慢性肝损伤的主要病因之一,该病的发展经历了多个进行性阶段,包括酒精性脂肪肝、酒精性脂肪性肝炎、酒精性肝炎、肝纤维化、肝硬化。近期关于全球疾病负担的研究指出,酒精相关肝病是前30 个死亡原因之一,ALD 已成为广受关注的公共卫生问题[1]。目前,ALD 缺乏有效治疗手段,药物治疗和手术治疗均存在较大的副作用[2]。
金丝桃苷(hyperin,Hyp),又名槲皮素-3-O-β-D-吡喃半乳糖苷,是一种天然黄酮醇苷类化合物,广泛存在于金丝桃科、葵科、桔梗科、杜鹃花科、唇形科、小檗科、蔷薇科等植物的果实及全草中[3],具有抗肿瘤[4]、免疫调节[5]、保护神经系统[6]、减轻肝脏损伤[7-8]等药理作用。近期研究表明,金丝桃苷抑制人乳腺癌细胞系(nuclear factor-kappa B,NF-κB)信号通路活化,增强Bax-caspase-3 通路活化,从而诱导肿瘤细胞凋亡,发挥抗肿瘤活性[4]。金丝桃苷能够降低单胺氧化酶水平,增强重组与合成蛋白(nuclear factor erythroid 2-related factor 2,Nrf2)表达,减轻四氯化碳(CCl4)诱导的肝脏纤维化及氧化损伤[9]。此外,金丝桃苷通过增强葡糖醛酸转移酶和磺基转移酶活性,降低肝毒性,减轻对乙酰氨基酚诱导的急性肝衰竭[7]。尽管这些研究揭示了金丝桃苷功能的多样性,但目前金丝桃苷在酒精性脂肪肝病中作用的研究尚少见。
短期酒精性肝炎模型(Gao-Binge 模型)是目前普遍使用的ALD 动物模型,建模后小鼠肝组织出现脂质沉积和炎性细胞浸润,肝细胞表现出肿胀、胞浆内脂肪性小泡等病理现象,该模型能较好地模拟人类酒精性脂肪肝病[10]。实验拟采用Gao-Binge 模型诱导小鼠酒精性脂肪肝炎,通过检测血清转氨酶水平、肝脏脂肪积累、氧化损伤以及炎症水平,探究不同剂量的金丝桃苷对小鼠酒精性脂肪肝炎的改善作用,以期为金丝桃苷在功能性食品与药品中的应用提供理论依据,为酒精相关肝病防治保健品的开发提供新策略。
1 材料与方法
1.1 材料与试剂
C57BL/6J 小鼠[体质量18~24 g,雄性,动物许可证号SCXK(京)2016-0006]:北京维通利华实验动物技术有限公司;金丝桃苷(纯度95%):美国Sigma 公司;谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate transaminase,AST)、乳酸脱氢酶(lactate dehydrogenase,LDH)、甘油三酯(triglyceride,TG)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)检测试剂盒:南京建成生物工程研究所;RNA 提取试剂(生物试剂)、反转录试剂盒:美国Thermo Fisher Scientific 公司;动物饲料(Lieber-DeCarli液体饲料):美国Dyets 公司;麦芽糖糊精、乙醇(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
Legend Micro17 离心机:美国Thermo Fisher Scientific 公司;SCIENTZ-48 组织破碎仪:宁波新芝生物科技有限公司;Digital Sight DS-U3 光学显微镜:日本尼康公司;
MyCycler 基因扩增(polymerase chain reaction,PCR)仪:美国Bio-Rad 公司;LightCycler 480 实时定量PCR仪:瑞士罗氏公司。
1.3 方法
1.3.1 动物饲养及模型建立
实验小鼠给予恒温恒湿的无特定病原体动物(specific pathogen free,SPF) 级饲养环境,12 h 光/暗循环。动物实验经过中国医学科学院放射医学研究所实验动物伦理委员会的批准(IRM-DWLL-2022016)。将50 只实验小鼠随机分为5 组,分别为空白组、模型组、金丝桃苷低、中、高剂量(12.5、25.0、50.0 mg/kg)组,每组10 只小鼠。小鼠使用麦芽糖糊精液体饲料喂养5 d,使小鼠适应液体饮食,第6 天模型组及金丝桃苷处理组的小鼠饲料更换为5%酒精液体饲料,空白组给予同等热量的麦芽糖糊精液体饲料,继续喂养10 d 后,在早上7:00~9:00 以5 g/kg 剂量进行酒精(30%,体积分数) 或麦芽糖糊精灌胃,9 h 后收集血清和肝组织样本。5%酒精液体饲料喂养期间,金丝桃苷处理组的小鼠每日8:00~9:00 灌胃,并给予相应的金丝桃苷,空白组和模型组给予同等体积生理盐水。
1.3.2 血清指标的测定
自小鼠眼眶后静脉丛取血,静置30 min,4 ℃、1 500 r/min 离心15 min 收集血清,参照检测试剂盒说明书进行血清ALT、AST、LDH 活力和TG 含量测定。
1.3.3 肝脏指标的测定
取0.2 g 肝组织置于冰上,按照SOD、MDA、TG 检测试剂盒说明书测定肝组织TG 和MDA 含量,以及SOD 活性。
1.3.4 肝脏病理学及免疫组化观察
取新鲜肝脏切成小块,用10%福尔马林固定肝组织,经石蜡包埋、切片后,进行常规苏木精-伊红染色(hematoxylin and eosin staining,H&E)和淋巴细胞抗原6 复合体(lymphocyte antigen 6G,Ly6G)免疫组织化学染色,并在光学显微镜下观察。
1.3.5 肝脏油红染色
取新鲜肝脏组织块放入液氮冷冻,用冰冻切片包埋剂(optimal cutting temperature comp,OCT)包埋,组织冰冻切片后,进行油红染色,并在光学显微镜下观察。
1.3.6 目的基因mRNA 相对表达量
按照RNA 提取试剂使用说明书提取肝组织总RNA,使用反转录试剂盒将总RNA 逆转录为cDNA,利用实时定量PCR 仪检测系统扩增肝组织cDNA。将Gapdh 作为内参基因,评估目的基因的相对表达水平。
1.4 统计分析
使用GraphPad Prism 7 进行统计学分析,结果表示为平均值±标准差。两组之间差异显著性使用标准双尾非配对t 检验,认为P<0.05 具有统计学意义。
2 结果与分析
2.1 金丝桃苷对小鼠肝脏指数的影响
金丝桃苷对小鼠肝脏指数的影响见图1。
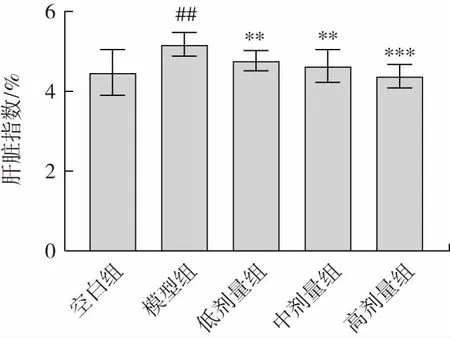
图1 金丝桃苷对小鼠肝脏指数的影响Fig.1 Effect of hyperin on liver index in mice
由图1 可知,模型组小鼠肝脏指数极显著高于空白组(P<0.01),说明酒精液体饲料会导致小鼠肝脏出现脂质沉积、肿胀现象,建模成功;与模型组相比,金丝桃苷低、中、高剂量组均能显著降低小鼠肝脏指数(低、中剂量组P<0.01,高剂量组P<0.001),说明金丝桃苷能够有效改善酒精饮食导致的小鼠肝脏肿大。
2.2 金丝桃苷对酒精饮食诱导的肝脏损伤小鼠血清生化指标的影响
ALT、AST 和LDH 是评价肝脏受损情况的重要生化指标,正常生理状态下,血清中ALT、AST 和LDH 活力较低,当肝脏受损时,血清中ALT、AST 和LDH 活力升高[11]。金丝桃苷对小鼠血清生化指标的影响见图2。
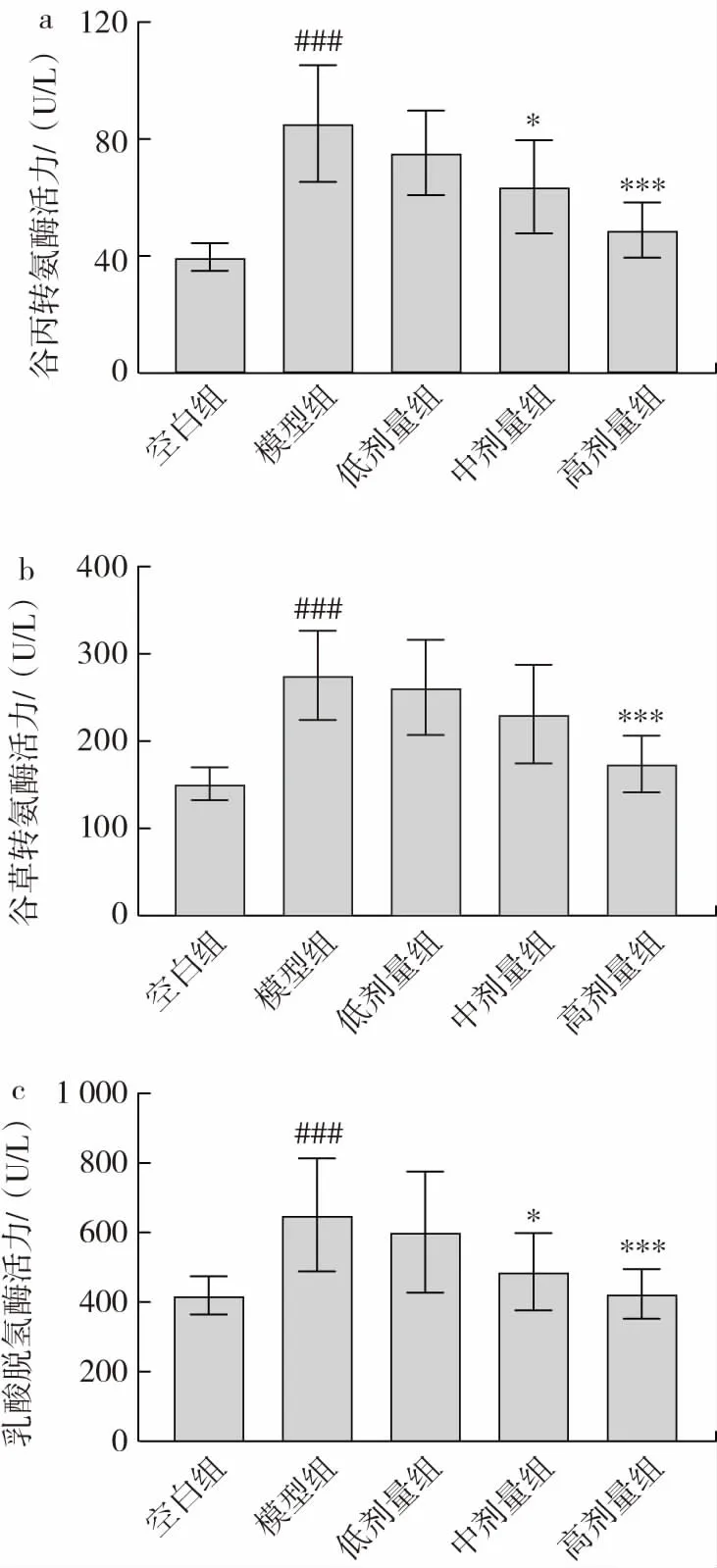
图2 金丝桃苷对小鼠血清生化指标的影响Fig.2 Effect of hyperin on serum biochemical indexes in mice
如图2 所示,与空白组相比,模型组小鼠血清中ALT、AST 和LDH 活力高度显著升高(P<0.001),说明酒精饮食导致小鼠肝脏受损。而金丝桃苷中、高剂量组能够显著降低小鼠血清ALT 和LDH 活力(高剂量组P<0.001),说明一定剂量的金丝桃苷对酒精饮食诱导的肝脏损伤具有改善作用。
对小鼠肝组织进行H&E 染色,结果如图3 所示。

图3 小鼠肝组织的病理切(标尺:50 μm)Fig.3 Histological examination of liver tissue sections of mice(scale bar: 50 μm)
由图3 可知,模型组小鼠肝组织出现脂质沉积,肝细胞表现出肿胀、胞浆内脂肪性小泡等病理现象,汇管区出现水样性病变。与模型组相比,金丝桃苷处理组能够减轻肝组织脂肪沉积,减少胞浆内脂肪性小泡,保持肝细胞结构完整。由此可见,在酒精饮食诱导的脂肪肝病模型中,金丝桃苷具有一定的保肝护肝效用。
2.3 金丝桃苷对酒精饮食诱导小鼠的肝脏脂肪变性的影响
为进一步探究金丝桃苷对酒精饮食诱导小鼠的肝脏脂肪变性的影响,实验检测血清及肝组织甘油三酯含量,结果如图4 所示。
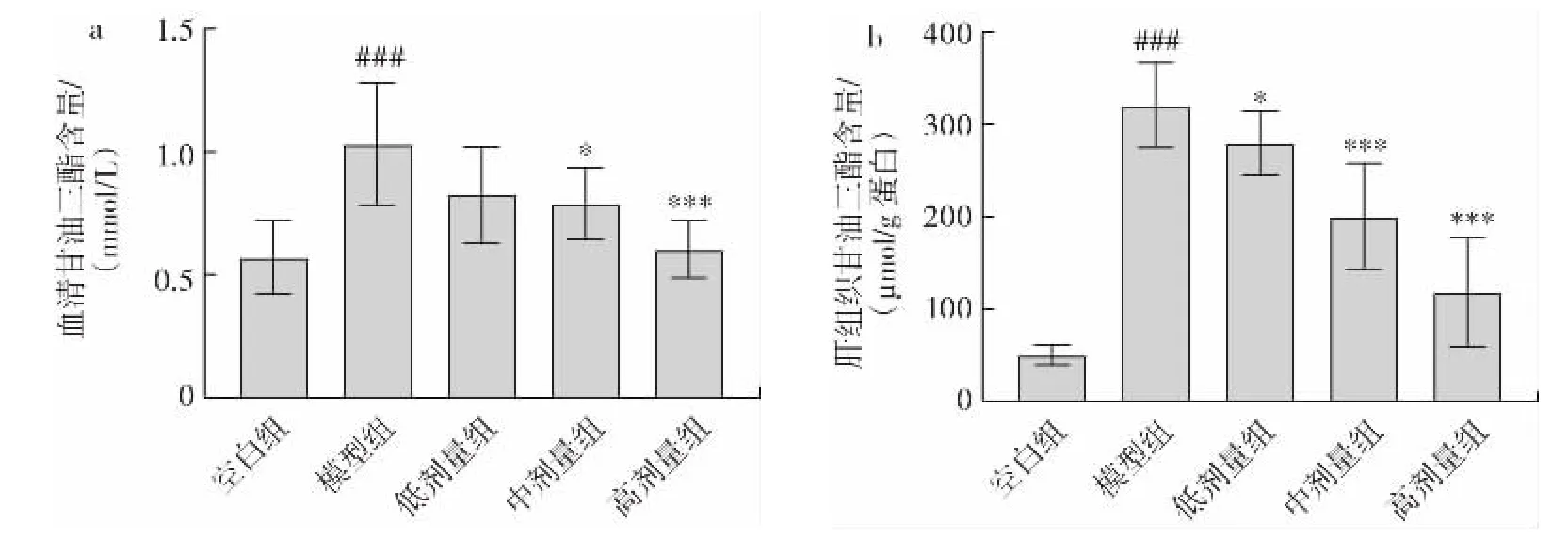
图4 金丝桃苷对小鼠血清及肝组织甘油三酯含量的影响Fig.4 Effect of hyperin on content of TG in serum and liver tissue in mice
由图4 可知,与空白组相比,模型组小鼠血清及肝组织甘油三酯含量高度显著升高(P<0.001),这主要是由于酒精饮食喂养导致小鼠肝细胞脂肪代谢紊乱,脂质在肝细胞中堆积产生[12]。金丝桃苷处理组能够显著降低小鼠肝组织的甘油三酯含量(低剂量组P<0.05,中、高剂量组P<0.001),血清甘油三酯含量也明显降低(中剂量组P<0.05,高剂量组P<0.001)。
进一步对小鼠肝组织进行油红染色,结果见图5。
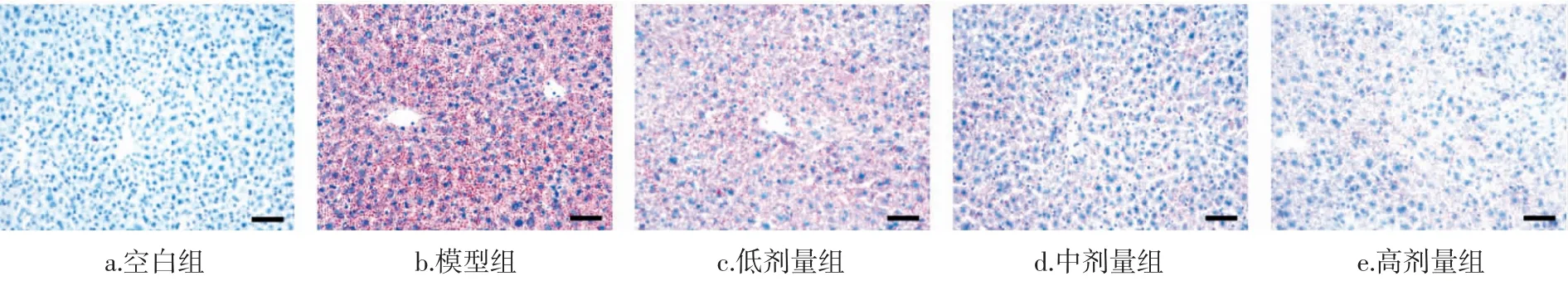
图5 小鼠肝组织的油红染色(标尺:50 μm)Fig.5 Oil red staining of liver tissue sections(scale bar: 50 μm)
由图5 可知,小鼠经过酒精液体饲料喂养后,肝组织油红染色着色区域明显大于对照饮食组,而金丝桃苷低、中、高剂量组小鼠肝组织的油红染色着色区域明显减少。以上结果说明,金丝桃苷能够减轻酒精饮食导致的肝脏脂肪变性。
2.4 金丝桃苷对酒精饮食诱导小鼠的肝脏脂质过氧化的影响
肝脏是酒精代谢的主要场所,乙醇中间代谢产物的肝毒性是ALD 发病的重要推动因素[13]。金丝桃苷对肝脏SOD 活性和MDA 含量的影响见图6。
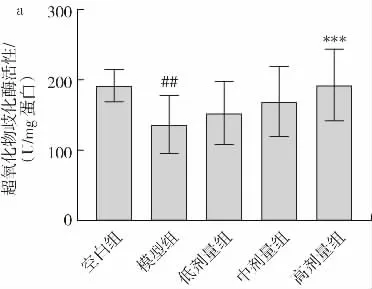
图6 金丝桃苷对肝脏SOD 活性和MDA 含量的影响Fig.6 Effect of hyperin on hepatic SOD activity and MDA livel in mice
由图6 所示,模型组小鼠肝脏SOD 活性极显著低于空白组(P<0.01),MDA 含量高度显著高于空白组(P<0.001),这是由于酒精代谢过程中会产生大量活性氧,抑制肝细胞的抗氧化能力,降低SOD 水平,脂质过氧化损伤造成MDA 含量升高[14]。与模型组相比,金丝桃苷干预组能够明显提升SOD 活性(高剂量组P<0.001),高度显著降低酒精中间代谢产物MDA 的含量(低、中、高剂量组P<0.001),这说明金丝桃苷能够有效减轻酒精饮食诱发的肝脏脂质过氧化损伤。
2.5 金丝桃苷对酒精饮食诱导小鼠的肝脏炎症反应的影响
ALD 的发病机制十分复杂,多种因素可能参与ALD 的发生发展,除了酒精代谢产物的肝毒性以外,免疫细胞介导的炎性损伤也是主要促进因素之一[15]。为了明确金丝桃苷对酒精饮食诱导小鼠的肝脏炎症反应的影响,实验检测了肝组织炎性细胞因子mRNA相对表达量的变化,结果如图7 所示。
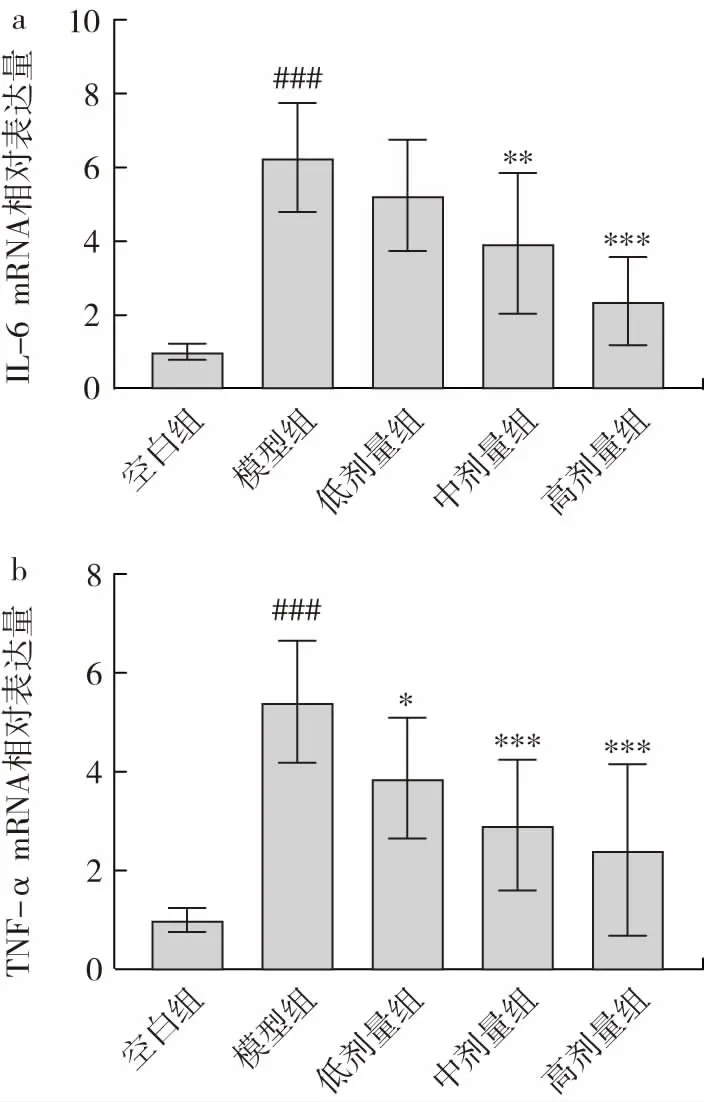
图7 金丝桃苷对TNF-α 和IL-6 mRNA 相对表达量的影响Fig.7 Effect of hyperin on relative mRNA expression of TNF-α and IL-6 in mice
由图7 可知,小鼠经过酒精液体饲料喂养后,模型组小鼠与空白组相比,肝组织IL-6 和TNF-α 的mRNA水平高度显著升高(P<0.001),金丝桃苷处理组能够显著抑制酒精诱导的肝脏IL-6 表达(中剂量组P<0.01,高剂量组P<0.001),显著降低TNF-α 的mRNA 水平(低剂量组P<0.05,中、高剂量组P<0.001)。
在酒精性脂肪肝病中,肝脏中性粒细胞浸润和中性粒细胞趋化因子表达上调是酒精性肝炎的重要特征之一[16]。因此,对小鼠肝组织进行Ly6G(中性粒细胞特异性标志物)免疫组化染色,结果见图8。

图8 小鼠肝组织的Ly6G 免疫组化染色(标尺:50 μm)Fig.8 Ly6G immunohistochemistry staining of liver tissue sections of mice(scale bar: 50 μm)
由图8 可知,模型组小鼠肝脏切片Ly6G 阳性染色细胞明显增加,说明酒精饮食小鼠的肝组织中出现中性粒细胞浸润增多的现象。小鼠经过金丝桃苷干预后,肝脏切片中Ly6G 阳性染色细胞减少,意味着中性粒细胞浸润明显减少。进一步,通过实时定量PCR 技术检测中性粒细胞趋化因子mRNA 相对表达量的变化,结果如图9 所示。
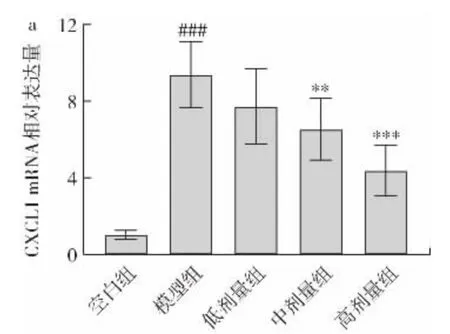
图9 金丝桃苷对CXCL1 和CXCL2 mRNA 相对表达量的影响Fig.9 Effect of hyperin on relative mRNA expression of CXCL1 and CXCL2 in mice
由图9 可知,与空白组相比,模型组小鼠肝组织中CXCL1、CXCL2 的mRNA 相对表达量高度显著升高,而金丝桃苷能够降低酒精饮食小鼠肝脏中性粒细胞趋化因子的表达水平(中剂量组P<0.01,高剂量组P<0.001)。以上结果说明金丝桃苷能够有效减轻小鼠酒精饮食诱发的肝脏炎症反应和中性粒细胞浸润。
在ALD 病程中,肝脏氧化损伤触发的获得性免疫反应和酒精诱导的固有免疫细胞活化会引起肝脏炎症反应发生,巨噬细胞、中性粒细胞等多种免疫细胞参与其中。乙醇的中间代谢产物如乙醛和丙二醛被抗原呈递细胞识别,激活T 细胞介导的细胞免疫反应,产生TNF-α 促炎细胞因子[17]。酒精损伤肠道屏障,使小肠通透性增强,LPS 通过门静脉系统入肝激活巨噬细胞,产生TNF-α、IL-6 等促炎因子,进而募集中性粒细胞等炎性细胞入肝脏[18-19]。中性粒细胞通过释放组织溶解酶、产生活性氧(robot operating system,ROS)损伤肝细胞,利用Ly6G 中和抗体清除中性粒细胞可以显著降低血清转氨酶水平[20],阻断CXCL1 明显抑制小鼠肝脏中性细胞浸润,减轻脂肪肝炎[21]。由此可见,抑制肝组织促炎细胞因子及中性粒细胞趋化因子表达,减少肝脏中性粒细胞浸润能够有效减轻酒精饮食导致的脂肪肝炎。一些研究表明,金丝桃苷能够抑制AKT/GSK3β 信号通路活化,降低TNF-α 和IL-6 等炎性因子分泌,减轻博来霉素诱导的小鼠肺纤维化[22]。此外,金丝桃苷诱导巨噬细胞Nr4A1 表达上调,促进巨噬细胞从促炎M1 表型向抑炎M2 表型极化,从而降低高脂饮食诱发的肝脏脂积累及炎症反应[23]。这与本文研究结果一致,即金丝桃苷能够减轻肝脏炎性因子和趋化因子表达,减少中性粒细胞浸润,改善酒精饮食诱导的脂肪肝炎。
3 结论
本文研究了金丝桃苷对酒精饮食诱发的小鼠脂肪性肝炎的改善作用。结果表明,一定剂量的金丝桃苷能够减轻Gao-Binge 模型诱导的小鼠酒精性肝损伤,降低血清转氨酶水平,减轻肝脏脂积累和脂质过氧化损伤,抑制炎性细胞因子及趋化因子表达,减少肝脏中性粒细胞浸润,改善小鼠酒精性脂肪肝炎,但其具体的作用机制有待进一步探究。本研究丰富了金丝桃苷功能的多样性,为金丝桃苷在保肝护肝保健品的开发提供理论和实验依据。
