猪圆环病毒3 型近五年的研究进展
2023-10-23王晶晶王丽萍译自Vol3142022198764
王晶晶,王丽萍 译自,Vol.314(2022):198764
唐芬兰 校 张配配 审 孟祥光 制图
猪圆环病毒是一种小型的环状、无包膜、单链DNA 病毒,可自然感染猪。目前已发现的猪圆环病毒有4 种,包括猪圆环病毒1 型(porcine circovirus type 1,PCV1)、猪圆环病毒2 型(PCV2)、猪圆环病毒3 型(PCV3)和猪圆环病毒4 型(PCV4)。PCV1 最初被认为是猪肾细胞系(porcine kidney cell line,PK-15)的细胞培养污染物而受到重视。然而,PCV1 被认为是非致病性的,因为目前没有因自然感染而导致猪暴发临床疾病的报道,也没有在实验性研究中重现。
PCV2 于20 世纪90年代在加拿大首次被发现,最初被确定为断奶仔猪多系统衰竭综合征(post-weaning multisystemic wasting syndrome,PMWS) 的病原体。此外,PCV2 还与多种临床症状有关,统称为PCV 相关疾病(PCV-associated disease,PCVAD)。与PCV2 感染相关的常见临床表现是断奶仔猪多系统衰竭综合征(PMWS)、繁殖疾病(PCV2-reproductive disease,PCV2-RD) 以及猪皮炎与肾病综合征(porcine dermatitis and nephropathy syndrome,PDNS)。尽管已有PCVAD 的商用疫苗,但该病仍被认为是全球养猪业中最具经济破坏性的疾病之一。
PCV4 于2019年首次被发现,但有关其临床影响和发病机制的资料仍然有限。PCV4 最早在患有呼吸道疾病、腹泻和PDNS 的7 周龄猪的相关样本中被检测到。最近的研究报道,在其他临床表现的猪样本中也分离到了PCV4,如患神经系统疾病或繁殖障碍的发病猪样本。然而,Sun 等和Tian 等指出,在PCV4的病例中大多数能够同时检测到其他多种病原体,如PCV2 或PCV3 等。因此,PCV4 感染的临床影响仍存在争议。
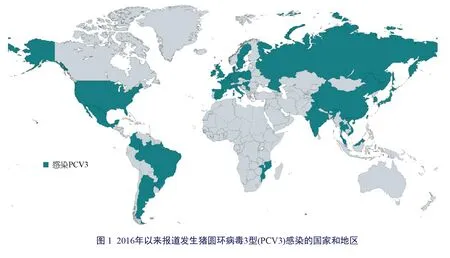
2016年,PCV3 首次在美国一家猪场的相关样本中被发现,当时该猪场的母猪死亡率增加,出现了PDNS 样的病变,并伴有以受孕率下降、木乃伊胎和死胎率增加为特征的慢性繁殖障碍问题。研究人员通过免疫组织化学和定量聚合酶链式反应(quantitative polymerase chain reaction,qPCR),排除了PCV2、猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)、甲型流感病毒(influenza A virus,IAV)和猪细小病毒(porcine parvovirus,PPV) 等其他并发病原体。宏基因组分析显示,存在一种新的遗传变异的猪圆环病毒。通过滚环扩增(rolling circle amplification,RCA)、PCR 和桑格测序(Sanger sequencing),研究人员证实存在一种由包含2 000 个核苷酸的环状基因组组成的新型PCV。该新型PCV 的衣壳氨基酸与PCV2的同源性为36%,与其他PCV 的同源性低于70%。因此,该新型PCV 被命名为PCV3。几乎同时,另一报道介绍了3 周龄猪出现病因不明的心肌炎。病毒宏基因组分析显示存在PCV3,原位杂交证实PCV3 在与心肌炎相关的心肌细胞,以及炎症细胞和小动脉中膜中复制。
此后,PCV3 成为猪的各种临床表现的疑似病原体,关于该病毒的田间报道和回顾性研究遍布全球(图1)。与PCV3 感染有关的发病机制和免疫反应也取得了进展。本综述旨在总结PCV3 在病毒的基因组特征、流行病学、发病机制、免疫反应和诊断方法上的研究进展。
1 病毒的基因组特征、结构和进化史
PCV 属于圆环病毒科圆环病毒属。所有的PCV 具有相似的形态,由一个紧密的环状单链DNA 基因组组成,其中有两个方向相反的主要开放阅读框(open reading frame,ORF)。PCV3 有一个由2 000 个碱基对组成的双义基因组,其中ORF1 编码由297 个氨基酸组成的复制酶(replicase,Rep)蛋白,ORF2 编码由214 个氨基酸组成的衣壳(capsid,Cap)蛋白,ORF3 编码一个由231 个氨基酸组成的蛋白,该蛋白的功能未知。PCV1 和PCV2 的基因组同源性接近80%,而PCV3 与PCV 家族其他成员的核苷酸同源性较低,与PCV1、PCV2 和PCV4 的核苷酸同源性分别为45.5%、46.8%和43.2%。此外,PCV3 Cap 蛋白与PCV1、PCV2 和PCV4 Cap 蛋白的氨基酸同源性分别为24%、26%~36%和24.5%。
结构分析表明,病毒Cap 结构蛋白能够自我组装成病毒样颗粒(virus-like particles,VLPs)。同样的结构分析表明,与其他环状病毒一样,这些VLPs 具有T=1 的二十面体对称结构,由60 个Cap 蛋白亚基组成2-、3-和5-重轴。PCV3 病毒粒子的半径约8.8 nm,然而对于病毒粒子的真正形态学研究尚未完成。低温电子显微镜结构显示,PCV3 VLPs 的β-链桶状核心区域从外表面到内凹区域发生了明显变化,表明与PCV2 VLPs 相比,其构象灵活性有所增加。对PCV2 和PCV3 的VLPs 比较评估表明,位于第72~79 个氨基酸和第109~131 个氨基酸的灵活区域存在明显差异。
此外,与PCV2 Cap 蛋白相比,PCV3 Cap蛋白的N 端部分密度较低,结构灵活性增加,表明其参与了多项功能。通过比较分析发现,不同PCV3 亚型的VLPs 没有明显的结构差异。这些结果符合PCV 的大体观察结果,即序列变化主要发生在表位水平,不会产生重大的结构变化或影响病毒衣壳的组装。
尽管PCV3 于2016年首次被报道,但大量回顾性研究表明,该病毒在被首次发现之前已经存在了几十年。回顾性研究证明,20 世纪60年代的福尔马林固定石蜡包埋组织样本是能够检测到PCV3 的最早的阳性样本。虽然PCV3的起源尚不清楚,但一种假设认为PCV3 起源于蝙蝠,在不考虑与其他PCV 重组的前提下,PCV3 与蝙蝠的圆环病毒相似。大约215年前,蝙蝠的圆环病毒可能通过野猪中间体跨物种传播给猪。分子系统发育分析预测,PCV3 的最近共同祖先大约起源于20 世纪中期(1945-1966)。最近,根据ORF2 编码氨基酸的差异,显示有6 种不同家系的PCV3 在南美洲和北美洲的猪群之间流行,证明了未知的全球PCV3流行模式的复杂性。
尽管可用的PCV3 全基因组和ORF2 序列很有限,但研究人员还是设计出了几种初步的分类系统。对PCV3 序列进行的同时期和回顾性系统进化分析表明,Cap 蛋白的第24 和27 个氨基酸发生了一致的突变,这可能是潜在的分子标记。根据这些突变,PCV3 可分为3 个进化支:PCV3a、PCV3b 和PCV3c。根据完整的编码序列(ORF1 和ORF2),PCV3a 可进一步分为2 个独特的亚分支(PCV3a-1 和PCV3a-2)和1 个中间进化支(PCV3a-IM)。此外,Chung等根据重组的病毒编码基因,通过最大似然法(maximum likelihood mapping)定位分析,对PCV3 的三种基因型和多种亚型,包括基因型1、基因型2(亚型a 和b)和基因型3(亚型a、b、c、d、e、f、g 和h),进行了分类。
为了统一分类方法,Franzo 等提出了PCV3 亚型的定义,即引导支持度(bootstrap support)大于0.9,全基因组水平的最大遗传距离为3%,ORF2 水平的最大遗传距离为6%,全基因组和ORF2 之间的结果一致。Franzo 等利用这一分类系统确定了2 个进化支,其中进化支1(PCV3a)由先前文献报道的多个亚型组成,进化支2 包含2006年从中国某猪场获得的2 个远缘序列。世界各地的研究人员在PCV3 基因组分析和进化方面取得了许多研究进展;然而,尚未获得有关这些不同的基因型如何引发不同的表型或增强病毒逃逸宿主免疫系统检测的信息。
2 易感宿主
虽然家猪是PCV3 的天然宿主,但一些家养的和野生的动物,如牛、犬、小鼠、岩羚羊、狍子、野猪、蜱虫和蚊子,也能感染该病毒。然而,没有证据表明这些动物在PCV3 的传播上发挥了作用。在家养动物中,牛(28.95%~34.70%为阳性样本)和犬(9.09%~23.60%为阳性样本)感染后会出现病毒血症,但没有出现临床疾病;实验室小鼠感染后也会发生病毒血症,样本的阳性率为100%。当然,还未确定家养动物和实验室动物在多大程度上充当了PCV3 的贮存宿主。Franzo 等报道,岩羚羊和狍子感染PCV3 后的发病率较低。Grassi 等未能在黄喉姬鼠、木鼠和堤岸田鼠(bank Voles)的相关样本中检测到PCV3,这意味着野生啮齿动物可能不会帮助PCV3 在野生动物种群中传播。
野猪可能是一个重要的病毒贮存宿主,Dei Giudici 等、Franzo 等、Klaumann 等和Prinz 等报道,PCV3 在野猪群中的流行率(23.00%~61.54%)高于在一些家养猪群中的。此外,Franzo 等发现,年龄不足12 个月的公猪对PCV3 的感染率低于年龄较大的公猪的。在经过为期5 个月的研究后,Klaumann等提出了长期持续感染的假说,这可能部分解释了年龄较大的公猪感染率较高的原因。
许多田间研究评估了病媒在PCV3 传播上的作用。Franzo 等在有野猪群和无野猪群地区对蜱虫上能否检测到PCV3 进行了研究,结果显示,在有野猪群的地区,能够在蜱虫上检测到PCV3,反之则没有,这表明野猪的存在也可能会影响PCV3 向蜱虫的传播。同样,从PCV3 阳性猪场中捕获的蚊子上也检测到了PCV3。Ha 等报道,在蚊子和猪上检测到的PCV3,它们的基因组序列有100%的核苷酸同源性;但没有临床或实验证据支持PCV3 可通过病媒传播。因此,在蚊子或蜱虫上检测到的PCV3 可能与PCV3 在猪群中的传播无关。总之,PCV3 感染的流行病学、家养动物和野生动物之间的相互作用似乎是一种复杂的关系。
3 临床疾病
PCV3 感染猪后会引发多种临床症状,但其在田间的临床相关性尚不清楚。本综述介绍了PCV3 感染引发的临床症状,这些症状在文献中有过报道,并得到了田间、流行病学或实验性研究的支持。
3.1 繁殖障碍和PDNS
首次检测到的PCV3 与母猪出现PDNS 样皮肤病变、高死亡率和繁殖障碍(包括流产、木乃伊胎和死胎率增加以及受孕率下降)有关。在这份原始报道中,受感染的母猪厌食,出现的肉眼病变,主要为多灶性丘疹、斑疹和浅表性皮炎,与PCV2 感染引发的原发性PDNS 没有区别。对皮肤病变进行组织学检查后,确诊发生了坏死性皮炎和表皮炎,伴有淋巴浆细胞性血管周围袖套、中性粒细胞浸润和出血。肾脏出现增生性肾小球肾炎、皮质肾小管萎缩和坏死以及间质纤维化。肺部表现为支气管间质性肺炎,气道和血管被聚集的淋巴细胞和浆细胞堵塞(图2A)。在与单核炎症细胞相关的肺泡间质中也检测到了PCV3(图2B)。淋巴结出现弥漫性肉芽肿性淋巴结炎,淋巴细胞减少。除了滤泡和滤泡周围淋巴细胞群外,巨噬细胞中也出现了PCV3 的胞浆内染色。随后的病例报道显示了各种临床症状,包括PDNS、繁殖障碍、流产、产木乃伊胎和死胎(表1)。
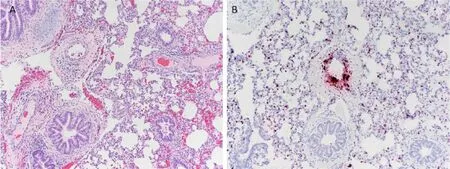
图2 PCV3 mRNA 原位杂交阳性信号相关的组织病理学病变
虽然该临床表现尚未在实验性研究中重现,但PCV3 可引发母猪繁殖障碍的证据主要来自田间报告。哥伦比亚的一份病例报告介绍了一家猪场的母猪出现了繁殖障碍,后备母猪在分娩前被确诊为PCV3 阳性,血清病毒滴度为7.4×103。分娩时该后备母猪出现难产,产下1 具木乃伊胎和10 头仔猪,其中2 头仔猪在围产期死亡。利用PCR 进行组织评估后显示,在PCV3 含量上,胎盘最高,其次为木乃伊胎组织,然后是围产期死亡仔猪的肠系膜淋巴结和肺脏。有趣的是,在这些新生仔猪病例中,肺脏出现间质性肺炎,肠系膜淋巴结表现为淋巴细胞减少和肉芽肿性淋巴结炎,这与之前在母猪上观察到的症状相同。此外,通过原位杂交证实了PCV3 在组织原位上大量复制。其他研究证实,不仅PCR 检测发现胎儿组织含有高浓度的病毒,而且通过原位杂交还发现PCV3在胎儿的脾脏、肾脏、脑和肺脏的动脉中进行自我复制,但未引发明显的组织学病变。偶尔在心肌细胞中发现PCV3 大量复制,但未观察到心肌炎(图3A-B)。虽然尚未确定引发上述生理现象的相关病因,但通过PCR 可在流产胎儿和死胎组织中检测到PCV3,未检测到其他病原体。然而,Tochetto 等在最近一项田间研究中发现,分娩母猪的病毒血症与死胎比例存在相关性,但该报道的数据却相互矛盾。据报道,在流产胎儿和胎盘合并感染或共同检测的情况下,PCV3 也是引发母猪出现繁殖障碍的部分病因;因此,需要进一步研究以确定PCV3 是这些混合感染病例的主要病原体或偶然发现的病原体。最后,Arruda 等报道,在与高流产率相关的围产期死亡病例中也检测到了PCV3。因此,与繁殖问题相关的新生仔猪死亡有可能是宫内感染的结果。
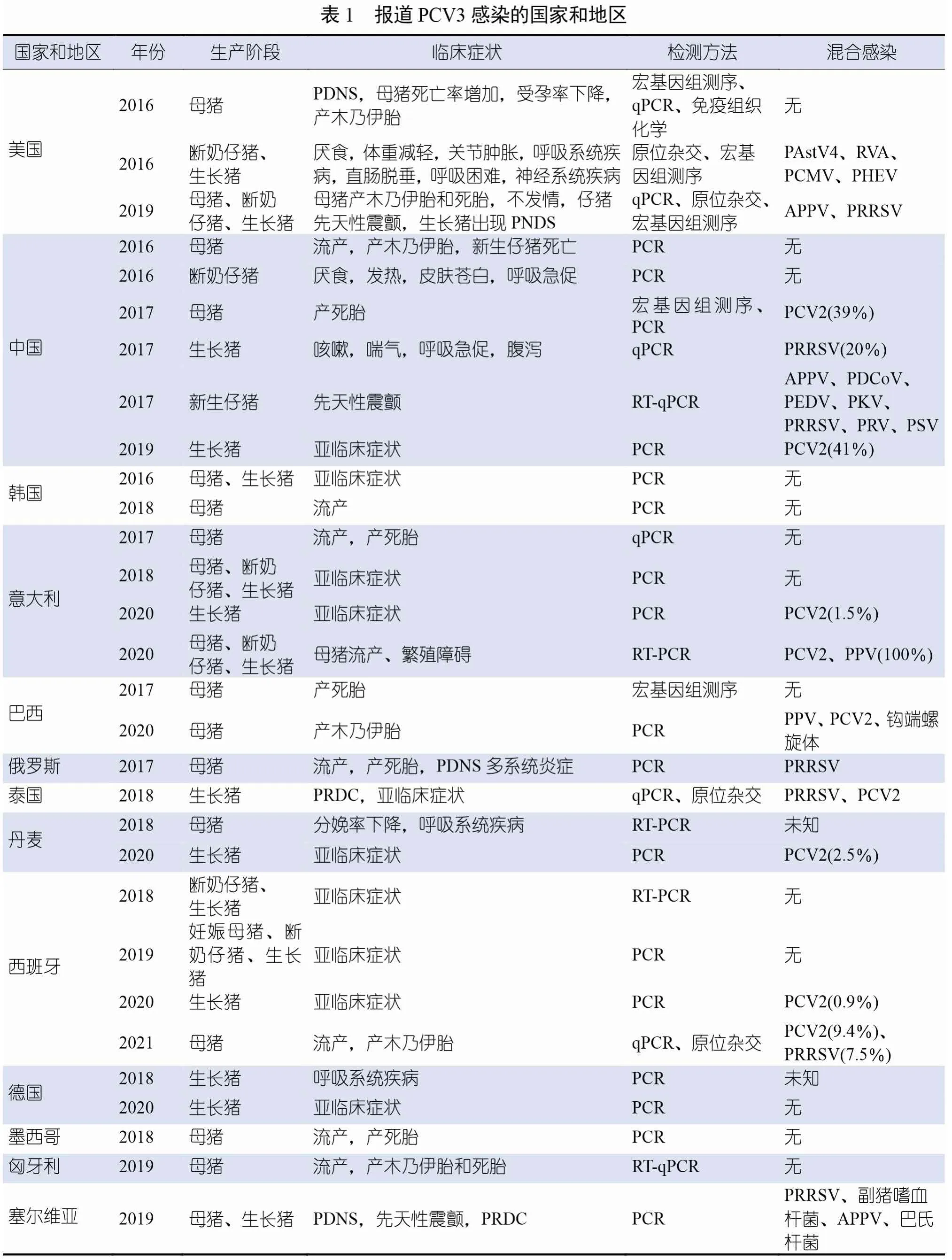
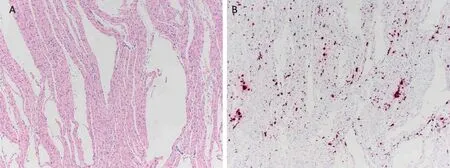
图3 猪圆环病毒3 型(PCV3)引起的流产胎儿心脏组织病变的原位杂交结果
3.2 多系统炎症综合征
在报道PCV3 感染的文献中,统一认为感染猪暴发了多系统炎症。美国首次报道PCV3感染的研究人员认为,这种新发现的病毒与保育猪(2~3 周龄) 和生长-育肥猪(9~10 周龄) 的多系统炎症有关。研究人员观察到的临床症状包括淋巴浆细胞性心肌炎、间质性肺炎和急性支气管炎,通过原位杂交在病变部位检测到了PCV3。这种炎症过程与PCV3 检测的临床关联或表现仍不清楚。然而,临床报道记述了猪发育不良,生产性能下降和突然死亡。虽然这些临床症状没有特异性,但组织学评估一致显示,围产期仔猪和断奶仔猪暴发了多系统炎症。
临床病例中报道的病变经PCR 和原位杂交证实为PCV3 阳性,同时包括淋巴浆细胞性血管炎(主要出现在心脏、肾脏和肠系膜血管),以及伴有表皮坏死的纤维素性坏死。在心脏、脾脏、肾脏和肝脏等多个组织的小血管内膜和中间层上都检测到了病毒,支持了多系统性血管周炎的观点(图4A-D)。Arruda 等发现,感染猪淋巴结中也出现了莫特细胞和大量的巨噬细胞。尽管文献描述不一致,但淋巴结和脾脏中淋巴细胞的减少与PCV3 有关(图5A-B)。Yajima 和Knowlton 详细介绍了PCV3 感染在心肌炎发生中的作用。
最近,McMurray 等发现,人感染冠状病毒后会出现一种类似的综合征,包括淋巴浆细胞性心肌炎和全身性血管炎。在其他病毒感染中,也曾出现过病毒血症持续时间长、中和抗体活性降低,随后出现有害的T 细胞反应。这种情况会引发非特异性多系统炎症综合征,通常会导致多系统衰竭。尚不清楚这些是否是PCV3 发病机制的基础,因此有必要开展更多的研究,以了解PCV3 感染的完整发病机制和临床表现,以及这种临床表现是否会因混合感染而加剧,或是否容易继发感染。
3.3 亚临床感染和混合感染
大量回顾性研究表明,亚临床感染发生在各年龄段的猪上,在无明显临床症状的组织中检测到PCV3 也证明了这一点(表1)。此外,除了在有亚临床症状的母猪体内检测到PCV3特异性抗体外,还在无明显临床症状的猪的唾液中检测到了PCV3。所有这些信息也得到了在未受到临床感染的猪体内检测到病毒血症的报道的支持。
在田间由PCV3 和多种猪病原体组成的共感染已被普遍报道。在全球范围内,有病例报道PCV3 与其他主要的具有重要经济价值的猪病原体混合感染,包括PCV2、PRRSV、PPV、猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)、猪德尔塔冠状病毒(porcine delta coronavirus,PDCoV)和经典猪瘟病毒(classical swine fever virus,CSFV),而其他一些PCV3 感染病例与流行率较低的病原体共同感染(表1)。一些研究报道了PCV3 与其他引起母猪繁殖障碍的病原体的混合感染率。在美国、中国、韩国、泰国和欧洲国家,PCV2 和PCV3 的混合感染率从1.26%到70.00%不等。PRRSV 和PCV3 的混合感染率从0.67%到61.54%不等。同时,Ha 等报道,PCV3 与PPV2、PPV6 和PPV7 的混合感染率分别为8.6%、20.0%和24.8%。意大利的一项报道显示,PCV3 和PPV 在散养猪和野猪上的混合感染率分别为2.6%和3.5%;然而,该研究并未在家猪上检出此类混合感染。此外,PCV2、PCV3 和PPV 混合感染在家猪、散养猪和野猪上分别为8.8%、53.0%和59.0%,这表明PPV 而非PCV3 可能是PCV2 导致猪发生繁殖障碍的一个重要辅助因素。Zhen 等对亚洲某国家猪的PCV3 阳性样本检测后发现,分别有83.3%、71.2%和50.0%的样本同时感染了猪细环病毒1 型(Torque teno sus virus,TTSuV1)、TTSuV2以及TTSuV1 和TTSuV2。虽然报道混合感染的文献很多,但没有关于以下方面的信息:(1)PCV3 作为主要病原体或混合感染病原体的作用;(2)混合感染导致的病毒复制增加。这些报道很少描述临床信息,而且仅限于介绍检测情况。总之,PCV3 与其他病毒和细菌混合感染的情况很常见,这表明PCV3 可能是某些病原体的辅助因子,或可能需要其他辅助因子才能引发临床疾病。建立混合感染模型可能有助于更好地了解引发临床疾病所需的辅助因子或易感因素。
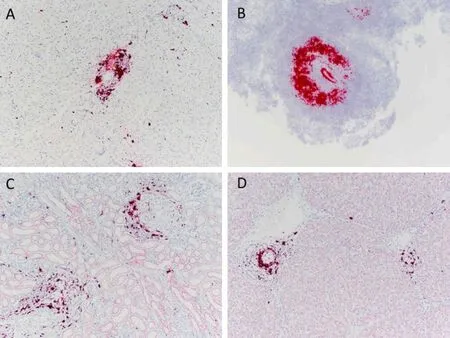
图4 组织进行mRNA 原位杂交的结果
3.4 在实验条件下观察到的临床疾病
PCV3 阳性样本是在野外条件下从亚临床个体上采集的,因此经常出现临床症状,这给实验带来了挑战。利用PCV3 分离株ISU27734感染6 周龄的剖宫产无初乳(colostrumdeprived,caesarian-derived,CD/CD)猪,猪经鼻腔和肌内接种PCV3 全病毒,并通过皮下注射用弗氏不完全佐剂乳化的钥孔戚血蓝蛋白(keyhole limpet hemocycanin,KLH) 进行免疫刺激。在为期28 d 的研究中,所有接种猪均未出现临床症状。经组织学检查发现,8 头仔猪中的4 头出现了亚急性多系统炎症,包括淋巴浆细胞性心肌炎、间质性肾炎和淋巴浆细胞性动脉周炎。总体而言,实验条件下诱发的病变在严重程度上要低于临床病例报告中描述的水平。
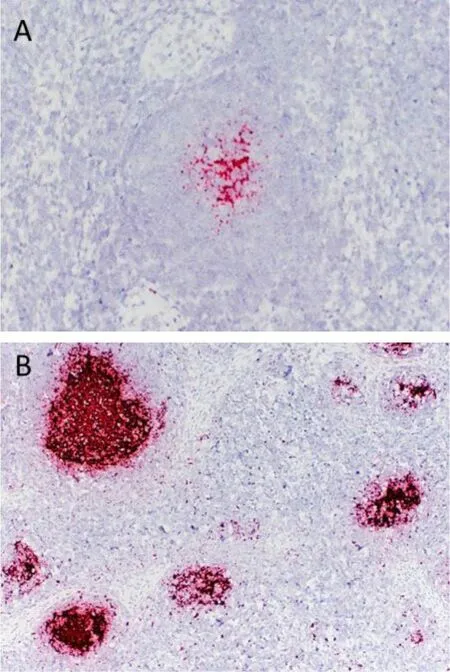
图5 淋巴组织的mRNA 原位杂交结果
另一项研究用PCV3 阳性组织匀浆感染第一个处理组的CD/CD 保育猪;用PCV3 感染材料感染第二个处理组的CD/CD 保育猪,并用KLH 作为佐剂。在这两个PCV3 感染组中,试验猪分别进行了肌内和鼻内接种,并在第一次接种疫苗7 d 后再次接种。在为期42 d 的研究中,试验猪在临床上没有发病,但两个感染组的试验猪都出现了多系统炎症的组织学病变,表现为淋巴浆细胞性心肌炎和动脉周炎、间质性肾炎、伴有血管周炎的淋巴浆细胞性脑炎、淋巴浆细胞性肝炎、淋巴浆细胞性动脉周炎以及肠浆膜和脾脏动脉炎。
根据这两项试验研究可以得出结论,PCV3感染足以使猪产生多系统炎症综合征。然而,实验性病变在严重程度上与田间病例报告介绍的病变程度不尽相同,这表明其他辅助因素或混合感染可能会加剧PCV3 的发病机制。最后,实验性研究未能再现明显的临床症状,这可能表明田间观察到的病例并不完全是PCV3 感染所致。
4 发病机制
4.1 病毒血症
田间研究表明,PCV3 感染引发的病毒血症在病毒被动物机体完全清除前会持续较长时间。在对4 家不同猪场的商品猪从断奶到屠宰期间进行的定期评估中发现,病毒血症是间歇性的,整个生产周期的阳性率为6.5%~25.0%,表明可能存在长期持续性感染。田间病例还表明,母猪体内的病毒载量可能与其所处的胎次有关,2 胎母猪体内的病毒载量最高,4 胎母猪的最低。Kedkovid 等指出,高胎次母猪体内的病毒载量减小,可能是由于在整个生产周期中多次感染PCV3 后产生了免疫力。同样,Eddicks 等研究发现,青年公猪体内的病毒载量较高,12 月龄以下的公猪体内的病毒载量明显高于大年龄公猪的。
在多项实验性研究中,最早在感染后3 d就能够从试验猪中检测到病毒血症,到感染后21 d 时,阳性猪的比例达到最高。此外,不同报道对基于基因组拷贝的病毒血症的介绍也不尽相同,在感染后3~21 d 达到最大浓度。病毒的毒株、感染途径、接种时猪的年龄以及不同实验环境中使用的潜在辅助因子可能只是影响病毒活力的几个因素。然而,所有这些研究一致报道,至少在感染后28 d 才可以检测到持续的病毒血症,有些病例在感染后42 d 才确诊。观察到的长期或持续性感染的可能性与在其他ssDNA 病毒感染中观察到的情况一致,如PCV2、TTSuV。
4.2 排毒和传播
目前已发现PCV3 有几种不同的排毒途径,但仍然未知病毒的传播途径。Kwon 等发现能够在亚临床感染的猪的唾液中检测到PCV3,表明PCV3 可以经口传播。此外,Kedkovid等利用PCR 检测猪的唾液腺,结果检测到了PCV3;然而,尚未通过免疫组织化学或原位杂交等原位检测方法证实病毒的复制。Temeeyasen 等在感染后3~28 d 从实验性接种的猪的鼻腔中检测到了间歇性排出的病毒,接种后第1 周从猪的粪便中检测到间歇性脱落的病毒。只有一项报道介绍了PCV3 可以垂直传播,1 头后备母猪在分娩前被确诊为PCV3阳性,在其胎盘、所产木乃伊胎和产后立即死亡的弱仔猪中检测到了病毒。Kedkovid 等证明,PCV3 还可通过初乳传播,这可能有助于病毒的垂直传播。然而,目前尚不清楚PCV3是否会通过乳腺发生感染和复制;因此,需要进一步探讨病毒通过初乳排毒的潜在机制。用qPCR 检测公猪的精液和睾丸组织,证明存在PCV3,这表明PCV3 可能有性传播的风险。Eddicks 等对一家种公猪场的人工授精的精液进行了检测,发现PCV3 的检出率相对较低,为1.7%。然而,公猪精液在PCV3 引起的繁殖障碍中所起的作用仍然未知。PCV3 在环境中的存活和持久性,以及病毒污染物在传播中的潜在作用,尚未得到充分的研究。Franzo等发现,对运输车消毒后,仍能从车上的海绵中检测到PCV3,表明环境样本可能有助于病毒的传播。总之,所有这些研究认为,PCV3可通过猪的大多数体液排毒,因此能够进行水平传播,并可在环境中持续存活。然而,需要进一步研究,以了解PCV3 在阳性猪场中永存的机制,以及亚临床感染个体在水平传播和垂直传播中的作用。
4.3 PCV3 在细胞和组织中的复制
尚不清楚PCV3 进入猪体细胞的具体机制以及与临床疾病相关的受体;不过,已确定病毒复制的不同细胞。原位杂交证明,在自然感染母猪的流产胎儿和木乃伊胎中,PCV3可以在心肌细胞、心脏和肾脏动脉的平滑肌细胞以及胎盘的滋养层细胞中复制。同样,在患有多系统炎症的断奶仔猪和生长猪上,普遍发现PCV3 可以在心肌以及心脏和肾脏动脉的平滑肌细胞中复制。此外,Arruda 等和Mora-Díaz 等在猪皮下脂肪细胞、大脑白质和灰质小动脉平滑肌以及室管膜细胞中检测到了PCV3。Arruda 等指出,在猪肠系膜和胸膜的间皮细胞、肺细胞、肺动脉平滑肌细胞、肾小管上皮细胞、肝细胞和淋巴结生发中心的淋巴细胞中罕见检测到病毒复制。
Mora-Díaz 等通过原位杂交发现,PCV3 可以在实验性接种的6 周龄CD/CD 猪的心肌细胞、心脏小动脉中膜、肾小管上皮细胞和肾脏动脉中膜中复制。此外,实验性研究也表明,PCV3 可以在5 周龄CD/CD 猪肝窦的内皮细胞,以及与间质性心肌炎和皮质间质性肾炎、脾脏白髓、小肠派伊尔结和肠道浆膜炎症灶有关的淋巴细胞中复制。免疫组织化学分析显示,4 周龄和8 周龄无特定病原体猪的心肌细胞、肾小管上皮细胞、肝细胞和肝窦,以及支气管、肠系膜和腹股沟淋巴结的皮质和髓质巨噬细胞出现阳性反应。Jiang 等证明,PCV3 可以在作为一种感染模型的昆明小鼠的心肌和肺泡中进行复制。总之,这些田间和实验性研究结果表明,PCV3 具有广泛的细胞趋向性,可能表明,存在一种常见的细胞受体来促进病毒进入细胞,并在细胞中复制。
事实证明,确定PCV3 复制的细胞系也具有挑战性。已尝试在多种细胞系中分离PCV3,包括猪肾上皮细胞(PK-15) 和猪睾丸细胞,但结果存在争议。从21 日龄猪的猪肾原代细胞中成功分离和传代了PCV3。虽然细胞病变效应似乎不是PCV3 感染的主要特征,但通过细胞质以及原位杂交对病毒核酸的检测证明存在病毒复制。也有报道称,在PK-15 细胞中成功分离到了PCV3,在猪肾原代细胞上观察到相似特征,没有细胞病变效应,原位杂交检测到较强的病毒复制。将线性化PCV3 DNA 转染猪肺泡巨噬细胞(3D4/21)细胞系,成功地从感染性克隆中解救出一种合成病毒。免疫荧光试验证明了PCV3 Cap 蛋白的核表达,表明3D4/21 细胞系可以支持病毒的复制和包装。
虽然关于受体和病毒入侵机制的资料有限,但研究人员推测PCV3 与PCV2 使用不同的机制。糖胺聚糖,包括硫酸乙酰肝素和硫酸软骨素B,已被确定为PCV2 感染所必需的黏附受体。然而,PCV3 Cap 蛋白缺失PCV2 Cap蛋白中的硫酸乙酰肝素结合基序。对PK-15细胞的研究表明,病毒主要是通过网格蛋白和发动蛋白2 介导的内吞作用入侵细胞,而病毒复制依赖于介导早期和晚期体内运输的Rab5 和Rab7,以及酸性细胞质环境。此外,核定位信号(nucleolar localization signal,NoLS)与核仁磷酸化蛋白(nucleolar phosphoprotein nucleophosmin-1,NPM1)之间的相互作用促进了核定位。Song 等发现,PCV3 Cap 蛋白的第1~38 位氨基酸残基可以直接与NPM1 相互作用。在NPM1 的N 端寡聚化结构域中,第48 位的丝氨酸的电荷性质对Cap 蛋白的相互作用和亚细胞定位至关重要。Zhou 等证明,PK-15 细胞感染PCV3 后,NPMI从细胞核转移到细胞质,导致与Cap 蛋白共定位。NPM1 上调会增加PCV3 的复制。在过去几年中,病毒感染的复杂机制已被部分揭开。然而,对PCV3 发病机制的进一步研究取决于能否找到一种稳定的细胞系,来持续支持PCV3复制,并随后分离出病毒。
5 免疫反应
5.1 先天性免疫反应和细胞因子的产生
尽管在免疫反应这一领域取得了一些进展,但人们对PCV3 感染的先天性免疫反应还不完全了解,仍需继续研究。一般来说,先天性免疫反应是宿主通过模式识别受体和病毒DNA 特有的病原体相关分子模式识别病毒而启动,从而诱导干扰素的产生。体外试验结果表明,PCV3 Cap 蛋白可通过视黄酸诱导基因样解旋酶(retinoicacid-inducible genelike helicase,RLH)或Toll 样受体(Tolllike receptors,TLRs) 激活促炎细胞因子白细胞介素6(interleukin 6,IL-6)、肿瘤坏死因子α(tumor necrosis factor α,TNFα) 以及核因子-κB(nuclear factor kappa-B,NF-κB) 信号。对体内先天性免疫反应模型的评估表明,PCV3 感染对IL-8 有调节作用,与PCV2 感染类似。然而,IL-10 和大多数促炎细胞因子(TNF-α、IL-1β、IL-2和IL-4) 对PCV2 的发病机制至关重要,但在PCV3 感染期间体内似乎并未受到影响。需要进一步的研究,以揭示PCV3 感染期间宿主识别的分子和实际机制的作用,以及干扰素和趋化因子产生的启动机制。这方面的信息将有助于更好地了解PCV3 亚临床感染、临床疾病的过程以及发生混合感染的可能性。
5.2 体液反应
目前对PCV3 体液反应的了解大多基于田间研究,这些研究主要试图检测是否存在PCV3 诱导的抗体。然而,人们对这些抗体在PCV3 感染期间的保护作用或动态变化知之甚少。Deng 等在一项回顾性研究中提供了自2015年以来PCV3 在中国猪群中流行的血清学证据,发现到2017年,PCV3 血清阳性率明显提高(由22.35%提高至51.88%)。另一项对中国PCV3 阳性猪场进行的血清学研究表明,在所有生产阶段的猪中,母猪的抗体滴度最高。此外,无论是否存在临床或亚临床的繁殖障碍,抗体水平和阳性猪的数量均无差异。最后,同一项田间研究报道,抗体阳性率与较高水平的病毒血症呈正相关。
在多家猪场进行的一项纵向研究中,病毒检测结果表明,6 周龄后的猪会出现不同的检测结果,到24 周龄时,阳性猪的数量会增加。根据这项研究的结果,人们推测母源抗体可以保护仔猪,由于母源抗体下降,阳性猪的比例随着年龄的增长而增加。其他田间研究也支持这一假设,因为3~4 周龄的仔猪没有发生病毒血症。总之,这些田间研究结果表明,PCV3可能具有与PCV2 相似的母源抗体动力学,即在未接种疫苗的猪群中,母源抗体在6~10 周龄消失,随后在保育后期和生长早期,感染猪的比例会增加。还需要进行更多的研究,以确定PCV3 母源抗体的存在和活跃状态及其在猪群感染动力学上的潜在作用。通过实验性接种,IgG 和IgM 反应进行了部分表征。早在感染后3~10 d 就能检测到特异性IgG 抗体,感染后17 d 抗体水平最高,感染后21 d 抗体水平迅速下降。此外,接种PCV3 并用KLH 刺激的猪会产生长时间的IgG 反应,感染后10 d 检测到抗体,感染后28 d 抗体达到最高水平,感染后42 d 仍可检测到抗体。用KLH 进行刺激可以反映现场的PCV3 感染情况,其中与单独感染PCV3 相比,KLH 辅助因子的存在会产生更强大的免疫反应。相反,在实验性接种的猪上并未观察到IgM 反应。
Zou 等指出,在很大程度上人类仍未对B 细胞反应进行探究,不过,利用免疫表位数据库分析资源预测了第93~103 位、第109~146 位和第170~181 位氨基酸残基的免疫原性B 细胞表位。为了进一步确定Cap蛋白中潜在免疫原性表位的特征,通过创建序列重叠区域显示,线性免疫原性B 细胞表位位于第51~65 位、第136~150 位和第155~169 位氨基酸残基。最小基序的氨基酸残基为第57~61 位、第140~146 位和第161~166 位,这些氨基酸残基已被确定为进化过程中的保守表位序列。在多序列比对中,第57~61 位和第161~166 位氨基酸基序上均未发现氨基酸置换或间隙,表明PCV3 流行株之间具有高度保守性。相比之下,在第140~146 位氨基酸基序中,100 个毒株中有1 个在第140 位氨基酸处出现了K 到R 的氨基酸置换,这意味着这些表位的保守性可能较低。有研究构建了三维模型,用于了解Cap 蛋白的结构和组装成VLPs 的过程。在PCV3 Cap 单体中,所有确定的线性表位都暴露在病毒Cap蛋白表面。然而,当组装成VLPs 时,表位第140~146 位被包埋在内部,表明该表位位于Cap 蛋白的内部。对实验早期产生的单克隆抗体进行筛选后发现,表位第140~146 位占主导地位。这种对特定表位的优势抗体反应可能是“诱骗表位”的特征,在这种表位中,免疫系统产生的抗体几乎没有中和能力来降低病毒滴度。
5.3 细胞介导的免疫反应
PCV3 感染后细胞介导的免疫反应尚不明确。研究表明,5 周龄的CD/CD 猪接种PCV3感染物质并用KLH 刺激后,并没有产生明显的细胞反应。因此,在T 细胞亚群中没有观察到差异,包括辅助性T 细胞(CD4+CD8+)、细胞毒性T 细胞(CD4 CD8+高)、记忆性T 细胞(CD4+CD8+低) 和调节性T 细胞(CD4+CD25+Foxp3+)。这些结果与PCV2 感染期间观察到的细胞反应形成鲜明对比,在PCV2 感染期间,由于CD8+和CD4+CD8+双阳性T 细胞群减少,淋巴细胞明显减少。实验性研究还表明,PCV3感染可降低植物血凝素刺激下的外周血单核细胞(peripheral blood mononuclear cell,PBMC)的增殖,导致淋巴细胞增殖减少。这种对植物血凝素(一种有丝分裂原)反应弱可能是因为T 细胞无能。从感染PCV2 的猪上分离到的PBMC 中也观察到类似的反应,PBMC 对超级抗原或有丝分裂原的反应较弱或无反应,降低了IL-4、IL-2 和IFN-γ 的水平。有趣的是,无论外周对PCV3 的免疫反应如何,组织评估显示,淋巴细胞的大量涌入都与T 细胞群有关,这意味着感染组织会发生T 细胞群失衡,而不会转化为全身性变化。虽然PCV3 最初与淋巴细胞耗竭有关,但现在已清楚,PCV3 感染并不具有PCV2 的大多数特征,如淋巴细胞减少、淋巴组织中组织细胞替代以及巨噬细胞和B 细胞对病毒的吸收。总之,细胞反应的这些关键差异表明,PCV3 对猪免疫系统的调节和功能的影响与PCV2 的不同。
5.4 免疫逃逸策略
多项田间和实验性研究表明,PCV3 感染的特点是病毒血症时间长。然而,尚未完全清楚允许病毒血症时间延长的免疫逃逸机制。一些体外研究证明,PCV3 Cap 蛋白可抑制干扰素(interferon,IFN)-α 和IFN-β 的产生。在人胚肾细胞(human embryonic kidney cells 293T,HEK-293T) 中,PCV3 Cap 蛋白抑制了干扰素刺激反应元件(IFN-β-stimulated response element,ISRE) 启动子的活性,表明Cap 蛋白能抑制IFN 信号。然而,该研究还表明,PCV3 Cap 蛋白既不影响信号转导及转录激活蛋白(signal transducer and activator of transcription,STAT)1 和STAT2 的表达和磷酸化,也不影响IFNs 转录和激活所必需的pSTAT1/pSTAT2 的异源二聚化。此外,PCV3 Cap 蛋白与核转运蛋白α1(karyopherin subunit alpha 1,KPAN1) 的相互作用并不影响核转运活性。细胞质DNA 传感器环磷酸鸟苷-磷酸腺苷酸合成酶(cyclic GMP-AMP synthase,cGAS) 可识别外源DNA,并激活cGAS-STING 通路,从而产生I 型干扰素。此外,GTP 酶激活蛋白(SH3结构域) 结合蛋白1[GTPase-activating protein-(SH3domain)-binding protein 1,G3BP1]通过促进DNA 结合和cGAS 激活,可增强先天性抗病毒免疫反应。PCV3 Cap 蛋白通过RGG 结构域与G3BP1 相互作用,抑制cGASSTING 信号,从而抑制DNA 诱导的IFN-β mRNA 转录和干扰素启动子的激活。这些研究表明,PCV3 可调节I 型干扰素反应,以逃逸宿主免疫反应。
自噬利用溶酶体和液泡来回收细胞成分,被认为是病毒用于增强复制和持久性的另一种机制。PCV2 Cap 蛋白通过AMPK/ERK/TSC2/mTOR 信号通路诱导完全自噬,使病毒能够通过自噬机制加强复制。研究表明,PCV3 Cap蛋白可在HEK-293T 细胞中通过mTOR 途径诱导自噬。Cap 的表达导致磷酸化的mTOR 含量降低,而mTOR 的水平保持不变。此外,LC3-Ⅱ与LC3-Ⅰ的比率以及p62 与β-肌动蛋白的比率的增加,也表明泛素-蛋白酶体途径可能有助于自噬。要确定PCV3 Cap 蛋白和其他ORFs在猪细胞系和体内模型中诱导细胞凋亡和自噬的情况,还需要进一步的研究。
6 诊断
6.1 临床诊断
PCV3 感染的最终临床结果仍存在疑问。最近发布的PCV3 感染的病例定义有PCV3 繁殖障碍和PCV3 系统疾病。然而,除了多系统炎症外,这一新的病例定义提出的临床症状均未在实验性研究中重现。临床上,PCV3 感染最常见的症状是母猪繁殖障碍和PDNS 样病变,以及生长猪的多系统炎症。由于PCV3 感染与其他猪病原体感染的临床表现相似和部分相同,仅凭临床症状确诊PCV3 感染可能并不准确。因此,PCV3 相关疾病(PCV3-associated disease,PCV3-AD)需要实验室支持。
6.2 直接检测方法
目前已开发出多种基于PCR 的诊断检测方法,包括基于荧光染料掺入法(SYBR Green)的实时qPCR、基于TaqMan的实时PCR和直接PCR,对组织、器官、血清、唾液、鼻拭子和环境样本的检测限均小于102拷贝/μL。微滴式数字PCR 具有更高的灵敏度,可检测组织和血清样本中的PCV3,检测限为1 拷贝/μL。重组酶聚合酶扩增(recombinase polymerase amplification,RPA) 和环介导等温扩增(loop-mediated isothermal amplification,LAMP)等等温扩增方法也已成功开发,可用于检测组织和血清样本,其灵敏度与qPCR 相当。最近,利用等温扩增原理的诊断分析(添加指示剂染料甲酚红和苯酚红)实现了血清样本的可视比色检测。
由于PCV3 与其他猪源性病毒混合感染的发生率相对较高,一些方法可以在存在其他病原体的情况下检测PCV3。多重qPCR 检测法可从组织提取的病毒DNA 中检测PCV3 及其他PCV和其他病原体,其灵敏度与PCV3 的单重qPCR相当。利用双标记(TaqMan)探针开发了一种四重实时PCR 检测方法,可同时检测组织样本中的PCV1、PCV2、PCV3 和PCV4,其特异性和灵敏度与单重和传统PCR 检测方法相当。此外,用于组织样本中PCV2 和PCV3 双重检测的高灵敏度微滴式数字PCR 对PCV2 和PCV3 的检测限分别为2 拷贝/μL 和1 拷贝/μL。
原位杂交已被用于证实PCV3 在可疑病变组织复制。一些检测方法使用RNAScope 检测平台,利用探针靶向PCV3 ORF1 病毒mRNA 的反向补体。其他原位杂交方法利用了PCV3 特异性地高辛探针。通过原位杂交或RNAScope诊断PCV3 时,提交的组织病理学标本应包括心脏、肺脏、脾脏和淋巴结的样本。PCV3 抗体的开发及其在抗原直接检测中的应用一直受到限制,这可能是由于病毒难以分离。不过,也有少数研究利用免疫组织化学和免疫荧光来检测PCV3 抗原。PCV3 Cap 蛋白的单克隆抗体与PCV2 没有交叉反应,并且在扁桃体和淋巴结上能很好地检测到PCV3 抗原。有报道称,在间接免疫荧光检测中使用向BALB/c 小鼠腹腔注射PCV3 颗粒产生的多克隆抗体,通过细胞培养可确定病毒。
6.3 间接检测方法
为了检测PCV3 特异性抗体,已建立了几种ELISA 检测方法。密码子优化的全长Cap 蛋白已在大肠杆菌表达系统和杆状病毒表达系统中成功表达。与PCV2 相似,PCV3 Cap 蛋白N端33 个氨基酸为核定位信号,具有较多的精氨酸,且密码子少,阻止了蛋白质在原核系统中表达。因此,大多数报道的ELISA 使用的是在大肠杆菌中表达的截短Cap 蛋白,其核定位信号序列被排除在外。Deng 证明,间接ELISA 灵敏度高,PCV3 特异性IgG 的最大稀释度为1∶3 200;同时,未发现与PCV1、PCV2、PPV、PRV、PRRSV 和CSFV 等其 他猪源性病毒产生交叉反应。文献报道的ELISA 大多数是为评估PCV3 特异性IgG 而开发的。然而,Mora-Díaz 等开发了一种间接ELISA,最早可在接种后7 d 检测PCV3 特异性IgM。PCV3特异性抗体的血清学评估也是通过使用表达PCV3 Cap 或转染重组pcDNA3.1-Cap 的杆状病毒进行直接免疫荧光检测来实现的。
7 总结与未来展望
自2016年报道首例由PCV3 感染引发的病例以来,该病毒已在全球范围内被广泛报道,并引发了多种临床症状。其中三种主要表现形式不断被报道,并在一定程度上得到了文献的支持:多系统炎症综合征、繁殖障碍和PDNS以及亚临床感染。在大量病例报道中,很难确定PCV3 在不同临床表现中的致病作用,原因如下:一是PCV3 常与多种病原体混合感染;二是病理学评估不足;三是缺乏原位检测,无法确定病变或感染组织中是否存在病毒基因组或抗原。迄今为止,与PCV3 感染有关的重要证据是母猪繁殖障碍、多系统炎症和亚临床感染。
还需要在实验条件下进行进一步的研究,以确定PCV3 感染作为引起临床疾病的主要病原体的真实效果。要解决这个问题,关键的一步是要开发实验挑战模型,使其能够再现与田间报道相似的疾病严重程度。目前,关于PCV3 混合感染的报道有很多,因此,应将此类混合感染作为引起更严重的PCV3 临床疾病的潜在因素进行评估。回顾性研究显示,PCV3已在全球流行了几十年,另一种假设是PCV3可能是PCV2 和PRRSV 等其他病原体感染的辅助因子,只是PCV3 当时尚未被发现。因此,应开发PCV3 混合感染模型,以证明PCV3 与其他病原体之间的协同作用关系。
持续病毒血症已在实验中得到证实,并在田间研究中得到了确认,这表明存在再感染的可能性。然而,目前还没有阐明PCV3 如何导致长期持续感染以及可能会再感染的机制。多项研究表明,PCV3 可通过猪的唾液、鼻腔分泌物和粪便排毒;然而,人们对水平传播的机制仍知之甚少。PCV3 通过公猪的精液和母猪的初乳进行垂直传播已得到证实,垂直传播的重要证据是在分娩前呈PCV3 阳性的后备母猪所产死胎和木乃伊胎中也检测到了PCV3。此外,家猪和野猪群作为PCV3 贮存宿主以及跨物种传播的可能性尚未被确定。更好地了解传播途径可以有效地控制和预防疾病。利用PCR可以在多种组织中检测到PCV3,因此,开发针对特定样本类型的更灵敏、更特异的诊断方法是应用不同诊断策略的当务之急。
缺乏有效的病毒分离方法和培养分离病毒的细胞系是目前PCV3 研究的主要限制之一。文献中关于通过获得感染性克隆分离病毒的报道也很少。虽然可以推测PCV3 入侵和复制的一些基本机制与PCV 家族的其他成员相似,但仍需要进一步的研究来确定合适的细胞系,从而有效地分离病毒,研究病毒致病的基本机制。
最后,尽管人们在了解与PCV3 相关的体液免疫反应方面取得了进展,但免疫反应的特征仍不太明了。有趣的是,通过实验性接种或田间研究检测到的抗体与病毒清除之间并无关联。病毒分离株的缺乏阻碍了对中和抗体的评估,而Cap 蛋白中的非特异性原表位或“诱骗表位”可能会影响中和抗体的产生,从而减少或延迟中和抗体的产生,进而影响病毒的清除。因此,需要进行更多的研究来评估中和抗体反应。此外,在评估细胞反应及其在病毒清除中的作用方面也鲜有进展。
本综述总结了自PCV3 首次报道以来的研究进展。此外,还需要进一步的研究以填补领域中存在的不足,包括:(1)病毒循环及其在亚临床感染动物中的作用;(2)持续性病毒血症对病毒排毒和病毒在环境中存活的作用;(3)混合感染的发病机制和免疫反应;(4)引发不同临床表现的因素;(5)该病对养猪业的实际影响。
