固沙林恢复土壤酶化学计量特征与养分限制效应
2023-10-23张延文周雅洁张不染拓卫卫佟小刚
张延文, 周雅洁, 张不染, 拓卫卫, 杨 京, 佟小刚
(1.西北农林科技大学 水土保持研究所, 陕西 杨凌 712100; 2.西北农林科技大学 资源与环境学院, 陕西 杨凌 712100)
沙漠化是全球生态环境防治的重大问题。过去七十年,我国通过大规模生态林工程的实施,实现了沙漠化的逆转,产生了巨大的生态恢复效益[1-2]。但限于沙漠化地区的脆弱生态环境,维持固沙林植被与土壤的自我恢复能力,成为沙区生态系统可持续恢复的关键[3]。大量研究表明林地系统养分转化与累积调控着植被与土壤的协同恢复[4]。以往人们多关注于固沙林植被恢复的生态功能,如土壤养分含量的增加、微生物活性的提高等[5-7]。现在越来越多的研究关注到植被和土壤之间的协同交互关系以及相关的生物学养分转化过程,这对认识植被恢复养分循环机理具有重要的科学意义。
土壤胞外酶作为土壤有机质分解的驱动力,可以调节有机质分解转化和微生物吸收利用土壤C,N,P等养分元素[8-9],有效催化生态系统中物质与能量的转化[10]。因此,探究生态酶活性可以表征微生物对能量与养分的利用效率[11]。特别是生态酶的化学计量特征与微生物的养分需求密切相关[12],微生物活动受何种养分资源限制可以由土壤生态酶计量比表达[13-14]。如通过酶活性计算的矢量长度和矢量角度可反映微生物活动受限养分类型,也可帮助明确植被恢复过程中微生物营养限制的演变特征。Sinsabaugh等[15]研究发现酶的生态化学计量比可以更好地反映微生物的代谢和营养需求之间的生化平衡。Zhao等[16]将土壤碳、氮、磷的化学计量学与土壤微生物和β-葡萄糖苷酶、亮氨酸氨肽酶、β-1,4-乙酰氨基葡萄糖苷酶、碱性磷酸酶的化学计量学结合起来研究,结果表明土壤微生物和酶的化学计量学在很大程度上受土壤养分化学计量学的调控。因此,土壤胞外酶及其生态化学计量通过反映土壤微生物对碳氮磷养分的需求,从而可以显示出微生物的营养限制作用[17]。但目前生态酶化学计量特征及其养分限制效应对沙漠化土地植被恢复的响应研究还较为薄弱。
毛乌素沙地是我国沙漠化治理的典型区域,通过60多年的治理,植被覆盖率已由50年代连片沙丘的1.8%[18]增加到目前的80%。鉴于此,本研究选择毛乌素沙地从半固定沙地到长期恢复的典型灌木和乔木固沙林为研究对象,探究沙漠化土地植被恢复过程中土壤生态酶活性及其化学计量比演变特征以及对微生物养分限制的影响,深入揭示人工固沙林重建植被过程养分转化能力与机理。
1 材料与方法
1.1 研究区概况
项目研究区位于毛乌素沙地东缘陕西榆林市红石峡试验林场(38°20′N,109°44′E)(图1)。区域海拔1 050~1 500 m,属典型的大陆性季风干旱和半干旱气候,平均温度为8.1℃[19],年平均降水量415 mm,其中60%~70%的降雨量集中在夏季。由于该地区是典型的农牧交错带,历史上经过过度的开垦、耕作和放牧导致了严重的沙漠化,风成砂质土中含沙量为92.6%[20]。在此之后该区域陆续开展了防风治沙的生态工程。先在流沙表面设置草方格机械沙障固定流沙,后有天然先锋植物侵入并将流沙变为半固沙地[21]。经过持续人工管理,每隔5 a持续种植相同树种、相似密度的固沙灌木和乔木,逐渐形成了灌木草或乔木草的植被体系。目前该区域完整的植被面积扩增至33.3 km2,植被逐渐恢复,形成以樟子松(Pinussylvestrisvar.mongholicaLitv.)为主要树种的乔木防护林[22],以沙棘(HippophaerhamnoidesL.)、花棒(HedysarumscopariumFisch. et Basiner)和踏郎(HedysarummongolicumTurez)为主要树种的灌木防护林,林下形成狗尾草(SetariaviridisL. Beauv.)、沙竹(PsammochloavillosaTrin. Bor)、猫头刺(OxytropisaciphyllaLedeb.)、油蒿(ArtemisiaordosicaKrasch.)等植被,随后植被系统进入自然演替阶段。
1.2 样地选取
2020年9月采用空间替代时间法,基于林场造林年限与树种情况的调研,选择半固定沙地为0 a植被恢复对照样地,以及1964年、1974年、1985年和1995年种植的柠条为主灌木林和以樟子松为主的乔木林,分别对应植被恢复56 a,46 a,35 a和25 a的林地。每个林地选择立地条件相似的3个样地作为研究重复,样地间的距离大于50 m,在每个样地上设置20 m×20 m的标准采样区,采用等距抽样法调查植物群落。所有样地都来自于流沙地,具有同样的原始条件。各样地分布及基本特征见表1,其中SF表示半固定沙地、SH表示灌木固沙林、AR表示乔木固沙林,下角标数字代表恢复年限。

表1 样地基本特征及0-20 cm土层深度的土壤理化性质Table 1 Descriptions of the sampling sites and soil physicochemical properties at 0-20 cm layer
1.3 采样方法
采用土钻(直径5 cm×120 cm长)在每个标准采样区上按照“S”型布 设16个点采集土样,混合成该小区代表土样,并同时采用环刀法测量土壤容重。所有土芯均被剖分成两层(0—10 cm和10—20 cm),来自同一层的土壤被混合为一个土壤样本。土壤样本通过2 mm的筛,已清除植物残体与根系,同时将鲜土样同冰袋保存带回实验室冷藏,及时完成指标的测定。
1.4 指标测定
1.4.1 土壤理化性质的测定 土壤含水量是在105℃的烘箱内加热 24 h后,采用称重的方法测定。土壤容重采用环刀法,土壤pH使用带有玻璃电极的pH计(PHS-3C,上海仪电,中国)在水土比为1∶2.5(干土质量:去离子水体积)下测得。
1.4.2 酶活性测定 采用改进的微孔板荧光法[9]测定酶活性(表2)。具体为:称取1 g鲜土置于250 ml三角瓶中,加入120 ml纯水和5 ml pH为8.0的醋酸钠缓冲液,震荡2 h。再用移液枪分别向酶标版的样品孔加入150 μl震荡悬浊液和50 μl酶底物;空白微孔加入150 μl震荡悬浊液+50 μl缓冲液;淬火标准孔加入150 μl震荡悬浊液和50 μl标准物质;阴性对照孔加入150 μl缓冲液和50 μl酶底物(合成的富含C-,N-或P-的底物);参考标准孔加入150 μl缓冲液和50 μl标准物质(标准物质为4-甲基伞形酮(4-Methylumbelliferone, MUB))。最后将酶标板放在25℃下暗培养4 h后加入1 mol/L的NaOH 50 μl终止反应。使用多功能酶标仪在365 nm激发光、450 nm波长处读取吸光值[11]。酶活性表达为每克干土单位小时产生的底物物质的量〔nmol/(g·h)〕。

表2 土壤胞外酶种类Table 2 Types of soil extracellular enzymes
土壤胞外酶活性计算公式[9]:
Ab=FV/(eV1tm)
(1)
F=(f-fb)/q-fs
(2)
e=fr(CsV2)
(3)
q=(fq-fb)/fr
(4)
式中:Ab为土壤样品的酶活性〔nmol/(g·h)〕;F为校正后的样品荧光值;V为土壤悬浊液的总体积(125 ml);V1为微孔板每孔中加入样品悬浊液的体积(0.2 ml);t为暗培养时间;m为干土样的质量(1 g鲜土换算成干土样的质量);f为酶标仪读取样品微孔的荧光值;fb为空白微孔的荧光值;q为淬火系数;fs为阴性对照微孔的荧光值;e为荧光释放系数;fr为参考标准微孔的荧光值;Cs为参照标准微孔的浓度(10 μmol/L);V2为加入参照标准物的体积(0.000 05 L);fq为淬火标准微孔的荧光值。
土壤胞外酶生态化学计量计算公式[9]:
C∶NEEA=BG/(NAG+LAP)
(5)
C∶PEEA=BG/AP
(6)
N∶PEEA=(NAG+LAP)/AP
(7)
式中:EEA为土壤胞外酶活性;BG为β-葡萄糖苷酶;NAG为N-乙酰氨基葡萄糖苷酶;LAP为亮氨酸氨肽酶;AP为磷酸酶。
土壤胞外酶(LAP+NAG)或NAG的活性变化都可以反映土壤微生物对氮资源的需求状况,且BG∶(NAG+LAP)∶AP或BG∶NAG∶AP均可表示土壤胞外酶生态化学计量关系[11],因此本试验测定了LAP和NAG的活性,并用(LAP+NAG)进行计算和分析。土壤微生物养分限制计算公式[23]:
(8)
Vector angle=Degrees{ATAN2(ln BG/ln AP),
〔ln BG/ln(NAG+LAP)〕}
(9)
式中:Vector length为矢量长度;Vector angle为矢量角度;BG为β-葡萄糖苷酶;NAG为β-乙酰氨基葡萄糖苷酶;LAP为亮氨酸氨肽酶;AP为磷酸酶。
矢量长度越长,C限制越大;矢量角度小于45°时,值越小表示N限制越大,而大于45°时,值越大表示P限制越大[24-25]。另一种表示方法中,评估微生物资源限制基于酶活性的比率,特别是BG/(LAP+NAG)较高为N限制,(NAG+LAP)/AP表示N和P限制[26]。
1.5 数据统计分析
数据结果用均值±标准差(SD)来表示。采用方差分析(ANOVA)方法,分析年代序列对土壤酶活性差异的影响;比较最小显著差异(LSD)在p<0.05时的差异;使用皮尔森相关分析土壤养分特征与酶活性以及化学计量的相关关系;以上所有统计方法是用SPSS 25.0版本完成,使用Origin 24.0绘制相关图。
2 结果与分析
2.1 土壤酶活性变化特征
植被恢复后,土壤中β-葡萄糖苷酶、β-1,4-乙酰氨基葡萄糖苷酶、亮氨酸氨肽酶和碱性磷酸酶活性均随着恢复年限的增长呈显著增加趋势。在0—10 cm土层,BG,NAG和LAP酶活性乔、灌木林随着植被年限的增加快速增加,在恢复56 a后,BG活性分别是对照(0 a)的10.08,14.99倍,NAG活性分别是对照(0 a)的5.71,7.08倍,LAP活性分别是对照(0 a)的8.38,6.97倍;AP活性在乔、灌木林随着植被年限的增加缓慢增加,且在恢复56 a后,AP活性分别是对照(0 a)的3.79,3.85倍。在10—20 cm土层中,56 a的BG活性乔、灌木林平缓增加分别比对照(0 a)增加了3.94,16.58 nmol/(g·h);LAP和AP活性在乔、灌木林随着植被年限的增加缓慢增加,LAP活性分别是对照(0 a)的15.1,13.5倍,AP活性分别是对照(0 a)的19.6,17.6倍;NAG乔木林随着植被年限的增加急剧增加是对照(0 a)的58.13倍(图2)。
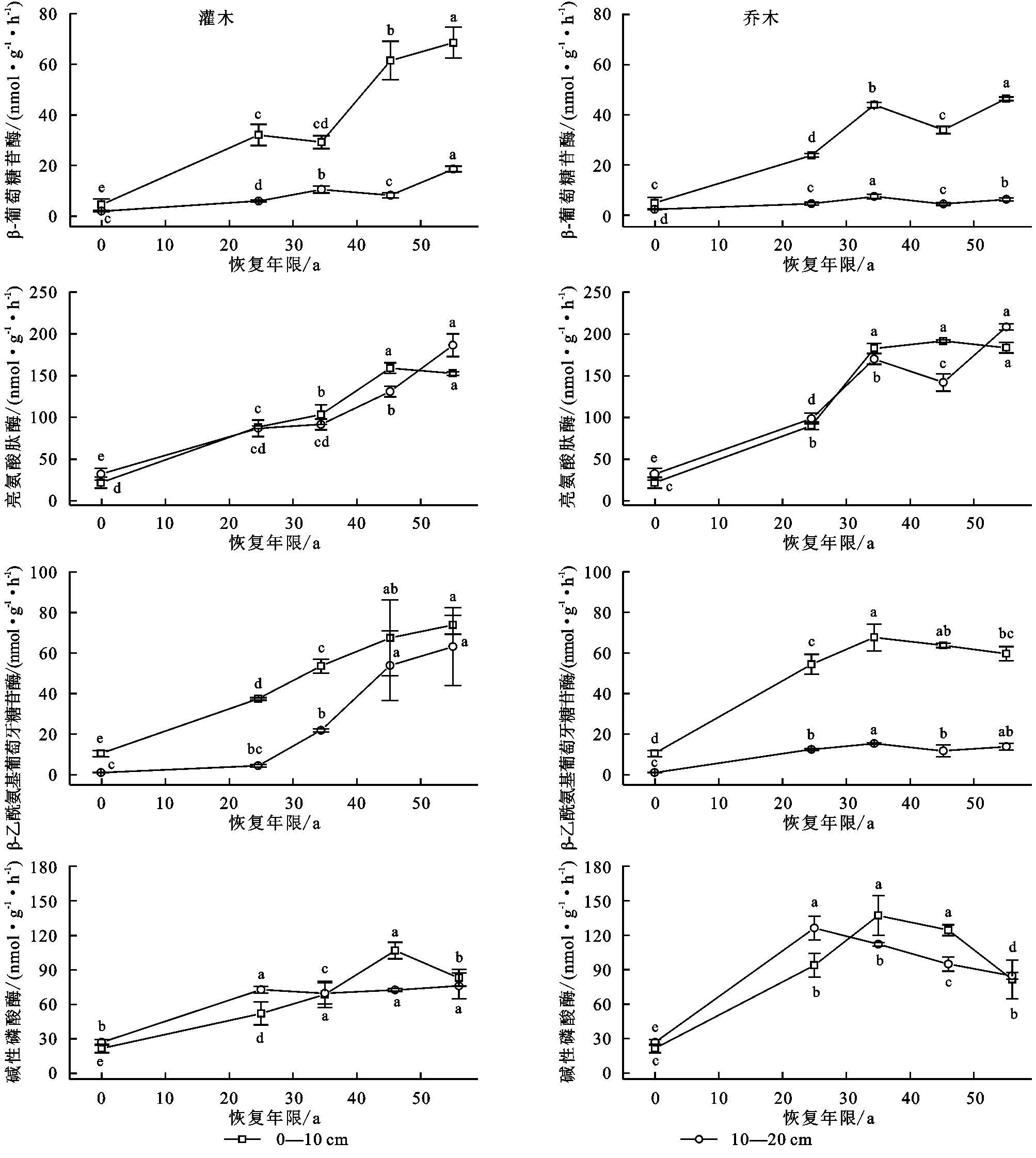
图2 不同恢复年限下乔、灌木林地在不同土层的酶活性特征Fig. 2 Enzyme activity characteristics of trees and shrubs in different soil layers under different recovery years
BG活性的乔、灌木林地和NAG+LAP活性的乔木林地在两土层中有显著性差异;0—10 cm和10—20 cm的AP活性在乔木和灌木林地中存在显著差异(图3)。

图3 不同林地与土层酶活性和酶化学计量特征Fig. 3 Enzyme activity and stoichiometric characteristics of different woodlands and soil layers
2.2 固沙林恢复过程酶活性比值演变特征
植被重建后,灌木林地上,土壤酶C∶N,N∶P和C∶P在不同土层整体上随年限增加而增加;乔木林地上,10—20 cm土层土酶C∶N和C∶P逐渐减少且小于对照(0 a)。在0—10 cm土层的乔、灌木林中,土壤酶C∶N,C∶P和N∶P逐渐增加均在第56年达到最大,分别是对照(0 a)的1.2倍和2.2倍,2.8倍和4.0倍,2.0倍和1.8倍;且在10—20 cm土层的灌木林中,土壤酶C∶N,C∶P和N∶P也逐渐增加,均在第56年达到最大0.08,0.25,3.29分别是对照(0 a)的1.2,3.2倍和2.7倍;在10—20 cm土层的乔木林中,土壤酶C∶N和C∶P平缓减少,在恢复56 a后分别比对照(0 a)减少了0.03,0.01 nmol/(g·h)。经过56 a的植被恢复,灌木林地土壤酶C∶N和C∶P高于对应土层的乔木林地,两种林地土壤酶N∶P变化相似(图4)。

图4 不同恢复年限下乔、灌木林地在不同土层的酶生态化学计量特征Fig. 4 Ecostoichiometric characteristics of enzymes in different soil layers of Trees and shrubs in different restoration years
2.3 酶化学计量指示微生物营养限制的作用
随着植被恢复两类林地矢量长度均逐渐增加,随矢量长度越长,C限制增大,对比对照组在第56年达到最大值。乔、灌木林在0—10 cm土层中矢量长度达到最大时分别是对照(0 a)的1.8倍和2.0倍。在灌木林10—20 cm土层中,矢量长度波动增加,第56年时最大为恢复6 a的2.8倍(图5左);10—20 cm土层乔木林中,矢量长度波动增加,在恢复36 a时最大为对照组(0 a)的1.9倍(图5左)。当矢量角度大于45°时为P限制,且随着其值的增加而增大,当矢量角度小于45°时为N限制,且随着其值的增加而减小。在植被恢复过程中,微生物N限制随着植被恢复显著增加,而P限制并不明显。在0—10 cm土层灌木林矢量角度均小于45°且无显著变化,乔木林矢量角度逐渐减小且均小于45°,在第56年达到最小;在10—20 cm土层灌木林中,矢量角度先增加后减小,且均小于45°,即产生P限制,乔木林在植被恢复25 a时大于45°,即无N限制产生P限制,之后在第56年时最小(图5右)。
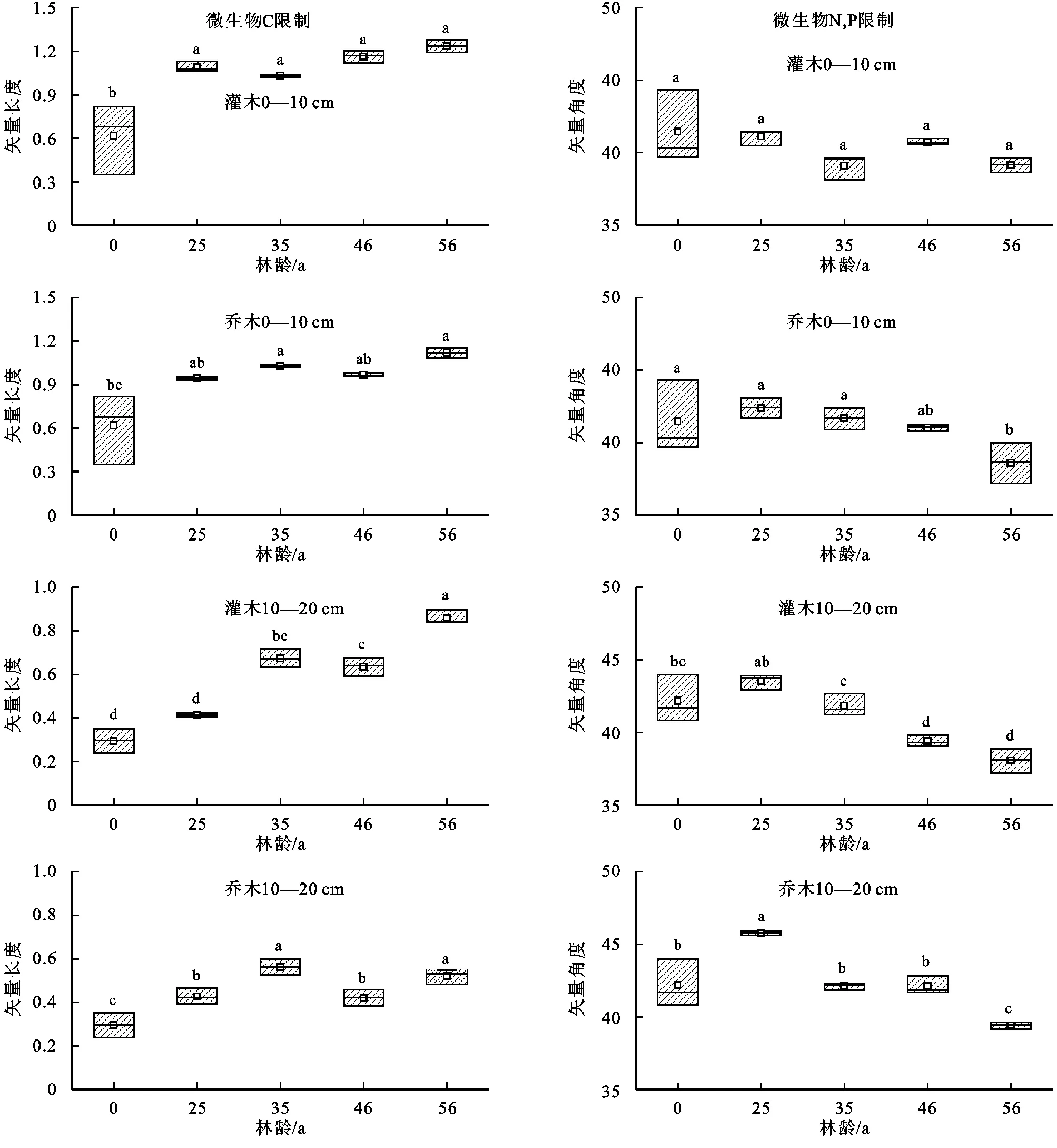
图5 不同恢复年限下矢量长度(左)与矢量角度(右)Fig. 5 Responses under vector length (left) and vector angle (right) for different recovery years
当(NAG+LAP)/AP大于1时,产生微生物N限制,小于1时产生微生物P限制,当BG/(NAG+LAP)大于1时产生微生物C和N限制以及C和P限制。生态酶化学计量比分析表明,在10—20 cm土层中,乔木林仅在第25年存在微生物P限制,其他年份均为N限制,整个植被恢复阶段均无C和N限制以及C和P限制(图6)。
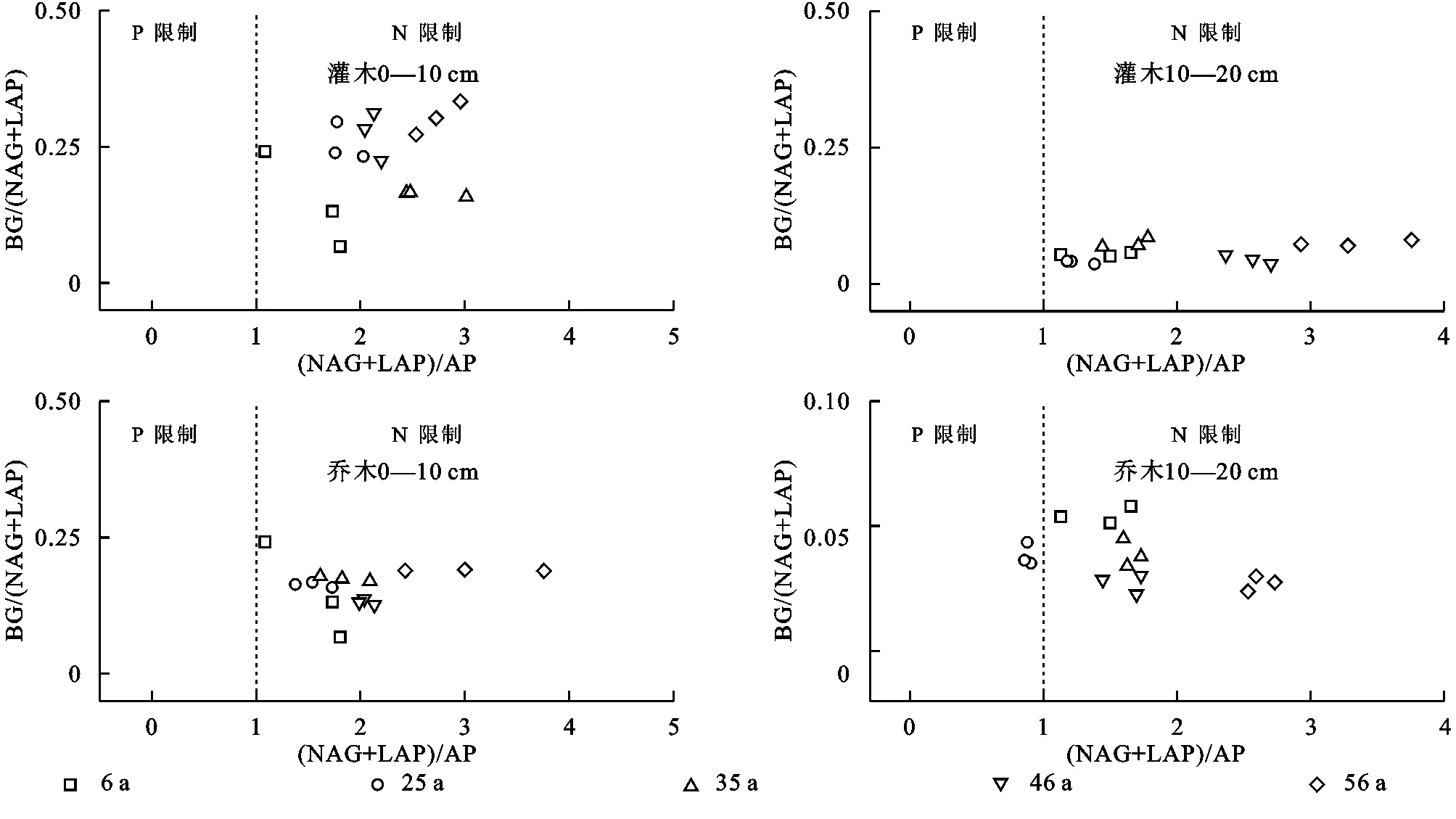
注:BG表示β-1,4-葡萄糖苷酶;NAG表示β-1,4-乙酰氨基葡萄糖苷酶;LAP表示亮氨酸氨肽酶;AP表示碱性磷酸酶。图6 土壤酶化学计量散点图显示微生物资源限制养分Fig. 6 A scatter plot of soil enzymatic stoichiometry showing the general pattern of microbial resource limitation
3 讨 论
3.1 固沙林恢复过程土壤胞外酶活性及其化学计量演变特征
本研究两种固沙林恢复过程酶活性均呈现显著增加的趋势,其中以氮转化酶(NAG+LAP)活性对植被恢复变化响应最敏感。随着植被恢复,固沙林土壤有机碳、全氮和全磷含量不断增加,土壤性状、各理化指标显著提高[27],引起微生物需求更多养分吸收和转化反应,分泌更多的酶,导致酶活性表现出增强趋势。其中碳转化酶(BG)活性和氮转化酶(NAG+LAP)活性为:整体上随年限增加而增加,磷转化酶(AP)活性为先增加后减小。恢复56 a后,在不同土壤剖面中3类土壤酶活性都为表层(0—10 cm)较高。这与李陆平等[28]的研究结果相同。由于植被恢复首先改善了表层土壤理化性质,使得表层土壤胞外酶活性也随之提高。同时,土壤表层水热条件和通气状况良好,又有微生物生长所需的营养物质,则微生物生长旺盛,代谢活跃使得表层的土壤酶活性较高[29]。植被恢复44 a后氮转化酶(NAG+LAP)的活性在0—10 cm土层呈现逐渐稳定的趋势,在10—20 cm的土层中继续增加,导致产生这种现象的原因可能是由于凋落物主要堆积在表层土壤,从而利于表层土壤肥力增加,深层土壤中酶含量具有滞后效应,当上层土壤中酶的含量达到平衡时,经过上层的淋溶与沉积作用,下层土壤的酶活性仍然继续上升。
化学计量比代表了微生物需求的相对比例,当微生物需求的元素少时就会不断分泌相应的酶,以满足自身的需要,从而使化学计量比发生变化。酶的不同比例的增加也显著改变了酶的化学计量。不同土壤胞外酶活性的比值与土壤C∶N∶P值密切相关,可以用来评价土壤微生物C,N,P养分资源的需求状况[30]。本研究中,随着植被恢复年限增长,土壤C∶N,C∶P和N∶P逐渐增加,全球尺度上,土壤酶C∶N比为1.41,酶C∶P比为0.62,酶N∶P比为0.44。本研究中,灌、乔木林的酶C∶N最大值分别为0.30,0.19,远小于1.41的全球平均值;酶N∶P比的最小值分别为1.02,0.88,也显著高于全球均值(0.44),这意味着该区域土壤整体具有相对较高的 N分解胞外酶活性,从而反映出土壤 N元素的相对缺乏,使得微生物需要生产更多的N分解酶,以满足自身代谢的需要[9]。这是基于目前公认的个别碳氮转化酶之间的关系得出的生态酶化学计量关系,还不能完整反映对微生物养分需求的指示作用。可能需要考虑更多的与碳氮转化相关的酶进行化学计量分析。本研究中的灌木林地树种为豆科固氮树种,樟子松、油松为非固氮树种,然而随着植被恢复年代增加,土壤C,N限制仍然呈现增加趋势,建议建立更稳定的乔灌草相结合的植被体系[31]。
3.2 固沙林恢复过程土壤酶活性变化的生态效应
随着植被恢复,土壤中凋落物增加,促进微生物分泌更多胞外酶,使得土壤C,N,P的增加。榆林固沙林植被恢复过程中,土壤中微生物C限制在恢复56 a达到最大,N限制随着植被恢复最终显著增加,而P限制并不明显。随着植被恢复,土壤C限制逐渐增强的原因可能是土壤N的相对过高,由于土壤中有效氮水平很高,导致C∶N没有达到有利于微生物生长的这两种元素的阈值比率,土壤C可能不足以支持微生物生长。土壤氮是研究生态系统中微生物生长的一个重要限制因素,而榆林毛乌素沙地固沙林土壤微生物基本上处于N限制,且微生物N限制相对于微生物P限制更为明显,灌木林土壤N限制普遍高于乔木林,这可能与物质的投入和枯落物的C/N密切相关,半固定沙地植被恢复后,以枯落的形式向土壤中输入了大量的C和N,这极大地促进了土壤有机质的积累。但是在不同林地中,有不同的枯落物进入土壤,因此导致土壤中有机质在长期的演变过程中表现出了不同的特征[32]。
4 结 论
榆林毛乌素沙地随固沙林植被恢复,乔木和灌木林地土壤酶活性均随之显著提升,且土壤中氮转化酶(NAG+LAP)活性对土壤环境的变化反应最敏感,碳转化酶(BG)活性增加速度显著小于氮转化酶(NAG+LAP)和磷转化酶(AP)活性。微生物通过酶对C,N,P转化效应显著增强。同时,植被恢复也显著提高了土壤生态酶的C∶N,C∶P和N∶P,但研究区域中,灌木和乔木林的酶C∶N均远小于全球平均值,酶N∶P比的最小值也显著的高于全球均值,表明该区域土壤具有相对较高的N分解胞外酶活性,反映出土壤N元素的相对缺乏,使得微生物需要生产更多的N分解酶,以满足自身代谢的需要,并且这种氮限制效应在灌木林土壤显著高于乔木林。可见,在毛乌素沙地固沙林恢复过程与固氮型植被混合造林可能是维持固沙林可持续恢复的一条可行途径。
