灵孢多糖通过抑制TLR4/NF-κB通路改善EAE小鼠的髓鞘脱失
2023-10-22李彦青杨智超宋丽娟王翰斌杨立志刘建春肖保国马存根
李彦青,王 青,杨智超,宋丽娟,王翰斌,杨立志,刘建春,肖保国,马存根
(1. 山西中医药大学神经生物学研究中心,国家中医药管理局多发性硬化益气活血重点研究室,山西 晋中 030619;2. 山西国润制药有限公司,山西 大同 038100;3. 复旦大学附属华山医院神经病研究所,上海 200025)
多发性硬化(multiple sclerosis,MS)是一种慢性免疫介导的中枢神经系统(central nervous system,CNS)疾病,通常以神经炎症、白质脱髓鞘、胶质细胞增生和血脑屏障损伤等为特征[1]。MS主要发生在20~40岁,是导致年轻人非创伤性残疾的主要原因[2]。虽然MS的致病机制尚不清楚,但T细胞、B细胞和其他免疫细胞似乎介导CNS的免疫应答。目前的临床疗法大多聚焦于通过发挥免疫抑制或免疫调节作用,在一定程度上降低复发率[3]。然而,目前的药物仅对部分MS患者有效,对继发性进展性MS几乎没有作用。因此,迫切需要开发新型有效的治疗药物。
用髓磷脂少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein,MOG)免疫C57BL / 6小鼠诱导的实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)是研究MS的理想模型,其通过诱导CD4+T细胞分化为效应T细胞并迁移至CNS引发一系列的炎症反应,目前其参与CNS炎症及免疫反应的调节机制尚不清楚[4]。相关研究发现,Toll样受体4(Toll-like receptor 4,TLR4)在MS患者和EAE小鼠脊髓中上调,并且会激活下游核因子κB(nuclear factor kappa-B,NF-κB)的表达,产生更高水平的促炎细胞因子,加重髓鞘脱失和炎性浸润导致的神经损伤[5]。因此,通过抑制TLR4/NF-κB信号通路可能是改善EAE进展的有效途径。
灵芝是中国著名的中草药,在传统中医中已有超过1000年的使用历史,已被用于治疗各种疾病并促进健康和长寿。灵孢多糖(ganoderma lucidum polysaccharides,GLPS)是灵芝水溶性提取物中的主要生物活性成分,具有免疫调节、抗血管生成和抗氧化以及抗炎的作用[6]。先前的研究表明,GLPS能够通过减弱小胶质细胞介导的神经炎症并且增强有益的吞噬作用来发挥神经保护作用,从而治疗阿尔茨海默病(Alzheimer′s disease,AD)和帕金森病(Parkinson′s disease,PD)等神经退行性疾病[7]。然而,目前尚不清楚GLPS对EAE是否有治疗作用。因此,本研究拟采用GLPS作用于EAE小鼠模型观察其对髓鞘脱失及炎性浸润的改善作用,并初步探讨其作用机制及其与TLR4/NF-κB信号通路的相关性。
1 材料与方法
1.1 材料
1.1.1实验动物 6~8周龄C57BL/6雄性小鼠(体质量18~20 g,SPF级)共30只,购买于北京维通利华实验动物技术有限公司,生产许可证号:SYXK(京)2022-0052。小鼠于山西中医药大学动物房饲养,饲养条件为:温度(20±2)℃,湿度40%~50%,昼夜交替规律,自由取食饮水。所有动物实验均符合动物实验伦理委员会的规定和要求。
1.1.2试剂 MOG35-55(国泰生物);结核分枝杆菌H37Ra(tuberculosis myco-bacterium,TB,BD Bioscience);百日咳毒素(pertussis toxin,PTX,Sigma);完全弗氏佐剂(complete Freund's adjuvant,CFA,Alexis);GLPS注射液(山西国润制药有限公司,H20003510);固蓝染色试剂盒(luxol fast blue,LFB,Solarbio,G3245);苏木素-伊红染色试剂盒(hematoxylin-eosin staining,HE,Solarbio,G1120);流式抗体干扰素-γ(interferon-gamma,IFN-γ)、白细胞介素17(interleukin 17,IL-17)、叉头样转录因子3(forkhead transcription factor 3,Foxp3)均购买于Thermo Fisher;TLR4(proteintech,19811-1-AP);MBP(Abcam,EPR21188);MyD88(Abclonal,A0980);NF-κB(Cell Signaling Technology,D14E12);p-NF-κB(Cell Signaling Technology,93H1);β-actin(Bioworld,AP0060);HRP标记羊抗兔二抗(Boster,BA1055);RIPA裂解液(Servicebio,G2002)。
1.1.3仪器 荧光显微镜(Leica,DM40008/DFC450C);流式细胞仪(BD Bioscience,Accuri C6);电泳仪(Bio-Rad,165-8004);低温型研磨仪(Servicebio,KZ-III-F);增强型ECL化学发光仪(AZURE Biosystem,C300);低温冷冻离心机(Thermo fisher,ST8);多功能酶标仪(Thermo fisher,Multiskan SkyHigh);冰冻切片机(Leica,CM 1950)。
1.2 方法
1.2.1小鼠分组及EAE模型制备 将30只小鼠按照体质量随机平均分为正常对照组、EAE模型组、GLPS组,将MOG35-55多肽稀释成5 g·L-1,与等体积含TB的CFA混合,在EAE模型组和GLPS组小鼠脊椎周围任选4点进行皮下注射(0.1 mL/只),正常对照组不予抗原处理。免疫后第0 h和48 h腹腔注射PTX(400 ng/只)增强免疫应答。从免疫当天开始,GLPS组小鼠每天腹腔注射给予GLPS[8](5 mg·kg-1),正常对照组及EAE模型组小鼠腹腔注射等体积生理盐水,连续21 d。
1.2.2小鼠神经功能评分 造模后每天同一时间段记录小鼠体质量变化。采用5分评分法进行神经功能评分[9]:0分,四肢正常,尾部没有症状不发病;1分,尾部张力下降或无力;2分,尾部全瘫或肢体轻瘫;3分,双后肢瘫痪或肢体全瘫;4分,四肢瘫痪且被动翻身后不能复位;5分,濒死或死亡。
1.2.3固蓝染色检测脊髓组织病理情况 将小鼠脊髓组织制成厚度为10 μm的冰冻切片,置于70%乙醇溶液中15 min后,取出切片放入配制好的LFB染液中,于60 ℃孵育过夜,之后依次放入95%乙醇、去离子水、0.05%碳酸锂溶液中充分浸洗。经不同浓度乙醇梯度脱水、二甲苯透明、中性树胶封片后置于显微镜下观察。
1.2.4HE染色检测脊髓组织炎性浸润情况 将冰冻切片置于苏木精染液中5 min,去离子水洗去浮色,滴加分化液分化1 min,去离子水浸洗两次后(每次3 min),置于伊红染液中1 min,取出切片依次放入75%乙醇、85%乙醇、95%乙醇、无水乙醇梯度脱水3 s,之后再置于无水乙醇中浸洗1 min、二甲苯透明、中性树胶封固后镜下观察。
1.2.5MBP免疫荧光染色检测髓鞘脱失情况 取出冰冻切片恢复至室温后放入1× PBS中洗去包埋剂,用1% BSA+0.3% Triton X-100 (1× PBS配制)封闭通透30 min,加入按比例稀释的MBP一抗,4 ℃冰箱过夜。第2天,1×PBS浸洗3次,每次5 min,加入对应种属的荧光二抗,室温避光孵育2 h后,1× PBS浸洗3次,用抗荧光淬灭封片剂封片,显微镜下观察。
1.2.6流式细胞术检测脾脏及淋巴结组织中IL-17、Foxp3的表达 将EAE模型组、GLPS组小鼠脾脏及淋巴结组织研磨过滤离心后用1%BSA制备成细胞悬液,分装于相应的流式管中,分别加入检测的流式抗体,于室温下避光20 min。PBS洗涤3次,最后每管加入500 μL PBS,用流式细胞仪检测IL-17、Foxp3的表达。
1.2.7Western blot检测脊髓组织中MBP、TLR4、MyD88、NF-κB的表达 取小鼠脊髓组织加入RIPA裂解液,于低温组织研磨仪研磨成组织匀浆,将其放入4 ℃离心机,10 000 r·min-1离心15 min后取上清,采用BCA法测定蛋白浓度,取上清加入Loading Buffer并煮沸10 min备用。通过SDS-PAGE分离等量的蛋白质(20 μg)并湿转到PVDF膜上,5%脱脂奶粉封闭1 h后,按照稀释比例分别加入相应的一抗并放入4 ℃冰箱过夜。第2天,TBST浸洗3次后,加入对应种属的二抗,室温孵育2 h,TBST浸洗3次。通过增强型ECL化学发光仪检测并摄取蛋白条带图像,ImageJ软件分析条带图像的平均灰度值。

2 结果
2.1 灵孢多糖对EAE小鼠体质量和神经功能的影响Fig 1A结果显示,与正常对照组相比,EAE模型组小鼠出现明显的精神不振、进食量减少等情况,从第9天开始体质量出现明显下降趋势(P<0.05,P<0.01);与EAE模型组相比,GLPS组体质量下降情况相比于模型组更为缓和,从第13天开始明显减缓(P<0.05和P<0.01);而且,EAE模型组小鼠在第11天开始出现神经系统功能障碍,伴随尾部张力下降、后肢瘫痪或前肢瘫痪、大小便失禁等表现(P<0.05),第16天开始进入高峰期,表现更为明显(P<0.01);而GLPS组小鼠各时间段神经功能临床评分均低于EAE模型组,发病潜伏期推迟,进入高峰期评分明显降低(P<0.01),见Fig 1B。实验结果表明,GLPS能够减轻EAE诱导的小鼠体质量减轻并且缓解其临床症状。
2.2 灵孢多糖减轻EAE小鼠的髓鞘脱失和炎性浸润Fig 2结果显示,与正常对照组相比,EAE模型组小鼠脊髓白质可见大范围髓鞘脱失区域,伴随明显的空泡形成(P<0.01),大量炎性细胞浸润(P<0.01),并且MBP表达明显低(P<0.01);与EAE模型组相比,GLPS组小鼠脊髓白质脱髓鞘范围与空泡形成均减少(P<0.01),仅有少量炎性细胞浸润(P<0.01),MBP表达明显增高(P<0.01)。说明GLPS能够减轻EAE小鼠的髓鞘脱失和炎性浸润。
2.3 灵孢多糖影响EAE小鼠脾脏和淋巴结中IL-17、Foxp3的表达Fig 3流式细胞术结果显示,与EAE模型组比较,GLPS组小鼠脾脏及淋巴结组织中IL-17明显降低(P<0.01),而Foxp3明显增高(P<0.01)。说明GLPS能够通过下调促炎因子IL-17的表达减轻炎症程度,上调Foxp3的表达抑制免疫反应,调节免疫平衡。
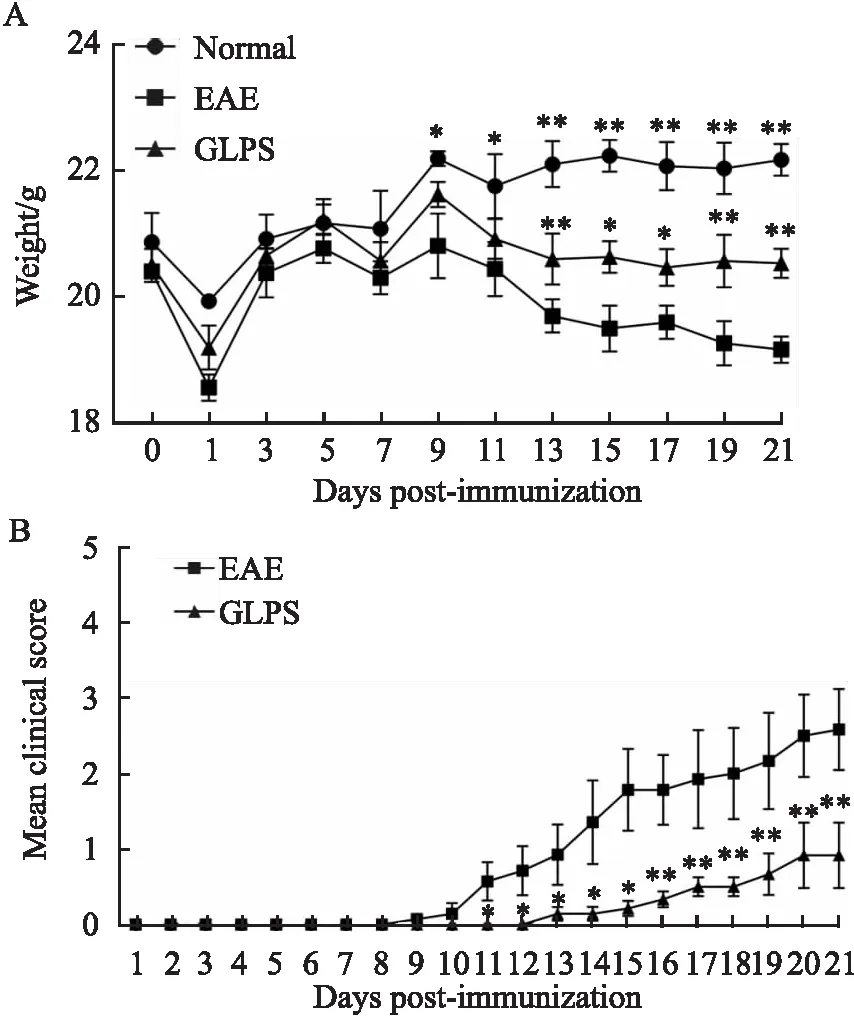
Fig 1 GLPS intervention reduced weight loss and clinical behavior in EAE mice
2.4 灵孢多糖对EAE小鼠脊髓组织中TLR4/NF-κB通路蛋白表达水平的影响Fig 4结果显示,与正常对照组相比,EAE模型组小鼠脊髓组织中TLR4、MyD88、p-NF-κB蛋白表达量均明显升高(P<0.01);与EAE模型组比较,GLPS组小鼠脊髓组织中TLR4、MyD88、p-NF-κB蛋白表达量均明显降低(P<0.01)。可以推测,GLPS可以通过抑制TLR4/NF-κB通路来改善EAE小鼠炎性反应,改善髓鞘脱失。
3 讨论
近年来,虽然针对MS患者的疾病修饰疗法取得了一定的进展,但MS的整体治疗效果尚未最大化,开发新的安全有效的药物仍然是一个非常重要的目标。GLPS作为天然药物灵芝的主要生物活性成分,具有抗氧化、抗炎、免疫调节等作用,并且药性稳定、毒副作用小[6]。研究表明,GLPS能够通过抑制MAPK信号通路保护成纤维细胞免受紫外线诱导的氧化衰老作用[10],并且在多种疾病中表现出抗炎或免疫抑制作用,包括AD、PD等神经退行性疾病[7]。在本研究中,通过构建小鼠EAE模型,我们发现小鼠出现体质量下降以及不同程度的神经功能障碍,病理检测观察到小鼠脊髓组织中大范围髓鞘脱失及炎性细胞浸润情况,同时维持髓鞘结构和功能的稳定的标志物MBP表达显著降低,说明模型是成功的。GLPS干预有效地抑制了EAE小鼠的体质量的下降及神经功能评分的升高,改善了小鼠脊髓组织的髓鞘脱失和炎性浸润,增加了MBP的表达,证实了GLPS对EAE小鼠有较好的治疗作用。
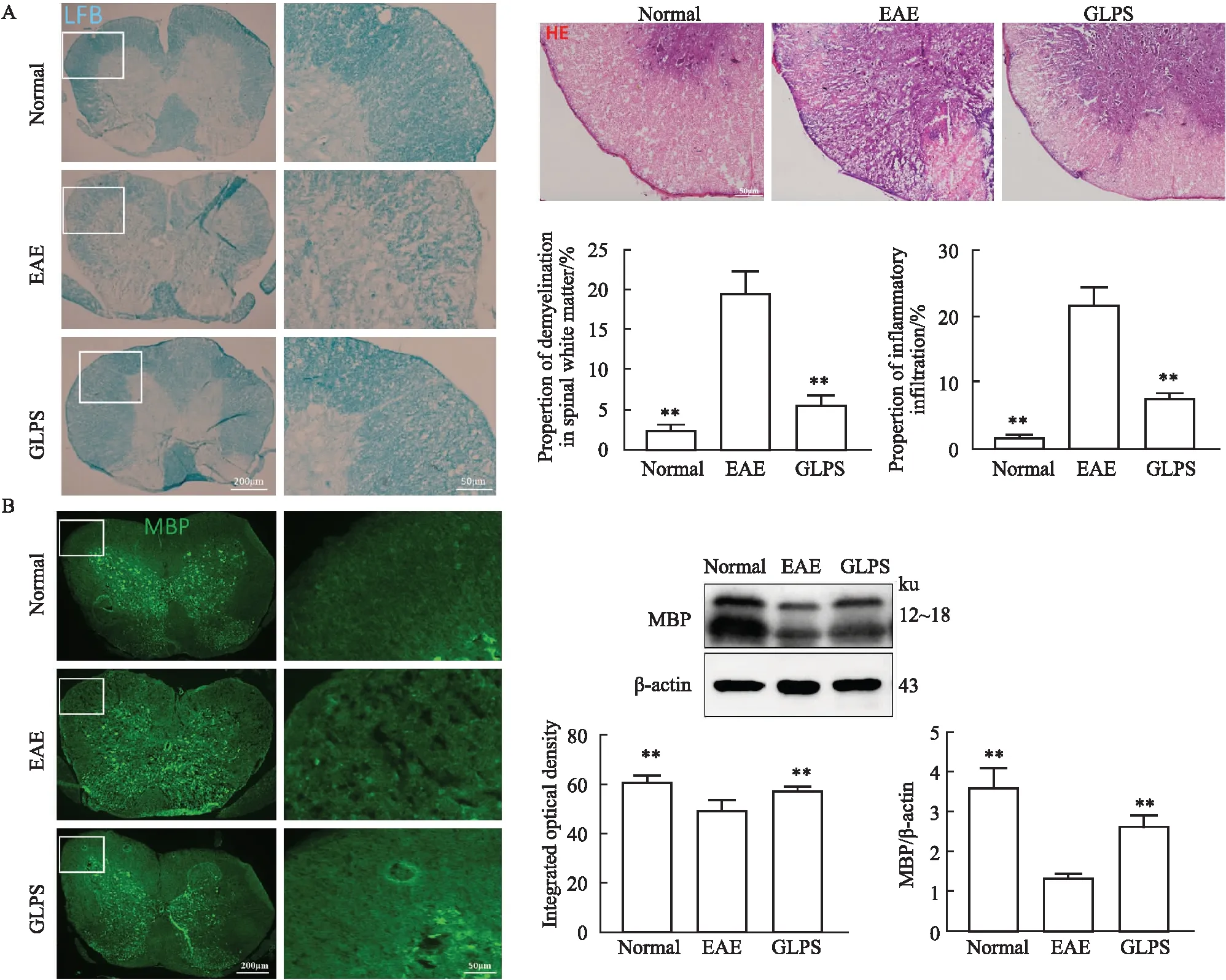
Fig 2 GLPS reduced myelin loss and inflammatory infiltration in EAE mice
自身反应性CD4+T细胞在EAE的发生发展过程中起主要作用,活化的CD4+T细胞从外周迁移到CNS,在效应性T细胞活化过程中,细胞因子和趋化因子的产生影响局部微环境,最终决定免疫反应的结果[11]。其中IL17产生跨髓磷脂成分的T细胞自身反应是MS发病机制的核心,IL-17是T细胞诱导的炎症反应的早期启动因子,可以通过促进释放炎性细胞因子来放大炎症反应[12]。对于机体内自身免疫效应的过度活化,往往需要调节性T细胞(regulatory T cells,Tregs)来维持免疫自我耐受性并预防多种自身免疫性疾病,Tregs缺乏或抑制功能受损会导致严重的自身免疫性疾病和慢性炎症,而Foxp3被认为是Tregs发育,稳定性,特别是抑制功能的主要转录因子[13]。在先前的研究中,已经证明了通过降低IL-17的含量,增加Foxp3的表达对EAE治疗有明显的改善作用[14]。本研究显示,与EAE模型组比较,经GLPS干预后EAE小鼠脾脏和淋巴结组织中IL-17表达显著降低,Foxp3表达显著升高,表明GLPS可以通过抑制炎性细胞因子以及效应性T细胞的活化来减轻EAE小鼠的炎症反应和过度的免疫效应。
TLR4/NF-κB信号通路是一条关键的炎症信号转导途径,密切参与细胞分化、增殖、凋亡和促炎反应[15]。其中TLR4是第一个被鉴定的哺乳动物TLR,是在炎症信号转导中起关键作用的天然免疫受体。相关研究表明,使用TLR4配体(如脂多糖)干预会加重EAE,而靶向破坏TLR4会阻止EAE的进展[16]。激活的TLR4能够通过其关键接头分子MyD88形成复合物,并最终激活NF-κB,NF-κB作为TLR4信号通路的下游效应子,是调节T细胞、巨噬细胞和小胶质细胞等炎症细胞活性的主要转录因子之一,可介导多种炎症过程。已经证明NF-κB在MS患者的CNS的多种细胞类型中被激活,对疾病的发展有明显的影响[17]。Yoon等[18]的研究显示,灵芝的乙醇提取物能够通过抑制TLR4/NF-κB途径来抑制脂多糖诱导的小胶质细胞中的炎症反应。但对GLPS通过抑制TLR4/NF-κB途径发挥抗炎作用机制的研究还知之甚少。本研究发现,EAE模型组小鼠脊髓组织中TLR4/NF-κB蛋白表达水平相较于正常对照组明显升高,经GLPS干预后TLR4/NF-κB蛋白表达水平明显降低,说明GLPS可能通过抑制TLR4/NF-κB通路的活化来减缓炎症反应从而治疗EAE小鼠。
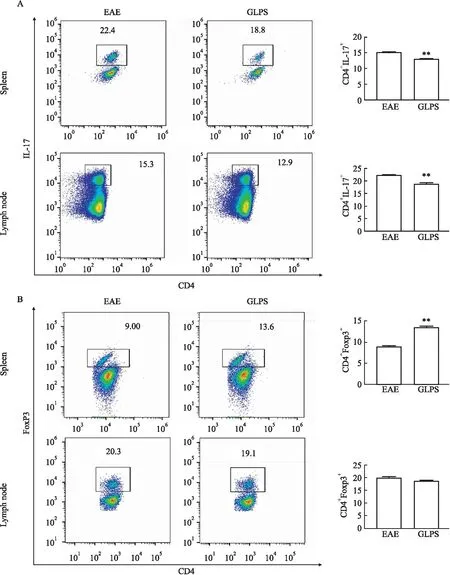
Fig 3 Effects of GLPS on levels of Th17 and Treg cells in spleen and lymph nodes of EAE
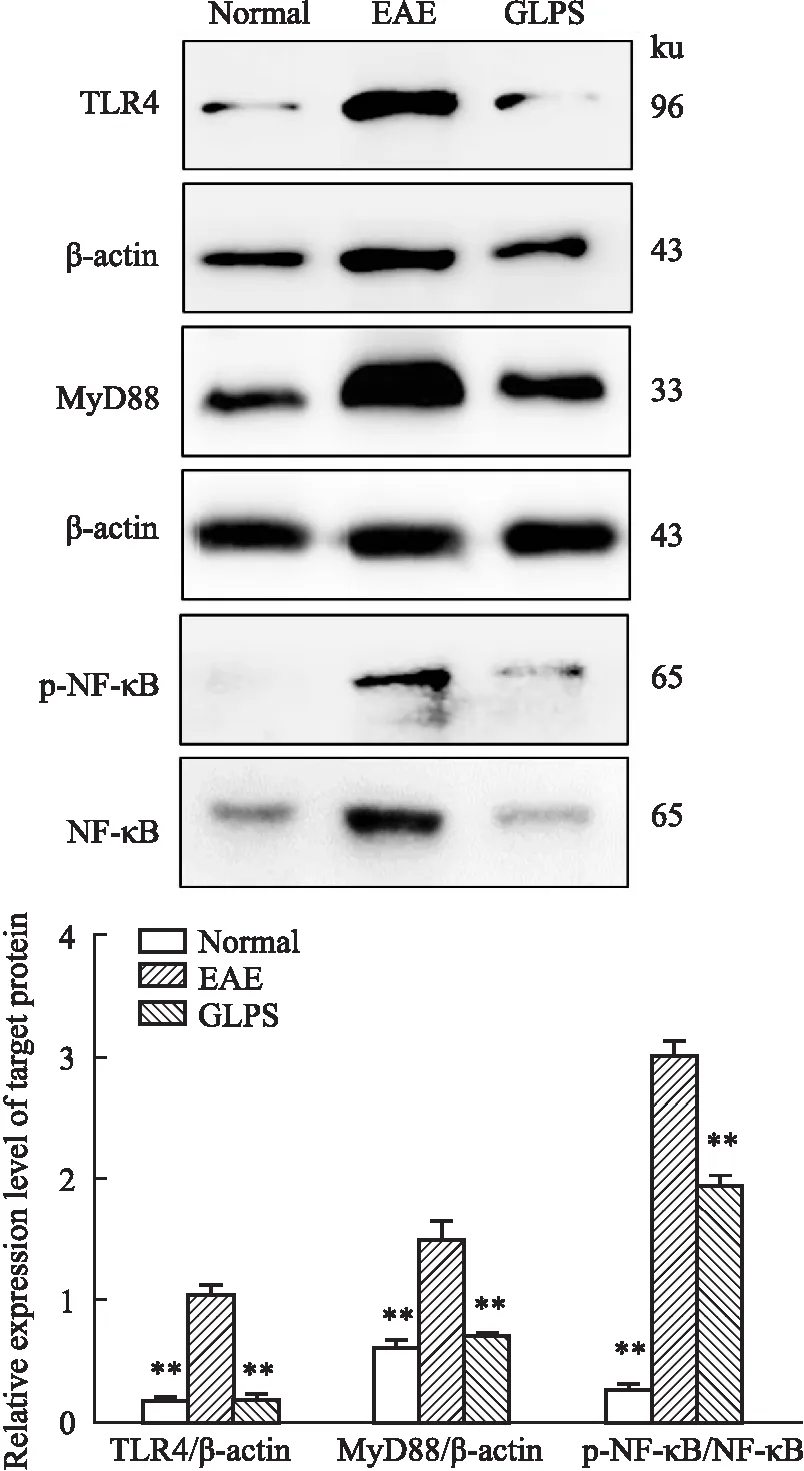
Fig 4 Effects of GLPS on expression of TLR4/NF-κB in spinal cord of EAE mice **P<0. 01 vs EAE group
综上所述,GLPS能够明显改善EAE小鼠的髓鞘脱失和炎症反应,其作用机制可能与抑制TLR4/NF-κB信号通路激活有关。但这项研究仍有一定的局限性,GLPS如何抑制TLR4/NF-κB信号通路活化以及这条通路的相关作用性的关键程度仍然需要进一步的体外实验去验证。
