金诺芬逆转非小细胞肺癌奥希替尼获得性耐药的作用
2023-10-22李凌凌刘文一赵齐林吴兰香
李凌凌,刘文一,王 楠,赵齐林,吴兰香
(重庆医科大学 1.生命科学研究院,2.附属第一医院心胸外科,重庆 400016)
肺癌是全世界发病率与死亡率均较高的恶性肿瘤,其中80%~85%为非小细胞肺癌(non-small cell cancer, NSCLC)[1]。由于该疾病早期无典型症状,接近70%的NSCLC患者确诊时已属中晚期,不仅失去了手术机会,而且对常规化疗及放疗均不敏感,5年生存率仅约15%[2]。近年来,表皮生长因子受体-酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor, EGFR-TKI)等分子靶向药物的问世,使得NSCLC的临床治疗获得了突破性进展。
奥希替尼(osimertinib, Osi)是首个获美国FDA批准上市的第三代EGFR-TKI,可选择性地与敏感突变型及T790M耐药突变型EGFR发生不可逆结合,阻断下游信号传导而达到抗肿瘤的目的。鉴于其良好的临床疗效与安全性,该药被推荐用于EGFR突变阳性NSCLC患者的一线治疗[3]。然而,绝大多数在用药初始阶段具有良好反应性的患者,9~14个月后均会出现获得性耐药现象,导致治疗失败、疾病进展[4]。该现象产生的原因非常复杂,目前,已发现的分子机制主要包括两大类:EGFR依赖性机制,如EGFR C797S突变等;EGFR非依赖性机制,如c-MET、HER2等代偿性信号通路建立以及病理组织类型转化等[5]。为了克服Osi耐药、增强其疗效,除了目前正在研发的针对EGFR C797S突变的第四代EGFR-TKI外,寻找耐药逆转剂、探索联合治疗方案已成为当前研究的热点。目前已有研究表明,帕比司他、阿司匹林及姜黄素对NSCLC细胞EGFR-TKI药物获得性耐药具有一定的逆转作用[6-8],但是,特异性安全性更高、疗效稳定有效性更好的药物逆转剂还有待被进一步探索发现。
本研究以Osi获得性耐药的NSCLC细胞为研究对象,通过高通量筛选FDA批准的药物分子库,发现金诺芬(auranofin, ANF)对NSCLC细胞Osi获得性耐药有显著逆转作用,为临床克服该现象提供了新思路。
1 材料与方法
1.1 材料RPMI 1640培养基和胎牛血清购于美国Gibco公司;FDA批准的1 470种药物分子库(L4200)和CCK-8试剂盒(C0005)购于美国TargetMol公司;基质胶(356234)和Transwell小室(353097)购于美国康宁公司;青霉素-链霉素(C0222)、结晶紫染液(C0121)、EdU试剂盒(C0071S)购于上海碧云天生物技术有限公司;4%多聚甲醛(DF0135)购于北京雷根生物技术有限公司;Osi(B1104)购于美国APExBIO生物科技有限公司;ANF(HY-B1123)购于上海皓元生物医药科技有限公司;逆转录试剂盒(RR073A)购于日本TaKaRa公司;PCR引物由上海生物工程有限公司合成;Anti-HSPB8 (DF2481)购于美国Affinity Biosciences,Anti-GAPDH(bs-2188R)购于北京博奥森生物技术有限公司,Anti-LC3B(3868T)购于美国Cell Signaling Technology公司,辣根酶标记山羊抗兔IgG(ZB-2301)购于北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1细胞培养 人非小细胞肺癌细胞株H1975(携带EGFR L858R和T790M突变)和PC9(携带EGFR第19外显子缺失突变)购于中国医学科学院基础医学研究所。H1975和PC9细胞培养于含10%胎牛血清、1%青霉素和链霉素的RPMI 1640培养液中,于37 ℃、5% CO2培养箱中进行培养。取对数生长期的H1975和PC9细胞,用0~0.5 μmol·L-1递增浓度的Osi处理,直至细胞可在含0.5 μmol·L-1Osi培养液中稳定生长,即为H1975/OR与PC9/OR细胞。实验前2周撤去药物,常规培养以备用。
1.2.2CCK-8法进行高通量药物筛选并检测细胞活力 取对数生长期的H1975/OR与PC9/OR细胞,接种于96孔板中(5×103个细胞/孔),24 h后加入10 μmol·L-1或1 μmol·L-1浓度的1 470种待测药物,同时加入0.5 μmol·L-1Osi,于37 ℃、5% CO2条件下处理72 h后,加入10%的CCK-8溶液继续孵育1 h,酶标仪检测450 nm吸光度,细胞存活率=(实验组吸光度-空白组吸光度)/(对照组吸光度-空白组吸光度)×100%;检测细胞活力时,用不同浓度的Osi(0、1.25、2.5、5、10 μmol·L-1)或/和ANF(0.625、1.25、2.5、5 μmol·L-1)处理细胞72 h,加入CCK-8试剂后继续孵育1 h,酶标仪检测450 nm吸光度后,计算细胞半数抑制浓度(half maximal inhibitory concentration, IC50)。
1.2.3药物协同指数测定 将H1975/OR与PC9/OR细胞培养至对数生长期,接种于96孔板(5×103个细胞/孔)中。培养24 h后,采用正交试验设计方法,参考单药的IC50值,Osi组设浓度0、2、4、6、8 μmol·L-1,ANF组设浓度0、0.8、1、2 μmol·L-1,继续孵育72 h,检测方法同“1.2.2”。计算每个浓度下对细胞活力的抑制率,采用Compusyn软件分析两药联合效应,并采用中位数效应原理确定药物联合指数(combination index, CI)。CI=D1/Dx1+D2/Dx2,其中,D1和D2分别表示Osi和ANF联合应用产生同等效果所需要的剂量,Dx1和Dx2分别表示抑制一定水平细胞活力所需的Osi和ANF的剂量。CI<1代表两药在该浓度组合下具有协同作用,CI=1代表两药在该浓度组合下具有相加作用,CI>1代表两药在该浓度组合下具有拮抗作用。
1.2.4流式细胞术检测细胞凋亡 取对数生长期细胞接种于6孔板(2×105个细胞/孔),24 h后单独加入Osi、单独加入ANF或者用Osi+ANF联合处理,48 h后收集贴壁及上清中所有细胞,加入5 μL Annexin V-FITC和5 μL碘化丙啶(PI)染色液,于4 ℃避光孵育15 min,利用流式细胞仪检测细胞凋亡。
1.2.5EdU细胞增殖检测 取对数生长期细胞接种于24孔板(4×104个细胞/孔),24 h后单独加入Osi、单独加入ANF或者用Osi+ANF联合处理,48 h后加入EdU继续孵育2 h。将细胞用4%多聚甲醛固定后,用Click反应液和Hoechst避光染色,于正置荧光显微镜下观察并拍照,ImageJ软件处理图像并计数。EdU阳性细胞率=Edu染色阳性细胞数/Hoechst标记细胞数×100%。
1.2.6Transwell实验检测细胞迁移和侵袭能力 细胞迁移实验中,取对数生长期细胞接种于6孔板(2×105个细胞/孔),24 h后单独加入Osi、单独加入ANF或者用Osi+ANF联合处理,48 h后将细胞转移至24孔板Transwell小室的上室中(2×104个细胞/孔)进行无血清培养,下室中加入含20% FBS的RPMI 1640培养基500 μL,培养24 h后加入4%多聚甲醛固定15 min,加入0.1%结晶紫室温下染色15 min,于显微镜下拍照并用ImageJ软件计数。在细胞侵袭实验中,提前24 h于Transwell小室中铺基质胶,其余步骤同细胞迁移实验。
1.2.7RNA的提取以及实时荧光定量PCR检测基因表达 取对数生长期的H1975/OR和PC9/OR细胞接种于6孔板,24 h后单独加入2 μmol·L-1Osi、单独加入1 μmol·L-1ANF或者用Osi+ANF联合处理,48 h后用RNA提取试剂盒提取细胞总RNA,同时提取H1975和PC9两种细胞的总RNA,用逆转录试剂盒合成cDNA,以cDNA为模版进行实时荧光定量PCR反应,反应条件为:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,共40个循环,计算2-ΔΔCt值计算目的基因的相对表达水平,每组设置3个复孔,所用引物见Tab 1。
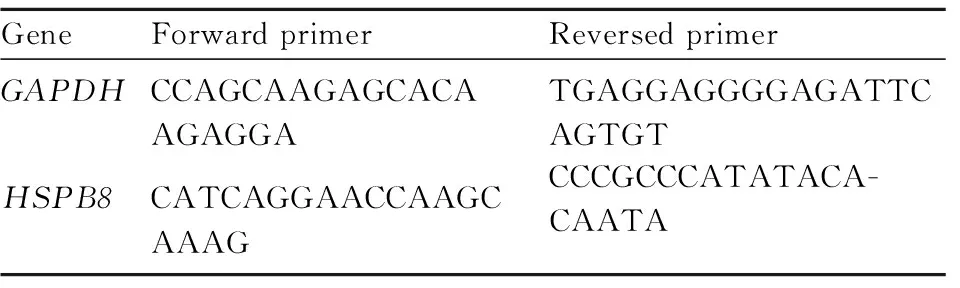
Tab1 Sequence of primers(5′- 3′)
1.2.8Western blot检测 取对数生长期的H1975/OR和PC9/OR细胞接种于6孔板中,24 h后单独加入2 μmol·L-1Osi、单独加入1 μmol·L-1ANF或者用Osi+ANF联合处理,48 h后收集细胞提取蛋白,同时收集H1975和PC9两种细胞的蛋白,用BCA试剂盒检测不同组蛋白浓度,进行SDS-PAGE电泳,然后电转至PVDF膜上,用5%脱脂奶粉封闭2 h后,4 ℃摇床过夜孵育一抗,用TBST洗涤3次后,加入二抗室温孵育1 h,再用TBST洗涤3次后,使用ECL系统检测蛋白表达量,实验重复3次。
1.2.9RNA的抽提以及RNA-seq检测 委托上海美吉生物医药科技有限公司进行测序,采用TRIzol(Invitrogen)法提取H1975和PC9敏感株以及H1975/OR和PC9/OR(分别用2 μmol·L-1Osi单独处理和2 μmol·L-1Osi与1 μmol·L-1ANF联合处理)细胞的总RNA,检测RNA样品的质量以保证使用合格的样品进行转录组测序。RNA文库的建立采用TruSeqTMRNA sample preparation Kit(Illumina,SanDiego,CA)试剂盒,文库使用Illumina HiSeq xten/NovaSeq 6000测序平台进行高通量测序,测序读长为PE150。

2 结果
2.1 建立并验证NSCLC细胞Osi获得性耐药模型本研究首先利用Osi敏感性H1975和PC9细胞,按照药物浓度递增法建立Osi获得性耐药细胞株H1975/OR与PC9/OR。CCK-8检测结果显示,Osi对H1975与H1975/OR的IC50值分别为0.074 μmol·L-1与5.204 μmol·L-1,耐药指数为70.31;Osi对PC9与PC9/OR的IC50值分别为0.042 μmol·L-1与5.692 μmol·L-1,耐药指数为136.99(P<0.01,Fig 1A)。流式细胞凋亡检测结果(Fig 1B)所示,与敏感株相比,0.5 μmol·L-1Osi处理48 h后,H1975/OR细胞凋亡率较H1975细胞降低了72.6%(6.99%vs25.51%,P<0.05),而PC9/OR细胞的凋亡率较PC9细胞下降了84.6%(4.55%vs29.53%,P<0.01)。以上结果表明,Osi获得性耐药NSCLC细胞株构建成功。
2.2 NSCLC细胞Osi获得性耐药逆转剂筛选为了寻找NSCLC细胞Osi获得性耐药的逆转剂,本研究利用FDA批准的1 470种药物分子库,通过CCK-8方法筛选与0.5 μmol·L-1Osi联用后可以明显杀伤H1975/OR与PC9/OR细胞的药物(Fig 2A)。首先将药物浓度设置在10 μmol·L-1,将10 μmol·L-1待筛药物与0.5 μmol·L-1Osi共同作用于H1975/OR细胞进行初筛,筛选出对细胞活力抑制率>50%的药物,共有91种(Fig 2B),其中30%为激酶抑制剂,17%为RNA、DNA、蛋白合成抑制剂,还包括组蛋白去乙酰化酶抑制剂、离子通道类抑制剂、蛋白酶体抑制剂等(Fig 2C)。随后,将这91种药物的浓度降至1 μmol·L-1,与0.5 μmol·L-1Osi联用后,同时在H1975/OR和PC9/OR细胞上进行复筛,发现14种药物对H1975/OR细胞活力的抑制率>50%,11种药物对PC9/OR细胞活力的抑制率>50%,其中有7种药物对两种耐药细胞活力的抑制率同时>50%,分别是帕比司他、硼替佐米、卡非佐米、伏立诺他、ANF、罗米地辛、高三尖杉酯碱(Fig 2D)。接下来,本研究比较了这7种药物在单独给药以及与0.5 μmol·L-1Osi联用时对两种耐药细胞活力的影响,发现ANF在两种情况下对细胞的杀伤作用差异最为明显:单独给药时,ANF对H1975/OR与PC9/OR细胞活力的抑制率分别为46.07%与40.32%;当与0.5 μmol·L-1Osi联用时,对H1975/OR与PC9/OR细胞活力的抑制率分别上升到了66.67%与70.76%(Fig 2E)。以上研究结果表明,不同于所筛选出的其他药物,尽管ANF在单独用药时对Osi获得性耐药的NSCLC细胞有一定杀伤作用,但是与Osi联合应用时效果更加明显,提示ANF的作用靶点极有可能与NSCLC细胞在耐药过程中发生改变的某些生物学特性密切相关。在此基础上进一步验证其对NSCLC细胞Osi获得性耐药的逆转作用,并探索其耐药逆转机制,不仅有助于探索新的安全有效的耐药逆转方案,还可以从全新视角了解更全面的Osi获得性耐药产生原因,为临床克服该现象提供新的解决思路。
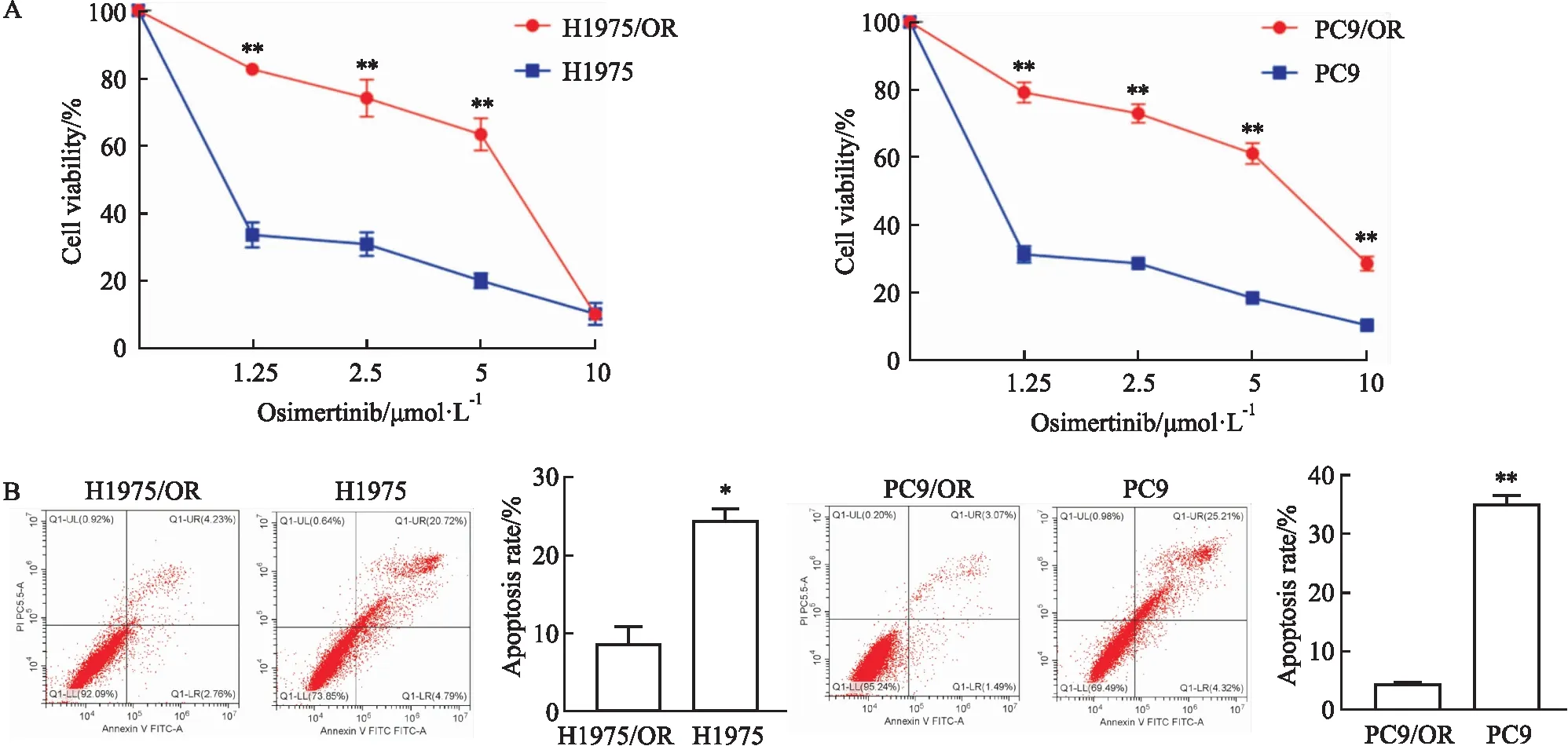
Fig 1 Establishment and validation of osimertinib acquired resistant NSCLC cell lines
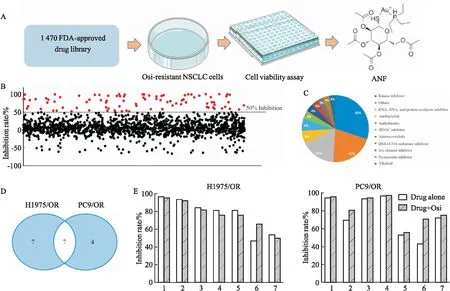
Fig 2 High-throughput screening drugs to reverse osimertinib acquired resistance
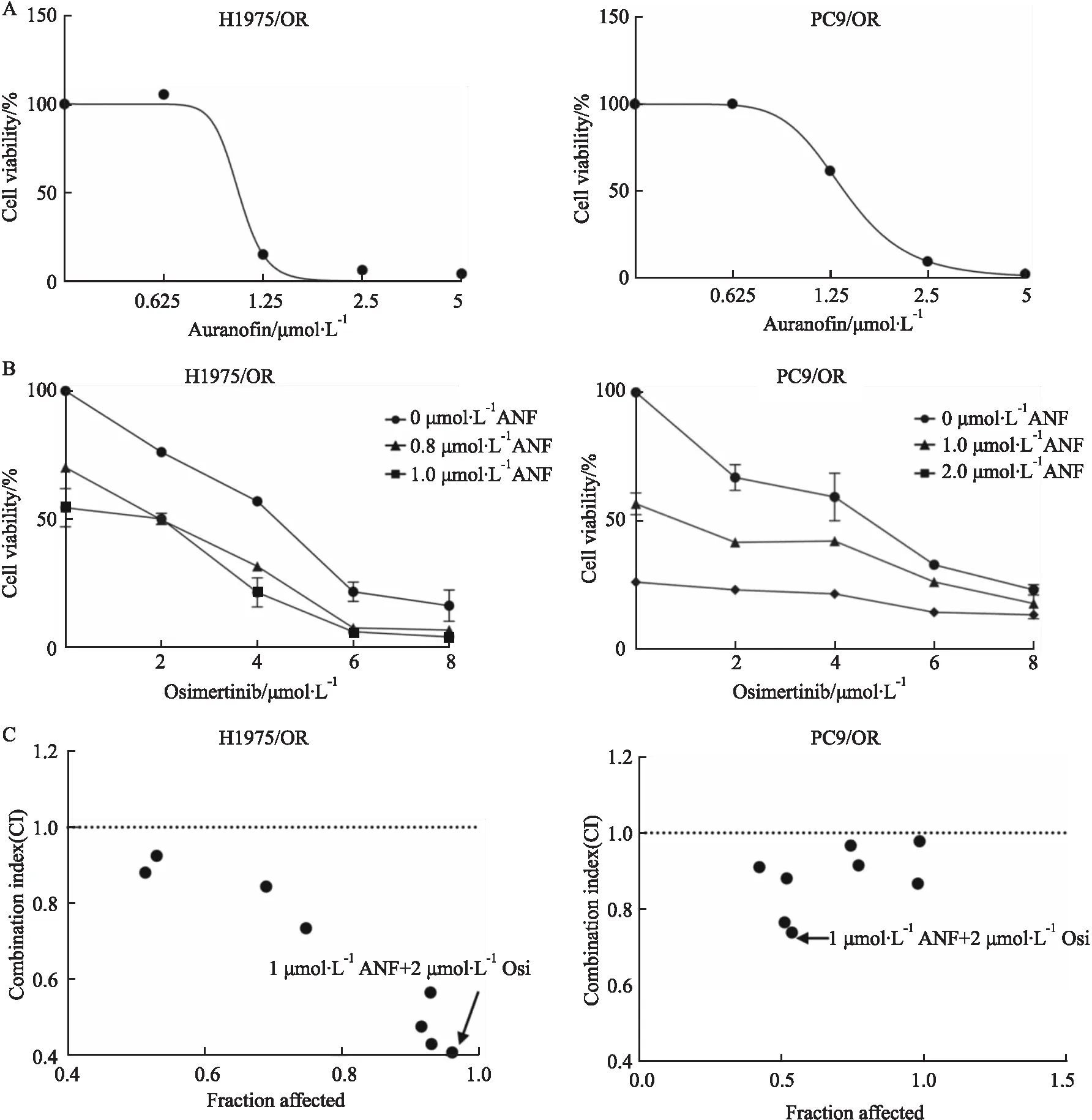
Fig 3 Different concentrations of auranofin and osimertinib combination effect on osimertinib resistant NSCLC cells
2.3 ANF与Osi联合用药效果评价为了进一步验证ANF与Osi联合用药的效果,并确定两药联用的最佳剂量,本研究首先利用CCK-8法检测了ANF单独处理Osi获得性耐药NSCLC细胞的IC50值,以便初步确定药物浓度范围。结果表明,ANF对H1975/OR细胞的IC50值为1.16 μmol·L-1,对PC9/OR细胞的IC50值为1.40 μmol·L-1(Fig 3A)。随后,将不同浓度ANF(0、0.8、1、2 μmol·L-1)与不同浓度Osi(0、2、4、6、8 μmol·L-1)作用于细胞,观察对细胞生长活力的抑制率(Fig 3B),并将抑制率数据输入CompuSyn软件中计算CI值[9]。结果发现,在所选的药物浓度配比方案下,两株细胞中所计算出的CI值<1,说明在这些浓度下,两种药物联用均产生了协同作用。其中,以1 μmol·L-1ANF+2 μmol·L-1Osi方案CI值最小,协同作用最强(Fig 3C),为最佳配比,故作为后续实验的浓度。
2.4 ANF与Osi联用对Osi获得性耐药NSCLC细胞生长增殖与凋亡的影响在EdU细胞增殖实验中,与对照组相比,ANF与Osi联合处理48 h后,H1975/OR与PC9/OR细胞的EdU阳性细胞比例分别下降了71.7%与86.5%,而ANF单独处理组则分别下降了39.9%与30.4%,Osi单独处理组分别下降13.6%与11.5%(P<0.01,Fig 4A)。流式凋亡检测结果也显示,相比于两者单独用药,ANF与Osi联合处理48 h后,两种耐药细胞株的凋亡率较两种药物单独处理组均明显增多(P<0.01,Fig 4B)。以上结果提示,ANF与Osi联用可明显抑制H1975/OR与PC9/OR细胞的生长增殖并诱导凋亡。
2.5 ANF与Osi联用对Osi获得性耐药的NSCLC细胞迁移与侵袭的影响细胞迁移实验结果表明,与对照组相比,ANF与Osi联合处理48 h后H1975/OR与PC9/OR细胞的迁移能力分别下降了86.5%与81.8%,而ANF单独处理组则分别下降了60.6%与40.2%,Osi单独处理组分别下降了14.2%与32.5% (P<0.01,Fig 5A);同样,细胞侵袭实验结果表明,与对照组相比,ANF与Osi联合处理使H1975/OR与PC9/OR细胞的侵袭能力分别下降了75.5%与80.3%,而ANF单独处理组则分别下降了49.6%与44.5%,Osi单独处理组分别下降了11.5%与13.1%(P<0.01,Fig 5B)。以上结果提示,ANF与Osi联用可显著抑制H1975/OR与PC9/OR细胞的侵袭与迁移能力。
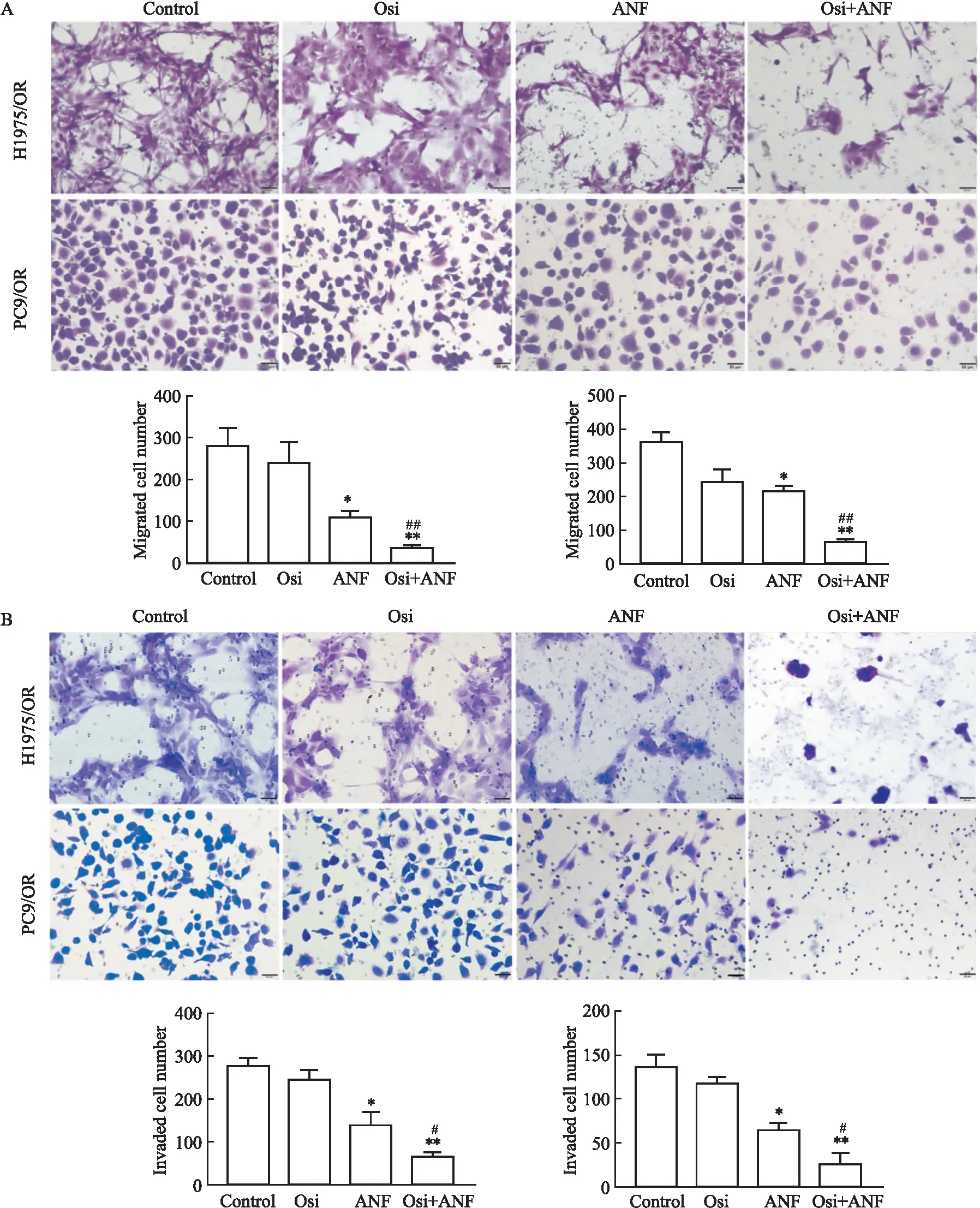
Fig 5 Auranofin and osimertinib combination inhibited migration and invasion ability of osimertinib resistant NSCLC cells
2.6 ANF和Osi联合用药后诱导HSPB8和自噬增加在H1975/OR与PC9/OR通过RNA-seq结果筛选联合用药与单独用Osi的差异表达基因(Fig 6A),共有36个基因在两个细胞中均上调,34个基因在两种细胞中均下调(Fig 6B),此外,在H1975与H1975/OR的RNA-seq结果中发现差异表达的基因中HSPB8耐药后下调,而该基因在联合用药后上调,对敏感株和耐药株进行qRT-PCR验证(Fig 6C)发现HSPB8在耐药后明显下调(P<0.01),而联合用药后明显上调(P<0.01),Western blot结果显示(Fig 6D),在两种细胞中,与敏感株相比,HSPB8表达水平明显下调(P<0.05或P<0.01),与单独加Osi相比,Osi和ANF联用HSPB8表达水平明显上调(P<0.01),且LC3-II/LC3-I水平明显上调(P<0.01),说明细胞耐药机制是通过下调HSPB8,而联合用药可以促进HSPB8表达,导致细胞自噬增多最终导致肿瘤细胞死亡。
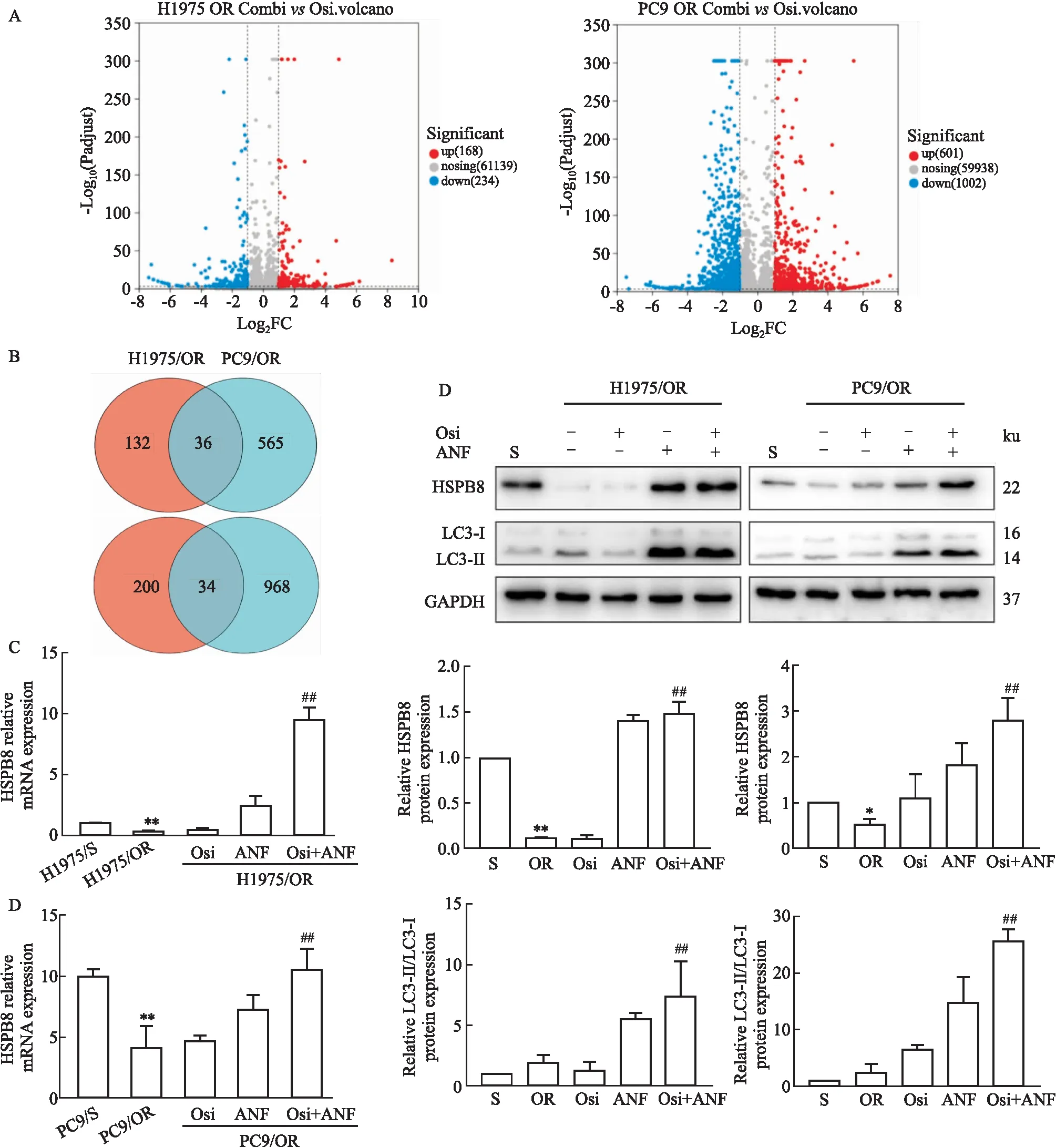
Fig 6 Auranofin and osimertinib combination induced HSPB8 expression and autophagy in osimertinib resistance NSCLC cells
3 讨论
肺癌的靶向治疗在多数研究中取得了明显有效的成果,EGFR突变在肺腺癌中比例高达40%~55%,第三代靶向药物Osi因为其疗效显著而被广泛应用,但是患者产生了获得性耐药限制了其应用。因此,开发、发掘新的药物克服Osi耐药,有望为临床耐Osi肺癌患者提供一个新的治疗思路。本研究通过高通量筛选发现一种抗类风湿关节炎的药物ANF可恢复Osi敏感性,并证明了其与Osi联用有协同效果,在细胞增殖、凋亡以及侵袭迁移上有明显的趋势。
ANF是一种含金的化合物,1985年被FDA批准用于治疗类风湿关节炎,很多研究表明其可以作为一种抗癌药发挥作用[10],在哺乳动物中ANF发挥其作用的机制主要是抑制硫氧还蛋白氧化还原酶TrxR1和TrxR2,这个机制在1998年被研究,到目前仍然是最主要的作用机制。硫氧还蛋白还原酶是硫氧还蛋白系统的关键酶,在很多癌症中报道癌组织中TrxR/Trx系统上调,且和癌症的进展与耐药相关,高表达TrxR/Trx系统还与肺癌和乳腺癌预后差相关[11]。除此之外,ANF可以通过其他多种作用机制发挥抗癌作用,在多发性骨髓瘤中已被报道ANF可以抑制NF-κB和JAK2/STAT3信号通路从而抑制骨髓瘤的进展[12],2013年Wang等报道PKCitoa也是ANF的靶点之一。在NSCLC中报道ANF可以抑制PKCitoa,进而抑制ELF3的磷酸化和后续转位到细胞核促进转录的功能,最终导致癌细胞生长受到抑制[13]。多数研究表明,ANF单独应用具有抗癌作用,但是所需浓度较大,会产生一定的副作用,而联合用药可以降低两药的浓度减小副作用且可产生较好的抑制效果,Liu通过高通量的药物库筛选出ANF在耐药的肺小细胞癌中增强顺铂疗效,联合用药诱导ROS增多,最终导致线粒体损伤和DNA损伤[14]。ANF被报道与吉非替尼联用也有协同抗癌效果,但是其对增强Osi敏感性效果尚未被研究。
HSPB8属于热休克蛋白中小分子热休克蛋白家族(small heat shock proteins,sHSPs),在环境和生理刺激下表达增多,分子量22 ku,其与BAG3结合后可将错误折叠蛋白通过自噬途径降解[15]。有研究报道,HSPB8既有促癌作用又有抑癌作用,在不同肿瘤中表达情况不同,如在黑色素瘤中,HSPB8和TAK1结合导致p38-MAPK信号通路激活最终导致细胞凋亡,激活的TAK1在Ser552位点结合并磷酸化β-catenin,导致CDK2转录减少,最终导致细胞周期阻滞[16];在肝细胞癌中,HSPB8和PI3K结合抑制癌细胞的侵袭和迁移[17]。其在肺癌中的研究较少,本研究发现HSPB8在肺癌中发挥抑癌作用且与自噬相关。
综上所述,本研究从高通量筛选入手,从1 470种FDA批准的药物库中在H1975/OR和PC9/OR细胞中筛选增强Osi敏感性的药物,最终选出ANF在其血药浓度时即可发挥抑制肿瘤细胞生长和增强Osi疗效的作用,并从两个细胞系的功能上进行研究,发现两药联用效果明显,对其作用机制进行研究后发现,耐药后HSPB8表达水平下调,而联合用药后HSPB8和自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ表达水平上调,自噬增强导致肿瘤细胞死亡增多说明HSPB8作为抑癌基因在NSCLC耐Osi细胞株中发挥作用。该研究有望对临床耐药患者的用药方案的选择提供新思路。
