减毒沙门菌SGN1对鼻咽癌的抑制作用及机制研究
2023-10-22赖运浩谭绮婷黄庭祺彭月荣李芳红赵正刚周素瑾麦家洛赵子建
赖运浩,谭绮婷,黄庭祺,刘 石,彭月荣,李芳红,赵正刚,周素瑾,麦家洛,赵子建
(1. 广东工业大学生物医药学院,广东 广州 510006;2. 北京理工大学珠海学院材料与环境学院 广东 珠海 519085;3. 广州华津医药科技有限公司, 广东 广州 510700)
鼻咽癌是一种高发于中国南部以及一些东南亚地区,在世界其他地区却罕见的癌症[1]。鼻咽癌发生率男性高于女性[2]。EB病毒(Epstein-Barr virus,EBV)感染和环境以及遗传因素是鼻咽癌发生的主要原因[3]。目前鼻咽癌主要治疗技术手段是进行常规化疗或者放疗,但治疗效果有限,30%~40%病人治疗4年后复发且发生远处转移,且对放射治疗不敏感[4-6]。因此寻找一种治疗有效减少复发的手段具有重要意义。
溶瘤细菌疗法是目前极具创新疗法,靶向性高,定植肿瘤微环境[7]。细菌可以通过基因工程改造编码和通过局部递送有效载荷,包括小分子、毒素、免疫调节剂、前药物转化酶,小干扰RNA和纳米体等[8]。已有临床试验证明VNP20009的安全性[9],但其有效性有待研究。由广州华津医药科技有限公司自主研发SGN1利用VNP20009靶向性以及绝大多数肿瘤细胞具有甲硫氨酸依赖性特点进行基因工程改造获得高表达甲硫氨酸酶减毒沙门菌SGN1,甲硫氨酸酶可分解甲硫氨酸为甲硫醇、α-酮丁酸和氨,进一步降低肿瘤细胞内甲硫氨酸水平[10]。前期已有研究在其他肿瘤如乳腺癌中有良好治疗效果,且副作用低[11],但鼻咽癌对甲硫氨酸限制的敏感性以及高表达甲硫氨酸酶减毒沙门菌SGN1在鼻咽癌上的治疗作用仍有待进一步研究。本研究通过甲硫氨酸限制培养以及利用减毒沙门菌SGN1研究对鼻咽癌的治疗作用及机制,为后期临床治疗奠定理论基础。
1 材料与方法
1.1 材料
1.1.1菌种与细胞株 SGN1、VNP20009-V(VNP-V)均来自广州华津医药科技有限公司。人源鼻咽癌细胞HNE细胞、5-8F细胞和CNE-2细胞,由中南大学研究中心赠予。
1.1.2实验动物 4~5周龄的♂BALB/c-nude裸鼠鼠购自广东药康生物科技有限公司,饲养于广东药科大学实验动物中心,实验伦理严格遵循广东药科大学动物护理委员会规定(批号:GOPUSPF2017048)。
1.1.3试剂与仪器 普通RPMI 1640培养基(含甲硫氨酸, 货号11875119)、不含甲硫氨酸的RPMI 1640(货号A14517-01)培养基购自Gibco公司;L-甲硫氨酸(L-Methionine, Met, 货号M5308)、L-同型半胱氨酸(L-Homocysteine, Hcy, 货号H9633)、硫酸卡那霉素(E00400)购自Sigma公司;青霉素和链霉素(货号15140-122)购自赛默飞公司;胎牛血清(FBS, 货号Z7185FBS)购自Zeta公司;胰蛋白胨(货号VG0300)、酵母提取物(货号LP0021B)购置赛默飞公司;PBS片剂(磷酸缓冲盐溶液, 货号B640435)、硫酸庆大霉素(货号A506614)、CCK-8试剂盒(货号E606335)购自上海生工生物公司;氯化钙(货号1.02378)、硫酸镁(货号1.05886)购自德国默克公司;BCA蛋白定量试剂盒(货号23235)购自赛默飞公司、ECL发光液(货号E412-01-AA)购自南京诺维赞公司;Bcl-2(货号D55G8)、GADPH(货号2118S)抗体购自CST公司;HPR标记的山羊抗兔二抗(货号A21245)购自赛默飞公司;细胞周期与细胞凋亡检测试剂盒(货号C1052)上海碧云天生物技术有限公司;APC Annexin-V/PI凋亡检测试剂盒(货号640932)购自Biolegend公司。AC2-4S1型二级生物安全柜购自ESCO公司;TDZ5-WS型多管架自动平衡离心机购自大龙兴创实验仪器(北京)有限公司;流式细胞仪购自美国贝克曼公司;ChemiDoc+XRS化学发光凝胶成像系统美国伯乐公司;倒置显微镜购自德国尼康公司;酶标仪购自美国BioTek公司。
1.2 方法
1.2.1细胞培养 人源鼻咽癌细胞培养采用1%双抗(含100 mg·L-1链霉素和100 kU·L-1青霉素)以及10%胎牛血清的RPMI 1640培养基,放置于37 ℃、5% CO2培养箱中进行培养,每隔2~3 d进行传代1次。所有细胞实验均取处于对数生长期的细胞进行研究。
1.2.2细胞计数检测细胞生长曲线 取人鼻咽癌细胞接种于6孔板,分为con、Met-Hcy+、Met-Hcy-(con:对照组含终浓度为200 μmol·L-1甲硫氨酸不含同型半胱氨酸RPMI 1640完全培养基;Met-Hcy+:含终浓度为200 μmol·L-1同型半胱氨酸不含甲硫氨酸RPMI 1640完全培养基;Met-Hcy-:既不含甲硫氨酸也不含同型半胱氨酸RPMI 1640完全培养基)。各组放置于37 ℃、5% CO2培养箱中进行2、4、6 d进行培养。取相应时间点进行消化并且用血细胞计数板进行计数和统计。
1.2.3细胞平板克隆 每组细胞以每孔3000个细胞分别接种于6孔板中,分成con组和met-组(met-为RPMI 1640完全培养基不含甲硫氨酸组别),贴壁后con组为含甲硫氨酸的1640完全培养基,met-改为不含甲硫氨酸RPMI 1640完全培养基,每隔3 d进行换液,培养21 d;吸除上清液用PBS清洗2次,添加1 mL甲醇固定15 min;用2%结晶紫染液染色15 min,直接用肉眼计数形成细胞克隆数并进行统计。
1.2.4细胞划痕实验 取对数生长期细胞消化重悬种板,每孔添加4×105个细胞过夜培养,当细胞长满整个孔进行划痕,划痕完成后用1 mL PBS洗2次将划痕时漂浮起来的细胞洗去,分为对照组con和实验组met-,然后根据组别加入完全培养基和完全培养基甲硫氨酸缺陷培养基。在0 h、24 h在划痕同一位置进行拍照取样,通过观察划痕面积的变化情况对细胞的迁移性能进行检测。
1.2.5流式细胞术检测细胞周期 取对数生长期的细胞,细胞数为5×105/皿,实验组met-用甲硫氨酸缺陷培养基处理48 h或4 d,用胰酶消化轻微吹打成单细胞悬液,1 000×g离心5 min用PBS清洗2遍。离心去上清,各加入1 mL预冷70%乙醇固定24 h。固定后离心去上清,加入PI染液37 ℃避光温育30 min,用流式细胞仪检测各组细胞周期情况。
1.2.6流式细胞术检测细胞凋亡 用甲硫氨酸缺陷培养基提前种板分为对照组con和实验组met-,对照组按照1 ∶1 000的比例加入甲硫氨酸(200 mmol·L-1),而实验组则进行甲硫氨酸缺陷培养。培养4 d后进行消化处理,后将细胞悬液离心2分钟弃去上清,加入1 mL PBS进行吹打混匀;再离心2分钟弃去上清;接着添加100 μL Binding Buffer吹打混匀进行缓冲,再加5 μL APC Annexin V混匀;后再加10 μL PI染液充分混匀进行染色,避光静置15分钟;静置结束后再加入400 μL的Binding Buffer,混匀后使用流式细胞术法进行细胞凋亡检测。
1.2.7蛋白免疫印迹检测凋亡蛋白表达 使用RIPA强裂解液对各组蛋白进行提取,用BCA试剂盒对蛋白浓度进行测定并用5 × SDS进行95 ℃变性。经过电泳、转膜、封闭,按1 ∶1 000稀释一抗,然后4 ℃孵育过夜,用二抗(1 ∶5 000)室温孵育1 h后,用化学发光成像仪进行曝光,用Image Lab分析条带灰度。
1.2.8细菌细胞共培养实验 分别划线接种VNP-V和SGN1于5 mL改良型LB液体培养基(含50 mg·L-1卡那霉素)过夜培养,取过夜培养液以1 ∶100转接于改良型LB液体培养基8000 ×g离心5 min去除培养基,生理盐水重悬离心重复3次,离心生理盐水重悬后调节浓度为1×1012cfu·L-1,根据不同需求用于后续菌胞共培养。每组以1.0×105个细胞每孔分别接种于6孔板中,贴壁后,根据细胞细菌比例1 ∶100分别加入VNP-V和SGN1共培养5 h后,用庆大霉素进行灭活24 h进行用CCK8进行检测细胞增殖,而细胞凋亡情况通过流式细胞术进行检测。
1.2.9裸鼠皮下构建5-8F异种肿瘤模型 制备5-8F细胞悬液浓度为每毫升0.5×107细胞,取200 μL注射于裸鼠右腋下,待皮下肿瘤约80~100 mm3分成3组con、VNP-V、SGN1,每组3只分别进行瘤内给药,对照组瘤内注射20 μL生理盐水,而VNP-V组和SGN1组分别注射2×105cfu/只。每隔3 d使用游标卡尺量取肿瘤体积[肿瘤体积(mm3)=0.52×长(mm)×宽2(mm2)]和称取小鼠体质量,绘制肿瘤生长曲线。

2 结果
2.1 人源鼻咽癌细胞HNE-2、5-8F和CNE-2具有甲硫氨酸依赖性为了证明人源鼻咽癌细胞对甲硫氨酸具有依赖性,在甲硫氨酸缺陷的培养条件下对鼻咽癌细胞5-8F、HNE-2、CNE-2进行培养,分别在第0、2、4、6天对细胞进行计数,发现对照组的5-8F、HNE-2、CNE-2细胞正常生长,而甲硫氨酸缺陷组生长受到显著抑制即使补充同型半胱氨酸组(P<0.01),5-8F、HNE-2、CNE-2细胞生长仍然受到抑制(Fig 1A-C),以上结果提示,人源鼻咽癌细胞HNE-2、5-8F和CNE-2具有甲硫氨酸依赖性。

Fig 1 Nasopharyngeal carcinoma cells depended on methionine
2.2 甲硫氨酸限制抑制鼻咽癌细胞的克隆形成能力和迁移能力为进一步探讨甲硫氨酸限制对鼻咽癌细胞5-8F、HNE-2的增殖和迁移能力的影响,通过平板克隆实验结果发现,甲硫氨酸缺陷培养的实验组鼻咽癌细胞单克隆形成能力相对对照组显著受到了抑制,具有统计学差异(Fig 2A,B,P<0.01)。此外,同时进行划痕实验,通过划痕面积的改变来检测细胞的迁移能力。根据实验结果显示(Fig 2C),划痕后24 h,甲硫氨酸缺陷培养组的细胞划痕伤口愈合受到抑制。以上结果表明甲硫氨酸缺陷对鼻咽癌细胞HNE-2、CNE-2的迁移有抑制作用。
2.3 甲硫氨酸限制促进鼻咽癌细胞凋亡和周期阻滞为了探索甲硫氨酸缺陷对鼻咽癌细胞的凋亡和细胞周期作用,用流式细胞术检测甲硫氨酸缺陷后对鼻咽癌细胞的凋亡和周期的变化。首先用PI检测甲硫氨酸缺陷对鼻咽癌细胞CNE-2周期的变化情况,结果表明,甲硫氨酸缺陷阻滞鼻咽癌细胞周期在G2/M期(Fig 3A,B)。然后进一步用PI/Annexin-V染料检测在甲硫氨酸缺陷培养条件下鼻咽癌凋亡情况,结果表明,甲硫氨酸缺陷促进鼻咽癌细胞凋亡(Fig 3C,D),且具有统计学差异(P<0.01)。进一步检测细胞凋亡蛋白情况,通过Western blot检测抗凋亡蛋白Bcl-2,结果发现甲硫氨酸剥夺明显下调鼻咽癌细胞Bcl-2的表达(Fig 3E-G),从而促进鼻咽癌细胞凋亡。
2.4 SGN1诱导鼻咽癌细胞发生凋亡前期研究减毒沙门细菌SGN1可表达甲硫氨酸酶从而降低肿瘤细胞内甲硫氨酸[10],因此进一步验证SGN1对人源鼻咽癌细胞生长抑制作用,首先将鼻咽癌细胞5-8F、HNE-2、CNE-2与SGN1以共培养比例(1 ∶100)进行菌胞共培养5 h,结果发现SGN1抑制人鼻咽癌细胞5-8F、HNE-2和CNE-2细胞增殖(Fig 4A),并且通过PI/Annexin-V染色流式细胞术检测发现,SGN1促进鼻咽癌细胞的凋亡(Fig 4B,C),且较对照组具有统计学差异。
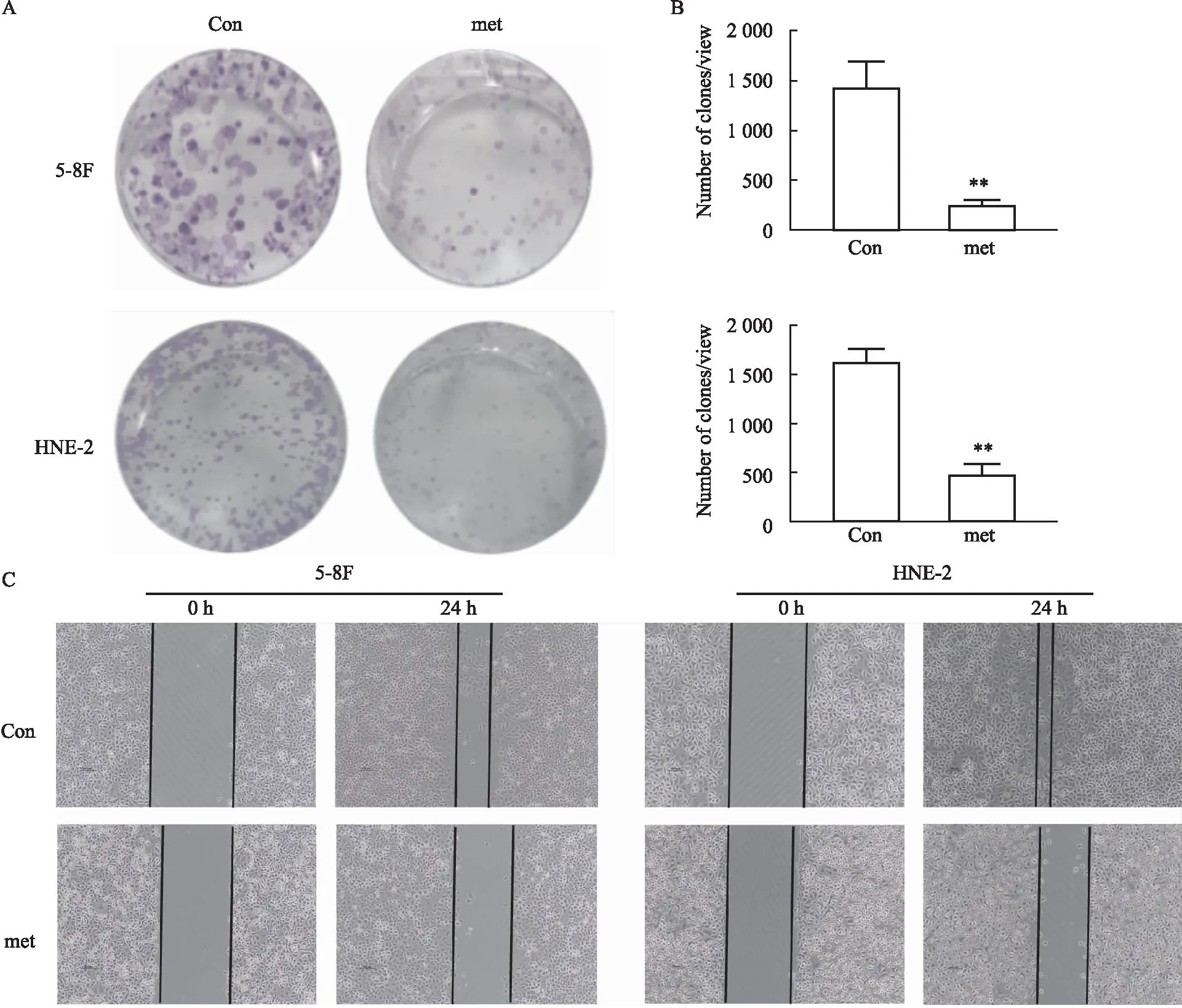
Fig 2 Effect of methionine deprivation on monoclonal formation and migration of nasopharyngeal carcinoma cells(n=3)
2.5 SGN1抑制鼻咽癌异种移植瘤生长为了进一步观察SGN1在体内的效果,我们通过构建鼻咽癌皮下异种移植瘤(5-8F)模型,通过瘤内给予药物后,观察裸鼠的活动、进食无明显差别,体质量呈稳定趋势。与对照组、VNP-V相比,SGN1显著抑制肿瘤生长,且瘤重明显低于对照组(P<0.05)和VNP-V组(P<0.01)(Fig 5C,D),而VNP-V相对对照组组无明显差异(Fig 5 B),说明SGN1可抑制鼻咽癌异种移植瘤的生长。
3 讨论
鼻咽癌是一种复杂多因素疾病,且疾病发生发展速度快,目前治疗药物有限,因此寻找一种治疗有效减少副作用的药物具有重要意义。甲硫氨酸是人体必须氨基酸,参与DNA、蛋白质等重要物质的合成,而肿瘤普遍具有甲硫氨酸依赖性,剥夺甲硫氨酸能够特异的抑制肿瘤细胞的生长[12]。而且前期研究主要关注限制甲硫氨酸饮食和注射重组甲硫氨酸酶疗法,尽管这两种限制甲硫氨酸的方法有一定抑制肿瘤的作用,但同时也伴有较为严重的副作用,如导致患者体重减轻、引起机体免疫反应等[13-14]。而细菌作为靶向载体表达作用分子,具有用于治疗肿瘤潜在的临床价值。SGN1具有VNP20009靶向性及安全性和可分解肿瘤细胞内甲硫氨酸特性,能特异的与肿瘤竞争甲硫氨酸,前期研究已在骨肉瘤、乳腺癌取得显著的药效作用[15],在本研究经甲硫氨酸限制处理人鼻咽癌细胞生长速度减慢,克隆形成率下降以及迁移。以上结果表明,SGN1可限制肿瘤甲硫氨酸,发挥抑制人鼻咽癌细胞生长的作用。
甲硫氨酸限制影响S-腺苷甲硫氨酸(S-adenosyl-l-methionine,SAM)合成减少,从而降低甲基化进而造成代谢缺陷,导致细胞周期阻滞进而促进细胞发生凋亡。甲硫氨酸依赖性肿瘤细胞中的甲硫氨酸减少可导致细胞周期停滞在S/G2期,而停滞在S/G2期细胞易发生自发性死亡并对化疗药物更加敏感[16]。本研究通过剥夺肿瘤细胞甲硫氨酸使肿瘤细胞细胞周期阻滞在G2/M期。G2期检查点能防止受损DNA和未完成复制DNA进入有丝分裂,而鼻咽癌细胞DNA复制在G2/M期受阻,导致肿瘤细胞不能完成DNA复制进一步阻断细胞有丝分裂,从而可能诱导细胞发生凋亡。细胞凋亡是细胞程序性死亡的一种方式,由多基因控制此过程,如Bcl-2、caspase家族等[17]。通过甲硫氨酸缺陷处理人鼻咽癌细胞,流式细胞术检测发现甲硫氨酸缺陷处理后人鼻咽癌细胞凋亡率增加,并且Western blot结果显示下调抗凋亡蛋白Bcl-2,以上结果表明甲硫氨酸剥夺可促进鼻咽癌细胞发生凋亡,因此通过剥夺肿瘤细胞甲硫氨酸抑制肿瘤生长是可行有效的。
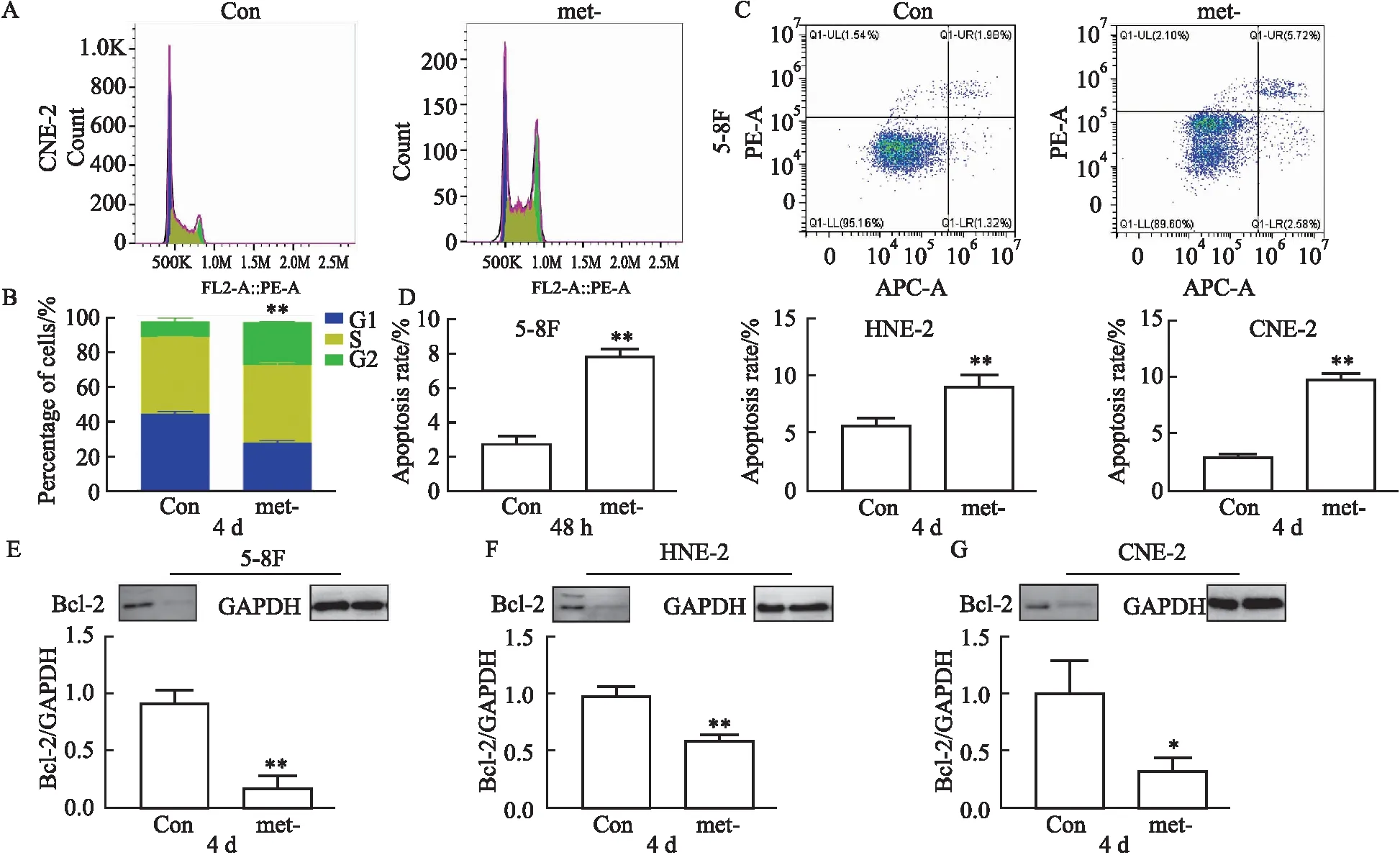
Fig 3 Effect of methionine deprivation on cell cycle and apoptosis in nasopharyngeal carcinoma cells(n=3)
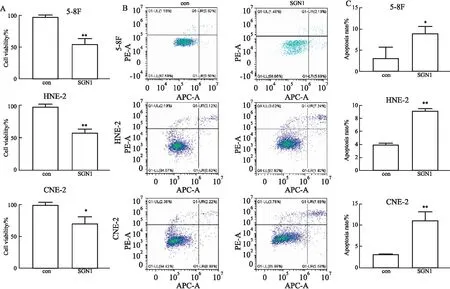
Fig 4 SGN1 inhibited proliferation and induced apoptosis in nasopharyngeal carcinoma cells(n=3)
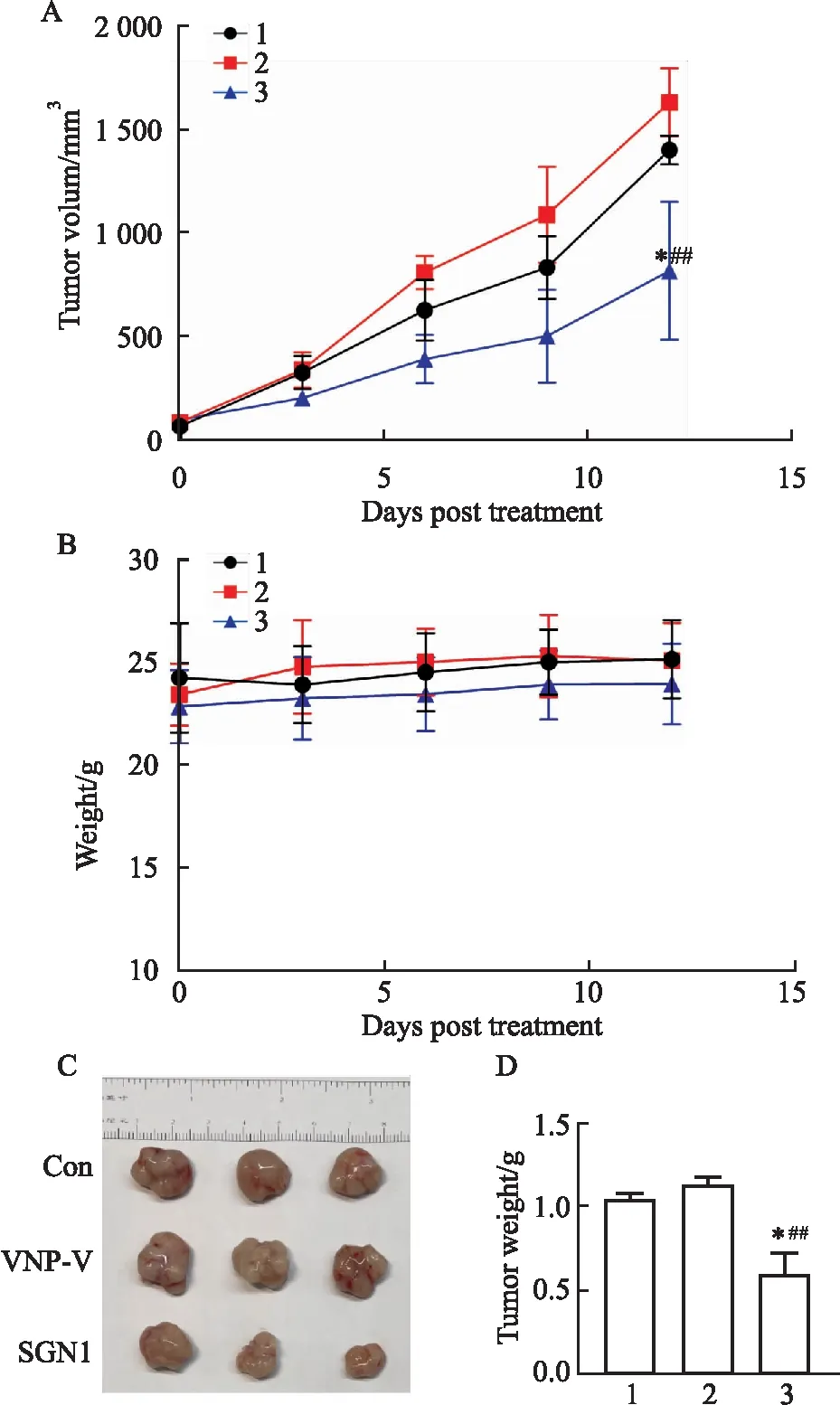
Fig 5 SGN1 inhibited nasopharyngeal carcinoma 5-8F subcutaneous xenograft tumor growth(n=3)
细菌的天然靶向性可作为介导载体用于抗肿瘤治疗,减毒沙门菌SGN1以VNP20009为载体表达甲硫氨酸酶,甲硫氨酸酶可分解肿瘤内甲硫氨酸,可解决重组甲硫氨酸酶容易被人体代谢的问题。本研究首先通过SGN1与鼻咽癌细胞进行共培养,发现减毒沙门菌SGN1抑制鼻咽癌细胞增殖并诱导肿瘤细胞发生凋亡,体内实验结果表明,SGN1显著抑制鼻咽癌5-8F皮下抑制瘤的生长,而小鼠体质量则不受影响。说明减毒沙门菌SGN1可作为鼻咽癌潜在治疗药物,但SGN1是通过哪些信号分子诱导肿瘤细胞凋亡以及在患者体内激活免疫功能协助如何抗肿瘤机制还需进一步研究。
综上所述,高表达甲硫氨酸酶减毒沙门菌SGN1显著抑制人鼻咽癌细胞的增殖,可能通过阻滞细胞周期G2/M期诱导细胞凋亡,从而抑制鼻咽癌细胞的生长。因此利用沙门菌靶向表达甲硫氨酸酶用于治疗鼻咽癌具有临床潜在价值,同时也为SGN1在临床治疗鼻咽癌提供药理研究基础。
