基于非靶向代谢组学的烟草镰刀菌根腐病和黑胫病拮抗链霉菌及其代谢产物的鉴定
2023-10-21单宇航李淑君吴元华安梦楠
刘 鹤,单宇航,邱 睿,李淑君,张 崇,吴元华,安梦楠*
(1.沈阳农业大学植物保护学院,沈阳 110866;2.烟草行业黄淮烟区烟草病虫害绿色防控重点实验室/河南农业科学院烟草研究所,许昌 461000)
目前由于化学肥料与农药的滥用,导致土壤健康逐渐恶化,病原物抗药性增强,给烟草土传病害的防控带来很大困难[1],因此生物防治逐渐受到人们的重视与选择。其中微生物源代谢产物的开发及利用,不仅对烟草土传病害防控技术的研究开发具有重要意义,也符合我国发展绿色植保的要求。目前开发的针对烟草土传病害的生防微生物只有少数芽孢杆菌和木霉菌等[2],鲜见防治烟草土传病害生防链霉菌的相关报道。
微生物代谢产物的结构鉴定多以发酵工艺为基础,通过系列繁琐的纯化步骤,分离提纯得到单体化合物后才可明确结构,全过程表现出高度的随机性、时变性、非线性和时滞性[3],因此色谱-质谱联用(LC/MS)的非靶向代谢组学的应用与发展就有效缩短了代谢产物成分鉴定的过程[4]。非靶向代谢组学可基于高通量、高分辨率、高灵敏度的特点,定性和相对定量生物体系中的代谢物,最大程度反映总的代谢物信息,实现在单次分析中全面检测和鉴定全部小分子量的代谢产物,有助于尽快确定代谢产物中的有效成分,或一些潜在的先导化合物。LC/MS 技术已成为代谢组学研究中重要工具之一[5],且适用于分析难挥发或热稳定性差的代谢物[6]。
本研究以烟草镰刀菌根腐病和烟草黑胫病为靶标对象,将针对两种病害均具有良好生防作用的链霉菌SN53 进行了分类鉴定,通过LC/MS 非靶向代谢组鉴定出其发酵液中主要成分为茴香霉素,并且以纯品为对照,通过高效液相色谱明确了茴香霉素在粗提物中的含量。然后通过病原菌生长抑制试验,测定了SN53活性代谢产物—茴香霉素对烟草镰刀根腐病菌和烟草黑胫病菌的抑菌活性及EC50值,为后续对生防菌剂的开发和利用提供了理论基础。
1 材料与方法
1.1 供试材料
实验室前期从河南省洛阳市伊川县烟草种植基地中烟草土传病害常发区域筛选得到一株生防菌,编号SN53。烟草镰刀根腐病菌Fusariumoxysporum和烟草黑胫病菌Phytophthoranicotianae由河南省农业科学院烟草研究所分离保存,经28 ℃活化培养3 d 后用于后续试验。试验所用培养基[7]为马铃薯葡萄糖琼脂培养基(PDA),高氏一号培养基,酵母麦芽浸汁琼脂培养基(ISP2),燕麦粉琼脂培养基(ISP3),无机盐淀粉琼脂培养基(ISP4),甘油天冬酰胺琼脂培养基(ISP5),蛋白胨酵母提取物铁琼脂培养基(ISP6)及酪氨酸琼脂培养基(ISP7)。
1.2 方法
1.2.1 生防菌SN53 抑菌活性测定 以烟草镰刀根腐病菌和黑胫病菌作为靶标病原菌,采用平板对峙法,将培养7 d 的SN53 菌饼(直径5 mm)放置于PDA 平板中央,病原菌菌饼(直径5 mm)对称放于生防菌两侧。平板于28 ℃恒温培养箱中培养,观察菌株对靶标菌的抑菌效果。
1.2.2 菌株SN53 的鉴定 吸取适量SN53 菌悬液涂布在高氏一号培养基上,28 ℃培养5 d 后在光学显微镜下观察其菌落和孢子形态并通过扫描电镜观察其菌丝形态特征。培养性状观察:用接菌针挑取SN53 菌种在PDA、高氏一号培养基、ISP-2、ISP-3、ISP-4、ISP-5、ISP-6 和ISP-7 平板上进行划线,28 ℃倒置培养5 d 后观察菌株的菌落形状、颜色和质地等培养性状。根据《链霉菌鉴定手册》和《伯杰细菌鉴定手册》对SN53 进行生理生化特征检测。
按照DNA 提物试剂盒的说明对SN53 的DNA 进行提取;再利用细菌16S rDNA 通用引物:63F:5′-AGAGTTTGATCCTGGCTCAG-3′;1492R:5′-TACGGCTACCTTGTTACGACTT-3′进行PCR 扩增。PCR采用20 μL 反应体系:2×TaqPCR Mix 10 μL,正反向引物(10 μmol/L)各0.4 μL,DNA 模板0.4 μL,ddH2O补足到20 μL。PCR 反应条件:94 ℃预变性5min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1.5 min,32 个循环;72 ℃延伸10 min。最后将PCR 产物进行测序并将所获得的序列进行BLAST 比对,使用MEGA7软件以邻接法将所得到的序列与NCBI 下载的其他分离物的16S rDNA 序列进行处理,构建系统进化树。
1.2.3 SN53 发酵液LC/MS 非靶向代谢组的检测 参考司洪阳[7]的微生物代谢产物粗提物制备方法,取SN53 菌株的孢子悬浮液接种于LB 液体培养基中,28 ℃、180 r/min 摇瓶培养2 d 作为种子液。将SN53种子液接种于高氏一号培养基中,接种量为5%,发酵培养6 d。将发酵液先经10000 r/min、4 ℃下离心15 min 去除菌丝体,再经0.22 μM 滤膜收集发酵液。发酵滤液使用Amberlite XAD 16 大孔吸附树脂,按5%(m/V)的比例对培养液中的活性物质进行吸附后烘干树脂。用甲醇对烘干的树脂进行洗脱,并将洗脱液进行旋转蒸发,最终得到得甲醇浸膏粗提物用于LC-MS 非靶向代谢组的检测。样品采用ACQUITY UPLC BEH C18 column(100 mm×2.1 mm,1.7 μm,Waters,USA)进行色谱分离,以进样量为5 μL,柱温为40 ℃,流速0.3 mL/min,流动相为0.1%甲酸水(A)和乙腈(B)的条件对代谢物按以下梯度进行洗脱:0~1.0 min,5% B;1.0~9.0 min,5%~100% B;9.0~12.0 min,100% B;12.0~15.0 min,5% B。
高效液相色谱分离后的样品,经Q-Exactive 四级杆-静电场轨道阱高分辨质谱仪,采用电喷雾电离(ESI)正离子和负离子模式进行质谱分析。ESI 源条件如下:离子源气1 和2 分别为60,气帘气为30,源温度320 ℃,离子源喷雾电压为±3.5 kV;MS 扫描范围为80~1200 Da。二级质谱经高敏感模式下数据依赖型扫描获得,其中去簇电位为±60 V,碰撞能为35±15 eV。
采用Compound Discoverer 3.0 软件进行数据处理,包括峰提取、峰对齐、峰校正、标准化等。检索HFMDB、Biocyc、Lipidmaps、HMDB、metlin 等数据库对代谢物进行结构鉴定,所用方法为精确质量数匹配(<25 µg/mL)和二级谱图匹配的方式。
1.2.4 非靶向代谢组学的验证及产物含量测定 利用高效液相色谱法对LC/MS 非靶向代谢组学中测定出的含量最高的化合物进行验证。准确称量0.2 g 1.2.3 中得到的粗提物用于产物验证试验,同时称取茴香霉素标准品(市购)为对照组,并用流动相溶解后,配置成100、200、400、600 和800 µg/mL 的茴香霉素标准品溶液,超声30 min 后经0.22 µm 的滤膜过滤。参考郭霞凌和李辉[8]的色谱条件,设置流动相为0.05 M,pH 6.0 的磷酸盐缓冲液与乙腈体积比(磷酸盐缓冲液:乙腈=80:20),样品进样量为20 µL,检测波长为225 nm,流速为1.0 mL/min,色谱柱为Venusil MP C18(4.6×250mm,5 µm),柱温为30 ℃。
记录并比较样品与标准品出峰时间确认产物成分,同时参考外标法[9]利用不同质量浓度的茴香霉素标准品的出峰时间以及相应的峰面积来绘制标准曲线,得到线性方程及回归系数。最后带入粗提物样品的出峰面积计算出茴香霉素的含量。
1.2.5 茴香霉素对烟草镰刀根腐病菌及黑胫病菌菌丝生长影响的测定 将茴香霉素纯品(市购,纯度99.8%)按照不同比例加入冷却至50 ℃的PDA 培养基中,使其终浓度分别为200、400、800、1600 和3200 μg/mL。而后将直径为5 mm 的病原菌菌饼倒置接入含药平板中央,28 ℃恒温培养4 d。利用十字交叉法测量菌落直径。以不加茴香霉素培养的病原菌为对照,每个试验重复3 次。计算不同浓度的茴香霉素对烟草镰刀根腐病菌菌丝的生长抑制率。茴香霉素对烟草黑胫病菌的菌丝生长抑制试验方法同上,其中茴香霉素终浓度为25、50、100、200 和400 μg/mL。菌丝生长抑制率(%)=(对照菌落直径—处理菌落直径)/对照菌落直径×100。将菌丝生长抑制率换算成概率值(y),茴香霉素的浓度换算成固定对数(x),建立线性毒力回归方程y=a+bx,计算EC50。
1.3 数据统计与分析
使用 SPSS 26.0 软件对试验数据进行单因素方差分析(One-Way ANOVA)。
2 结果与分析
2.1 SN53 抑菌活性及菌种鉴定
以烟草镰刀根腐病菌(图1A)和黑胫病菌(图1B)为靶标菌,通过平板对峙试验结果表明,生防菌SN53 对两种病原菌均有较好的抑制效果。通过对SN53 在培养基上的形态观察发现,菌落呈灰白色圆形,边缘较中间稀疏,界限不分明,表面干燥(图2A)。显微镜下观察SN53 的菌丝分支较多,呈直线形(图2B)。孢子呈椭圆形,成熟后孢子链成串珠状(图2C)。扫描电子显微镜下观察菌丝多呈锐角分支(图2D)。
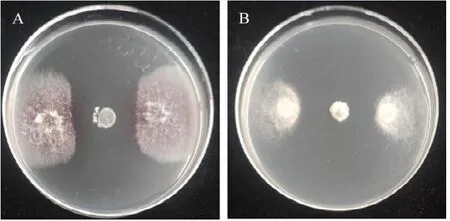
图1 SN53 对病原菌的抑制效果Fig.1 Inhibitory effect of SN53 on pathogenic fungi
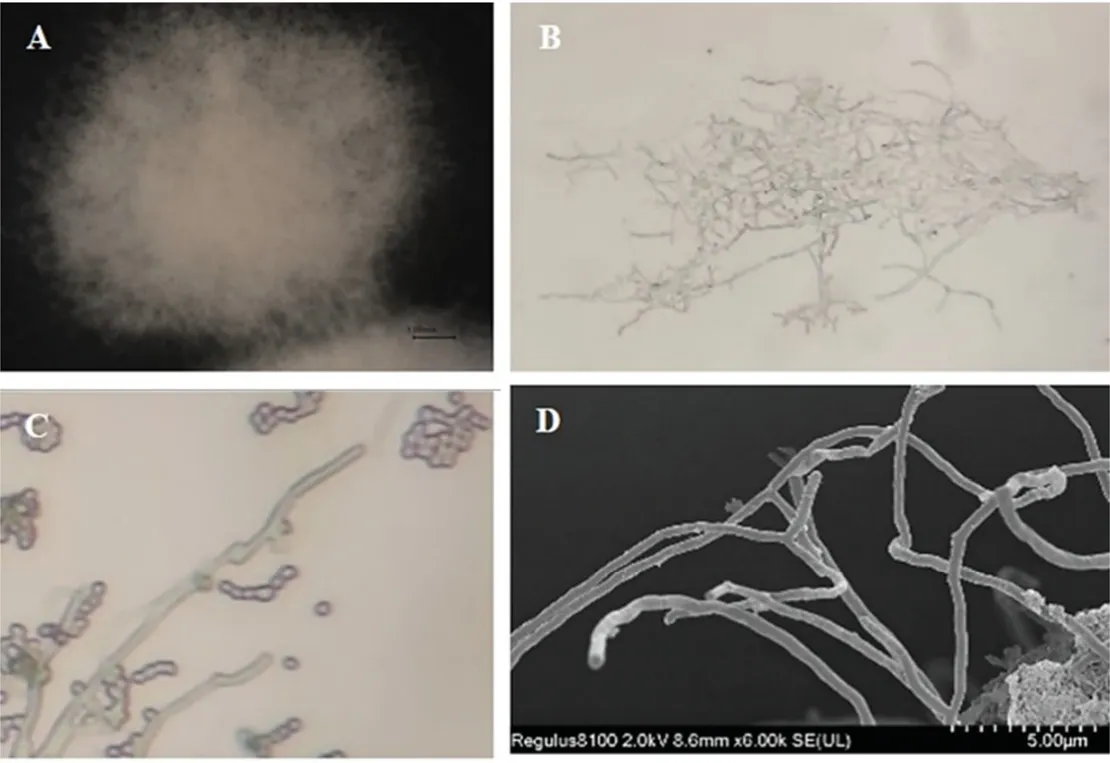
图2 菌株SN53 的形态学观察Fig.2 Morphological observation of strain SN53
将菌株SN53 接种在8 种培养基上,7 d 后进行培养特征的观察结果表明,SN53 在高氏一号培养基、PDA 培养基、ISP2、ISP7 培养基上生长状况良好,在ISP4、ISP5、ISP6 培养基上生长状况一般,而在ISP3培养基上生长状况最差;气生菌丝在不同培养基上颜色存在差异,呈黄白色、白色、橄榄色、黄色;基内菌丝多为黄色,在高氏一号培养基上呈橄榄色(表1)。
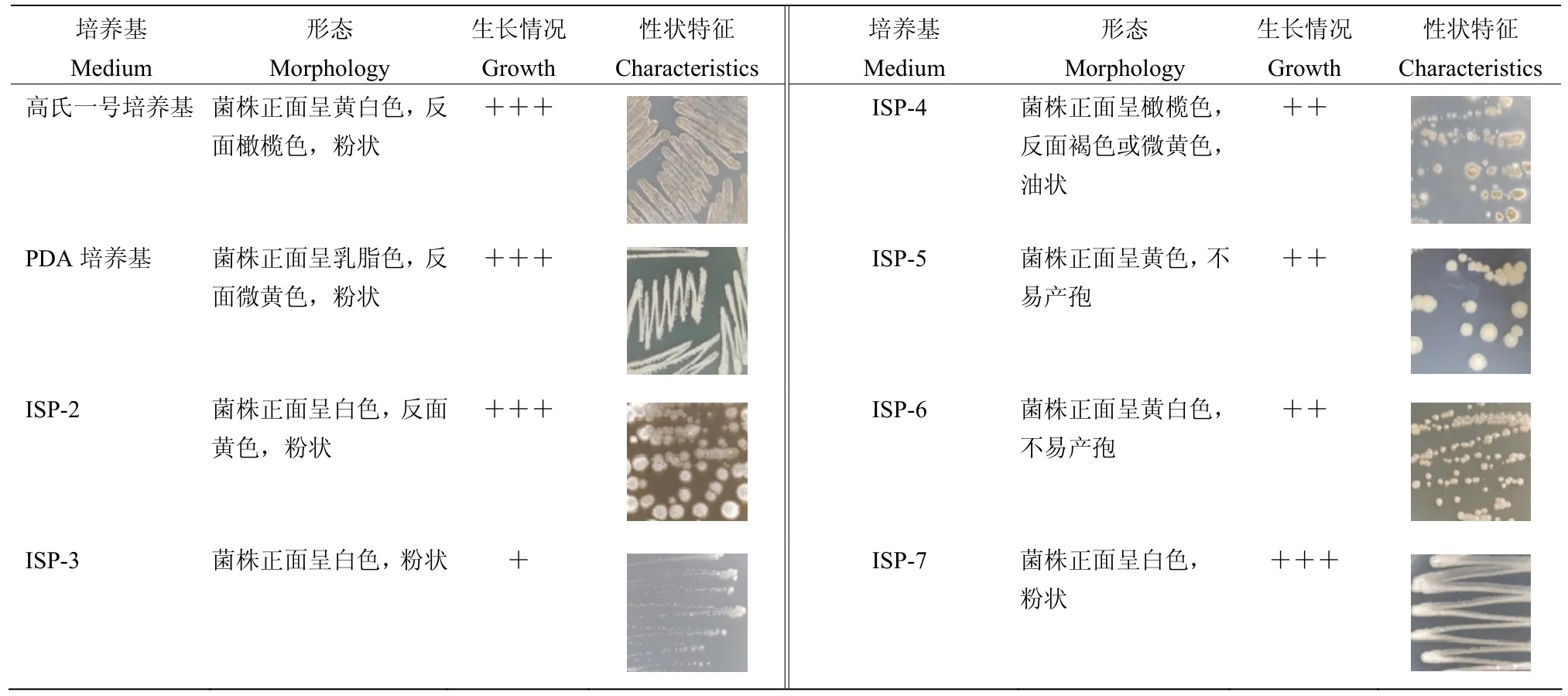
表1 菌株SN53 在不同培养基上的培养特征Table 1 Cultural characteristics of strain SN53 on different medium
菌株SN53 的生理生化检测结果表明该菌株V-P 试验阳性,可利用柠檬酸盐为碳源,不能利用丙酸盐,可以使明胶液化、淀粉水解、在pH 5.7 中生长,不能在7% NaCl 中生长,具备还原硝酸盐的能力,可以利用D-甘露醇作为碳源,不能利用L-阿拉伯糖、D-木糖作为碳源(表2)。对SN53 进行16S rDNA 序列扩增测序比对结果显示,SN53 序列与链霉菌属序列相似性达到99%;系统进化树分析结果显示,SN53 与淀粉酶产色链霉菌Streptomycesdiastatochromogenes(登录号为EU814698.1)位于同一分支上(图3)。综上,结合形态学、生理生化及分子生物学分析结果,鉴定菌株SN53 为淀粉酶产色链霉菌。
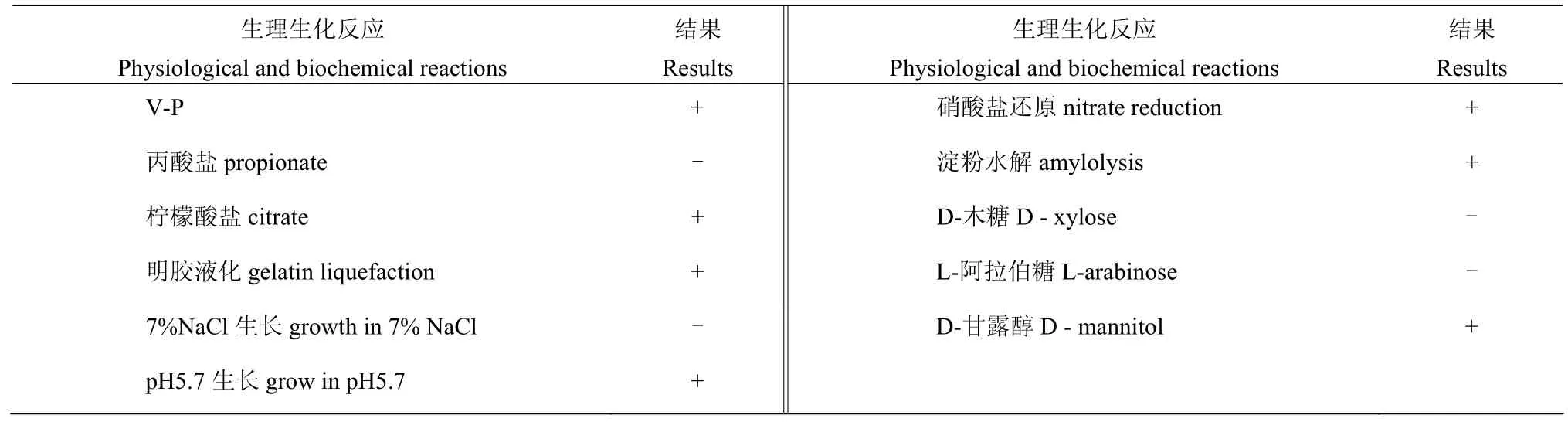
表2 菌株SN53 的生理生化特征Table 2 Physiological and biochemical characteristics of SN53
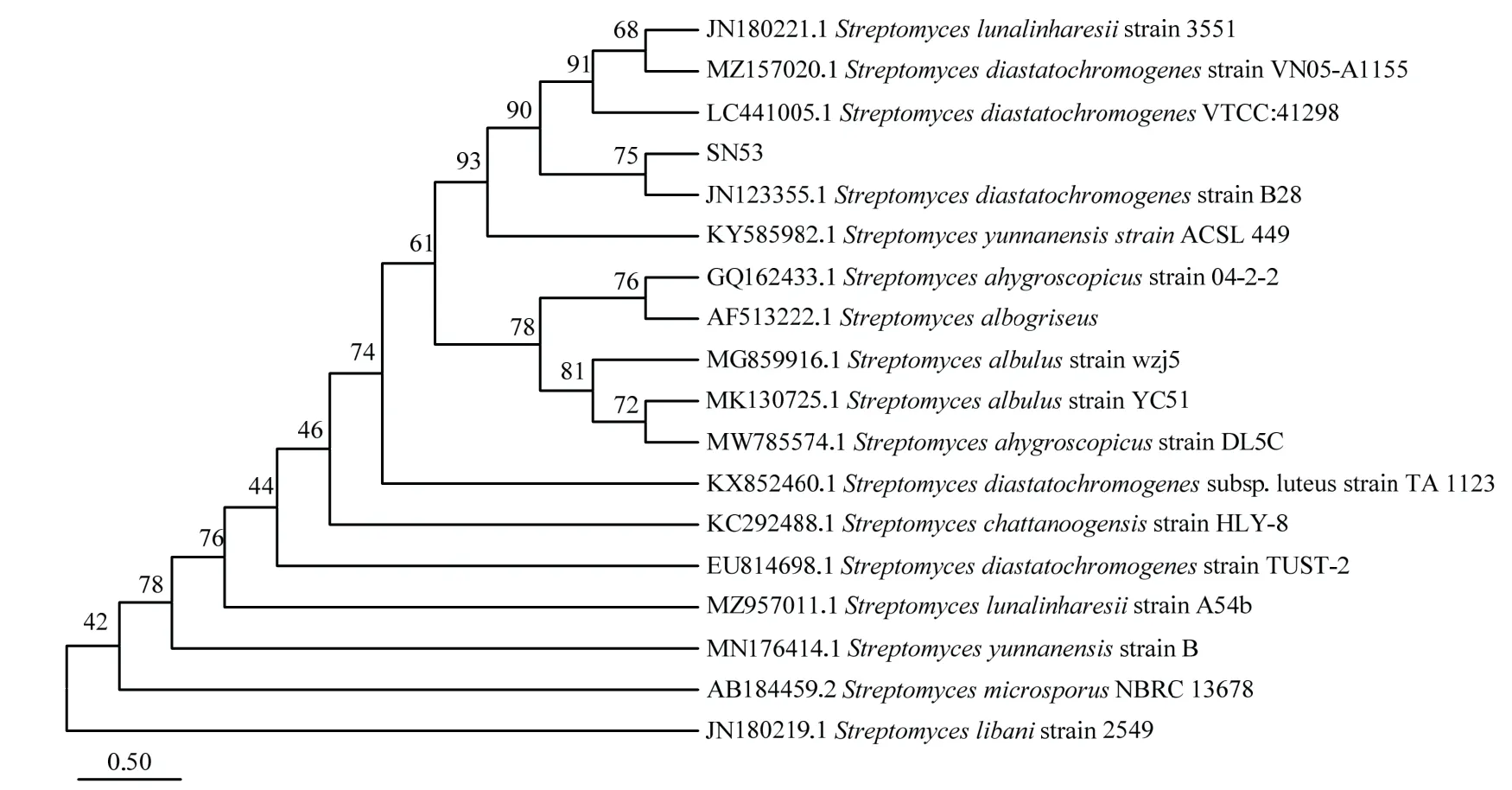
图3 菌株SN53 的16S rDNA 序列系统发育进化分析Fig.3 Phylogenetic analysis of 16S rDNA sequence of strain SN53
2.2 SN53 代谢产物粗提物的LC/MS 非靶向代谢组检测
通过非靶向代谢组学鉴定发现,SN53 粗提物中共含有2429 种代谢产物,正离子模式(POS)下检测到1567 种,负离子模式(NEG)下检测到862 个代谢物(图4)。其中鉴定出多种具有生物活性的物质,包括氨基糖苷类抗生素,如茴香霉素;2,5-哌嗪二酮类物质,如环苯丙氨酸-脯氨酸;多酚类物质,如霉酚酸等,代谢产物中茴香霉素含量最高(表3)。
2.3 SN53 代谢产物粗提物的LC/MS 非靶向代谢组验证及产物含量测定
利用市购的茴香霉素标准品和SN53 粗提物在相同条件下进行HPLC 检测,从标准品液相图谱可知,茴香霉素的出峰时间在27 min 左右,SN53 粗提物的液相图谱显示在27.762 min 有单峰出现,出峰时间基本一致,证明SN53 粗提物中含有物质茴香霉素(图5,6)。
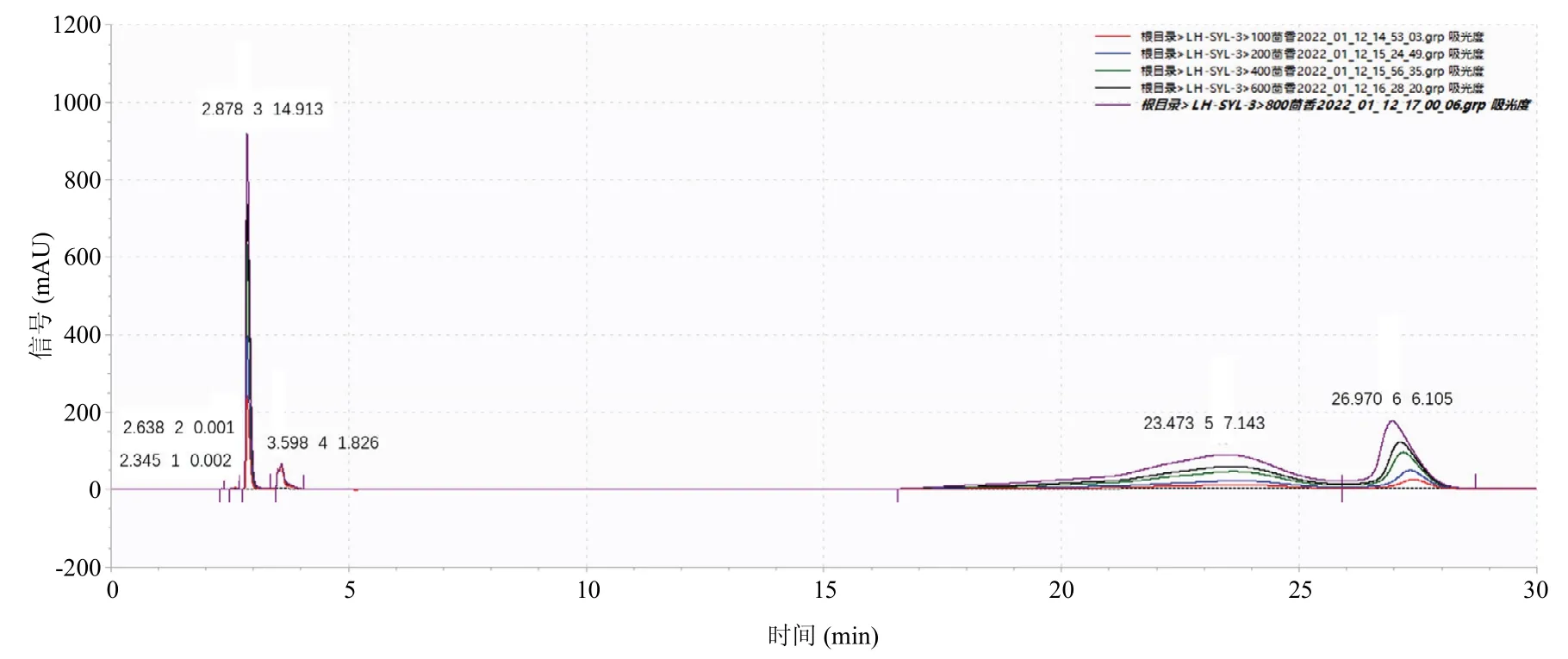
图5 茴香霉素标准品的高效液相色谱图Fig.5 High performance liquid chromatogram of anisomycin standard
对茴香霉素系列浓度标准品得到的液相色谱峰面积进行线性回归计算,得到茴香霉素的线性方程为y=11.1x+78.42,回归系数R2为0.9885,且标准品质量浓度(横轴)与峰面积(纵轴)之间的线性关系均比较好,趋势线的回归系数R2均趋近于1,趋势线可靠(图7)。将粗提物中的峰面积代入所得的线性方程中,得到粗提物中茴香霉素浓度为42.398 μg/mL,结合茴香霉素进样体积为20 μL,计算得出1 g 粗提物中茴香霉素含量为423.98 μg。
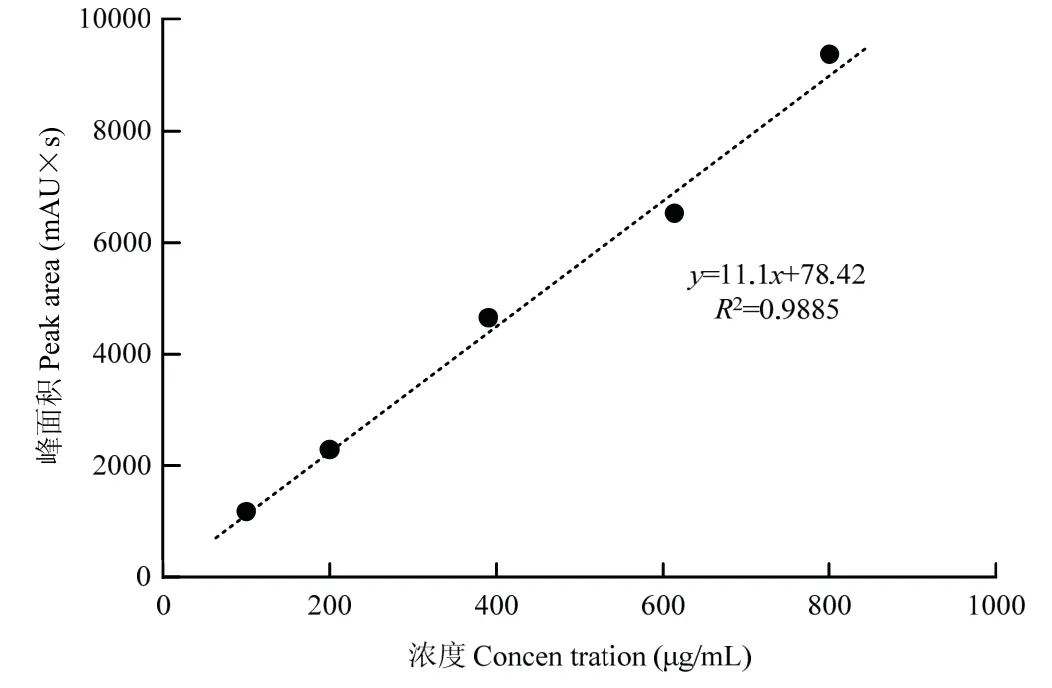
图7 茴香霉素的标准曲线Fig.7 Standard curve of anisomycin
2.4 茴香霉素对烟草镰刀根腐病菌及黑胫病菌菌丝生长的影响
为了确定茴香霉素对烟草镰刀根腐病菌和黑胫病菌菌丝生长的抑制作用,测定了不同浓度茴香霉素处理下烟草镰刀根腐病菌(图8)和黑胫病菌(图9)的菌丝生长直径,并计算出药剂对病原菌的EC50值。结果显示,茴香霉素对烟草镰刀根腐病菌的毒力回归方程为y=1.1035x+1.4775,相关系数R²=0.9843,EC50值为1556.36 μg/mL(图10);茴香霉素对烟草黑胫病菌毒力回归方程为y=1.7831x+2.1205,相关系数R²=0.9328,EC50值为40.74 μg/mL(图10),茴香霉素对烟草黑胫病菌的菌丝生长抑制效果优于根腐病菌。

图8 不同浓度茴香霉素对烟草镰刀根腐病菌菌丝生长的抑制效果Fig.8 Inhibition effect of anisomycin at different concentrations on mycelial growth of F.oxysporum
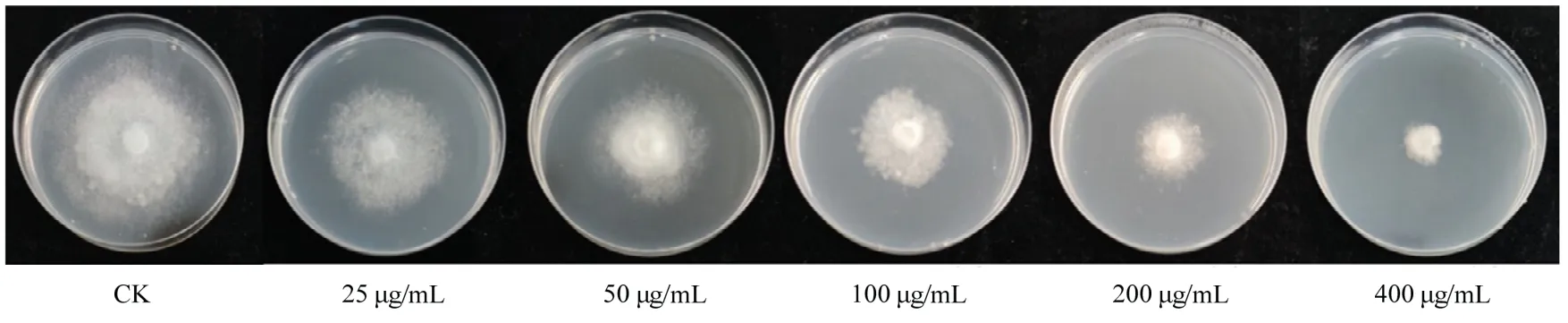
图9 不同浓度茴香霉素对烟草黑胫病菌菌丝抑制效果Fig.9 Inhibition effect of anisomycin at different concentrations on mycelia of P.parasitica
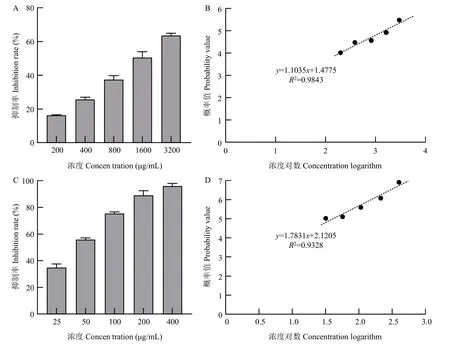
图10 茴香霉素对烟草镰刀根腐病菌及黑胫病菌菌丝生长抑制率及毒力回归方程Fig.10 Inhibition rate of different concentrations of anisomycin on the mycelial growth and toxicity regression equation of F.oxysporum and P.parasitica
3 讨论
放线菌Actinomyces 是应用最广泛的一类生防菌,也是许多农用抗生素的重要来源之一。其中,链霉菌作为放线菌中的重要成员,在生物防治方面具有巨大潜能,如始旋链霉菌产生的普那霉素对革兰氏阳性菌具有很强的杀菌作用;密旋链霉菌产生的寡霉素具有很强的抑制真菌生长的作用;灰色链霉菌产生的阿波霉素对大多数革兰氏阴性杆菌和革兰氏阳性球菌都有显著的抗菌活性[10-12]。本研究通过抑菌试验筛选得到了一株对烟草镰刀根腐病和黑胫病的防效较好的菌株SN53,经系列鉴定确定为淀粉酶产色链霉菌Streptomycesdiastatochromogenes。目前,关于淀粉酶产色链霉菌防治植物病害的研究较少,徐亦雯等[13]利用淀粉酶产色链霉菌1628 的代谢产物防治了浙麦冬黑斑病;同时生防菌1628 还可有效防治杭白菊枯萎病[14];本实验室前期针对淀粉酶产色链霉菌抗烟草靶斑病的作用机制也展开了研究[15]。因此本研究为淀粉酶产色链霉菌在防治植物靶标病害的应用上提供了新的见解。
探索链霉菌代谢产物中活性成分的种类,对生防菌的生产应用及后续作用机制的研究有着至关重要的作用。链霉菌产生的抗生素类物质如春雷霉素、农抗120、嘧肽霉素、井冈霉素、多抗霉素、申嗪霉素等,已作为高效低毒生物农药而投入到商品化生产中;其他黄酮类、酚类、四环素类、氨基糖苷类等生物活性物质也已在医学、制药、农学等多个领域被广泛应用[16]。非靶向代谢组学具有可鉴定代谢物种类多、极性跨度大和样品浓度动态范围广等特点,可以无偏向地检测样本中所有能检测到的代谢物分子,对产物进行定性定量分析。目前,该技术在微生物代谢产物的研究、食品造假鉴定、有机农产品未知污染物检测和有机乳制品含量确认等方面都有所应用[17,18]。本研究利用非靶向代谢组学从SN53 发酵液中共检测到2429 种代谢产物,其中茴香霉素、环苯丙氨酸-脯氨酸、儿茶素没食子酸和大观霉素等含量较高,参考已有分离纯化操作,本文得到了SN53 发酵液中含量最高的活性代谢产物—茴香霉素,该化合物也为淀粉酶产色链霉菌代谢产物组分的新报道。
茴香霉素于1954 年首次被发现,是一种含氮杂环类芳香族衍生物抗生素,作为一种蛋白合成抑制剂,在多个领域均有应用[19]。例如,在医学方面,茴香霉素与健忘症产生、机体系统免疫和抗肿瘤活性方面有所联系,还具有杀灭阿米巴原虫的作用;在农业方面,茴香霉素作为生物农药农抗120 的主要活性成分之一,可防治多种植物真菌性病害,比如枯萎病、炭疽病、立枯病、白绢病、白粉病等[20-22]。但关于茴香霉素能够抑制烟草镰刀根腐病菌和黑胫病菌的研究则鲜有报道。本文通过非靶向代谢组学明确了链霉菌SN53 活性代谢物—茴香霉素具有抑制烟草镰刀根腐病菌和黑胫病菌活性,并进一步通过菌丝生长抑制试验明确了茴香霉素对两种病原菌的EC50。本研究为烟草镰刀菌根腐病和黑胫病的生物防治提供了新的有价值的来源,并为生防菌代谢产物—茴香霉素在农业防治土传病害上的应用和机制研究提供了重要参考依据。
