激活嘌呤回补途径提高淀粉酶产色链霉菌丰加霉素产量
2023-10-21张子轩申屠旭萍俞晓平
张子轩,宋 阳,申屠旭萍,俞晓平
(中国计量大学生命科学学院/浙江省生物计量及检验检疫技术重点实验室,杭州 310018)
丰加霉素(Toyocamycin,TM)是链霉菌的次生代谢产物,作为核苷类抗生素家族中重要成员之一,具有高效性、低毒性和低残留的特性,在农业植物真菌病害的生物防治中具有广阔的应用前景。1970年,Suhadolnik 利用同位素14C 和3H 喂养试验发现了一种新型的核糖类抗生素,其核糖C1 连接类似鸟嘌呤的脱氮杂嘌呤环,分子式为C12H13N5O4,命名为丰加霉素[1]。由于其对动物病原菌如白假丝酵母Candidaalbicans,金黄色葡萄球菌Staphylococcusaureus的生长有强烈的抑制作用,其生物活性研究报道主要集中在抗病原菌方面[2]。近期有研究发现,TM 对多种植物疫病具有良好的防治效果。丰加霉素由淀粉酶产色链霉菌发酵产生,对水稻纹枯病菌、葡萄炭疽病菌和番茄灰霉病菌等7 种植物病原真菌具有良好的抑制作用[3],也能够抑制稻瘟致病菌孢子的萌发和菌丝的生长[4]。因此,丰加霉素在农业植物病害生物防治领域具有巨大的应用潜力,丰加霉素作为生防菌株淀粉酶产色链霉菌的次级代谢产物,对环境更加友好[3]。
链霉菌属Streptomyces是一种广泛分布于土壤、海洋、极端条件等环境中的高等放线菌。链霉菌所能产生的天然次级代谢产物是世界上70%抗生素的来源。淀粉酶产色链霉菌S.diastatochromogenes1628 最初是2006 年从土壤样本中分离出来,经进一步提取分离研究表明,菌株1628 能产生多种次生代谢产物,包括丰加霉素和四烯大环内酯类化合物(四霉素A、四霉素P 和四环素B)[5]。由于丰加霉素在生防领域的效果显著,未来有可能应用于植物病害防治,本研究将有助于推动丰加霉素的产业化生产。链霉菌的次级代谢产物受到菌体内多层次调控因子的调节作用,常规的结构基因过量表达通常无法大量提高目标代谢产物产量,因此需要对链霉菌次级代谢产物的合成途径进行分析。前期研究发现合成TM 的前体物质为GTP,而GTP 通常由嘌呤合成途径和嘌呤回补途径维持GTP 的稳态[6,7]。嘌呤合成途径为利用5-磷酸核糖(Ribose-5-P)通过核糖磷酸焦磷酸激酶(Ribose-phosphate pyrophosphokinase,Rpp)催化合成5-磷酸核糖-1-焦磷酸(PRPP),PRPP 在嘌呤操纵子作用下经过次黄嘌呤(HPX)合成肌苷酸(IMP)(从HPX 到IMP 由HprT 催化),IMP 在GuaB、GuaA 催化下合成GMP,GMP 在Gmk 催化下合成GDP,GDP 在Ndk酶催化下磷酸化形成GTP[8](图1)。前期研究表明,过量表达GTP 合成途径中的rpp基因能够提高胞内GTP 含量122%,丰加霉素产量提高133.3%,产量达到340.2 mg/L[9]。但由于在生长稳定期存在严谨反应抑制GTP 合成途径以及激活嘌呤回补途径的作用。因此,本研究从维持嘌呤稳态的嘌呤回补途径入手,提高TM 产量。
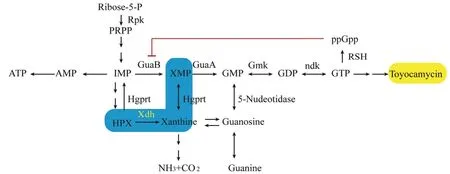
图1 GTP 合成途径与回补途径Fig.1 The synthesis and salvage pathway of GTP
嘌呤回补途径(purine salvage pathway)指的是菌体利用外源或者内源细胞更新产生的嘌呤(碱基或核苷)转化为核苷酸,核苷被转化为碱基[10]。例如,外源鸟苷被降解为鸟嘌呤,鸟嘌呤通过(也可以不通过)黄嘌呤途径合成GMP。外源或内源代谢产生的腺苷通过腺嘌呤或者肌苷合成次黄嘌呤,次黄嘌呤HPX合成肌苷酸IMP,两条途径均可以实现嘌呤回补[8](图1)。而对于黄嘌呤与次黄嘌呤之间的转变过程,受到黄嘌呤脱氢酶(xanthine dehydrogenase,xdh)基因簇的催化。因此,xdh基因簇是实现嘌呤回补途径的重要环节,也是合成GTP,维持细胞内GTP 稳态的重要步骤。xdh基因簇由3 个基因(xdhA、xdhB、xdhC)组成,共同受到XdhR 蛋白的阻遏调节,在严谨反应发生时,较高浓度的ppGpp 与XdhR 基因结合,激活嘌呤回补途径[8]。另一方面,有研究表明,XdhR 也是次级代谢基因簇表达的抑制性调控因子,能够结合到次级代谢基因簇的启动子区,调节次级代谢产物合成[11]。但是xdhR基因在淀粉酶产色链霉菌中的基因功能尚未明确,需要通过敲除xdhR基因来研究xdhR 对丰加霉素合成的影响。
本研究旨在阐明xdhR基因的序列特征、在淀粉酶产色链霉菌1628 中对于形态分化的影响,以及xdhR基因与TM 生物合成中的相关性。同时,也考察敲除xdhR基因后对嘌呤合成途径基因转录、胞内GTP 含量的影响,进一步揭示xdhR基因对丰加霉素合成的重要意义。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 研究所用的淀粉酶产色链霉菌S.diastatochromogenes1628 菌株是由浙江省生物计量及检验检疫技术重点实验室提供。大肠杆菌E.coliJM109,质粒pKC1139 是大肠杆菌-链霉菌穿梭质粒,用于构建敲除突变株(均由本实验室保存)。
1.1.2 培养基 LB 培养基:10 g 蛋白胨,10 g NaCl,5 g 酵母提取物,1 L 超纯水,pH 调至7.4;葡萄糖酵母矿物质(Glucose yeast extract mineral,GYM)培养基:10 g 麦芽提取物,4 g 葡萄糖,4 g 酵母提取物,2 g NaCl,1 g 酶解酪蛋白,600 μL OB 溶液(5 g CuSO4·5H2O,7.5 g FeSO4·7H2O,5 g MgSO4·7H2O,3.6 g MnSO4·7H2O,9 g ZnSO4·7H2O,35 g CuCl2·2H2O,1 L 超纯水),1 L 超纯水,pH 调至7.4;马铃薯葡萄糖琼脂(Potato dextrose agar,PDA)培养基:200 g 马铃薯,20 g 葡萄糖,20 g 琼脂,1 L 超纯水,pH 调至7.0;MS 培养基:20 g 黄豆粉,20 g 甘露醇,18 g 琼脂粉,1 L 蒸馏水,pH 调至7.4。
1.1.3 引物 本试验所用引物如表1 所示
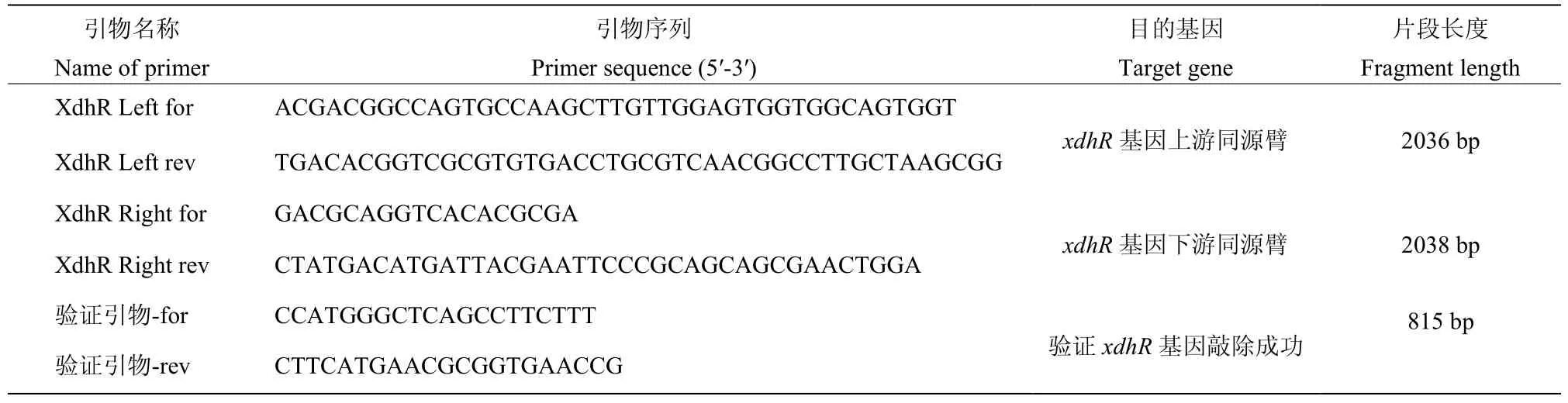
表1 本试验所用引物Table 1 Primers used in this study
1.2 方法
1.2.1 淀粉酶产色链霉菌1628 RNA 的提取 挑取菌株1628 培养平板上单菌落(5 mm 直径)接种至液体GYM 培养基,于28 ℃、180 r/min 条件下培养2 d,摇匀菌液,以2%接种量接至新液体GYM 培养基于28 ℃、180 r/min 条件下培养至4 d,每隔24 h 取50 mL 菌液,4 ℃、7000 r/min 离心5 min,并用磷酸盐缓冲液(phosphate buffer,PBS,20 mmol/L,pH 7.4)清洗菌体2 次,最后弃去PBS 上清,将菌体转移至无菌滤纸吸净水分,挑入研钵中使用液氮研磨至粉末状,RNA 的提取按照TaKaRa 的RNA 提取试剂盒(No.9767)说明书进行操作。
1.2.2xdhR基因的敲除质粒的构建 通过同源重组的方法对xdhR基因进行敲除。以菌株淀粉酶产色链霉菌1628 基因组DNA 为模板,通过XdhR Left for/ XdhR Left rev 和XdhR Right for/XdhR Right rev 分别扩增xdhR基因上、下游同源臂并连接在pKC1139 质粒上,构建xdhR基因的敲除质粒。将质粒转化进大肠杆菌JM109感受态,使用验证引物-for/rev 进行菌落PCR 验证,将显示阳性结果对应菌落进行扩培,提取质粒酶切验证,测序验证成功后为载体pKC1139-ΔXdhR。
1.2.3 敲除xdhR基因的菌株构建 用热激的方法将 pKC1139-ΔXdhR转入E.coliET12567(pUZ8002)获得结合转移供体菌株E.coliET12567(pUZ8002/ΔXdhR),并通过对转化子进行质粒提取、酶切验证确认供体菌正确。随后在MS 平板上培养野生型菌株1628,收集孢子后,与大肠杆菌ET12567(pUZ8002/ΔXdhR)混合,通过接合转移的方法将敲除质粒整合到菌株1628 基因组中,在含有安普霉素的MS 平板上覆盖萘啶酮酸筛选转化子。挑取转化子转接至含有安普霉素的平板上,28 ℃培养7 d,制备孢子悬液。经适当稀释后,以每个平皿 104个孢子的浓度涂布在不含抗生素的GYM 培养基上42℃高温培养。随后挑取单菌落在无抗性GYM 培养基上28 ℃松弛培养,将生长出来的菌落同时影印到GYM(Ap)和无抗GYM 培养基上,筛选发生双交换(ApS)的xdhR基因阻断突变株。随机选择10 株xdhR基因阻断突变株接种于无任何选择压力的基本培养基上,28 ℃下培养,验证其稳定性。并采用XdhR Left for/ XdhR Right rev 引物验证xdhR基因敲除成功。
1.2.4 菌株发酵及丰加霉素产量测定方法 分别挑取淀粉酶产色链霉菌1628 和重组菌1628_ΔXdhR培养平板的单菌落接种至液体GYM 培养基于28 ℃、180 r/min 条件下培养2 d,以2%的接种量转接至液体GYM培养基于28 ℃、180 r/min 条件下培养10 d。每隔24 h 取1 mL 发酵液11000 r/min 离心10 min,取上清,使用0.22 μm 的微孔滤膜过滤于1.5 mL 的液相瓶中备用,采用HPLC 方法分析丰加霉素含量[12]。
流动相A 为超纯水,流动相B 为色谱甲醇,用孔径0.45 μm 的偏氟膜过滤色谱甲醇,用孔径0.45 μm 的纤维膜过滤超纯水,过滤后将流动相瓶放置于超声波清洗仪中超声30 min,去除气泡。色谱柱为C18 色谱柱,柱温设置为30 ℃。洗脱方法见表2。
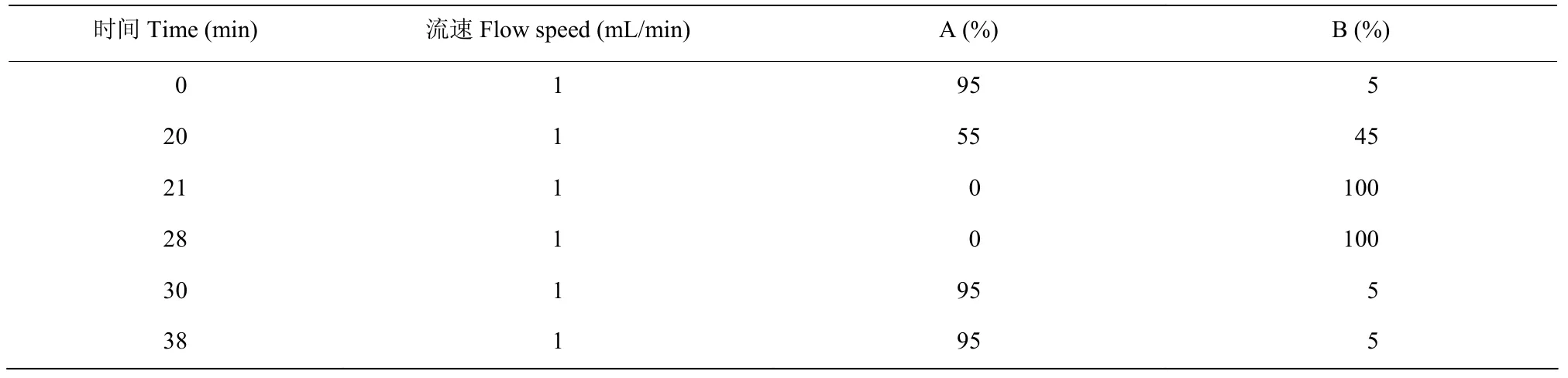
表2 HPLC 条件Table 2 HPLC conditions
1.2.5 SEM 电镜分析 挑取链霉菌培养平板上单菌落(5 mm 直径)接种至液体GYM 培养基,于28 ℃、180 r/min 条件下培养2 d,用枪头吸取菌丝体置于1.5 mL 离心管内吸取量保证离心后沉淀于管底约为黄豆大小,室温、2000 r/min 离心,弃掉上清。用PBS 洗菌体1~2 次,弃掉上清,沿管壁缓慢加入4℃预冷的电镜固定液,放置于4 ℃保存,固定12 h 以上寄送样品送公司进行SEM 电镜拍照。
1.2.6 RT-qPCR 方法 以S.diastatochromogenes1628 的gyrB基因作为内参基因,以丰加霉素生物合成关键基toyB、toyC、toyD、toyE、toyF、toyG、toyI、toyM和嘌呤合成途径关键基因guaA,gmK,ndk为目的基因分别设计荧光定量PCR 引物。分别收集淀粉酶产色链霉菌1628 和重组菌1628_ΔXdhR培养4 d 的菌体,提取总RNA 取1 μg 反转录,以反转录后的cDNA 为模板,进行荧光定量PCR 分析。荧光定量PCR程序设置如下:95 ℃,30 s;95 ℃,5 s,60 ℃,30 s,共40 个循环。每个基因做3 个重复,使用TaKaRa荧光定量PCR 试剂盒(No.RR071A)配制反应体系。
1.2.7 GTP 含量测定方法 挑取链霉菌培养平板上单菌落(5 mm 直径)接种至液体GYM 培养基,于28 ℃、180 r/min 条件下培养2 d,以2%接种量接至新液体GYM 培养基于28 ℃、180 r/min 条件下培养至所需生长期,取50 mL 菌液,4 ℃、7000 r/min 离心5 min,用磷酸缓冲盐溶液(phosphate buffered saline,PBS)清洗菌体2 次后液氮研磨至粉末状,将破碎后的菌体100 mg 浸泡在3 mL 2 mol/L 甲酸中,并在冰水中孵育30 min。将醋酸铵(50 mol/L,pH 4.5)加入到粉碎的组织中至体积为6 mL,并在4 ℃、5000 r/min 离心5 min 后收集上清液。
固相萃取(SPE)过程根据文献[13]进行,用1 mL 甲醇和1 mL 50 mmol/L 醋酸铵(pH 4.5)对SPE 柱进行预处理后,将上述样品溶液装载到SPE 柱上。用1 mL 50 mmol/L 醋酸铵(pH 4.5)清洗SPE 柱,用1 mL 甲醇洗涤SPE 柱,用1 mL MeOH:H2O:NH4OH(20:70:10)溶液从SPE 柱上洗脱核苷酸。4 ℃冷冻干燥后,溶解于200 μL 水中,使用0.22 μm 的微孔滤膜过滤后,采用文献中相同的方法[13]利用LC-MS 法测定GTP 含量。
1.2.8 抑菌活性测定 将链霉菌接种于GYM 培养基中28 ℃、180 r/min 培养4 d,离心收集上清发酵液将发酵液稀释6 个梯度(稀释后发酵上清液浓度分别为0%,20%,40%,60%,80%,100%),后取100 μL涂布于PDA 培养基上。将水稻纹枯和黄瓜枯萎病菌接种于PDA 培养基中于28 ℃培养箱中培养2 d,分别利用打孔器获得5 mm 菌片,将菌片放置于涂布有不同浓度发酵液的PDA 培养平皿中心,每组设置3 组平行重复,取平均值计算抑制率,对照组为无菌水处理。抑制率(%)=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100。
2 结果与分析
2.1 序列对比和进化树分析
在淀粉酶产色链霉菌中,xdhA、xdhB、xdhC基因在基因组中顺序排列,受到位于上游的XdhR 调控因子的调控作用。xdhA编码一个2Fe-2S 的结构域、xdhB编码一个FAD 结合结构域,xdhC编码一个钼结合结构域,这三个结构域共同组成一个含钼氧化还原酶[8]。在xdhR与xdhA的起始密码子中间,存在两个方向的启动子,也存在着XdhR 蛋白的结合序列。同时,通过序列比对发现,这段基因间序列存在2 个不完美的回文序列,与天蓝色链霉菌内的xdh基因簇的基因排布一致,并且存在重叠的-35 区,这些位点可能是XdhR 的结合位点。
通过进化树分析发现,淀粉酶产色链霉菌xdhR序列与来自蚁链霉菌Streptomycesformicae菌株的xdhR氨基酸比较相近,与唐德链霉菌Streptomycestendae菌株的xdhR氨基酸序列相似度较低。与模式菌株变铅青链霉菌Streptomyceslividans的序列相似度为61.9%,因此,淀粉酶产色链霉菌的xdhR基因具有与S.lividans中xdhR相似功能(图2)。
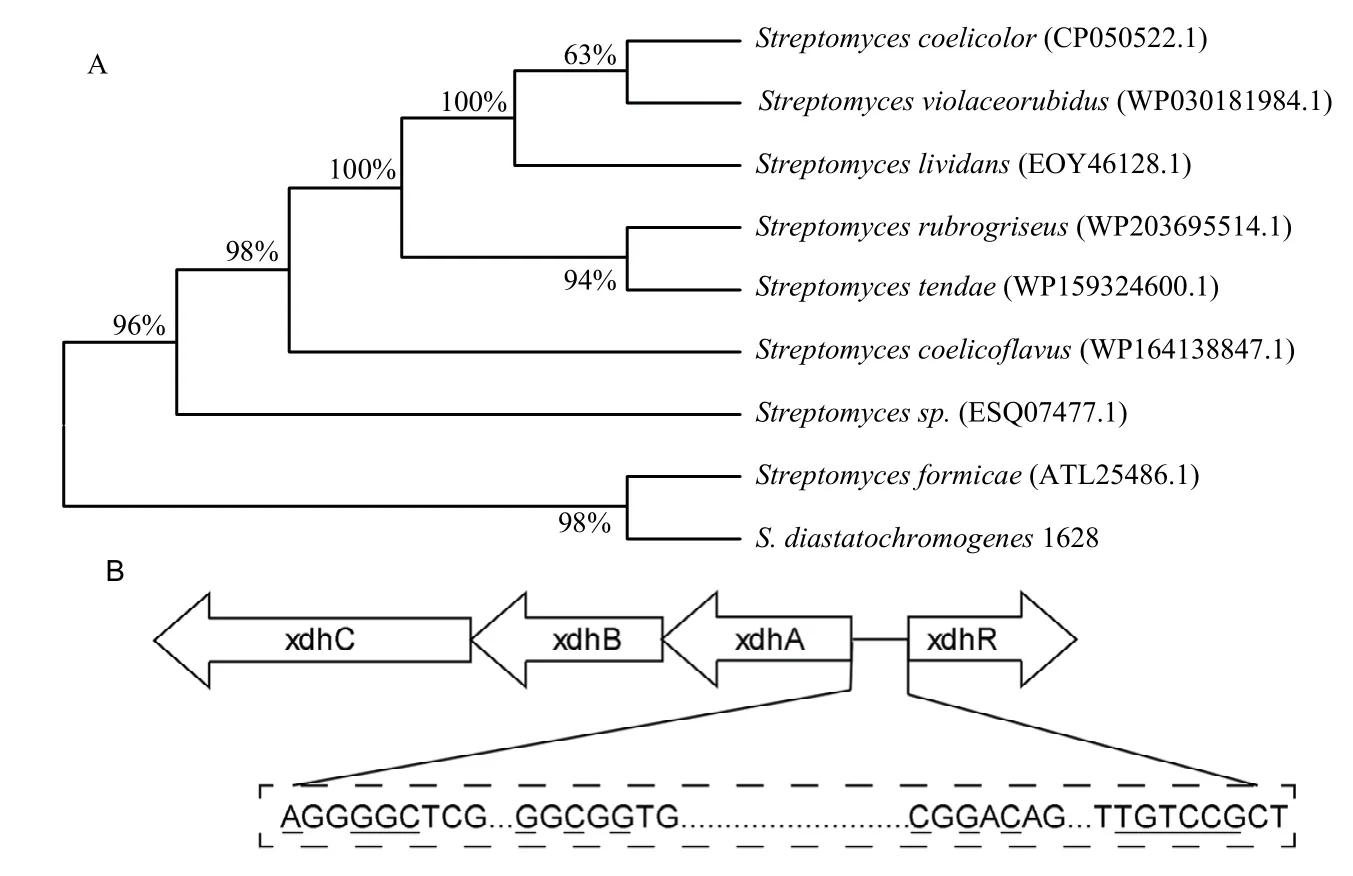
图2 xdhR 基因的进化树分析及序列分析Fig.2 Phylogenetic tree analysis and sequence analysis of xdhR gene
随后,对XdhR 的结构功能进行分析。XdhR 是TetR 家族的调控因子,该家族的调控因子具有保守的helix-turn-helix 结构域,用于结合DNA 分子。在TetR 家族的转录调控因子的C 端或者N 端,通常是各种各样的配体结合结构域,用于响应不同的配体分子。尽管TetR 家族的分子并没有特定的保守序列,但是通过Swiss-model 构建出的淀粉酶产色链霉菌XdhR 的三维立体结构表明(以2rek 为模板),结构上XdhR属于Ω 型,符合TetR 家族转录调控因子的结构特征[14]。说明该TetR 家族的调节分子可能通过与配体结合后的变构作用实现DNA 结合的功能。目前已知的XdhR 的配体为严谨反应信号分子ppGpp,因此,在ppGpp激活次级代谢基因转录时,会激活xdh基因簇的表达,进而激活嘌呤回补途径。
2.2 重组菌1628_ΔXdhR 的构建及验证
采用同源双交换方法进行无缝基因敲除,连接敲除基因上下游同源臂于pKC1139 载体上构建成敲除载体pKC1139-ΔXdhR,通过结合转移方法将载体转入淀粉酶产色链霉菌1628 中,随后通过高温诱导获得单交换突变株,松弛培养后筛选出同时在无抗GYM 培养基上生长而不在GYM(Ap)培养基上生长的同一菌落,随机选择10 株xdhR基因阻断突变株接种于无任何选择压力的基本培养基上,28 ℃下扩大培养测定其遗传稳定性。用引物XdhR Left for/ XdhR Right rev 进行验证,敲除成功后的结果长度为4074bp(图3),并通过基因测序确认敲除基因正确。重组菌1628_ΔXdhR构建成功。
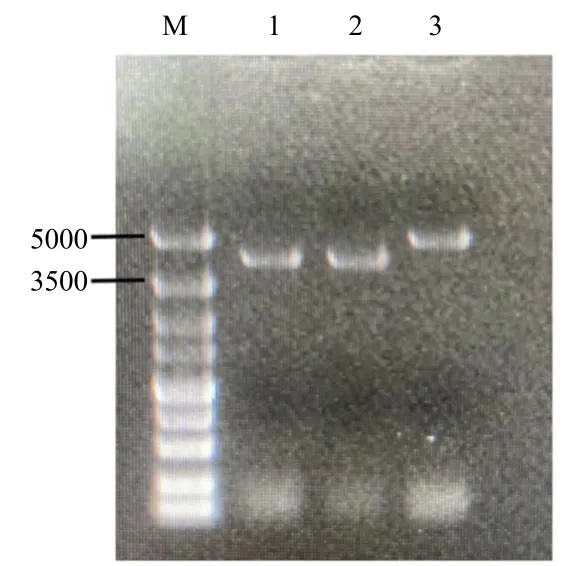
图3 1628_ΔXdhR 突变菌株的PCR 验证Fig.3 PCR result of recombinant 1628_ΔXdhR deletion mutant
2.3 激活嘌呤回补途径对丰加霉素产量的影响
调控因子XdhR 是嘌呤回补途径基因xdhA、xdhB、xdhC的转录抑制因子,所以敲除xdhR基因对于激活嘌呤回补途径具有重要作用。本研究中采用同源重组的方式构建xdhR基因的敲除菌株,测定重组菌1628_ΔxdhR菌株与淀粉酶产色链霉菌1628 菌株的丰加霉素产量。结果发现,发酵至 96 h 时,重组菌1628_ΔxdhR中丰加霉素产量达到最高 287.8 mg/L,较淀粉酶产色链霉菌1628 升高114.0%。该结果表明敲除基因xdhR对丰加霉素合成起促进作用(图4)。
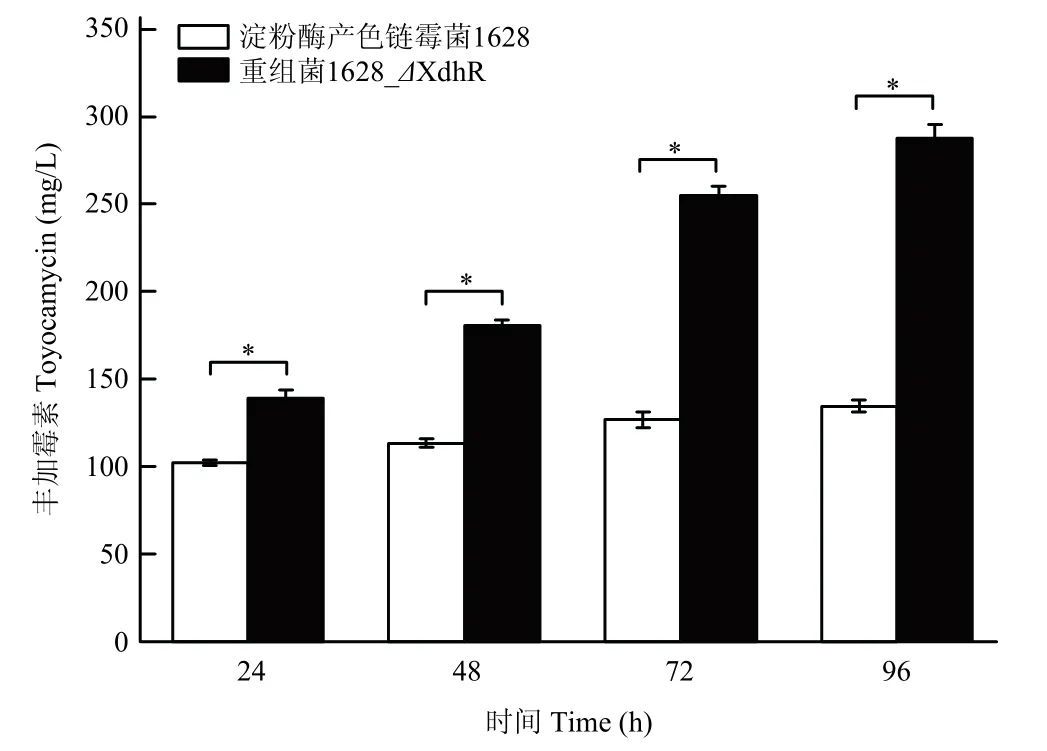
图4 淀粉酶产色链霉菌1628 及重组菌1628_ΔXdhR 的丰加霉素产素水平比较Fig.4 Comparison of toyocamycin production between amylase-producing S.diastatochromogenes 1628 and 1628_ΔXdhR
2.4 重组菌1628_ΔXdhR 和淀粉酶产色链霉菌1628 的菌落形态
通常,链霉菌的菌丝分化和形态学变化与次级代谢产物积累密切相关。淀粉酶产色链霉菌1628 的菌落呈白色正圆形(图5a),中央隆起,表面弧度较为圆润,菌丝表面较为平整光滑。重组菌1628_ΔxdhR(图5c)菌落较1628 原始菌菌更加粗糙。在SEM 电镜照片中,淀粉酶产色链霉菌1628(图5b)菌丝较为光滑稀疏,重组菌1628_ΔxdhR(图5d)菌丝较淀粉酶产色链霉菌1628 菌丝更加密一些,也附有更多一些絮状物质。说明嘌呤代谢途径变化,导致链霉菌菌丝形态发生变化。
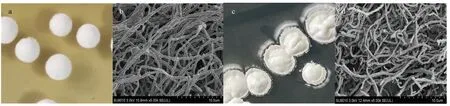
图5 淀粉酶产色链霉菌1628 及重组菌1628_ΔXdhR 菌落形态和电镜照片Fig.5 Colony morphology and electron microscopic photos of S.diastatochromogenes 1628 and recombinant 1628_ΔXdhR
2.5 敲除xdhR 基因对丰加霉素合成途径基因转录水平的影响
丰加霉素由丰加霉素合成基因簇合成,该基因簇主要受到全局调控因子adpA和途径特异性调控因子toyA的调控作用,toyB、toyC、toyD、toyE、toyF、toyG、toyI、toyM是合成丰加霉素的途径基因。因此,通过分析重组菌1628_ΔXdhR菌株与淀粉酶产色链霉菌1628 的toy基因表达水平差异,可以解释丰加霉素产量变化的原因。通过对重组菌1628_ΔXdhR菌株和淀粉酶产色链霉菌1628 在第四天进行转录水平分析发现,adpA的转录水平提高4.27 倍,说明XdhR 作为转录调控因子影响adpA基因的转录。而toy基因簇的途径特异性调控因子toyA的转录水平提升1.47 倍,能够激活toy基因簇结构基因的表达。在结构基因中,toyB、toyD、toyE的基因转录水平激活幅度较大,达到2.54 倍以上。而其他结构基因的转录水平激活在1.15~1.74 之间(图6)。

图6 淀粉酶产色链霉菌1628 及重组菌1628_ΔXdhR 的丰加霉素合成途径基因转录水平Fig.6 Gene transcription level of toyocamycin biosynthesis pathway in S.diastatochromogenes 1628 and recombinant 1628 _ΔXdhR
2.6 敲除xdhR 基因对嘌呤合成途径及嘌呤回补途径基因表达的影响
重组菌1628_ΔxdhR菌株中嘌呤合成途径基因guaA、gmK、ndk的转录水平变化,以及嘌呤回补途径基因xdhA、xdhB、xdhC基因的转录水平变化,表明1628_ΔxdhR对嘌呤代谢的总体影响。通过测定guaA,gmK和ndk基因的转录水平发现,敲除xdhR微弱的抑制嘌呤合成途径基因,guaA、gmK和ndk的转录水平分别降低12.9%、14.8%和24.4%(图7A)。通过测定嘌呤回补途径基因xdhA、xdhB和xdhC基因的表达水平发现敲除xdhR激活嘌呤回补途径幅度较大,xdhA、xdhB和xdhC的转录水平提升154.4%、56.9%和102.7%(图7A)。随后测定胞内GTP 含量来表征胞内GTP 水平的变化发现,24~96 h 敲除菌的胞内GTP 含量与野生菌株相比略有提升,但4 d 内的GTP 含量不存在显著差异,说明敲除xdhR基因仍然能够保持链霉菌内的GTP 稳态(图7B)。
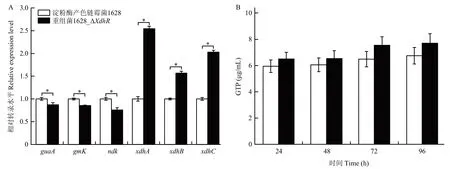
图7 淀粉酶产色链霉菌1628 及重组菌1628_ΔXdhR 对嘌呤合成和回补途径的影响Fig.7 The effect of xdhR gene on the purine biosynthesis and salvage pathway in S.diastatochromogenes 1628 and recombinant 1628_ΔXdhR
2.7 重组菌1628_ΔXdhR 对植物病原菌的抑制效果的影响
对照组(淀粉酶产色链霉菌1628)与处理组(重组菌1628_ΔXdhR)100%的发酵液对黄瓜枯萎病致病菌菌丝的抑制率分别是48.9%和69.3%(图8A)。而对于水稻纹枯病致病菌,重组菌1628_ΔXdhR发酵上清液的抑菌效果则更好,淀粉酶产色链霉菌1628 和重组菌1628_ΔXdhR100%的发酵液对水稻纹枯病致病菌菌丝的抑制率分别是69.3%和100%(图8B)。试验结果表明,淀粉酶产色链霉菌重组菌1628_ΔXdhR发酵上清液对植物病原菌的生长相较于淀粉酶产色链霉菌1628 有明显提高。
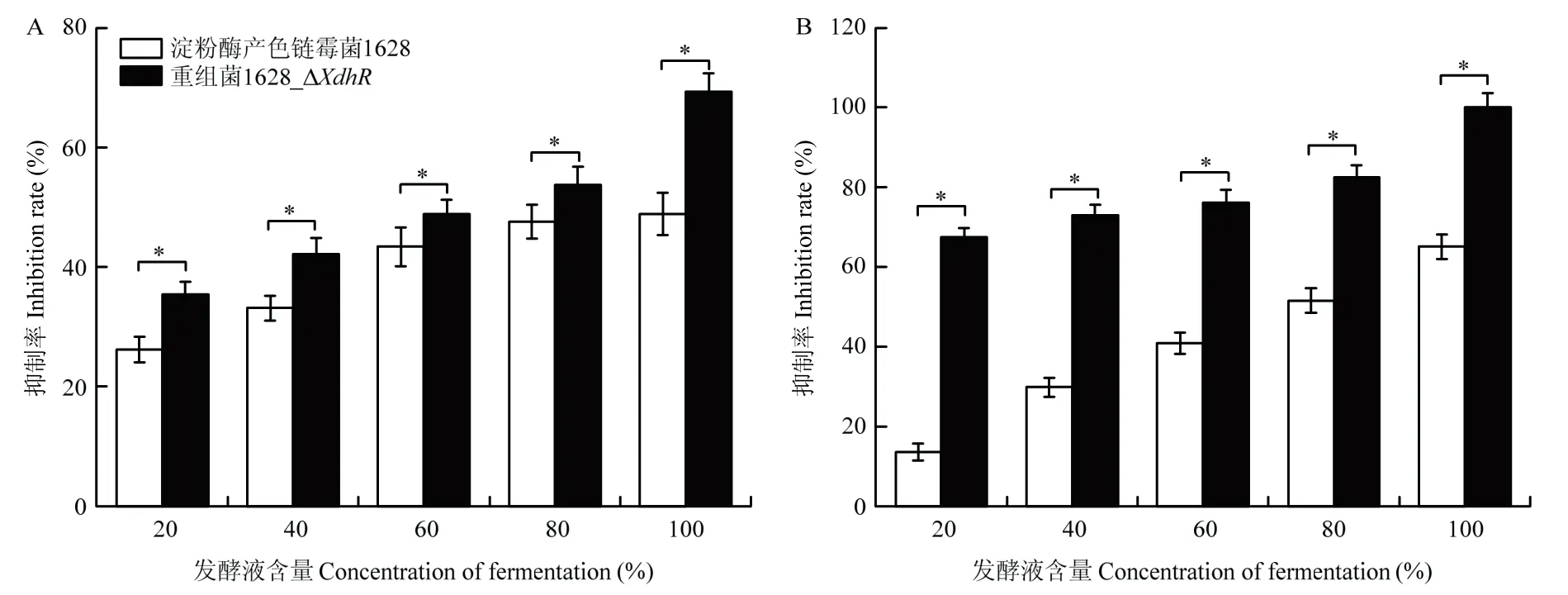
图8 不同含量淀粉酶产色链霉菌1628 及重组菌1628_ΔXdhR 发酵液对黄瓜枯萎病病菌和水稻纹枯病致病菌菌丝生长的影响Fig.8 Effect of different concentration of fermentation broth of S.diastatochromogenes 1628 and recombinant 1628_ΔXdhR on mycelial growth of Fusarium oxysporum f.sp.cucumerinum and Rhizoctonia solani
3 讨论
TetR 家族蛋白参与细胞的各种功能,包括多药耐药、抗生素的生物合成、建立致病性和调控代谢途径[15,16]。它们通常作为阻遏物发挥作用,通过与特定配体结合到特定基因前调控基因表达[17,18]。本研究在构建敲除xdhR基因菌株时也观察到TM 产量的提高,说明xdhR基因对于TM 的产量具有负调控作用。在天蓝色链霉菌中也有类似现象,在敲除xdhR基因后放线红素的合成提高2.5 倍[11]。通过电镜照片对比可知,xdhR基因不仅对于TM 的产量有调控作用,对于菌落形态分化也有着调控作用,使得菌落不再光滑,菌丝变得更密和更粗糙。
XdhR 存在于嘌呤合成与回补途径中,所以敲除xdhR基因后,导致嘌呤合成与回补途径基因转录水平的变化,其中嘌呤合成途径基因转录水平略有抑制,而嘌呤回补途径基因xdhA、xdhB和xdhC大量表达,进一步分析胞内GTP 水平发现GTP 含量略有提高,然而,胞内GTP 含量在野生型菌株和xdhR敲除菌株中不具备显著性差异,说明链霉菌中存在其他调控途径来维持GTP 的稳态。例如,IMP 脱氢酶(IMP dehydrogenase)能够与ATP、GTP 和ppGpp 结合来改变自身催化活性[19],发酵后期胞内ppGpp 积累导致GTP 被利用[10]等。同时,GTP 含量的大幅度改变也会导致微生物生长速度减慢甚至死亡[20]。所以对于核苷类抗生素来说,提高其前体供应(如ATP 和GTP 等核苷类底物)仍然是比较困难的任务。另一方面,结合GTP 稳态以及更高的丰加霉素产量来说,XdhR 对丰加霉素的激活机制不是通过提高丰霉素前体GTP供应而激活,而更有可能的是XdhR 直接对丰加霉素合成基因簇转录的激活,类似现象在天蓝色链霉菌M145 中已有发现[11]。
长期以来对于植物病害的防治都很大程度依赖于化学防治,但化学农药的使用会带来大量的环境污染和生态破坏等负面影响[21]。生物防治在环境保护和绿色健康方面的优越性很大程度上高于化学防治,因此应用生物防治和生物抗菌已迫在眉睫。丰加霉素作为一种具有巨大应用潜力的农用抗生素,本课题组前期发现丰加霉素可以拮抗黄瓜立枯丝核菌,防止黄瓜立枯病[22]。丰加霉素在其他生防菌株中也发挥抑菌作用,如在抗真菌农药农抗120 的产生菌S.hygrospinosusvar.beijingensis的次级代谢产物中也鉴定到丰加霉素成分[23]。此外,关于农抗120 的生防研究发现它对自粉病、瓜果和蔬菜炭疽病、西瓜枯萎病以及水稻纹枯病其有显著的防治效果,同时也有促进植物增产的作用[24]。这些研究表明丰加霉素在植物防治中的重要地位。本研究中通过提高丰加霉素产量大幅度提高淀粉酶产色链霉菌的生防效果,也为其他生防菌株改造和提高生防效果提供了可靠的理论依据。
