沉默尿苷二磷酸葡萄糖醛酸转移酶基因OfUGT逆转亚洲玉米螟对Cry1Ie蛋白的抗性
2023-10-21林雅玲何康来王振营尚素琴张天涛
林雅玲,何康来,王振营,尚素琴,张天涛*
(1.中国农业科学院植物保护研究所/植物病虫害生物学全国重点实验室,北京 100193;2.甘肃农业大学植物保护学院,兰州 730070)
亚洲玉米螟Ostriniafurnacalis(Guenée)(Asian corn borer,ACB)属鳞翅目Lepidoptera,草螟科Crambidae,是玉米上重要的钻蛀性害虫,主要在心叶期和穗期造成为害,并且取食后的伤口更利于植物病原体的侵入[1],对玉米的产量和品质造成直接或间接的损害,是制约玉米产业高质量发展的重要因素。苏云金芽胞杆菌Bacillusthuringiensis(Bt)是迄今为止应用最成功的病原菌[2]。Bt 在孢子形成过程中产生的杀虫晶体蛋白对鳞翅目、鞘翅目、双翅目等害虫具有特异性杀虫作用,但对人类和其他非靶标昆虫无害[3,4]。转Bt基因作物能够有效控制亚洲玉米螟,但长期种植转单一Bt基因作物,使害虫一直处于高选择压力之下,抗性的产生不可避免[5]。害虫的抗性进化是威胁转Bt 作物杀虫效率的主要因素[6]。目前,对于抗性的治理可采用的策略主要是“高剂量/庇护所”策略和“多基因”策略[7,8]。但是Kaduskar 等[9]利用Crispr/cas9技术逆转黑腹果蝇Drosophilamelanogaster对拟除虫菊酯的抗性,使得利用基因编辑技术逆转昆虫的抗性成为一种可能。
植物和昆虫之间的关系在不断发展,许多昆虫依靠生化策略来减轻在其食用植物中有毒化学物质的影响[10]。尿苷二磷酸葡萄糖醛酸转移酶(UDP-glucuronosyl transferase,UGTs)参与糖基化反应,在植物体内是最大的糖基转移酶家族[11],分布广泛,在动物、细菌及病毒中也皆存在。在UGT 酶的催化下,供体分子的糖基可转移到受体分子的糖苷配基上,对溶解度、稳定性和生物活性都有影响[12],从而使受体的性质发生改变,能将疏水性物质转变成水溶性物质[13,14],糖基化反应使得糖苷具有更强的极性,更容易溶于水,毒性更小,更容易排出[15]。昆虫可通过UGT 酶的糖基化反应将食物中的有毒物质降解,以减少有毒成分对其产生的为害,糖基化反应在生物体排除和抑制内生或外源性的有毒物质的过程中至关重要。草地贪夜蛾Spodopterafrugiperda利用SfUGT33F28基因特异的dsRNA 干扰沉默特定的UDP-糖基转移酶使得玉米防御性物质苯并噁嗪类化合物失活,证明了UGT 酶在体内糖基化中的作用[16]。然而,对昆虫UGT基因的特性,尤其是在功能水平上的研究仍然很少,对这种解毒酶超家族的研究不如细胞色素P450 单加氧酶(cytochrome P450 monooxygenase,P450)、谷胱甘肽S-转移酶(glutathione S-transferase,GST)和羧酸酯酶(carboxylesterase,CarE)等解毒酶的深入。
RNA 干扰(RNA interference, RNAi)是通过双链RNA(double-stranded RNA, dsRNA)诱导细胞内基因沉默的现象,dsRNA 降解了mRNA 或调控靶标基因的表达,从而表现出相应的功能缺陷。RNAi 技术在病虫害防治中展示出巨大的应用潜力,且因其有效性和潜在靶标基因的多样性不易与其他杀虫剂等产生交互抗性,因此成为一种新兴的病虫害防控手段[17,18]。RNAi 技术在昆虫基因功能的研究方面应用较多,昆虫许多重要基因功能应用RNAi 技术而得到阐明。Yang 等[19]使用GST基因特异的干扰dsRNA 饲喂稻飞虱Nilaparvatalugens若虫后继续饲喂含阿魏酸的饲料,发现若虫死亡率显著高于饲喂对照饲料的若虫,RNA干扰后增强了阿魏酸对稻飞虱的毒性。还有研究通过饲喂亚洲玉米螟膜结合海藻糖酶基因dsRNA,发现48 h 后幼虫中肠几丁质合成酶基因表达量下降,并且导致幼虫发育迟缓,因此推测膜结合海藻糖酶基因可能是防治亚洲玉米螟的靶标基因[20]。
本研究基于前期对抗性和敏感亚洲玉米螟转录组比较筛选出尿苷二磷酸葡萄糖醛酸转移酶基因OfUGT(GenBank 登录号:XM_028311489.1)[21],为进一步研究其功能,我们以亚洲玉米螟抗Cry1Ie 蛋白品系为研究对象,利用RNAi 方法沉默该基因,明确沉默该基因后对抗性品系耐药性的影响。
1 材料与方法
1.1 供试材料
1.1.1 供试昆虫 亚洲玉米螟各种群均饲养于中国农业科学院植物保护研究所玉米害虫组。饲养条件为温度(27±1)℃,相对湿度70%~80%,光周期16L:8D。敏感品系(ACB-BtS)在室内使用无琼脂半人工饲料[22]饲养,未接触任何Bt 制剂或蛋白;Cry1Ie 抗性品系是以敏感品系为虫源,在饲料中加入一定量Cry1Ie蛋白筛选得到。
1.1.2 供试蛋白 试验所用Cry1Ie 蛋白购自北京安百胜生物科技有限公司。
1.2 UGT 基因序列分析
通过EditSeq 软件查找序列开放阅读框。利用DNAMAN 软件进行氨基酸的翻译。
1.3 UGT 基因在亚洲玉米螟不同品系中表达量测定
将亚洲玉米螟3 龄幼虫置于冰上,待其昏迷后,用镊子取出肠道,放入PBS 缓冲液中,剪去后肠,用解剖针将中肠撕开,洗去内容物,放到蒸馏水中再清洗一遍,用滤纸吸干水份,放入200 µL Trizol 中,5头幼虫中肠为1 个处理,每个处理3 个重复。
采用Trizol 法提取总RNA,经1%琼脂糖凝胶电泳检测质量和Nanodrop 2000(Thermo Scientific,USA)测定浓度后,使用TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix(TransGen Biotech,China)试剂盒反转录成cDNA 用于qRT-PCR 试验。
使用Primer 3PLUS 设计引物,对引物的扩增效率进行验证后用于qRT-PCR,以亚洲玉米螟核糖体蛋白L8OfRPL8(登录号:NW_021132278)基因为内参基因[23],采用2-∆∆CT方法[24]计算目的基因的相对表达量。qRT-PCR 反应体系使用PerfectStart Green qPCR SuperMix(TransGen Biotech,China)试剂盒,采用20 µL 反应体积,包含10 µL 2×PerfectStart Green qPCR SuperMix、0.8 µL 正向引物、0.8 µL 反向引物、0.4 µL passive reference dye(50×)、1.0 µL cDNA 模板和7.0 µL 无离子水。使用ABI 7500 fast real-time PCR系统,采用两步法进行反应,95 ℃变性30 s 后进行40 次循环:95 ℃(10 s)和60 ℃(20 s),然后进行熔解曲线分析,评价扩增的特异性。
1.4 dsRNA 合成及沉默效率验证
采用T7 Ribo MaxTMExpress RNAi System(Promega,USA)试剂盒合成dsRNA;dsRNA 纯化后测定浓度并分装保存于-80 ℃冰箱中备用。
随机选取Cry1Ie 抗性品系3 龄幼虫注射,以注射GFP基因dsRNA 的幼虫为对照,通过qRT-PCR 检测对UGT基因沉默效率。将3 龄亚洲玉米螟幼虫放到冰上麻醉5 min,使用NANOJECT Ⅱ(Drummond,USA)显微注射器将体外合成UGT基因的dsRNA 从第3 对腹足注射到幼虫体内,每头幼虫注射100.00 nL浓度为3000.00 ng/µL 的dsRNA,注射相同含量GFPdsRNA 的幼虫为对照,每组处理各注射45 头;24 h、48 h 及72 h 后分离中肠,并提取总RNA,使用qRT-PCR 进行定量分析。每个处理包括3 个生物学重复,每个重复5 头幼虫。
1.5 沉默UGT 基因前后生测试验
将3 龄幼虫注射300.00 ng 的dsRNA 后,放到普通饲料饲养48 h 后,转移到蛋白毒素浓度为500.00 µg/g和1000.00 µg/g 的饲料上进行试验,设置空白对照组CK,7 d 后统计存活数,比较注射dsUGT和dsGFP后的致死效果。
1.6 数据统计与分析
使用Excel 2016 进行数据处理和分析。利用GraphPad Prism 9.0 软件进行差异显著性分析(P<0.05)。
2 结果与分析
2.1 UGT 基因序列分析
OfUGT(XM_028311489.1)cDNA 序列全长1610 bp,开放阅读框的长度为1545 bp,编码514 个氨基酸(图1),相对分子质量为187.47 kDa,等电点(PI)为6.57。
2.2 UGT 基因在亚洲玉米螟抗性和敏感品系中表达量差异
与敏感品系相比,UGT基因在ACB-IeR 中相对表达量显著增高22.52 倍(P=0.0026)(图2)。试验中所用引物列于表1。

表1 qRT-PCR 和合成dsRNA 所用引物Table 1 Primers for qRT-PCR and dsRNA synthesis
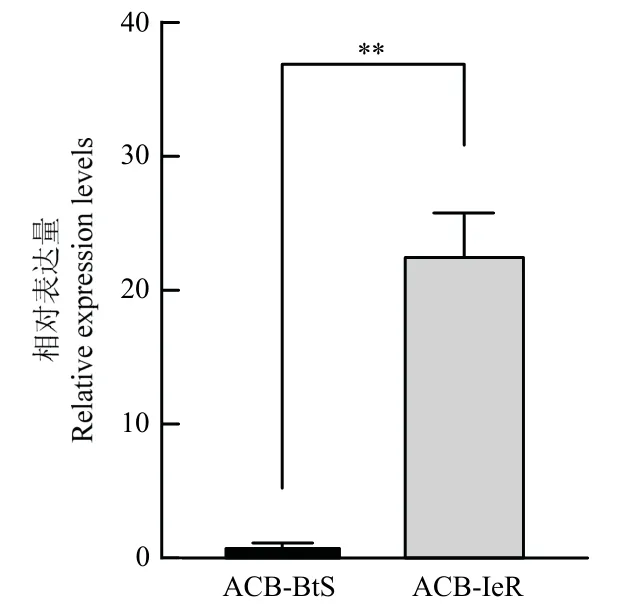
图2 OfUGT 基因在亚洲玉米螟抗性品系(ACB-IeR)和敏感品系(ACB-BtS)3 龄幼虫中的表达量Fig.2 The expression of OfUGT in resistant strain (ACB-IeR) and susceptible strain (ACB-BtS) of Asian corn borer 3rd instar larvae
2.3 亚洲玉米螟抗性品系注射UGT 基因和GFP 的dsRNA 后表达量差异
注射dsRNA 后,24 h、48 h 及72 h 的亚洲玉米螟目的基因UGT的相对表达量均低于对照GFP(图3),且处理后48 h 显著降低75%(P=0.0053),处理后72 h 显著降低60%(P=0.0101)。结果表明,通过显微注射dsRNA 能够沉默亚洲玉米螟UGT基因。

图3 RNA 干扰对Cry1Ie 亚洲玉米螟抗性品系3 龄幼虫UGT 基因相对表达量的影响Fig.3 Effects of RNAi on relative expression of UGT gene in Cry1Ie ACB-IeR 3rd instar larvae
2.4 沉默抗性品系亚洲玉米螟UGT 基因后对Cry1Ie 蛋白抗性变化
经过基因沉默效率验证,结果表明在处理后48 h,对Cry1Ie 抗性品系中UGT基因沉默效率最高。因此,在注射dsRNA 48 h 后进行生测,将幼虫转移至浓度为500.00 µg/g 和1000.00 µg/g 的混合Cry1Ie 蛋白的人工饲料上,7 d 后,对照组在蛋白毒素浓度为1000.00 µg/g 时的存活率较浓度为500.00 µg/g 时降低4.17%,但无显著性差异;亚洲玉米螟注射dsGFP后在不同浓度蛋白中存活率也无显著性差异,但注射dsUGT后亚洲玉米螟在蛋白毒素浓度为1000.00 µg/g 时的存活率显著降低(P<0.001,图4)。在蛋白毒素浓度为500.00 µg/g 时,注射dsUGT和dsGFP的抗性亚洲玉米螟存活率无显著性差异,分别为80.56%和81.94%;在蛋白毒素浓度为1000.00 µg/g 时,注射dsUGT后的抗性玉米螟较注射dsGFP的存活率显著降低(P<0.01),分别为55.56%和79.17%(表2)。
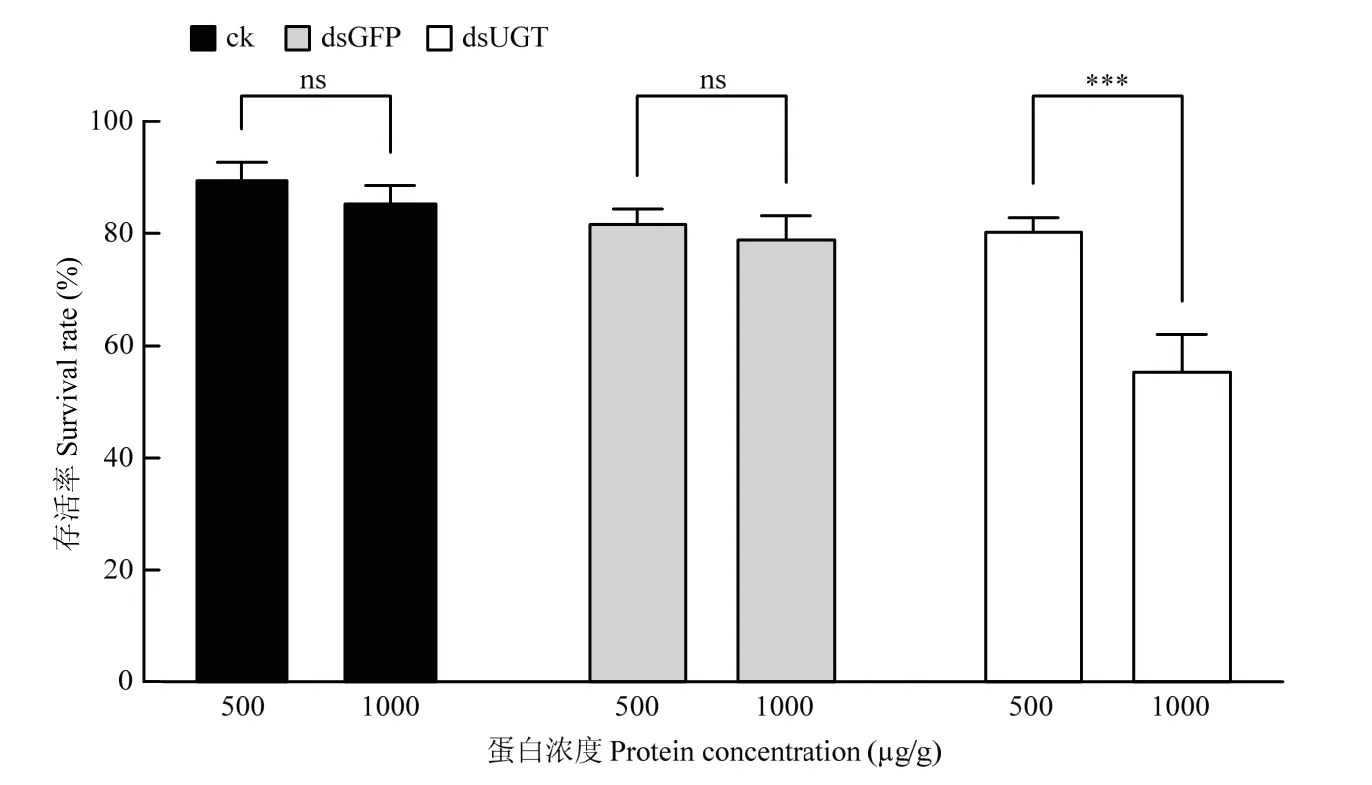
图4 亚洲玉米螟Cry1Ie 抗性品系幼虫沉默UGT 基因后在不同浓度Cry1Ie 蛋白饲料上的存活率比较Fig.4 Comparison of survival rates of Cry1Ie ACB-IeR larvae with the knockdown UGT gene on different concentrations of Cry1Ie protein
3 讨论
靶标害虫对Bt 毒素的抗性是影响转基因作物长期使用的关键,昆虫抵抗外源性有毒物质的机制十分复杂[25],因此,了解抗性的产生原因对于开发和实施新的病虫控制策略非常重要。对抗性产生关键基因进行改造,实施针对性的研究成为迫切的需要。Kaduskar 等[9]使用CRISPR/Cas9 编辑的果蝇抗性品系逆转了对拟除虫菊酯的抗性,使得将抗杀虫剂种群恢复到敏感状态成为可能,这种成功的先例使我们看到利用基因编辑技术逆转昆虫抗性的可能性。故而,当前研究利用RNAi 方法验证UGT基因在抗性亚洲玉米螟中的功能,为逆转亚洲玉米螟对Bt 毒素的抗性奠定基础。
解毒酶是昆虫代谢杀虫剂和植物次生物质的主要措施之一,在降解外源性有毒物质发挥着重要的作用[26]。昆虫主要的三大解毒酶是P450、GST 和CarE[27],此外,有报道认为UGTs 在昆虫解毒过程中也扮演重要角色[28]。UGT 酶属二相代谢酶,它通过糖苷结合参与多种亲脂性物质的生物转化,从而达到解毒和排除外源有毒物质的作用[29]。前人研究发现昆虫可以利用UGTs 代谢寄主植物中的有毒物质,如亚洲玉米螟可利用UGT 酶降解玉米中的有毒物质环状异羟肟酸(cyclic hydroxamic acids,cHx)[30]。此外,Li 等[29]对小菜蛾Plutellaxylostella中的UGT进行了全基因组鉴定,当小菜蛾暴露于杀虫剂的半致死浓度时大多数UGT基因的表达受到影响。可见,昆虫对Bt 毒素产生抗性可能不仅仅与受体基因突变或缺失相关,值得注意的是,相关研究表明UGT与几种昆虫对氯虫苯甲酰胺、拟除虫菊酯、噻虫嗪等杀虫剂的抗性有关,UGT基因被抑制后可增加昆虫对杀虫剂的敏感性。Pan 等[31]研究发现UGT344M2基因被抑制后显著增加了抗性品系棉蚜Aphisgossypii若虫对螺虫乙酯的敏感性。还有报道指出[32],UGT2B17基因在四个氯虫苯甲酰胺抗性品系中相对表达量上调,RNAi 沉默该基因后,氯虫苯甲酰胺对小菜蛾的毒性显著增加;并且该研究在使用UGT 酶抑制剂磺吡酮和5-硝基尿嘧啶处理后,氯虫苯甲酰胺对小菜蛾3 龄幼虫的毒性也显著增加了,由此推断UGT基因表达量的上调可能在昆虫对杀虫剂产生耐药性中起重要作用。此外,Du 等[33]从转录组数据中鉴定并克隆了烟粉虱Bemisiatabaci两个UGT基因,命名为UGT352A4和UGT352A5,RT-qPCR验证两个UGT基因在噻虫嗪抗性品系中相对于敏感品系过度表达,并且RNAi 后,UGT352A5在烟粉虱抗性品系中表达量下降,导致了抗性品系死亡率显著升高。这是解毒基因在外源有毒物质代谢分解中起关键作用的证据。
与前人报道一致,当前研究的UGT基因(XM_028311489.1)在ACB-IeR 中相对表达量与ACB-BtS相比显著上调。ACB-IeR 3 龄幼虫注射dsUGT后,UGT基因表达量下降。Cry1Ie 抗性品系3 龄幼虫在Cry1Ie蛋白浓度为1000.00 µg/g 时存活率为86.11%,故其致死中浓度大于1000.00 µg/g,所以对照组在Cry1Ie蛋白浓度为1000.00 µg/g 时的存活率低于浓度为500.00 µg/g 时,但无显著性差异。在浓度为500.00 µg/g的Cry1Ie 蛋白毒素中,注射dsUGT和dsGFP后的幼虫的存活率没有显著性差异,但较空白对照组存活率显著降低;然而注射dsGFP后的幼虫在浓度为1000.00 µg/g 的Cry1Ie 蛋白毒素中存活率较空白对照组降低,但无显著性差异,推测是由于注射造成的伤害带来的差异。此外,注射dsUGT后的幼虫在浓度为1000.00µg/g 的Cry1Ie 蛋白毒素中的存活率较空白对照和注射dsGFP的都显著下降,由此可以看出RNAi 沉默OfUGT基因后可以降低抗性品系亚洲玉米螟对Cry1Ie 蛋白的抗性,但对抗性的逆转程度还需要后续更进一步的研究。
