丁哌卡因对胰腺癌PANC-1细胞氧化应激和凋亡的影响
2023-10-21李思宇孟媛媛王帝李璐赵宁晓王一飞
李思宇,孟媛媛,王帝,李璐,赵宁晓,王一飞
(1.河北北方学院附属第一医院血管腺体胃肠外科,河北 张家口 075000;2.中国人民解放军空军特色医学中心普外科,北京 100080;3.河北北方学院附属第一医院感染性疾病科,河北 张家口 075000;4.河北医科大学第四医院胃肠外科,河北 石家庄 050000)
胰腺癌是一种恶性程度高、疾病进展快的恶性肿瘤疾病。近年来,胰腺癌的发病率和病死率逐年增加,但治疗胰腺癌的手段有限且疗效欠佳[1]。越来越多的研究显示,局部麻醉剂可能抑制肿瘤细胞,而在治疗癌症方面发挥有益作用[2-3]。丁哌卡因,也称布比卡因,是外科、产科局部或区域麻醉及术后镇痛的常用麻醉药物[4]。近期研究发现,丁哌卡因对多种肿瘤具有抑制作用[5-6]。Bundscherer等[7]研究显示,高浓度丁哌卡因对胰腺癌细胞PaTu 8988t、PANC-1 具有抗增殖的作用。但丁哌卡因抑制胰腺癌的相关作用机制尚未完全阐明。本研究主要观察丁哌卡因对胰腺癌PANC-1 细胞的影响,并探讨其作用机制。
1 材料与方法
1.1 材料
胰腺癌PANC-1 细胞购自中国科学院上海细胞库;丁哌卡因购自江西青峰药业有限公司,国药准字H20090253;CCK8 试剂盒购自日本同仁;一步法TUNEL细胞凋亡检测试剂盒、线粒体膜电位检测试剂盒(JC-1)购自上海碧云天生物科技有限公司;超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽(GSH)生化试剂盒、DCF-DA 荧光探针购自南京建成生物公司;Trizol 试剂购自美国Sigma 公司;逆转录试剂盒、荧光定量PCR 试剂盒购自日本TAKARA 公司;细胞周期依赖性激酶抑制因子(p21)、凋亡抑制蛋白(Survivin)、核增殖抗原(Ki67)、B 淋巴细胞瘤-2 基因(Bcl-2)、Bcl-2相关X蛋白(Bax)、半胱氨酸蛋白酶3(Caspase3)、切割后Caspase 3(cleaved cas 3)、原癌基因(c-Myc)抗体购自美国Abcam。
1.2 主要仪器
bx51 型荧光显微镜购自日本奥林巴斯公司,FACS CAlibur 型流式细胞仪购自美国BD 公司,CFX96型荧光定量PCR仪购自美国BioRad公司。
1.3 细胞培养与分组
PANC-1 细胞置于含有10%(φ)胎牛血清的DMEM 高糖培养基,5%(φ)CO2、37 ℃恒温培养箱中培养,待细胞融合至80%~90%时,添加0.25%胰蛋白酶消化细胞,取生长状况良好的细胞分为4 组:不使用丁哌卡因处理的细胞为对照组,以1.25、2.5、5 mmol/L 丁哌卡因[8]处理的细胞为丁哌卡因组。
1.4 CCK8检测细胞增殖能力
将细胞调整至4×107/L 接种于96 孔板,培养24 h,分别加入含有0.07、0.15、0.3、0.6、1.25、2.5、5、10、20、40、80 mmol/L 丁哌卡因的培养基处理24 h,另添加不含丁哌卡因的培养基处理的细胞为对照组,每孔加入含有10% CCK8 试剂的培养基继续培养1 h,酶标仪检测各孔吸光度值(A),计算细胞增殖抑制率[(对照组A 值-丁哌卡因组A 值)/对照组A值×100%]。
1.5 TUNEL染色观察细胞凋亡
取各组细胞置于6 孔板,加入固定液固定10 min,PBS 清洗2 遍后加入免疫染色强力通透液,室温孵育5 min,PBS 清洗1 遍,滴加TUNEL 检测液,37 ℃下避光孵育60 min,PBS 清洗3 遍,滴加抗荧光淬灭封片液,荧光显微镜下观察细胞凋亡,计算细胞凋亡率(凋亡细胞数/细胞总数×100%),激发波长450~500 nm,发射波长515~565 nm。
1.6 生化试剂盒检测氧化应激指标
收集各组细胞上清液,参照试剂盒说明书操作,检测细胞上清液中SOD、MDA 和GSH 的含量。
1.7 荧光探针检测活性氧(ROS)含量
取各组细胞置于6 孔板,加入10 μmol/L DCFDA 探针,孵育30 min,PBS 清洗2 遍后,荧光显微镜下观察,激发波长50 nm 下,DCF-DA 探针可与细胞中ROS结合发出绿色荧光。
1.8 流式细胞术检测线粒体膜电位
取各组细胞置于6孔板,加入JC-1工作液,继续培养30 min,再加入反应缓冲液清洗2次,以JC-1染色缓冲液重悬细胞,于流式细胞仪检测JC-1 单体(绿色)百分比。
1.9 实时荧光定量PCR检测生长标记物水平
添加Trizol试剂裂解细胞,提取总RNA,逆转录合成cDNA链,再进行实时荧光定量PCR扩增。p21上游引物序列:5′-CACAACCTCCGTCATGT GCT-3′,下游引物序列:5′-GCCGTTTTCGACCCTGAGAG-3′;Survivin 上游引物序列:5′-TTGGCAGGTGCCTG TTGAAT-3′,下游引物序列:5′-AGCCAGTCCCCC ACAGCAT-3′;Ki67 上游引物序列:5′-AAACCC CACCAAGTAAAACA-3′,下游引物序列:5′-CCA AGGCAAGCTCAGGAC-3′。扩增条件为:95 ℃预变性5 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,共40 个循环。以GAPDH 为内参,运用2-△△Ct公式,计算p21、Survivin、Ki67 mRNA 的相对水平。
1.10 蛋白印迹检测蛋白表达
添加RIPA 试剂提取细胞中总蛋白,BCA 试剂进行蛋白定量,混入上样缓冲液置于沸水中变性10 min;配制10%聚丙烯酰胺凝胶,点样后电泳分离蛋白,再切割目的蛋白凝胶进行电转,取出PVDF 膜置于5%脱脂牛奶中,室温封闭2 h,加入一抗(1∶1 000),4 ℃下孵育过夜,再加入辣根过氧化物酶标记的二抗(1∶5 000),37 ℃孵育1 h,最后添加ECL化学发光剂显影。
1.11 统计学方法
各实验重复5 次,实验数据以表示,采用统计学软件SPSS17.0 分析处理,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 丁哌卡因对PANC-1细胞增殖的影响
CCK-8 实验检测显示,丁哌卡因处理后对PANC-1 细胞增殖均产生了抑制作用,且随着丁哌卡因浓度的增加,抑制作用更明显(P<0.05),见图1。选取1.25、2.5、5 mmol/L丁哌卡因为后续实验浓度。
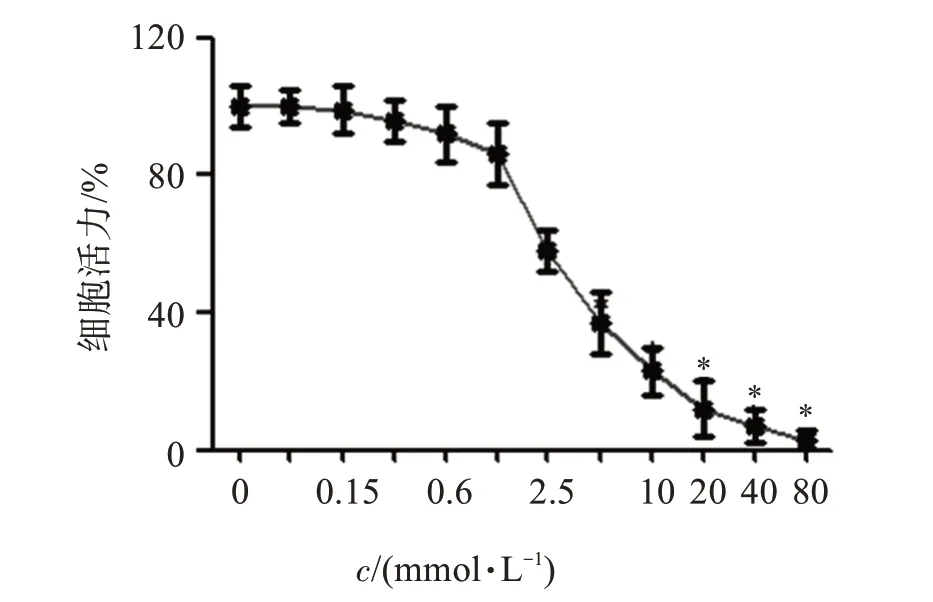
图1 丁哌卡因对PANC-1细胞增殖的影响Figure 1 Effect of bupivacaine on PANC-1 cell proliferation(±s,n=5)
2.2 丁哌卡因对PANC-1 细胞中生长标记物表达的影响
如图2,实时荧光定量PCR 和蛋白印迹检测显示,与对照组比较,2.5、5 mmol/L 丁哌卡因组p21 mRNA 及蛋白表达增加,Survivin、Ki67 mRNA 及蛋白表达减少(P<0.05)。
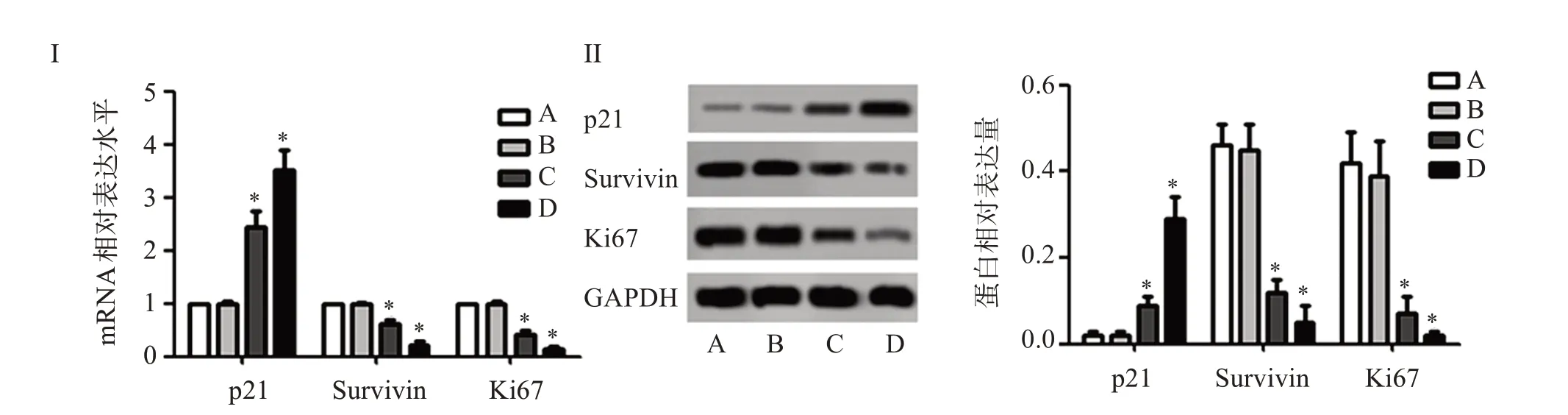
图2 丁哌卡因对PANC-1细胞中生长标记物表达的影响Figure 2 Effect of bupivacaine on the expressions of growth markers in PANC-1 cells(±s,n=5)
2.3 丁哌卡因对PANC-1细胞凋亡的影响
如图3,TUNEL 染色观察显示,呈亮蓝色染色的细胞为凋亡的PANC-1 细胞,对照组、1.25、2.5、5 mmol/L 丁哌卡因组细胞凋亡率分别为(2.37±0.68)%、(12.83±3.82)%、(19.74±4.13)%、(25.53±3.65)%,与对照组比较,2.5、5 mmol/L丁哌卡因组细胞凋亡率明显增加(P<0.05)。

图3 丁哌卡因对PANC-1细胞凋亡的影响(TUNEL染色,100×)Figure 3 Effect of bupivacaine on PANC-1 cell apoptosis(TUNEL staining,100×)
2.4 丁哌卡因对PANC-1 细胞上清液中氧化应激指标的影响
生化试剂盒检测显示,与对照组比较,2.5、5 mmol/L丁哌卡因组细胞上清液中MDA 含量明显增加,SOD和GSH含量明显减少(P<0.05),见表1。
表1 丁哌卡因对PANC-1细胞上清液中氧化应激指标的影响Table 1 Effect of bupivacaine on oxidative stress indexes in the supernatant of PANC-1 cells(±s,n=5)
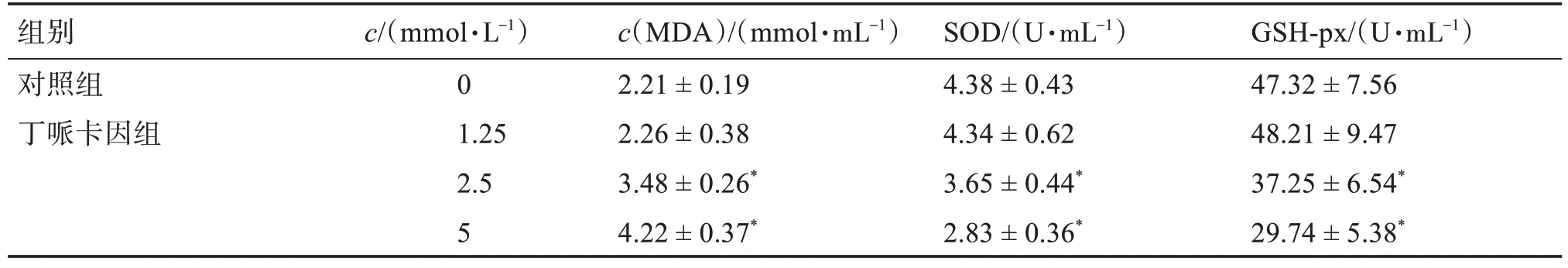
表1 丁哌卡因对PANC-1细胞上清液中氧化应激指标的影响Table 1 Effect of bupivacaine on oxidative stress indexes in the supernatant of PANC-1 cells(±s,n=5)
与对照组比较:*P<0.05。
组别对照组丁哌卡因组c/(mmol·L-1)0 1.25 2.5 5 c(MDA)/(mmol·mL-1)2.21±0.19 2.26±0.38 3.48±0.26*4.22±0.37*SOD/(U·mL-1)4.38±0.43 4.34±0.62 3.65±0.44*2.83±0.36*GSH-px/(U·mL-1)47.32±7.56 48.21±9.47 37.25±6.54*29.74±5.38*
2.5 丁哌卡因对PANC-1细胞中ROS含量的影响
如图4,荧光探针检测显示,对照组、1.25、2.5、5 mmol/L 丁哌卡因组ROS 含量分别为(0.62±0.18)%、(0.87±0.21)%、(11.53±2.62)%、(21.86±4.53)%,与对照组比较,2.5、5 mmol/L丁哌卡因组细胞中ROS含量明显增加(P<0.05)。

图4 丁哌卡因对PANC-1细胞中ROS含量的影响(DCF-DA探针,100×)Figure 4 Effect of bupivacaine on ROS level in PANC-1 cells(DCF-DA probe,100×)
2.6 丁哌卡因对PANC-1细胞线粒体膜电位的影响
如图5,流式细胞术检测显示,对照组、1.25、2.5 、5 mmol/L 丁哌卡因组JC-1 单体百分比分别为(2.64±0.68)% 、(3.11±0.82)% 、(9.73±2.21)% 、(22.37±3.69)%,与对照组比较,2.5、5 mmol/L 丁哌卡因组细胞中JC-1 单体百分比明显增加(P<0.05)。
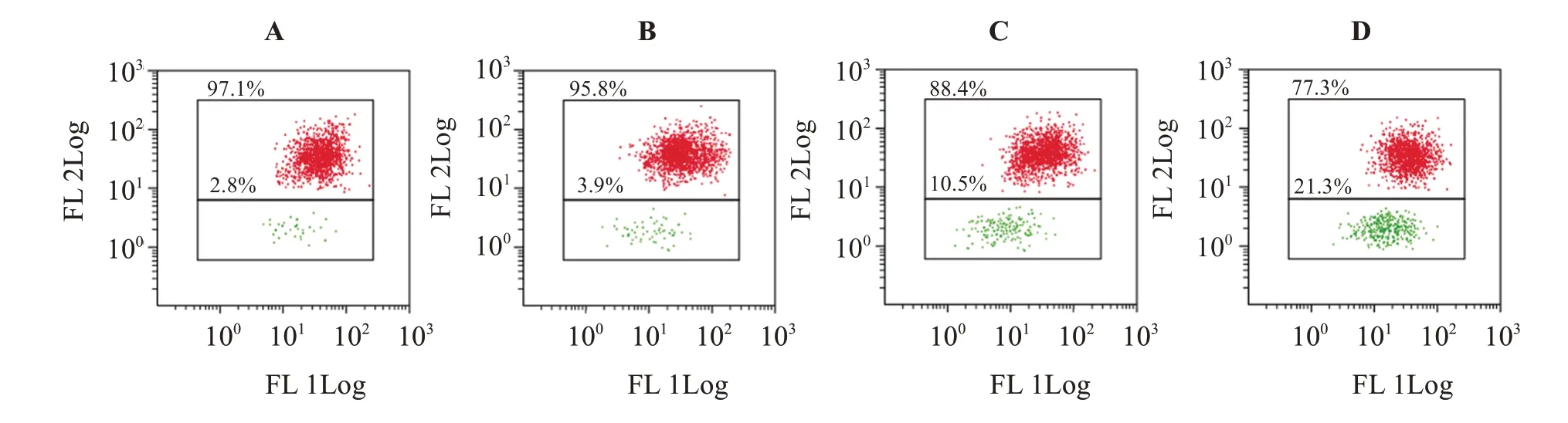
图5 丁哌卡因对PANC-1细胞线粒体膜电位的影响Figure 5 Effect of bupivacaine on mitochondrial membrane potential in PANC-1 cells
2.7 丁哌卡因对PANC-1 细胞中细胞凋亡标记物表达的影响
如图6,蛋白印迹检测显示,与对照组比较,2.5、5 mmol/L 丁哌卡因组细胞中Bax/Bcl-2、cleaved cas 3/cas 3 水平明显增加,c-Myc 蛋白表达明显减少(P<0.05)。
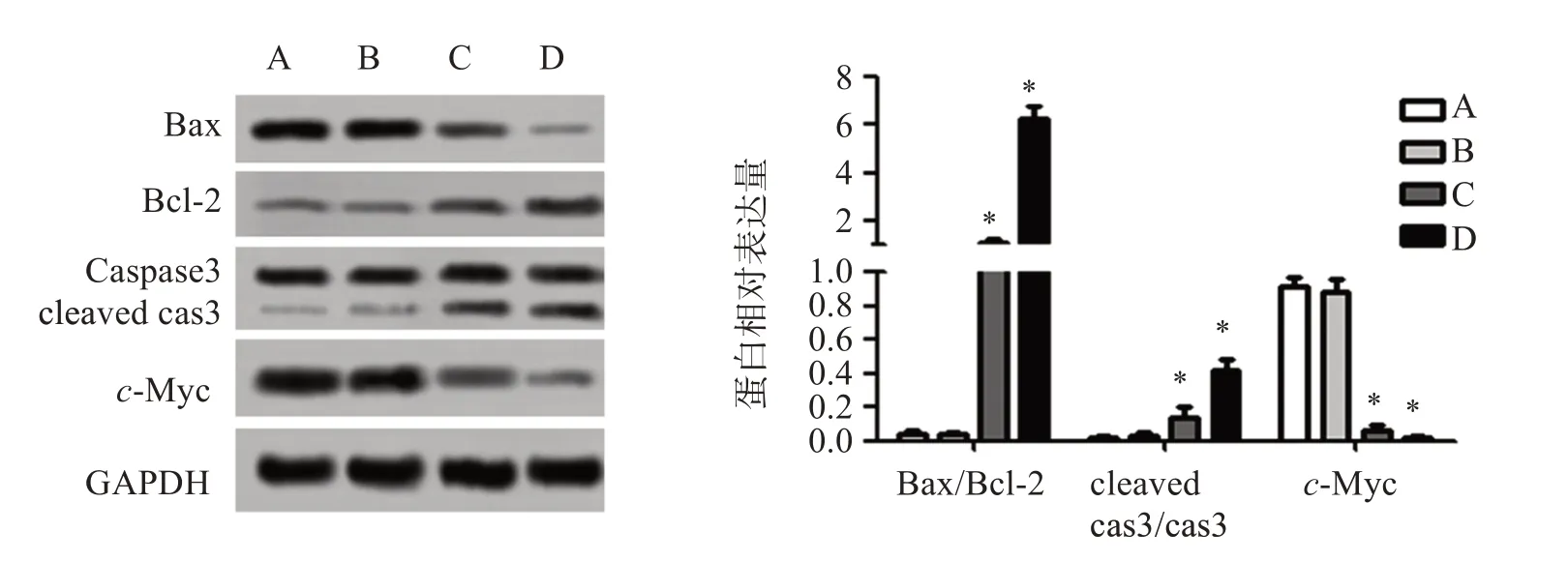
图6 丁哌卡因对PANC-1细胞凋亡标记物表达的影响Figure 6 Effect of bupivacaine on the expressions of apoptosis markers in PANC-1 cells(±s,n=5)
3 讨论
局部麻醉剂主要通过抑制神经元细胞膜钠内流,引起信号传导受阻,发挥麻醉作用[9]。研究表明,局部麻醉剂可诱导细胞凋亡和坏死,对多种类型细胞产生毒性作用,但其相关机制尚不完全清楚[10]。丁哌卡因是一种酰胺类长效局部麻醉药物,具有作用时间长、麻醉效果确切等优点。Chapman 等[11]研究发现,丁哌卡因体外对软骨肿瘤细胞具有明显的细胞毒性,并具有剂量和时间依赖性。Ru 等[12]观察局麻药物对乳腺癌细胞株MDA-MB-231、MCF7 的影响发现,高浓度丁哌卡因可明显抑制乳腺癌细胞的存活和迁移。细胞的异常增殖和凋亡是胰腺癌发生发展的首要条件,通过药物抑制胰腺癌细胞的存活将可改善胰腺癌患者预后[13]。目前,丁哌卡因对胰腺癌细胞增殖和凋亡的具体影响机制还未知。
细胞周期依赖性激酶抑制因子p21是肿瘤抑制因子,其表达增加可抑制细胞增殖[14]。Survivin 属于凋亡抑制蛋白家族,可直接抑制caspase 3、7 的活性,阻断凋亡信号通路,还可使肿瘤细胞逃避细胞DNA 合成后期和有丝分裂期,促进细胞异常增殖[15]。Ki67 是细胞内重要的增殖信号,其在细胞DNA 静息期出现,DNA 合成期逐渐升高,有丝分裂期升至高峰,但有丝分裂结束后迅速降解,是反映细胞增殖活性的敏感指标[16]。本研究结果显示,2.5、5 mmol/L 丁哌卡因作用于PANC-1 细胞后,PANC-1 细胞增殖能力明显降低,细胞凋亡率升高,p21 表达增加,Survivin、Ki67 表达减少,提示一定浓度丁哌卡因可抑制胰腺癌细胞PANC-1 的增殖,并诱导凋亡,可能是治疗胰腺癌的潜在药物。
肿瘤细胞产生大量的ROS 可能是导致细胞凋亡的主要原因。一方面,ROS 的产生会消耗细胞内抗氧化因子(SOD、GSH),导致氧化与抗氧化失衡,产生大量具有细胞毒性的氧化终产物MDA;另一方面,过量的ROS 可直接损伤细胞DNA 和线粒体,最终造成细胞损伤[17]。本研究中,胰腺癌细胞经不同浓度丁哌卡因处理后,细胞ROS 含量和上清液MDA含量增加,SOD和GSH含量则减少,提示丁哌卡因可能通过影响胰腺癌细胞氧化应激系统发挥作用,这与Cai等[18]研究结果相符。
局部麻醉剂具有高度脂溶性,可进入线粒体影响其能量代谢。细胞凋亡早期,线粒体膜电位会降低,JC -1 以单体形式存在于线粒体中,其单体含量与线粒体膜电位呈负相关[19]。本研究结果显示,丁哌卡因可增加胰腺癌细胞中JC-1单体含量,提示丁哌卡因可能通过降低线粒体膜电位,从而促进胰腺癌细胞的凋亡。Bcl-2 家族是参与细胞凋亡的重要蛋白,当Bcl-2 激活后,可引起线粒体外膜孔道的形成,促使细胞色素C 转移至胞质,级联式活化caspase 3,执行凋亡程序[20]。原癌基因c-Myc 蛋白产物位于细胞核,可控制DNA 转录,促进肿瘤细胞增殖[21]。本研究结果还显示,丁哌卡因可上调Bax/Bcl-2、cleaved cas 3/cas 3 水平,下调c-Myc 表达,进一步验证了丁哌卡因对PANC-1细胞促凋亡的作用。
综上所述,高浓度丁哌卡因可诱导胰腺癌PANC-1 细胞增殖抑制和凋亡,提高细胞内氧化应激水平。但本研究仅在细胞水平展示丁哌卡因对胰腺癌的抑制作用及初步分子机制,且效用浓度高于一般抗癌药物的体外实验浓度,未来将对此展开研究,为临床用药提供理论依据。
