硫化氢对需氧菌性阴道炎相关病原体介导阴道炎症反应的作用
2023-10-21王冬纳李六民徐建邦张意林周文良何淑明
王冬纳,李六民,徐建邦,张意林,周文良,何淑明
[1.中山市小榄人民医院(中山市第五人民医院)妇产科,广东 中山 528415;2.中山大学生命科学学院,广东 广州 510275]
需氧菌性阴道炎(aerobic vaginitis,AV)是生育期妇女常见的生殖道感染性疾病,与流产、胎儿感染和早产密切相关[1]。AV 的治疗手段包括雌激素、抗菌药物、抗炎药物和益生菌疗法等[2]。AV 发生的分子机制尚不清楚,治疗方案尚未形成共识,有待进一步研究从而提供更有效的治疗新策略。
AV 的突出临床表现是阴道内出现显著炎症反应和阴道上皮损伤。需氧性泌尿生殖道病原体的黏附导致局部免疫调节和炎症反应失衡;促炎细胞因子如IL-6 和IL-1β等在AV 患者阴道中生成显著增加[3],这是不良妊娠事件的重要危险因素[4]。AV患者阴道中最常见的致病菌是大肠杆菌(E. coli,7.5%)和金黄色葡萄球菌(S.aureus,4.5%)[5]。当阴道内菌群紊乱时,这些促炎细胞因子促进大肠埃希菌和金黄色葡萄球菌的生长,抑制乳酸杆菌的生长,加剧阴道炎症[6]。这些致病菌(如大肠杆菌)被用来制备大鼠AV 模型,研究AV 的发病机制和治疗措施[7]。
硫化氢(H2S)是一种气体,产生于各种器官,如大脑、肝脏和心血管系统[8]。H2S在炎症中的作用与其浓度密切相关:高浓度(病理浓度)的H2S 具有促炎作用,而低浓度(生理浓度)的H2S 具有抗炎作用[9]。研究表明,H2S 通过增强cAMP/蛋白激酶A(PKA)信号轴而激活囊性纤维化跨膜传导调节子(cystic fibrosis transmembrane conductance regulator,CFTR),从而调控阴道上皮细胞的Cl-转运[10-11]。CFTR 表达下调促进人阴道上皮细胞内Cl-聚集,而增强炎症反应[12]。H2S 在AV 炎症反应中的作用尚不清楚。NaHS 在水溶液中易水解生成H2S 和氢氧根。本研究用它作为H2S 的供体,探讨H2S 对需氧性细菌(大肠埃希菌和金黄色葡萄球菌)引起的阴道炎症反应的作用及其相关分子机制。
1 材料与方法
1.1 材料
人阴道上皮细胞株(VK2/E6E7)购自美国ATCC 公司。胎牛血清(1027-106)购自美国Gibco公司。青霉素/链霉素双抗(WH0518)购自天津市灏洋生物制品科技有限责任公司。Keratinocyte sFm培养基(17005042)购自美国Thermo Fisher 公司。NaHS(16721-80-5)购自安耐吉化学公司。CCK-8试剂盒(C0039)、RIPA 裂解液(P0013B)、PMSF(ST506)和氯离子探针MQAE(S1082)购自碧云天生物科技有限公司。大肠埃希菌(133264)和金黄色葡萄球菌(186335)购自北纳生物公司。RNA 提取试剂盒(RP1201)购自百泰克生物技术有限公司。HiScript II Q RT SuperMix 试剂盒(R223-01)购自诺唯赞公司。BCA 试剂盒(23227)购自美国Pierce 公司。PVDF 膜(IPVH00010)购自美国Millipore 公司。牛血清白蛋白BSA(A600332)购自中国生工生物工程股份有限公司。CFTR 一抗(sc-376683)购自美国Santa Cruz 公司。磷酸化p65 一抗(YP0191)和p65 一抗(YM3111)购自美国Immunoway 公司。β-actin 一抗(20536-1-AP)购自美国Proteintech 公司。HRP 偶联的抗兔二抗(BA1054)和抗鼠二抗(BA1051)购自武汉博士德生物工程有限公司。β-雌二醇(50-28-2)购自美国Sigma Aldrich公司。4%(φ)多聚甲醛(30525-89-4)购自西亚试剂公司。脱蜡剂(CX-001)购自广西岑溪松香厂。苏木精溶液(G1004)和伊红溶液(G1001)购自武汉赛维尔生物科技有限公司。
1.2 实验动物
40 只SPF 级雌性SD 大鼠,体质量180~220 g,购自广东省医学实验动物中心,生产许可证号:SCXK(粤)2018-0002。动物实验操作经中山市小榄人民医院伦理委员会批准(ZSXL-LL2018-038)
1.3 细胞培养与处理
VK2/E6E7 细胞在含10%(φ)胎牛血清和青霉素/链霉素(100 u/mL)的Keratinocyte sFm 培养基中培养。为确定NaHS 的最佳浓度,VK2/E6E7细胞在培养皿或板中过夜生长,然后给予不同浓度(1 ~200 μmol/L)的NaHS 孵育24 h 或48 h;NaHS 母溶液用超纯水(ddH2O)配制,然后在培养基中稀释到相应工作浓度。对照组细胞的培养基加入与处理组等量的ddH2O。
1.4 AV细胞模型的制备与NaHS干预
AV 细胞模型制备:VK2/E6E7 细胞与大肠埃希菌或者金黄色葡萄球菌共同孵育24 h。感染的细胞中加入NaHS(20 μmol/L)孵育24 h,进行ELISA、实时定量PCR(qPCR)、蛋白印迹和流式细胞检测。
1.5 CCK-8检测
根据产品说明书进行细胞活性测定。细胞处理完成后,将10 μL 的CCK-8 溶液加入到含有100 μL 培养基的孔中,继续在培养箱中孵育2 h,然后在多功能微孔分光光度计(Thermo Fisher,Multiskoun,美国)中测量450 nm波长处的吸光度值(A)。实验重复3次。
1.6 qPCR检测
根据产品说明书操作,使用RNA 提取试剂盒提取样品总RNA。采用HiScript II Q RT SuperMix试剂盒进行逆转录反应。qPCR 引物在探真生物公司合成。引物序列为:ACTB,正向引物:5′-AAGATCAAGATCATTGCTCCTCCT-3′,反向引物:5′-AGCTCAGTAACAGTCCGCCT-3′;IL-6,正向引物:5′-TGGAAATGAGAAAAGAGTTGTGC-3′,反向引物:5′-CGGAACTCCAGAAGACCAGA-3′;IL-1β,正向引物:5′-CCTATGTCTTGCCCGTGGAG-3′,反向引物:5′-CACACACTAGCAGGTCGTCA-3′。qPCR在20 μL反应体系中进行:1 μL cDNA,1.6 μL引物,10 μL SYBR,和7.4 μL ddH2O。反应条件为94 °C,30 s;60 °C,20 s;72 °C,20 s;40 个循环。实验重复3次。
1.7 蛋白印迹检测
细胞在含有PMSF(2 mmol/L)的RIPA 裂解液中裂解,使用BCA试剂盒检测样品的蛋白浓度。蛋白样品(10 μg/条带)在SDS-PAGE 凝胶中以80~120 V 电压进行电泳分离1.5 h。以250 mA 电流转移100 min将凝胶中蛋白转移到PVDF膜上。PVDF膜在室温下与TBST(含5% BSA)孵育1.5 h 进行封闭。PVDF 膜在4 °C 与以下一抗抗体孵育过夜:CFTR 一抗(1∶1 000)、磷酸化p65 一抗(1∶1 000)、p65 一抗(1∶1 000)和β-actin 一抗(1∶1 000)。PVDF膜用TBST 洗3 遍后,在室温下与HRP 偶联的抗兔/抗鼠二抗(1∶7 500)共同孵育2 h。印迹膜使用TanonTMHigh-sig ECL 底物按照产品说明进行孵育,在Tanon-5200 化学发光成像系统获取和分析蛋白印迹图像。实验重复3次。
1.8 流式细胞检测
细胞经胰蛋白酶消化获取细胞悬液,离心去上清。用PBS 洗涤3 次后,将细胞沉淀与含5 mmol/L MQAE 的Krebs-HEPES 溶液混匀,在室温下避光孵育30 min。用PBS 洗涤细胞3 次后,使用流式细胞仪(Novocyte2040R,ACEA,美国)和NovoExpress软件进行分析。测量并比较各组的平均荧光强度(MFI)。实验重复3次。
1.9 AV动物模型与分组给药
将40 只大鼠随机分为5 组,每组8 只,分别为:对照组、E. coli感染组(E. coli)、E. coli感染+NaHS处理组(E.coli+NaHS)、S.aureus感染组(S.aureus)和S.aureus感染+NaHS 处理组(S.aureus+NaHS)。AV 大鼠模型制备参照文献[13]方法进行。给予大鼠每天皮下注射0.5 mgβ-雌二醇,持续2 d 以诱导发情。通过用无菌棉签摩擦阴道组织50 次造成阴道壁机械性损伤。随后,将E.coli或S.aureus菌液(0.025 mL/100 g,3×107CFU)灌入阴道,并保持阴道呈朝上以防止溶液流出,连续灌注6 d;对照组阴道灌注等量生理盐水。NaHS 浓度为400 μmol/L。NaHS 治疗(E.coli/S.aureus+NaHS 组)从感染的第6 天开始进行。每只大鼠每天经阴道注射NaHS 溶液100 μL,连续3 d。在完成最后一次治疗24 h后,经麻醉后处死大鼠并收集阴道组织进行苏木精-伊红(hematoxylin and eosin,HE)染色和qPCR分析。
1.10 HE染色
阴道组织用4%(φ)的多聚甲醛固定,制作蜡块切片(3 μm)。切片在60°C 下孵育2 h后,使用脱蜡剂脱蜡10 min,用100%、95%和75%酒精对切片进行水合处理。组织切片HE 染色、漂洗、脱水、清理和封片,在显微镜下成像。
1.11 统计分析
实验数据以表示。使用GraphPad Prism 9软件进行统计分析。两组和两组以上的组间差异分别使用Student'st检验和单因素方差分析(Bonferroni检验)进行比较。P<0.05 为差异有统计学意义。
2 结果
2.1 NaHS对AV大鼠阴道炎症反应的作用
阴道组织HE 染色显示,对照组大鼠的阴道组织呈现有序排列的分层鳞状上皮和紧密的黏膜层,E.coli和S.aureus感染组大鼠的阴道组织黏膜层增生和上皮下炎症细胞浸润(如中性粒细胞和单核细胞)。与感染组相比,NaHS 干预组大鼠的阴道组织黏膜层增生和上皮下炎症细胞浸润明显减少(图1A)。与对照组相比,E.coli或S.aureus感染组大鼠阴道组织的IL-6(图1B)和IL-1β(图1C)mRNA表达显著增加,差异有统计学意义(P<0.05);与感染组相比,NaHS 干预组的IL-6 和IL-1βmRNA 表达显著降低,差异有统计学意义(P<0.05)。
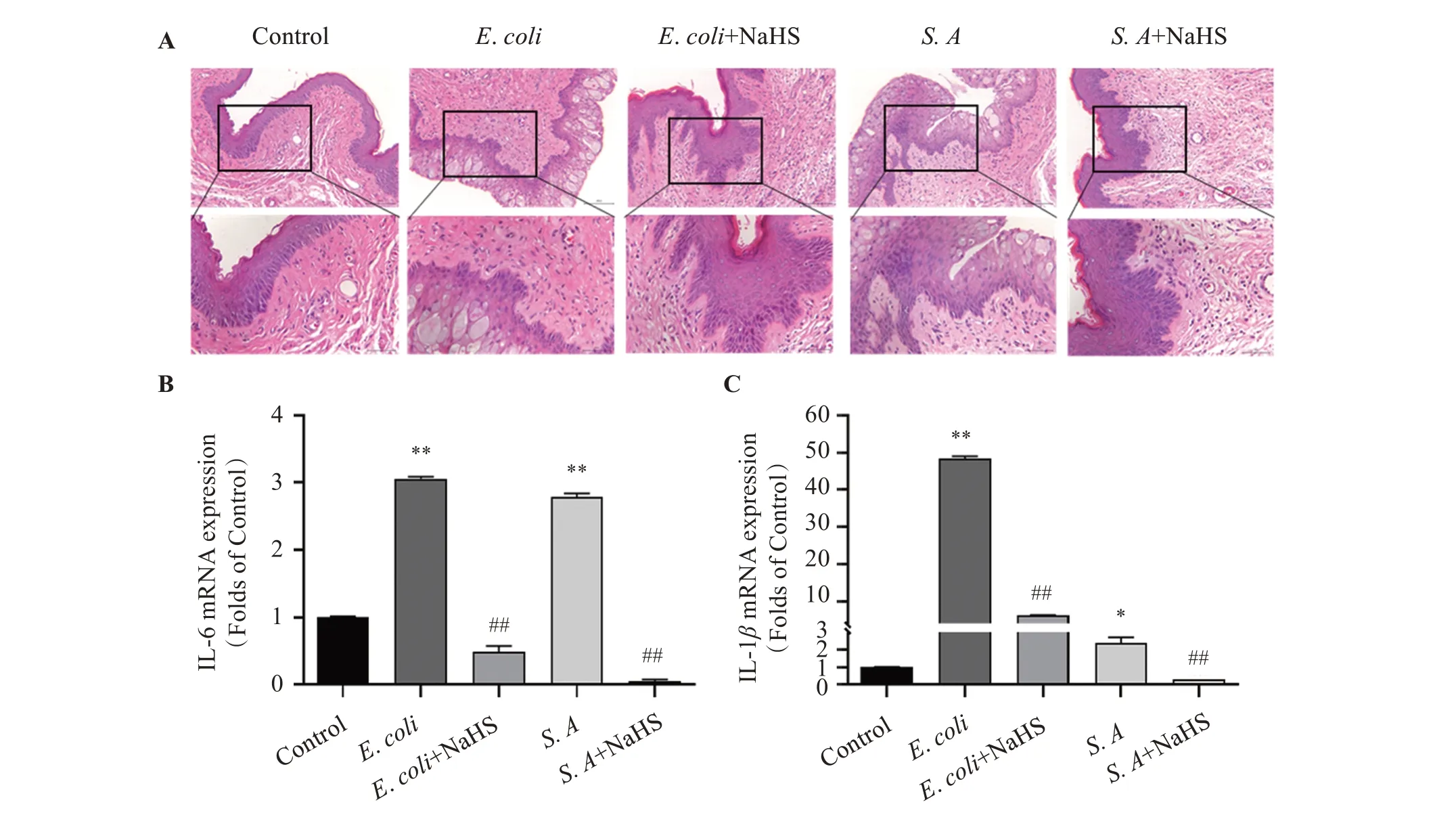
图1 NaHS对E.coli或S.aureus感染大鼠阴道组织形态变化和促炎细胞因子表达的影响Figure 1 Effect of NaHS treatment on morphological changes and proinflammatory cytokine expression in vaginal tissues of rats infected with E.coli or S.aureus(n=3)
2.2 NaHS 对E.coli 或S.aureus 诱导的阴道上皮细胞炎症反应的影响
CCK-8 结果显示,NaHS 在浓度范围1~200 μmol/L 时,与VK2/E6E7 细胞孵育24 h 对细胞活性没有明显影响,组间差异无统计学意义(P>0.05,图2A)。当孵育时间延长至48 h,细胞活性降低,与对照组相比,差异有统计学意义(P<0.05,图2B)。后续实验选择24 h作为NaHS处理的时间点。
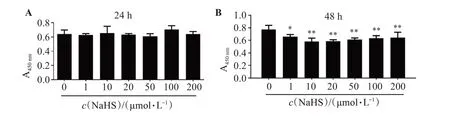
图2 NaHS对阴道上皮细胞活性的影响(n=3)Figure 2 Effect of NaHS on vaginal epithelial cell viability(n=3)
ELISA结果显示,与对照组相比,E.coli或S.aureus感染24 h 显著增加促炎细胞因子(IL-6 和IL-1β)的表达,差异有统计学意义(P<0.05,图3A—D)。与感染组相比,NaHS 干预组呈浓度依赖性地降低E.coli或S.aureus感染细胞中IL-6 和IL-1β的水平,差异有统计学意义(P<0.05,图3A-3D)。基于这些结果,本研究选择20 μmol/L NaHS作为后续实验的干预条件。

图3 NaHS对E.coli或S.aureus感染VK2/E6E7细胞中炎症细胞因子表达的影响Figure 3 Effect of NaHS on proinflammatory cytokine expression in VK2/E6E7 cells stimulated with E.coli or S.aureus(n=3)
与ELISA 结果一致,qPCR 结果显示,E. coli或S. aureus感染细胞的IL-6 mRNA 表达水平比对照组高,分别约为对照组的1.5 倍和1.6 倍。与感染组相比,NaHS(20 μmol/L)干预组细胞的IL-6(图3E)和IL-1β(图3F)mRNA 表达水平显著下降,差异有统计学意义(P<0.05)。
2.3 NaHS 对E.coli和S.aureus感染阴道上皮细胞NF-κB 信号通路的影响
如图4 所示,与对照组相比,E.coli或S.aureus感染组细胞的p-p65蛋白表达和p-p65/p65比值显著升高,差异有统计学意义(P<0.05)。与感染组相比,NaHS干预组细胞的p-p65蛋白表达和p-p65/p65比值显著降低,差异有统计学意义(P<0.05)。
2.4 NaHS 对E.coli 或S.aureus 感染阴道上皮细胞中的细胞内Cl-的影响
使用MQAE 作为细胞内Cl-的荧光指示剂。流式细胞检测结果显示(图5),与对照组相比,E.coli感染组VK2/E6E7细胞胞内Cl-增加了1.5倍,差异有统计学意义(P<0.05)。与感染组相比,NaHS干预组细胞内Cl-显著降低,差异有统计学意义(P<0.05)。

图5 NaHS对E.coli或S.aureus感染的VK2/E6E7细胞内Cl-浓度的影响Figure 5 Effect of NaHS on intracellular Cl- concentrations in VK2/E6E7 cells stimulated with E.coli or S.aureus(n=3)
蛋白印迹结果显示(图6),对照组、感染组和NaHS 处理组间的CFTR 蛋白表达的差异无统计学意义(P>0.05)。

图6 NaHS对E.coli或S.aureus感染的VK2/E6E7细胞CFTR表达的影响Figure 6 Effect of NaHS on CFTR expression in VK2/E6E7 cells stimulated with E.coli or S.aureus(n=3)
3 讨论
本研究结果表明NaHS 能抑制需氧菌阴道炎相关病原体E.coli或S.aureus感染引起的阴道炎症反应,同时发现NaHS 能抑制这些病原菌诱导的NFκB信号通路激活和细胞内Cl-的聚集。
需氧菌性阴道炎的主要特点是炎症反应明显增强,促炎细胞因子(如IL-1β和IL-6)水平升高[2]。本研究结果显示,E. coli和S. aureus感染使VK2/E6E7 细胞释放的IL-1β和IL-6 显著增加,而NaHS干预呈浓度依赖性降低这些促炎细胞因子的水平。与ELISA结果一致,NaHS显著降低E.coli和S.aureus感染VK2/E6E7细胞中IL-6和IL-1β的mRNA表达。NaHS 是一种快速释放的H2S 供体[14]。本研究结果表明NaHS 抑制E.coli和S.aureus感染引起的阴道上皮细胞炎症反应。与细胞实验结果一致,NaHS也显著抑制E.coli和S.aureus感染引起的AV 大鼠阴道组织中IL-6 和IL-1βmRNA 的过度表达和阴道组织的病理改变。本研究结果与曾佳洪等[15]报道的一致,曾佳洪等的研究显示在小鼠烧伤模型中,NaHS 通过降低包括IL-6 和IL-10 在内的一系列促炎细胞因子水平,显著抑制炎症反应。多项研究表明低浓度H2S(或H2S 供体)具有显著抗炎效应[9,16]。本研究揭示H2S对需氧菌性阴道炎相关病原菌感染引起的阴道炎症具有抗炎效应。
研究表明,滴虫性阴道炎感染通过降低阴道上皮细胞中CFTR 的表达而阻断细胞内Cl-分泌,进而导致细胞内Cl-聚集[17]。在脾细胞、内皮细胞和胆管上皮细胞中,CFTR 表达减少或者活性降低可导致细胞内Cl-堆积而促进炎症反应[18-20]。CFTR 功能缺陷的促炎作用与激活NF-κB 信号通路密切相关,而恢复CFTR 的表达则抑制NF-κB 介导的炎症反应[19,21]。H2S 通过激活CFTR 调节阴道上皮细胞中的Cl-离子转运[10]。本研究显示,E. coli和S. aureus感染诱发阴道炎症反应和激活NF-κB 信号通路,导致阴道上皮细胞内Cl-聚集,这些效应显著被NaHS抑制。研究结果表明H2S 抑制E.coli和S.aureus感染诱发的阴道炎症反应和NF-κB 信号通路,活化未通过调控CFTR 表达来实现。H2S 是否通过调节CFTR 通道活性而发挥其抑制需氧性病原菌诱发的阴道炎症还有待进一步研究。
综上所述,本研究表明,H2S 可能是通过抑制阴道上皮细胞内Cl-聚集而阻止NF-κB信号通路活化,从而抑制E. coli和S. aureus感染引发的阴道炎症反应。
