复方香鱼口服液的解热作用研究
2023-10-21覃金桥钟贵黄少敏谢旭格牛新迈陈智兰赵天琪廉静黄燕琼柳俊辉秦华珍
覃金桥,钟贵,黄少敏,谢旭格,牛新迈,陈智兰,赵天琪,廉静,黄燕琼,柳俊辉,秦华珍
(1.广西中医药大学药学院,广西 南宁 530200;2.广西中医药大学第一附属医院,广西 南宁 530023;3.广西壮瑶药技术研究中心,广西 南宁 530200)
外感发热是指六淫或疫毒侵袭人体,引起肌表营卫失和,脏腑功能失调,以发热、畏寒、烦躁、脉数等主要临床表现的一类外感病证,具有起病急、发生率高、病情变化快等特点[1-2]。复方香鱼口服液是根据桂派中医大师梁申教授的经验方复方香鱼合剂开发研制而成,该方由三叶香茶菜和鱼腥草组成,功效清热解毒、辛凉解表,主治外感发热,疗效显著,尚未发现严重不良反应病例[3]。虽能在学术丛书中查阅到该方,但近年来未见对其进行深入研究的相关报道。拟对梁老的经验方进行开发研究,给临床治疗提供科学的用药指导。本实验选取复方香鱼口服液为研究对象,通过腹腔注射脂多糖(LPS)和背部皮下注射干酵母混悬液两种方法建立发热模型,研究复方香鱼口服液的解热作用,为该口服液制剂的后期研究提供药效基础。
1 材料
1.1 药物与试剂
复方香鱼口服液,由广西中医药大学第一附属医院制剂中心提供,每毫升含生药1.62 g,批号20210622。三叶香茶菜、鱼腥草均购于广西仙茱中药科技有限公司,批号分别为20190501、20201202,经广西中医药大学中药鉴定学教研室马雯芳教授鉴定为正品,三叶香茶菜为唇形科植物牛尾草Isodon ternifolius(D.Don)Kudo 的全草。鱼腥草为三白草科植物蕺菜Houttuynia cordataThunb.的地上部分。阿司匹林肠溶片(拜耳,批号BJ56811)。干酵母(安琪酵母股份有限公司,批号HY1703)。LPS(Sigma 公司,货号L2880)。环磷酸腺苷(cAMP)试剂盒(批号20211210、20211010);前列腺素E2(PGE2)试剂盒(批号20211210),均由Bioswamp武汉贝茵莱生物科技有限公司提供。
1.2 实验动物
SPF级SD雄性大鼠,体质量180~220 g,购自湖南斯莱克景达实验动物有限公司,生产许可证号:SCXK(湘)2019-0004,饲养于广西中医药大学动物实验中心。实验期间,动物自由摄食饮水。该实验获得广西中医药大学动物伦理委员会的批准(编号DW20200627-086)。
1.3 主要仪器
98-1-B 电子调温电热套(天津市泰斯特仪器有限公司);DJ-1500 粉碎机(上海顶佳工贸);Multiskan sky 酶标仪(Thermo Scientific);Sorvall ST 16离心机(Thermo Fisher);SQP 万分之一克电子天平[赛多利斯科学仪器(北京)有限公司];OSE-Y30 高速组织研磨器[天根生化科技(北京)有限公司];BCD-210DCM-80 ℃冰箱(青岛海尔股份股份有限公司);XH-7涡旋混合器(常州朗越仪器制造有限公司);AF 206 AS 230/50/1 雪花制冰机(scotsman公司)。
2 方法
2.1 药物制备
鱼腥草提取液:取鱼腥草,加12倍量水浸泡0.5 h,回流提取2 次,第1 次回流提取1.5 h,第2 次1 h,收集滤液及橙黄色挥发油,合并2 次滤液,将0.2%的吐温-80 加入挥发油,在低于40 ℃的水温下超声混匀,再与浓缩药液混合,用纯水定容至含有生药量为0.72 g/mL 的鱼腥草药液,放至常温,4 ℃冰箱保存备用。
三叶香茶菜提取液:称取三叶香茶菜,加12倍量水浸泡0.5 h,回流提取2次,第1次回流提取1.5 h,第2 次1 h,合并2 次滤液,加热浓缩至含生药0.9 g/mL的药液,放至常温,4 ℃冰箱保存备用。
阳性药:精密称取阿司匹林肠溶片,加纯水研磨定容,制成质量浓度为0.02 g/mL的药液。
2.2 分组、造模与给药
2.2.1 干酵母致大鼠发热实验 取SD 大鼠80只,适应性喂养3 d,实验开始前,连续4 d早上同一时间间隔1 h 测肛温2 次,每次3 个数取平均值。将体温变化大于0.5 ℃,单次温度不在36.8~38.3 ℃范围内的大鼠剔除。实验前间隔1 h测定肛温2次,将体温变化大于0.3 ℃的大鼠剔除,取平均值作为大鼠的基础体温(T0)。剩下的大鼠随机分为空白组8 只,造模组64 只。造模组大鼠背部皮下注射10%干酵母混悬液(10 mL/kg),空白组大鼠背部皮下注射等量生理盐水。造模后4 h 开始测肛温,间隔1 h 测温1 次(Tx),连续测2 次,ΔT≥0.8 ℃表示造模成功,将建模成功的大鼠再次随机分为模型组、阳性药组(阿司匹林,0.2 g/kg)、复方香鱼口服液高、低剂量组(16.2、3.24 g/kg)、鱼腥草高、低剂量组(7.2、1.44 g/kg)、三叶香茶菜高、低剂量组(9.0、1.8 g/kg)。复方香鱼口服液的基础处方为三叶香茶菜20 g、鱼腥草16 g,各组给药量参照预实验和等效剂量换算确定,高剂量组给药剂量相当于该药物临床每日使用等效剂量的5 倍;低剂量组给药剂量与该药物临床每日使用等效剂量相等,各给药组剂量均以生药量计,每组8 只。空白组与模型组灌服蒸馏水,其余各组灌服相应受试药。给药后,间隔1 h 测温1 次,共6 次,计算体温变化值ΔT(ΔT=Tx-T0)。
2.2.2 LPS 致大鼠发热实验 取SD 大鼠80 只,同“2.2.1”项剔除不合格大鼠。剩余大鼠随机分为空白组8 只,造模组64 只。空白组腹腔注射生理盐水(1 mL/kg),造模组腹腔注射LPS溶液(100 μg/mL)。造模后1 h开始测肛温,此后每1 h测温1次,共监测5次。当体温升高≥0.8 ℃时,再次分组给药,分组与给药均同“2.2.1”项。给药后每隔1 h 测温1 次,共4次,计算体温变化值(ΔT)。
2.3 样本采集与测定
各组大鼠最后一次测温后进行麻醉,腹主动脉取血,置于加有肝素钠的采血管中,混匀。静置2~4 h后,于3 500 r/min,4 ℃,离心15 min,得血浆。按试剂盒说明测定血浆样本中的cAMP、PGE2的含量。
取血后,迅速取出全脑,冰浴下取下丘脑组织,立刻投入液氮中,固定后于-80 ℃冰箱内保存备用。
称取下丘脑组织,置于冰冷的PBS 溶液轻微洗涤后,加入9 倍量的PBS(pH7.4),冰浴中用匀浆器充分匀浆,于10 000 r/min,4 ℃,离心10 min,收集上清液,分装。按试剂盒说明测定下丘脑中cAMP、PGE2的含量。
2.4 统计学分析
通过SPSS 26.0进行统计分析。计量资料以表示,组间比较采用两样本均数t检验,多组间样本均数比较采用单因素方差分析,方差齐采用LSD 检验,方差不齐采用Games-Howell 检验。P<0.05 为差异有统计学意义。
3 结果
3.1 对干酵母致热大鼠模型的影响
3.1.1 对干酵母致热大鼠模型体温变化的影响 根据本实验前期对干酵母造模成功节点的摸索,结果显示,造模后前3 h,体温变化均值呈现降低趋势。造模后4 h,ΔT≥0.8 ℃,与空白组比较差异有统计学意义(P<0.01),说明造模成功;至5 h 时,所有大鼠体温升高值均达到0.8 ℃,此后大鼠体温变化值均持续平稳上升。从大鼠造模后11 h 的体温变化情况判定,可从造模后第4小时开始测温。见图1。
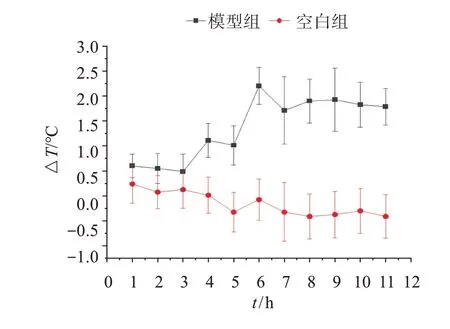
图1 大鼠皮下注射干酵母后体温变化Figure 1 Changes of body temperature in rats after subcutaneous injection of dry yeast
造模后,大鼠逐渐出现尾部发热变红,身体发烫,毛发竖立,活动减少的现象。与空白组比较,造模后4~5 h,模型组与各给药组大鼠体温明显升高(P<0.01),且造模后5 h,各组大鼠ΔT>0.8 ℃,表明干酵母致大鼠发热模型造模成功。见表1。
表1 大鼠皮下注射干酵母后体温变化Table 1 Changes of body temperature in rats after subcutaneous injection of dry yeast(±s,n=8)
与空白组比较:##P<0.01。
组别空白组模型组阿司匹林组复方香鱼口服液低剂量组高剂量组鱼腥草低剂量组高剂量组三叶香茶菜低剂量组高剂量组造模后各组体温变化ΔT/℃0 h 37.36±0.18 37.60±0.37 37.41±0.20 37.8±0.27 37.69±0.33 37.55±0.27 37.48±0.28 37.33±0.23 37.58±0.28 4 h 0.08±0.24 0.51±0.39##0.43±0.49##0.33±0.36##0.46±0.38##0.59±0.52##0.56±0.35##0.50±0.23##0.30±0.21##5 h-0.23±0.30 1.28±0.38##1.29±0.41##1.18±0.29##1.20±0.29##1.26±0.32##1.26±0.39##1.29±0.27##1.15±0.32##
与模型组比较,阿司匹林组的解热作用呈现持续稳定状态;复方香鱼口服液高剂量组ΔT于给药后3~6 h 显著降低(P<0.01);复方香鱼口服液低剂量组ΔT于给药后2~3 h、5~6 h 显著降低(P<0.01 或P<0.05);鱼腥草高剂量组ΔT于给药后3、4、6 h 显著降低(P<0.05);鱼腥草低剂量组ΔT于给药后6 h 显著降低(P<0.05);三叶香茶菜高剂量组给药后3~6 h ΔT明显下降(P<0.01 或P<0.05);三叶香茶菜低剂量组给药后6 h ΔT明显降低(P<0.05)。
同剂量组间比较:给药后1~2 h,鱼腥草低剂量组、三叶香茶菜低剂量组与复方香鱼口服液低剂量组ΔT差异具有统计学意义(P<0.05);给药后3 h,复方香鱼口服液低剂量组与三叶香茶菜低剂量组ΔT差异具有统计学意义(P<0.05)。给药后4 h,复方香鱼口服液高剂量组的ΔT与同剂量的单味药组比较,差异具有统计学意义(P<0.05)。给药后5~6 h,复方香鱼口服液高剂量组与鱼腥草高剂量组的ΔT比较差异有统计学意义(P<0.01 或P<0.05)。各低剂量组间的体温降低情况均弱于高剂量组表现出的解热效果,呈现出一定的量效关系。
阿司匹林所表现出的解热效果持续稳定,复方香鱼口服液解热效果较单味药更明显,且大鼠体温表现出持续降低状态,未呈现出反弹的趋势。复方香鱼口服液与单味药均具有解热作用,但从配伍前后的比较可知,配伍后的复方香鱼口服液表现出的解热作用虽不及阿司匹林的解热作用,但其表现出的解热作用却优于单味药。这与配伍后,增强其辛凉解表、清热解毒功效的目的一致。见表2。
表2 复方及其单味药对干酵母致热大鼠体温变化的影响Table 2 Effect of compound and its single drug on temperature changes of rats with dry yeast-induced fever(±s,n=8)
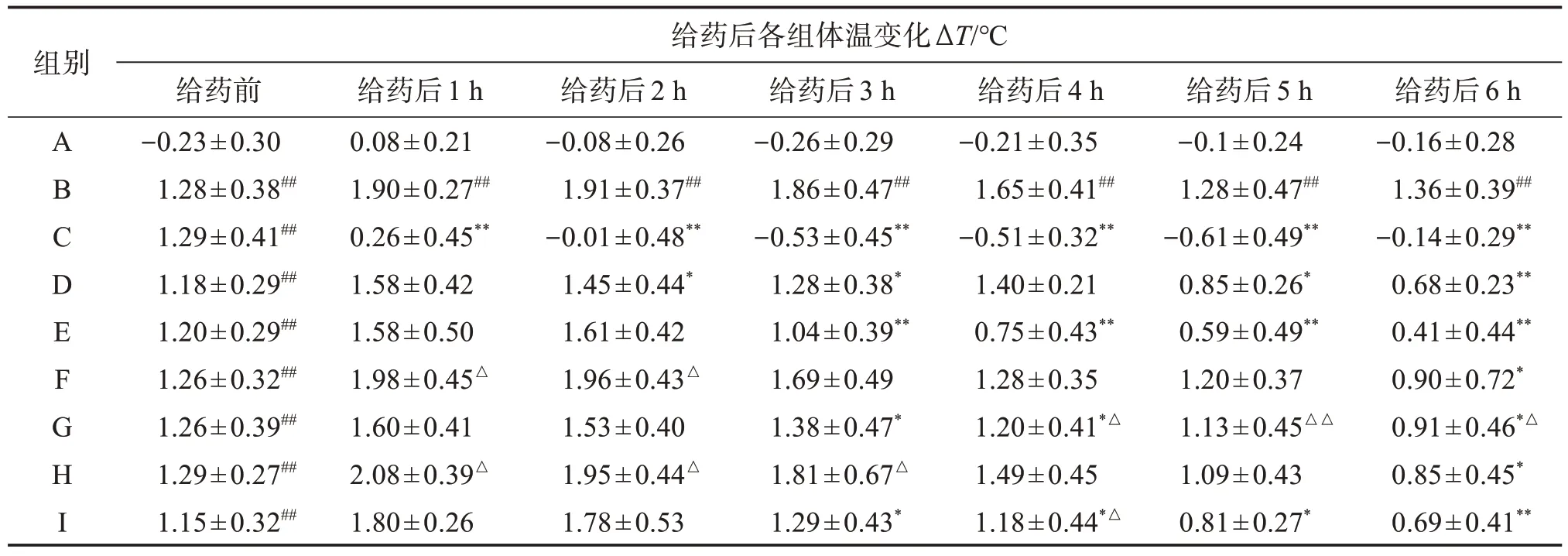
表2 复方及其单味药对干酵母致热大鼠体温变化的影响Table 2 Effect of compound and its single drug on temperature changes of rats with dry yeast-induced fever(±s,n=8)
A.空白组;B.模型组;C.阿司匹林组;D.复方香鱼口服液低剂量组;E.复方香鱼口服液高剂量组;F.鱼腥草低剂量组;G.鱼腥草高剂量组;H.三叶香茶菜低剂量组;I.三叶香茶菜高剂量组。与空白组比较:##P<0.01;与模型组比较:*P<0.05,**P<0.01;与复方香鱼口服液同剂量组比较:△P<0.05,△△P<0.01。
组别A B C D E F G H I给药后各组体温变化ΔT/℃给药前-0.23±0.30 1.28±0.38##1.29±0.41##1.18±0.29##1.20±0.29##1.26±0.32##1.26±0.39##1.29±0.27##1.15±0.32##给药后1 h 0.08±0.21 1.90±0.27##0.26±0.45**1.58±0.42 1.58±0.50 1.98±0.45△1.60±0.41 2.08±0.39△1.80±0.26给药后2 h-0.08±0.26 1.91±0.37##-0.01±0.48**1.45±0.44*1.61±0.42 1.96±0.43△1.53±0.40 1.95±0.44△1.78±0.53给药后3 h-0.26±0.29 1.86±0.47##-0.53±0.45**1.28±0.38*1.04±0.39**1.69±0.49 1.38±0.47*1.81±0.67△1.29±0.43*给药后4 h-0.21±0.35 1.65±0.41##-0.51±0.32**1.40±0.21 0.75±0.43**1.28±0.35 1.20±0.41*△1.49±0.45 1.18±0.44*△给药后5 h-0.1±0.24 1.28±0.47##-0.61±0.49**0.85±0.26*0.59±0.49**1.20±0.37 1.13±0.45△△1.09±0.43 0.81±0.27*给药后6 h-0.16±0.28 1.36±0.39##-0.14±0.29**0.68±0.23**0.41±0.44**0.90±0.72*0.91±0.46*△0.85±0.45*0.69±0.41**
3.1.2 对干酵母致热大鼠血浆中cAMP、PGE2及下丘脑中cAMP 水平的影响 与空白组相比,模型组大鼠血浆中cAMP、PGE2及下丘脑中cAMP 水平显著升高(P<0.01或P<0.05)。与模型组相比,阿司匹林组、复方香鱼口服液高、低剂量组、鱼腥草高剂量组、三叶香茶菜高剂量组大鼠血浆及下丘脑中cAMP 水平显著降低(P<0.01 或P<0.05);阿司匹林组、复方香鱼口服液高剂量组大鼠血浆中PGE2含量显著降低(P<0.05)。同剂量组间比较,复方香鱼口服液低剂量组与三叶香茶菜低剂量组大鼠血浆中的PGE2含量差异有统计学意义(P<0.05),见表3。
表3 干酵母致热大鼠模型中复方及其单味药对大鼠血浆cAMP、PGE2及下丘脑中cAMP水平的影响Table 3 Effects of compound and its single medicine on the levels of cAMP and PGE2 in plasma,and cAMP in hypothalamus in rats with dry yeast-induced fever(±s,n=8)

表3 干酵母致热大鼠模型中复方及其单味药对大鼠血浆cAMP、PGE2及下丘脑中cAMP水平的影响Table 3 Effects of compound and its single medicine on the levels of cAMP and PGE2 in plasma,and cAMP in hypothalamus in rats with dry yeast-induced fever(±s,n=8)
与空白组比较:#P<0.05,##P<0.01;与模型组比较:*P<0.05,**P<0.01;与复方香鱼口服液同剂量组比较:△P<0.05。
组别空白组模型组阿司匹林组复方香鱼口服液低剂量组高剂量组鱼腥草低剂量组高剂量组三叶香茶菜低剂量组高剂量组c(血浆cAMP)/(nmol·L-1)34.88±3.04 40.08±1.48##36.30±3.28**37.27±1.71*36.94±1.75*37.93±1.96 37.19±2.46*38.26±2.08 36.93±3.26*ρ(血浆PGE2)/(pg·mL-1)260.04±53.68 347.22±58.55#252.71±53.28*280.23±19.04 272.60±31.02*295.63±27.45 317.76±30.35 339.15±18.60△302.51±27.87 c(下丘脑cAMP)/(nmol·L-1)33.78±2.13 49.94±5.92##36.66±4.43**39.05±3.43*38.32±4.81*42.98±2.30 38.58±4.80*40.55±8.58 38.43±2.28*
3.2 对LPS致热大鼠模型的影响
3.2.1 对LPS致热大鼠模型体温变化的影响 LPS造模后,ΔT≥0.8 ℃,与空白组比较差异有统计学意义(P<0.01),表明LPS致热大鼠模型造模成功。见表4。
表4 大鼠腹腔注射LPS后体温变化Table 4 Changes of body temperature after intraperitoneal injection of LPS in rats(±s,n=8)

表4 大鼠腹腔注射LPS后体温变化Table 4 Changes of body temperature after intraperitoneal injection of LPS in rats(±s,n=8)
与空白组比较:##P<0.01。
组别空白组模型组阿司匹林组复方香鱼口服液低剂量组高剂量组鱼腥草低剂量组高剂量组三叶香茶菜低剂量组高剂量组造模后各组体温变化ΔT/℃0 h 37.18±0.09 37.33±0.25 37.36±0.31 37.31±0.35 37.44±0.24 37.44±0.23 37.60±0.26 37.38±0.35 37.43±0.42 5 h 0.01±0.04 1.04±0.33##1.01±0.38##0.93±0.18##1.04±0.32##1.05±0.37##0.95±0.30##0.96±0.26##1.03±0.38##
给药后1 h,与模型组比较,阿司匹林组的ΔT显著降低(P<0.05),其余各组均无明显差异。同剂量组间比较,鱼腥草高剂量组与三叶香茶菜高剂量组的ΔT具有显著性差异(P<0.05)。
给药后2 h,与模型组比较,阿司匹林组、复方香鱼口服液高剂量组、鱼腥草高剂量组的ΔT显著降低(P<0.01);同剂量组间比较,鱼腥草高剂量组与三叶香茶菜高剂量组的ΔT差异有统计学意义(P<0.01)。
给药后3 h,与模型组比较,阿司匹林组、复方香鱼口服液高低剂量组、鱼腥草高剂量组、三叶香茶菜高低剂量组的ΔT显著降低(P<0.01);同剂量组间比较,三叶香茶菜低剂量组与鱼腥草低剂量组的ΔT差异有统计学意义(P<0.05)。
给药后4 h,与模型组比较,阿司匹林组、复方香鱼口服液高剂量组、鱼腥草高剂量组、三叶香茶菜高剂量组的ΔT显著降低(P<0.01或P<0.05)。
结果表明,复方香鱼口服液高低剂量组、鱼腥草高剂量组、三叶香茶菜高低剂量组均对LPS 致热大鼠表现出明显的解热作用。同剂量的单味药有解热药效时,对应时间点的复方香鱼口服液也表现出一定的解热作用。见表5。
表5 复方及其单味药对LPS致热大鼠体温变化的影响Table 5 Effect of compound and its single drug on temperature changes of LPS-induced fever rats(±s,n=8)
分组同表2,与空白组比较:#P<0.05,##P<0.01;与模型组比较:*P<0.05,**P<0.01;与鱼腥草同剂量组比较:▲P<0.05,▲▲P<0.01。
组别A B C D E F G H I给药前0.01±0.04 1.04±0.33##1.01±0.38##0.93±0.18##1.04±0.32##1.05±0.37##0.95±0.30##0.96±0.26##1.03±0.38##给药后各组体温变化ΔT/℃给药后1 h 0.06±0.26 0.90±0.20##-0.23±0.73*0.85±0.46 0.66±0.38 0.68±0.44 0.21±0.65 0.74±0.58 0.86±0.51▲给药后2 h 0.15±0.45 0.80±0.45#-0.23±0.73**0.60±0.56-0.05±0.53**0.40±0.61-0.30±0.43**0.53±0.79 0.49±0.46▲▲给药后3 h-0.10±0.21 0.81±0.29##-0.20±0.46**0.23±0.53**0.15±0.31**0.61±0.25-0.03±0.27**0.21±0.53**▲0.08±0.51**给药后4 h-0.04±0.24 0.61±0.35##-0.38±0.55**0.24±0.41 0.08±0.41*0.25±0.39 0.06±0.43*0.28±0.49 0.19±0.45*
3.2.2 对LPS 致热大鼠模型中cAMP、PGE2水平的影响 与空白组相比,模型组大鼠血浆中cAMP 和下丘脑中PGE2含量显著升高(P<0.01)。与模型组相比,阿司匹林组、复方香鱼口服液高低剂量组,鱼腥草高剂量组、三叶香茶菜高低剂量组大鼠血浆中cAMP 显著降低(P<0.01 或P<0.05);阿司匹林组、复方香鱼口服液高低剂量组,鱼腥草高低剂量组、三叶香茶菜高剂量组下丘脑中PGE2显著降低(P<0.01 或P<0.05);同剂量组间比较,三叶香茶菜低剂量组与鱼腥草低剂量组大鼠血浆中的cAMP差异有统计学意义(P<0.05);三叶香茶菜与同剂量的鱼腥草组、复方香鱼口服液组下丘脑PGE2含量差异有统计学意义(P<0.01或P<0.05),见表6。
表6 LPS 致热大鼠模型中复方及其单味药对大鼠血浆cAMP及下丘脑PGE2含量的影响Table 6 Effects of compound and its single drug on plasma cAMP and PGE2 content in hypothalamus of LPSinduced fever rats (±s,n=8)
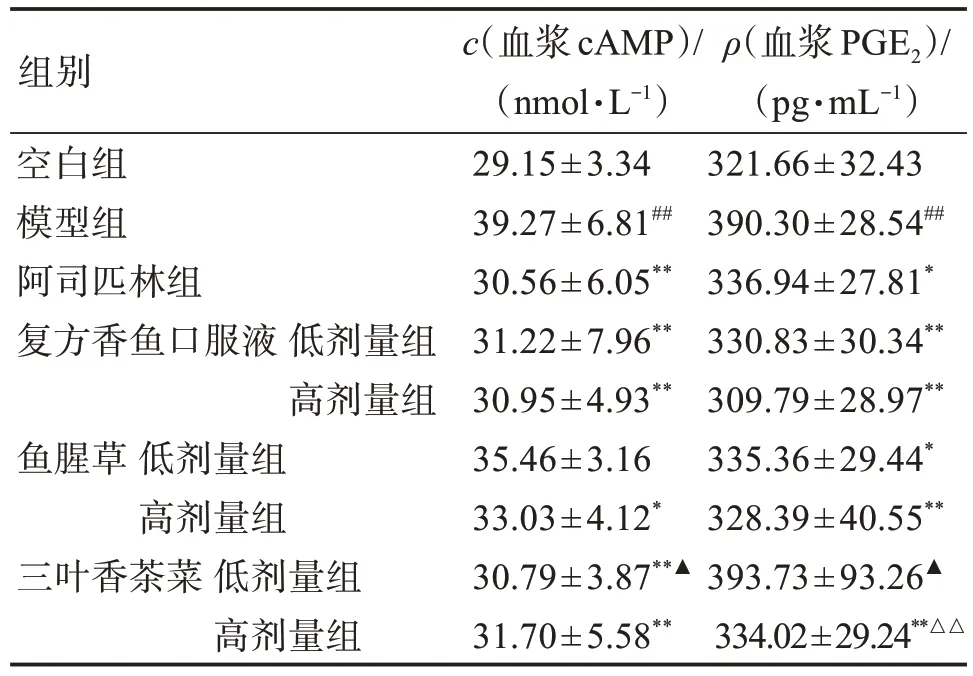
表6 LPS 致热大鼠模型中复方及其单味药对大鼠血浆cAMP及下丘脑PGE2含量的影响Table 6 Effects of compound and its single drug on plasma cAMP and PGE2 content in hypothalamus of LPSinduced fever rats (±s,n=8)
与空白组比较:##P<0.01;与模型组比较:*P<0.05,**P<0.01;与复方香鱼口服液同剂量组比较:△△P<0.01;与鱼腥草同剂量组比较:▲P<0.05。
组别空白组模型组阿司匹林组复方香鱼口服液低剂量组高剂量组鱼腥草低剂量组高剂量组三叶香茶菜低剂量组高剂量组c(血浆cAMP)/(nmol·L-1)29.15±3.34 39.27±6.81##30.56±6.05**31.22±7.96**30.95±4.93**35.46±3.16 33.03±4.12*30.79±3.87**▲31.70±5.58**ρ(血浆PGE2)/(pg·mL-1)321.66±32.43 390.30±28.54##336.94±27.81*330.83±30.34**309.79±28.97**335.36±29.44*328.39±40.55**393.73±93.26▲334.02±29.24**△△
4 讨论
外感发热的病机是外邪侵袭人体,正邪相争发生热性病证的病理过程[4]。在下丘脑体温调节中枢控制下,正常机体的产热与散热保持动态平衡,以维持体温稳定,当机体受致热原作用时,动态平衡被破坏导致发热[5-6]。该发热机制主要表现为外源性致热原(exogenous pyrogen)进入机体,刺激相应细胞产生内源性致热原(EP),作用于下丘脑内皮细胞,产生中枢介质使体温调定点失调,体温调节中枢对产热与散热重新调整,使体温在新的调定点达到平衡[7-10]。机体升温的同时,体温负调节中枢也被启动,产生负调节介质抑制体温升高,与正调节介质的致热作用综合决定体温调定点。因此,当机体出现热证时,可以通过减少正调节介质或升高负调节介质,使截断体温调节点上移,从而发挥解热作用[11]。
PGE2和cAMP 均是与发热相关的中枢介质,为体温正调节介质[12-14]。PGE2是一种前列腺素(PG),为花生四烯酸环氧合酶代谢产物,属于二十碳不饱和脂肪酸[15-16]。PGE2容易通过血脑屏障,与下丘脑温度敏感神经的PGE2受体相互作用,提高细胞内cAMP 使调定点升高[17-19]。PGE2作为致热物质之一,能够引起体温上升,而清热药通过降低环氧合酶的活性以抑制PG 的合成,使体温降低[20]。cAMP作为细胞中一种重要的第二信使,其含量变化与机体体温呈正相关[21]。当机体处于病理状态下时,内源性致热原诱发PGE2、cAMP 含量升高,促使体温调定点上移,引起发热[22-23]。因此,通过对cAMP、PGE2的含量进行测定可初步判断其解热机制。
三叶香茶菜味辛苦,性凉。鱼腥草味辛性,微寒。两药配伍合用,共奏辛凉解表、清热解毒之功,符合解表法及清热法的中药性味,且功效符合治疗准则。由三叶香茶菜和鱼腥草配伍而成的复方香鱼口服液的处方组成符合中药配伍原则,在辛凉解表、清热解毒的基础上增强了解表宣肺、清肺化痰之功,该疗效亦对应治疗外感发热。本研究根据复方鱼香口服液的功效和主治对其解热作用进行初步研究,并探讨鱼腥草和三叶香茶菜配伍前后的解热药效差异,在干酵母致热实验研究中,复方香鱼口服液及其单味药均能显著降低干酵母致热大鼠的体温差值,表现出明显的解热作用,且给药后4~6 h,灌服复方香鱼口服液后的大鼠体温变化与灌服单味药后的大鼠体温变化有显著性差异;且复方香鱼口服液高低剂量组、单味药高剂量组血浆和下丘脑中cAMP,复方香鱼口服液高剂量组血浆PGE2水平明显低于模型组,说明复方香鱼口服液对干酵母致热大鼠模型具有明显的解热效果,且单味药配伍后所得的复方,其辛凉解表、清热解毒功效得以增强。在LPS 致热实验研究中,复方香鱼口服液高低剂量组、鱼腥草高剂量组、三叶香茶菜高低剂量组与模型组比较均表现出明显的解热作用,且解热作用与剂量呈现一定的量效关系,且复方香鱼口服液高低剂量组血浆cAMP 和下丘脑PGE2水平较模型组显著降低,对其的改善作用优于单味药。两个实验模型研究结果均说明每个时间节点单味药所表现出的解热作用均能在复方中得以体现,且同剂量下,其配伍后得到的复方香鱼口服液在同一时间节点能表现出明显的解热效果。
综上所述,复方香鱼口服液有一定的解热作用,初步判断其作用机制可能与抑制cAMP、PGE2的合成,促使截断体温调节点上移有关。本实验为复方香鱼口服液的解热作用提供了药效研究基础,并对其配伍原理进行了初步论证,后期可在此基础上对复方香鱼口服液不同组分的解热作用或有效成分进一步研究,为临床应用提供依据。
