H2O2浸种对盐胁迫下紫花苜蓿种子萌发和幼苗生长的影响
2023-10-21陆姣云田宏张鹤山熊军波刘洋王振南
陆姣云,田宏,张鹤山,熊军波,刘洋*,王振南
(1. 动物胚胎工程及分子育种湖北省重点实验室,湖北省农业科学院畜牧兽医研究所,湖北 武汉 430064;2. 临沂大学农林科学学院,山东 临沂 276000)
盐胁迫是自然界中影响植物正常生长发育的主要非生物胁迫之一,目前全球范围内有20%的耕地和33%的灌溉农田受到土壤盐渍化的影响[1]。种子萌发及幼苗生长是植物生命周期的开始阶段,盐胁迫会使种子活力受到严重的影响[2-3]。盐胁迫一定程度上会影响植物细胞的正常代谢过程,增加渗透胁迫,对植物种子的萌发及一些生理生化指标产生明显抑制作用[4-5]。植物通过感受刺激和信号转导启动各种生理生化反应,积累各种有机渗透调节物质,提高酶活性及植物抗盐性,来维持渗透平衡,保护细胞结构,提高自身对盐胁迫的耐受性[6-8]。因此,揭示盐胁迫影响植物种子萌发的机制是目前研究的热点[9]。
过氧化氢(H2O2)作为植物体内的一种活性氧,是生物细胞应答逆境胁迫的重要信号分子,广泛参与植物多种生命活动过程及对各种非生物逆境胁迫的应答过程[5,10-11]。过氧化氢通过提高植物渗透物质含量,改善植物生理特性,来缓解盐胁迫对植物生长的危害[12]。近年来,外源H2O2对盐胁迫下植物种子萌发、幼苗生长及抗盐性影响的研究也日益增多。然而,H2O2对植物的抗性反应表现为保护和毒害双重作用,低浓度的H2O2会促进盐胁迫下植物抗氧化酶活性、脯氨酸含量、幼苗长度、干物质量等增加,降低细胞膜质过氧化程度,诱导植物对盐胁迫产生抗性反应,提高植物抗逆性;而高浓度H2O2会加速细胞的氧化损伤和细胞壁结构蛋白交联,甚至诱导程序性死亡[13-15]。
盐胁迫通过破坏渗透调节和离子平衡,造成作物活性氧积累和生长抑制[16]。一般来说,适宜浓度的外源H2O2可以通过调控抗氧化系统活性来减轻盐胁迫诱导的氧化伤害[17]。有研究表明,盐胁迫下H2O2浸种通过提高抗氧化酶活性和渗透调节物质含量,降低活性氧的积累及膜脂过氧化,来缓解NaCl 胁迫对小白菜(Brassica campestris)幼苗细胞的伤害,促进NaCl 胁迫下小白菜种子的萌发和幼苗生长[13]。适宜浓度的H2O2预处理能够明显提高盐胁迫下小麦(Triticum aestivum)幼苗中超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)及抗坏血酸过氧化物酶(ascorbate peroxidase,APX)的活性[18];提高绿豆(Vigna radiata)幼苗体内的抗坏血酸和谷胱甘肽含量,降低丙二醛(malondialdehyde,MDA)含量和超氧阴离子产生速率,提高植株的耐盐性[19]。可溶性糖和脯氨酸等是细胞重要的渗透溶质,其积累量与渗透胁迫强度密切相关[20],外源H2O2能够通过介导可溶性糖和脯氨酸积累,增强燕麦(Avena sativa)渗透调节能力,提高其耐盐性[17]。另外,也有研究表明,土壤盐渍化会造成苜蓿(Medicago sativa)出苗不齐或者幼苗长势较弱[5],盐胁迫会抑制苜蓿正常的光合作用及生长发育[21]。因此,研究外源H2O2对不同浓度盐胁迫下苜蓿的生长及抗氧化酶活性的影响,对提高苜蓿在盐碱地的适应性意义重大。基于此,本研究以阿尔冈金紫花苜蓿种子为研究对象,探究H2O2浸种处理对不同浓度盐胁迫下苜蓿种子萌发、幼苗生长及生理特性的影响,旨在为提高紫花苜蓿耐盐性提供理论依据。
1 材料与方法
1.1 试验材料
选用阿尔冈金紫花苜蓿种子为供试材料,种子购于济南市天桥区澳荷畜牧良种销售中心。
1.2 试验方法
试验于2020 年12 月-2021 年3 月在湖北省农业科学院畜牧兽医研究所动物胚胎工程及分子育种湖北省重点实验室进行。选取饱满完整的紫花苜蓿种子,用0.1%的KMnO4溶液消毒20 min,然后用清水冲洗干净。将所有种子分3 份,分别用0(蒸馏水)、5、100 μmol·L-1的H2O2溶液浸种12 h。选用直径10 cm 的培养皿,每皿铺放2层定性滤纸,用蒸馏水浸湿后每皿放入100 粒完好的种子,将不同H2O2浓度处理的种子各放入24 个培养皿,共72个培养皿。设置不同的盐浓度(0、0.6%、1.2%和1.8%的NaCl 溶液),每个浓度设6 个重复(6 个培养皿),每个培养皿内加4 mL 对应浓度的NaCl 溶液。将所有处理好的培养皿置于温度为25 ℃,光照为光16 h/暗8 h 的人工气候箱中培养。连续7 d 统计每天的发芽数,用于计算种子萌发相关指标,并在第7 天结束时,每个处理随机选取3 份全株幼苗,每份约0.5 g(鲜重),用于测定相关生理指标。
1.3 测定指标与方法
1.3.1 种子萌发相关指标 以胚芽长度与种子等长,胚根长度为种子长度2 倍作为种子萌发标准,于发芽试验第1 天起,统计每天的种子发芽数,并计算种子发芽率、发芽势、发芽指数和活力指数。公式如下:
式中:Dt为发芽试验的第t天,Gt为第t天的种子发芽数,GI 为发芽指数。
于发芽第7 天在每个处理中选取5 个培养皿,每皿随机选取6 株幼苗,用直尺测量幼苗长度、根长度。每个处理随机选取3 个培养皿,每皿随机选取10 株幼苗,用1/10000 天平分别称量苗鲜重和根鲜重;将称量完鲜重的苗和根置于105 ℃烘箱杀青10 min,后于65 ℃烘干24 h 至恒重,称苗干重和根干重,并计算全株鲜、干重,进而计算各部分的绝对含水量。
1.3.2 生理指标测定 采用氮蓝四唑光还原法测定超氧化物歧化酶活性[22];采用过氧化氢-碘量法测定过氧化氢酶活性[22];采用愈创木酚法测定过氧化物酶活性[22];采用硫代巴比妥酸氧化比色法测定丙二醛含量[22];采用磺基水杨酸法测定脯氨酸含量[23];采用蒽酮法测定可溶性糖含量[23];采用考马斯亮蓝法测定可溶性蛋白含量[23]。
1.4 数据统计与分析
采用Excel 2010 进行所有数据的录入及作图,数据用平均值±标准差表示,用SPSS 22.0 进行处理间单因素与双因素差异性统计分析。
2 结果与分析
2.1 外源H2O2对NaCl 胁迫下紫花苜蓿种子萌发的影响
综合分析发现,盐胁迫、H2O2及其二者交互作用对苜蓿种子发芽势、发芽指数和活力指数具有显著影响(P<0.001);盐胁迫、H2O2对种子发芽率有显著影响,但二者交互作用对发芽率无显著影响(P>0.05)(表1)。
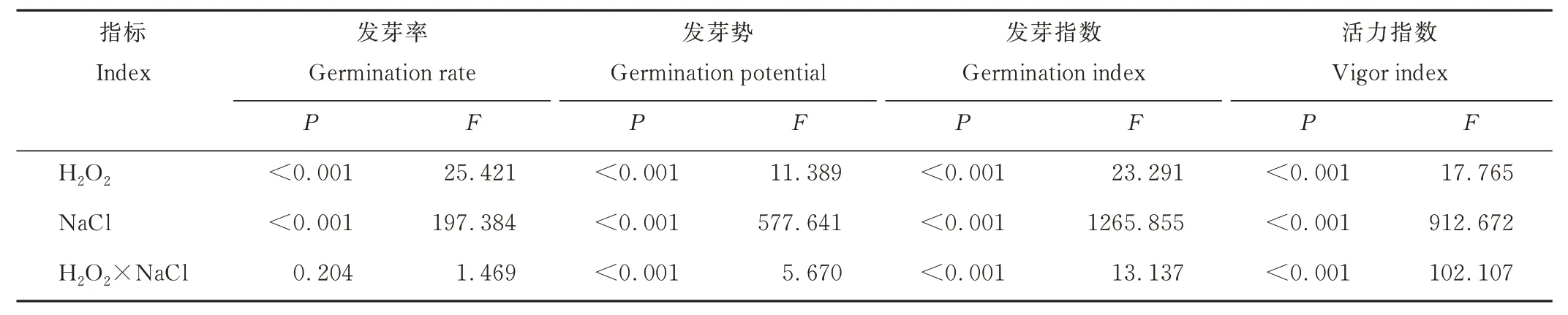
表1 H2O2、NaCl 及其交互作用对紫花苜蓿种子萌发的影响Table 1 Effect of H2O2,NaCl and their interaction on seed germination of alfalfa
随着盐浓度的增加,紫花苜蓿种子的发芽率、发芽势、发芽指数和活力指数均呈逐渐降低的趋势(图1)。100 μmol·L-1H2O2浸种处理下,0.6%盐胁迫下的种子发芽率、发芽势和活力指数均高于无盐胁迫处理。当盐胁迫浓度大于0.6%时,各萌发指标均显著降低(P<0.05)。1.8%盐胁迫下,种子发芽率低于50%,发芽势低于20%。
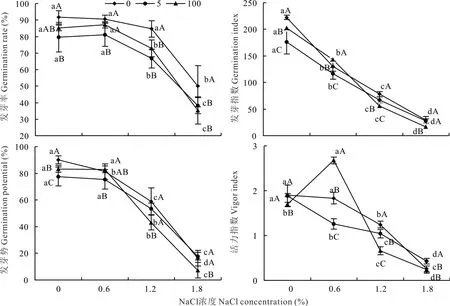
图1 外源H2O2对NaCl 胁迫下紫花苜蓿种子萌发的影响Fig.1 Effect of H2O2 immersion on seed germination of alfalfa under salt stress
H2O2浸种的种子发芽率及大部分H2O2浸种的种子发芽势、发芽指数和活力指数低于蒸馏水浸种处理(图1)。0.6%盐胁迫下,100 μmol·L-1H2O2浸种的种子发芽势、发芽指数和活力指数显著高于蒸馏水和5 μmol·L-1H2O2浸种(P<0.05)。1.8%盐胁迫下,5 μmol·L-1H2O2浸种的种子发芽势、发芽指数和活力指数均高于蒸馏水和100 μmol·L-1H2O2浸种。
2.2 外源H2O2对NaCl 胁迫下紫花苜蓿幼苗生物量的影响
除盐胁迫对根的绝对含水量影响不显著外,盐胁迫、H2O2浸种及其二者交互作用均显著影响紫花苜蓿幼苗、根及整株的鲜重、干重、绝对含水量和根冠比(P<0.01)(表2)。
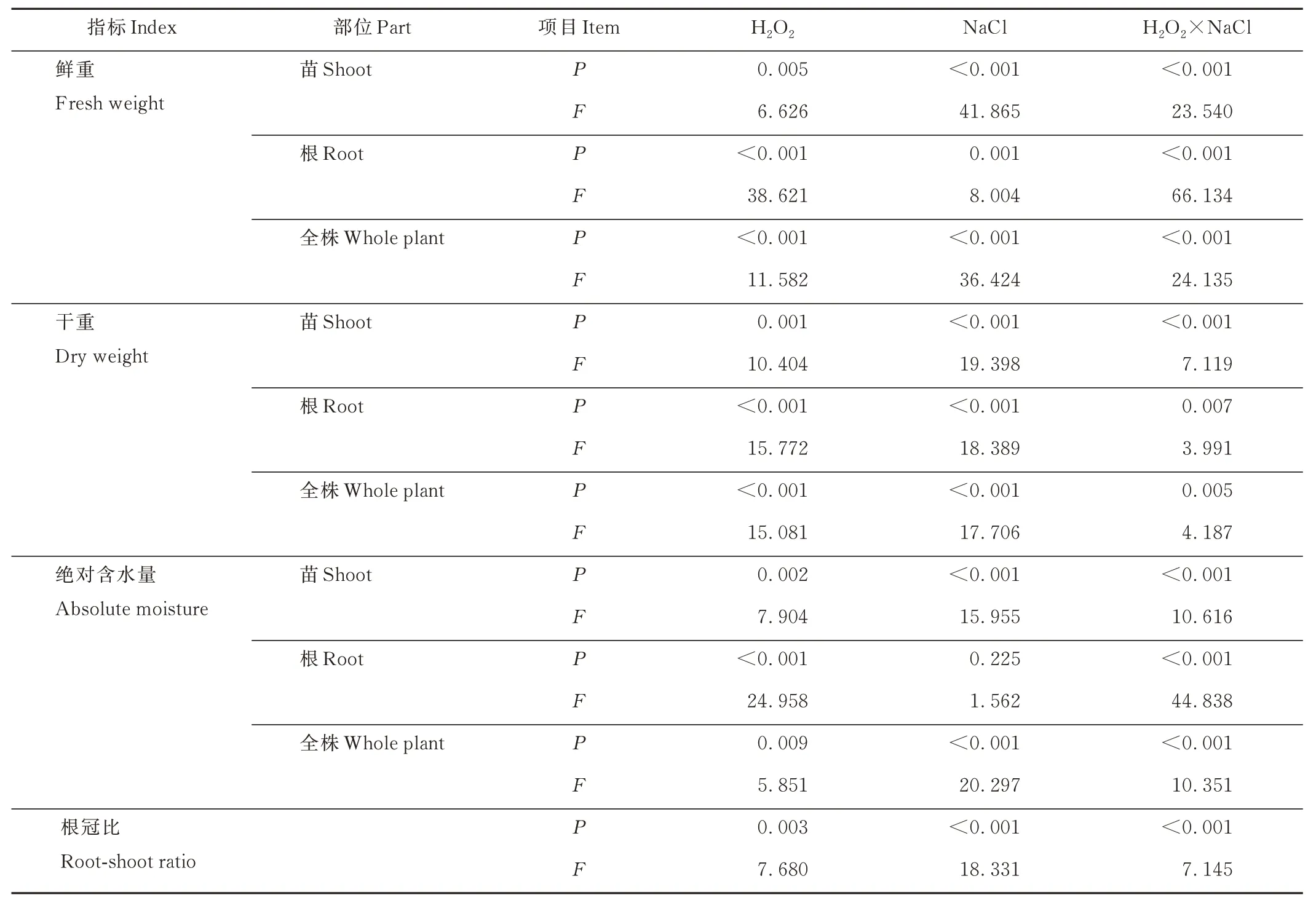
表2 H2O2、NaCl 及其交互作用对紫花苜蓿幼苗生物量、含水量和根冠比的影响Table 2 Effect of H2O2,NaCl and their interaction on seedling biomass,moisture and root-shoot ratio of alfalfa
不同盐胁迫、H2O2浸种处理下苜蓿幼苗的鲜重、干重、绝对含水量及根冠比变化不一致(表3)。盐胁迫处理下紫花苜蓿苗和全株鲜重均高于无盐胁迫处理,各浸种(蒸馏水、5、100 μmol·L-1H2O2)处理下分别在1.2%、1.8%和0.6%盐胁迫下达到最大。根鲜重在蒸馏水浸种处理下随着盐胁迫的加重逐渐减小,在5 μmol·L-1H2O2浸种处理下随着盐胁迫的加重先减小后增大,在100 μmol·L-1H2O2浸种处理下随着盐胁迫的加重先增大后减小。在各浸种处理下,紫花苜蓿苗干重均随盐胁迫的加剧而先增后减,根干重随盐胁迫的加剧逐渐减小。全株干重在蒸馏水和100 μmol·L-1H2O2浸种处理下随盐胁迫的加剧先增后减,且在100 μmol·L-1H2O2浸种下,0.6%盐胁迫处理显著高于无盐胁迫处理(P<0.05);在5 μmol·L-1H2O2浸种处理下,随盐胁迫的加剧逐渐减小。绝对含水量的变化与苜蓿幼苗鲜重的变化趋势一致。除蒸馏水浸种的1.2%盐胁迫处理外,苜蓿幼苗的根冠比均表现为盐胁迫处理显著低于无盐胁迫处理。
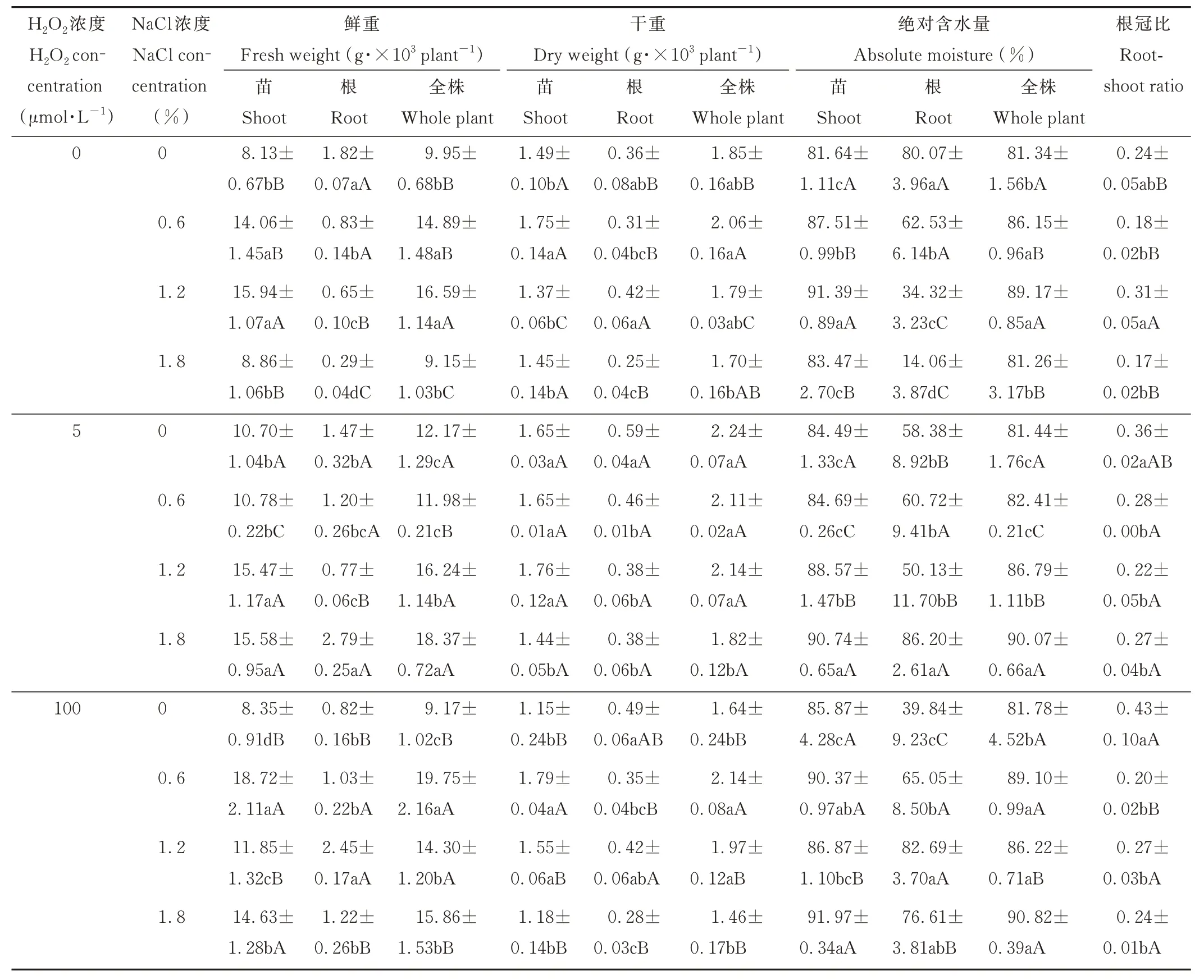
表3 外源H2O2对NaCl 胁迫下紫花苜蓿幼苗生物量、含水量和根冠比的影响Table 3 Effect of H2O2 immersion on seedling biomass,moisture and root-shoot ratio of alfalfa under salt stress
整体而言,苗、根和全株的鲜重表现为5 μmol·L-1H2O2浸种处理下最高,100 μmol·L-1H2O2浸种下次之,蒸馏水浸种下最低(表3)。苗、根和全株干重均在5 μmol·L-1H2O2浸种处理下高于100 μmol·L-1H2O2和蒸馏水浸种处理。无盐胁迫时,根绝对含水量在蒸馏水浸种处理下显著高于H2O2浸种处理;随盐胁迫加重,根绝对含水量在H2O2浸种处理下显著高于蒸馏水浸种处理(P<0.05)。苗和全株的绝对含水量在不同盐胁迫处理下对浸种的响应不一致。苜蓿幼苗根冠比表现为5 μmol·L-1H2O2浸种处理下最高,100 μmol·L-1H2O2浸种下次之,蒸馏水浸种下最低。
2.3 外源H2O2对NaCl 胁迫下紫花苜蓿幼苗抗氧化酶活性的影响
盐胁迫、H2O2浸种及其二者交互作用对SOD、POD、CAT 活性和丙二醛含量均有显著影响(P<0.05)(表4)。蒸馏水浸种处理下,SOD 活性随着盐胁迫浓度的增大而增大;5 和100 μmol·L-1H2O2浸种处理下,SOD 随着盐胁迫浓度的增大先降低后增大,1.2%盐胁迫显著低于无盐胁迫(P<0.05)(图2)。蒸馏水和100 μmol·L-1H2O2浸种处理下,CAT 随盐胁迫浓度的增大先增后减,0.6% 和1.2% 盐胁迫显著高于无盐胁迫;5 μmol·L-1H2O2浸种处理下,CAT 随盐胁迫浓度的增大而增大。蒸馏水和H2O2浸种处理下,POD 表现为盐胁迫低于无盐胁迫;蒸馏水浸种处理下,随盐胁迫浓度的递增,苜蓿幼苗的丙二醛含量先增后减,0.6%盐胁迫显著高于无盐胁迫;在5 和100 μmol·L-1H2O2浸种处理下,盐胁迫下的丙二醛含量均低于无盐胁迫,1.2%盐胁迫显著低于无盐胁迫(P<0.05)。
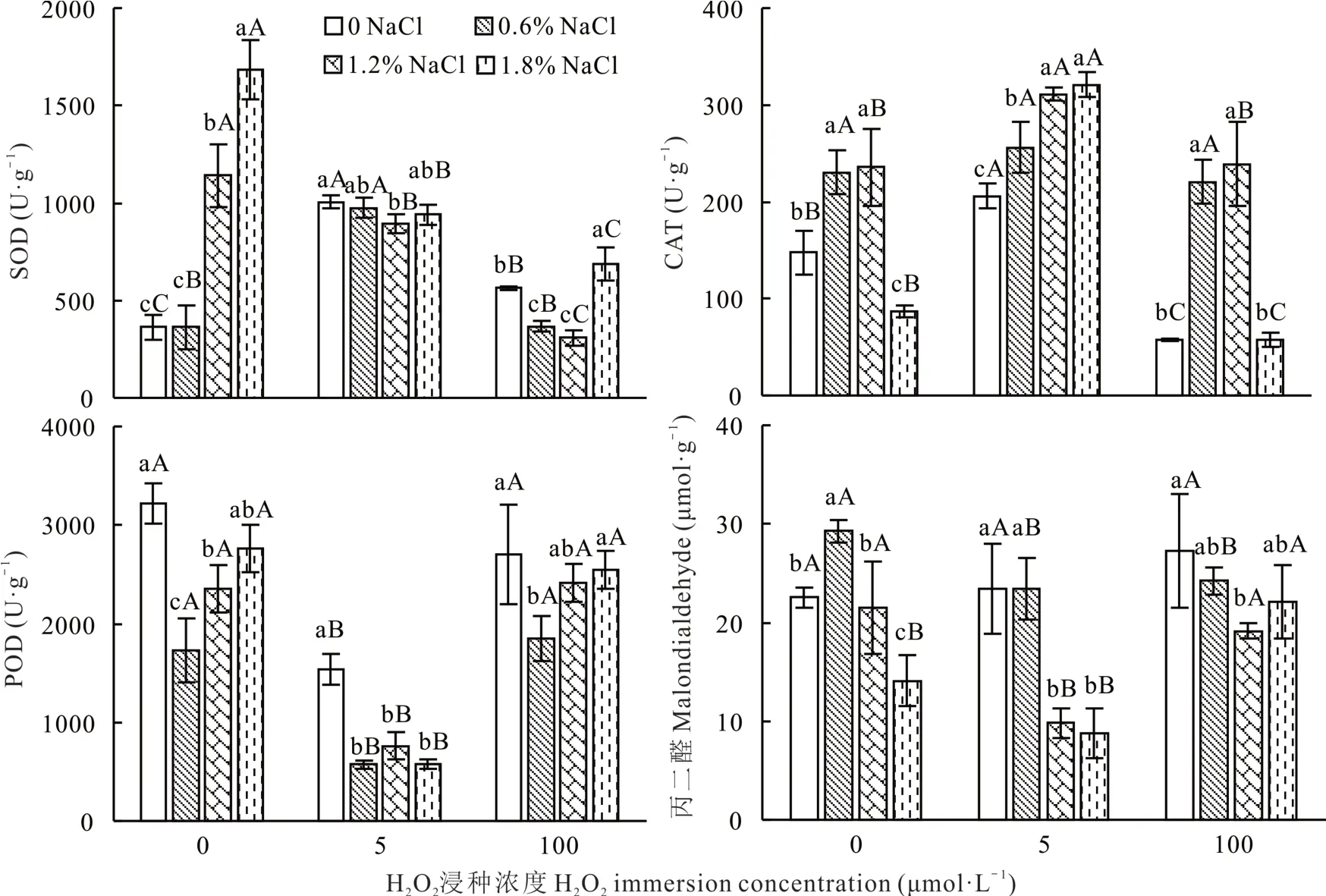
图2 H2O2和NaCl 处理对紫花苜蓿幼苗抗氧化酶活性的影响Fig.2 Effect of H2O2 immersion on seedling autioxidant enzyme activities of alfalfa under salt stress
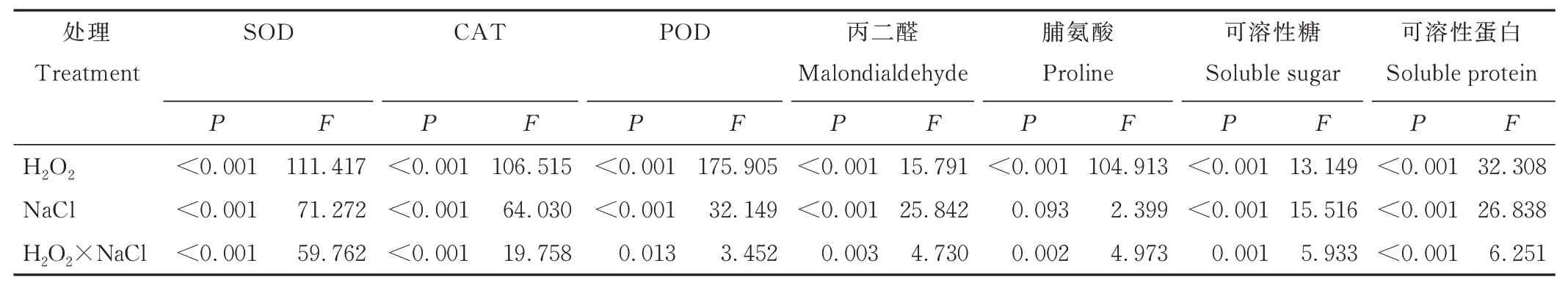
表4 H2O2、NaCl 及其交互作用对紫花苜蓿幼苗抗氧化酶活性及渗透调节物质的影响Table 4 Effect of H2O2,NaCl and their interaction on seedling antioxidant enzyme activity and osmotic regulator of alfalfa
无盐和0.6%盐胁迫下,苜蓿幼苗SOD 表现为蒸馏水浸种处理显著低于5 μmol·L-1H2O2浸种处理;1.2%和1.8%盐胁迫下,H2O2浸种处理下的SOD 显著低于蒸馏水浸种;各盐胁迫浓度下,5 μmol·L-1H2O2浸种的幼苗SOD 均显著高于100 μmol·L-1H2O2浸种(P<0.05)(图2)。除0.6%盐胁迫外,其他各盐胁迫下,苜蓿幼苗CAT活性在5 μmol·L-1H2O2浸种处理下显著高于蒸馏水和100 μmol·L-1H2O2浸种处理(P<0.05)。与之相反,各盐胁迫下,POD 在5 μmol·L-1H2O2浸种处理下显著低于蒸馏水和100 μmol·L-1H2O2浸种处理(P<0.05)。1.2%盐胁迫下,5 μmol·L-1H2O2浸种显著降低了幼苗丙二醛含量;1.8%盐胁迫下,5 μmol·L-1H2O2浸种降低而100 μmol·L-1H2O2浸种显著增大了幼苗的丙二醛含量(P<0.05)。
2.4 外源H2O2对NaCl 胁迫下紫花苜蓿幼苗渗透调节物质含量的影响
盐胁迫、H2O2浸种及其二者交互作用对可溶性糖和可溶性蛋白有显著影响,H2O2浸种及盐胁迫和H2O2浸种交互作用对脯氨酸的影响显著(P<0.01)(表4)。蒸馏水和100 μmol·L-1H2O2浸种处理下,脯氨酸含量随盐胁迫浓度的增加先减后增,1.2%盐胁迫显著低于无盐胁迫;5 μmol·L-1H2O2浸种处理下,盐胁迫降低了幼苗的脯氨酸含量,且随盐胁迫浓度的递增脯氨酸含量逐渐减小(图3)。可溶性糖含量在各浸种处理下均表现为随着盐胁迫浓度的增加而降低,与之相反,可溶性蛋白含量随盐胁迫浓度的增加而增大。

图3 H2O2和NaCl 处理对紫花苜蓿幼苗渗透调节物质含量的影响Fig. 3 Effect of H2O2 immersion on seedling osmotic adjustment substances of alfalfa under salt stress
在不同浓度盐处理下,脯氨酸含量在5 μmol·L-1H2O2浸种处理下显著高于蒸馏水和100 μmol·L-1H2O2浸种处理。在无盐、0.6%和1.2%盐胁迫下,可溶性糖含量随H2O2浸种浓度的递增逐渐减小,H2O2浸种处理显著低于蒸馏水浸种;在1.8%盐胁迫下,可溶性糖含量随浸种浓度的递增变化不大(图3)。无盐胁迫下,可溶性蛋白随H2O2浸种浓度的递增先增后减,5 μmol·L-1H2O2浸种处理下显著高于蒸馏水和100 μmol·L-1H2O2浸种处理;0.6% 和1.2% 盐胁迫下,100 μmol·L-1H2O2浸种显著低于蒸馏水和5 μmol·L-1H2O2浸种;1.8%盐胁迫下,各浸种处理间无显著差异。
3 讨论
3.1 H2O2浸种与盐胁迫对紫花苜蓿种子萌发的影响
盐胁迫是当今制约植物生产的重要环境问题,种子萌发是植物生命周期开始的阶段,种子活力受盐胁迫的显著影响[2,13]。宋莉璐等[24]研究表明盐浓度越高对苜蓿的胁迫力越强,当盐浓度达到1.8%时,完全抑制种子萌发。与之相似,本研究发现,盐胁迫对种子的萌发有明显的抑制作用,且随着胁迫浓度的增加抑制作用越强,1.8%NaCl 胁迫下,苜蓿种子的发芽率、发芽势、发芽指数和活力指数均显著降低。说明盐胁迫对苜蓿的生命力和出苗速度均有不良影响。这主要是因为盐胁迫通过使植物的细胞活性氧代谢失衡、生物大分子损伤,并抑制植物的光合和呼吸代谢等,直接或间接影响植物的代谢活动,从而影响植物的生长发育[13-14,25]。本研究中,100 μmol·L-1H2O2浸种后的发芽势、发芽指数和活力指数在0.6%盐胁迫下显著高于蒸馏水浸种,5 μmol·L-1H2O2浸种后的发芽势、发芽指数和活力指数在1.8%盐胁迫下高于蒸馏水浸种。说明在低盐胁迫下高浓度H2O2浸种可有效缓解盐胁迫对苜蓿种子萌发产生的伤害。朱利君等[26]研究发现,H2O2在缓解植物抗盐胁迫方面表现出“低浓度促进,高浓度抑制”的效应。与之不同,本研究中H2O2浸种相比于蒸馏水浸种均有缓解盐胁迫对种子萌发产生的伤害,可能是因为种类和盐胁迫浓度的不同,植物缓解盐胁迫的最适H2O2浓度也不同[13]。而H2O2浸种后的苜蓿种子发芽率、发芽势、发芽指数和活力指数均低于蒸馏水浸种。这主要是因为H2O2具有双重作用,一方面,其作为信号分子参与胁迫应答;另一方面,它的大量积累对植物细胞造成了伤害[27]。
3.2 H2O2浸种与盐胁迫对紫花苜蓿幼苗生长的影响
生长抑制是盐胁迫对植物最直观和最显著的影响,生物量是植物响应盐胁迫的综合反映,也是耐盐性的直接指标[17,28]。殷丽娟等[29]研究发现,当盐碱强度达到一定值后,盐碱强度越高,对野生大麦(Hordeum vulgare)幼苗植株鲜重的抑制作用越强。而李源[30]的研究发现,植株不同部位生长受到抑制作用不同,地上部分较根部受到抑制明显。本研究中,随盐胁迫浓度增加,其对苗和全株鲜重、绝对含水量的影响表现为先增后减的趋势,但对苜蓿幼苗根鲜重和绝对含水量的抑制作用逐渐增强,且根部较苗受抑制更加明显。这主要是因为:一方面盐胁迫诱导植物体内产生大量活性氧,低盐胁迫刺激植物启动抗氧化防御系统及时清除活性氧,保护细胞膜结构,但盐浓度过高时,植物体内多余的氧自由基积累造成生物膜受损,从而影响植物生长[30]。另一方面,盐胁迫下,最先感受胁迫信号的是植物根系,根部也是最直接的受害部位,根系生长受到抑制后会影响水分和养分的吸收运输,直接或间接地影响植物其他器官的生长发育[28],因而根系对盐胁迫的响应更加明显。刘建新等[31]研究发现燕麦(Avena sativa)幼苗在盐胁迫下植株干重明显降低。而本研究中,盐胁迫对苜蓿幼苗干重的抑制作用较鲜重小。冯玉龙[32]研究发现,喷施H2O2能够提高盐胁迫下番茄(Solanum lycopersicum)幼苗根系活力,促进植株生长,增加生物量积累。与之相似,本研究中,H2O2浸种提高了盐胁迫下苜蓿幼苗的鲜重、干重、绝对含水量和根冠比,且5 μmol·L-1H2O2浸种的提高效应更高。可能是因为适宜浓度的H2O2才能通过降低内源H2O2水平而更好地缓解盐胁迫对植物幼苗生长的抑制作用及提高幼苗的盐适应性[32]。
3.3 H2O2浸种与盐胁迫对紫花苜蓿抗氧化酶和渗透调节物质的影响
盐胁迫会抑制植物的呼吸代谢,使植物细胞内活性氧(reactive oxygen species,ROS)大量增加,造成细胞膜脂质过氧化等次生伤害。为了清除体内ROS,植物体内的抗氧化酶活性会增加,以提高植物的耐盐性[33-34]。本研究中,随盐胁迫浓度的增加,SOD 活性递增,CAT 活性和丙二醛含量先增后减,而POD 活性先减后增但均低于无盐胁迫。主要是因为在盐胁迫下,植物体内的抗氧化酶(SOD、CAT、POD 等)通过协同作用,清除过多的活性氧,来保护生物膜的完整性,使其在一定范围内耐盐[34];1.8%盐胁迫下CAT 活性显著下降,表明此时产生的活性氧超过了抗氧化系统的清除能力,植物因活性氧的代谢失调而受到伤害[31]。本研究中1.8%盐胁迫显著抑制苜蓿种子萌发和幼苗生长与其一致。
逆境胁迫下H2O2主要通过激活植物体内的细胞保护酶系统来抵御过多的ROS 对机体的伤害[35]。有研究表明,植物经H2O2预处理后,盐胁迫下其体内的抗氧化酶活性及非酶保护物质增加,有效抑制了丙二醛的积累及膜脂过氧化,从而保护植物细胞免受盐胁迫造成的氧化损伤[13,18]。本研究中,5 μmol·L-1H2O2浸种显著增加了盐胁迫下苜蓿幼苗的CAT 活性,降低了丙二醛含量,对SOD 活性的影响不一致;而100 μmol·L-1H2O2与蒸馏水浸种相比对盐胁迫下苜蓿幼苗的CAT、POD 活性及丙二醛含量影响不明显,但显著降低SOD 活性。表明H2O2能够调控盐胁迫下苜蓿幼苗的抗氧化防护系统,盐胁迫破坏了苜蓿ROS 清除的抗坏血酸-谷胱甘肽(ASA-GSH)循环系统,适宜浓度的H2O2能促进ASA-GSH 循环系统的有效运转,加强植株的ROS 清除能力,从而减轻盐胁迫诱导的氧化损伤;而高浓度的H2O2一定程度上加剧了盐胁迫的抑制作用[27,31]。
脯氨酸是一种重要的细胞渗透调节物质,具有渗透调节、蛋白质构成、保护细胞膜完整性、稳定酶和蛋白质以及清除自由基等多种生物功能[36-37]。可溶性糖既是渗透调节物质参与抗盐过程,也是植物大分子有机物合成的物质基础和能量来源,还可在细胞内无机离子浓度高时起保护酶类的作用[13,38]。可溶性蛋白有较强的持水力,其中大多数是参与代谢反应的酶类,其含量的变化与植物抗逆性密切相关[39]。本研究中,随盐胁迫的增强,可溶性蛋白含量递增,可溶性糖含量递减,脯氨酸变化不显著。主要是因为盐胁迫增加了可溶性蛋白的积累,抑制了可溶性糖的合成或加剧了可溶性糖的损耗[40],而脯氨酸在不同植物间对盐胁迫的响应没有规律,并且与植物耐盐性高低无关,从而不能作为植物耐盐性鉴定的生化指标[41]。另外,也有研究发现,盐胁迫下不同类型植物的渗透调节物质种类不同[42]。
在NaCl 胁迫下,适宜浓度的H2O2浸种处理可以进一步诱导小白菜根和芽中脯氨酸和可溶性糖含量的增加,提高细胞的渗透调节能力,从而提高小白菜幼苗的耐盐能力[13]。本研究中,5 μmol·L-1H2O2浸种提高了盐胁迫下苜蓿幼苗的脯氨酸和可溶性蛋白含量。说明5 μmol·L-1H2O2对可溶性蛋白和脯氨酸积累的促进作用可能是增强苜蓿渗透调节能力,提高耐盐性的因素之一。外源H2O2不仅能促进抗逆蛋白的表达,而且能够抑制活性氧的产生,影响蛋白酶活性的升高,从而抑制可溶性蛋白的降解[12,43-44]。100 μmol·L-1H2O2浸种降低盐胁迫下苜蓿幼苗脯氨酸、可溶性糖和可溶性蛋白含量,可能是因为盐胁迫导致苜蓿体内膜脂过氧化,体内积累过多的活性氧和H2O2,渗透调节失衡,抗盐能力减弱。而H2O2影响盐胁迫下苜蓿可溶性蛋白、可溶性糖和脯氨酸含量的分子机制还需要进一步探讨。
4 结论
1)随着NaCl 浓度的增加,苜蓿种子的发芽率、发芽势、发芽指数和活力指数均逐渐降低;苜蓿苗和全株的鲜重、干重、绝对含水量先增后减,根的鲜重、干重、绝对含水量逐渐减小;SOD 活性和可溶性蛋白含量逐渐增加,CAT 活性和丙二醛含量先增后减,POD 活性和可溶性糖含量均低于无盐胁迫。
2)H2O2浸种提高了苜蓿种子的发芽势、发芽指数和活力指数。5 μmol·L-1H2O2浸种处理下,苜蓿苗、根和全株的鲜重、干重、根冠比以及幼苗的SOD 和CAT 活性、脯氨酸和可溶性蛋白含量均高于100 μmol·L-1H2O2和蒸馏水浸种处理,而丙二醛含量为5 μmol·L-1H2O2浸种处理低于100 μmol·L-1H2O2和蒸馏水浸种处理。
3)盐胁迫抑制了苜蓿种子的萌发和幼苗生长,苜蓿通过提高自身抗氧化酶活性和渗透调节物质含量来抵御盐胁迫;H2O2浸种提高了苜蓿种子和幼苗的抗盐能力,且5 μmol·L-1H2O2浸种优于100 μmol·L-1H2O2浸种。
