人体痛风石中微塑料的定性与定量分析
2023-10-20黄育斌吕全伟
黄育斌,吕全伟
(1.汕头市龙湖区长平路153号,广东 汕头 515057;2.汕头市医学科学院,广东 汕头 515031)
微塑料(microplastics)为粒径小于5 mm 的塑料微粒,主要来源于工业生产的塑料颗粒制品和大块塑料垃圾在环境中降解形成的微塑料碎片[1-2]。作为新型全球污染物,微塑料已被证实广泛存在于空气、土壤、食物和水中[3],环境中微塑料的广泛存在增加了其通过摄入和吸入进入人体的机会。目前,包括肺、气管、胎盘、睾丸、血液、血栓、精液等多种人体部位已发现有微塑料的存在[4-5],这表明微塑料可以随着血液循环等途径分布到不同部位,并随后可能积聚在多种器官和组织中。
许多基于体外和动物实验的研究表明,微塑料可能会给人体健康带来不良影响,其中包括且不限于生殖毒性、肠道功能紊乱和炎症等[4]。2022 年,澳大利亚学者Rawle等[6]发现小鼠摄入微塑料一段时间后与长期关节炎相关,这项研究提示我们微塑料的摄入与关节炎症之间可能存在联系。
痛风作为一种受遗传、环境等多因素影响的常见代谢性关节炎,会给患者带来关节肿胀和剧烈疼痛,并常常伴随着痛风石在关节处堆积这一重要特征[7]。痛风在全球已影响约0.1%~10%的人口,在我国成人痛风患病率约占0.86%~2.20%,且呈逐年上升的趋势[8-9]。过往认为不健康的饮食搭配是导致痛风的关键风险因素[10],但是新的研究表明工业化带来的污染(如空气污染物二氧化硫)在诱发痛风中也可能起到重要作用[11]。然而,微塑料这种新型污染物是否与痛风存在联系,或者确切来说,其是否在痛风石中存在,或参与痛风石这一病理性结构的形成目前尚无报道。由于微塑料已经于空气、水,以及鱼、肉、奶、菜等多种食物中检出[12],且已知痛风又与环境、饮食搭配存在联系,那么探讨痛风石样品中是否存在微塑料,或许可以从不同角度探究痛风(痛风石)与环境因素和日常饮食的关系。本研究利用热解气相色谱/质谱(pyrolysisgas chromatography-mass spectrometry,Py-GC/MS)对不同关节痛风石样品中的微塑料进行分析鉴定,并探讨微塑料在痛风石形成中可能扮演的角色,拟为微塑料对人类健康的环境风险评估提供新的数据。
1 材料与方法
1.1 痛风石样品的收集
在这项研究中,共计收集到来自于5 名男性痛风患者(30~65岁)的5份痛风石样品。获取样品后,使用无塑化的生理盐水充分冲洗样品表面,以避免其被污染。之后,使用不锈钢手术器械分割样品,封装在玻璃瓶(0~4 °C)中并运送到第三方检测机构进行微塑料分析(上海微谱检测科技集团股份有限公司)。痛风及痛风石诊断符合《中国高尿酸血症与痛风诊疗指南(2019)》[13]。本研究已经汕头市医学科学院伦理审查委员会的批准(SMSE2023001)。
对本次5份初始样品,3份样品的一小部分被分割出来并通过傅里叶变换红外光谱仪(Fourier transform infrared spectrometer,FTIR spectrometer)检测以进一步确认样品为痛风石。此外,4份样品被分成2部分用于微塑料方面的重复检测以尽可能排除偶然所得的检测结果,1份样品因为质量有限仅够用于1次检测。因此,共计来自5名患者个体的9个样品通过Py-GC/MS进行微塑料分析。
1.2 痛风石样品的红外光谱分析
我们采用压片法对样品进行处理,即取1~2 mg样品在玛瑙研钵中研磨成细粉末,加入干燥的溴化钾粉末约100~200 mg(样品与溴化钾的比约为1∶100),研磨至混合均匀,装入压片模具内,随后使用模具真空压紧并保持1 min,取出样品并置于傅里叶变换红外光谱仪(赛默飞Nicolet iS10)固体样品架上检测。
1.3 微塑料分析前的样品预处理
基于先前文献所描述的方法[14],我们对Py-GC/MS微塑料分析方案予以修改完善。具体而言,就是将痛风石样品置于烧杯中,并按每克样品加入3 mL 硝酸的比例进行孵育。第1 次孵育在室温下持续48 h,然后第2 次孵育在110 °C 下持续1~2 h 以达到充分降解。当样品完全溶解后,加入纯水调节pH值至1~2 h供进一步分析。
1.4 Py-GC/MS微塑料分析
在本研究中,通过热解(PY-3030D Frontier) 与气相色谱联用检测样品中微塑料,即聚苯乙烯(polystyrene,PS)、聚乙烯(polyethylene,PE)、聚丙烯(polypropylene,PP)、聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)、聚氯乙烯(polyvinyl chloride,PVC)、聚碳酸酯(polycarbonate,PC)、聚己内酰胺(polyamide,PA6)、聚己二酰己二胺(polyadiohexylenediamine,PA66)、聚乳酸(polylactic acid,PLA)、聚己二酸对苯二甲酸丁二醇酯[poly(butylene adipate-coterephthalate),PBATResults 使用的色谱柱(Rtx-5MS)参数为长30 m、内径0.25 mm和膜厚0.25 μm。具体设置如下:30 min 程序实现色谱分离,其中40 ℃保持2 min,然后以每分钟20 ℃的速率升温至320 ℃并保持14 min。离子源温度设置为230 °C。氦气用作载气,分流比为5∶1。扫描范围为质荷比(m/Q) 29~600。
1.5 质量保证和质量控制
为避免外界污染干扰造成误差,并且确保采集数据的可靠性,实验过程中,包括样本采集、储运、加工、分析在内等环节均遵循无塑化原则。对采样和测试过程中可能的污染点、设置程序和实验室进行了严格的质量控制,包括尽可能增加重复次数以排除偶然性的检出结果。操作过程中,我们采用不锈钢器械分离痛风石,随后用玻璃容器储存和运输。考虑到样品采集、储存或运输过程中周围环境中的微塑料有可能进入玻璃容器,因此我们设置了对照试验,并选择超纯无菌水作为空白对照实验材料来监测可能存在的环境中的微塑料污染。在处理和分析过程中,检测人员穿着棉质实验室外套和丁腈手套,整个过程在通风橱中进行。此外,所有使用的玻璃装置均用明火烧灼,试剂通过带有聚四氟乙烯膜(0.45 μm)的玻璃装置泵送3 次,以排除可能存在的背景污染。在对照实验中,具体而言就是使用玻璃滴管将过滤后的超纯水装入玻璃瓶中,玻璃瓶盖上盖后并放在实验室搅拌器上过夜,其后,作为空白对照的超纯水与测试样品一起进行所有样品处理步骤。结果表示在质量控制空白对照中未发现微塑料。
2 结果
2.1 患者基本信息及样品的傅里叶红外光谱分析
在本项研究中痛风石样品来自5 名痛风患者的不同关节。本项研究涉及的5 名患者均为男性,年龄区间位于30~65 岁,其中4 名患者的痛风患病时长为2~10 年,1 名时长未知。样品取出的关节包括:肩关节、足部跖趾关节、食指关节及膝关节。患者有关情况详见表1。术前临床医生除了通过MRI、CT 等影像手段在临床上判定样品为痛风石之外,样品取出后我们使用FTIR仪对样品进行红外光谱测定,同时用尿酸钠标准品作对照。结果发现,样品和尿酸钠标准品图谱高度拟合,从而进一步确认样品为痛风石,图谱对比见图1。
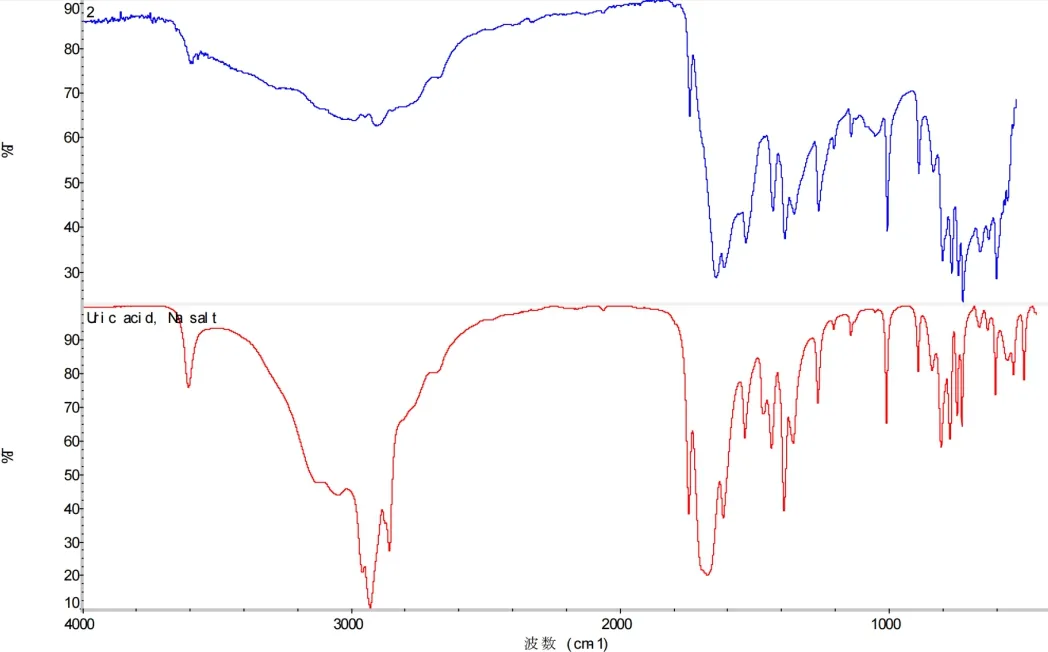
图1 样品与尿酸钠标准品匹配图

表1 患者基本情况
2.2 Py-GC/MS检测中的阴性对照设置
在对痛风石样品进行微塑料检测分析前,为了确保检出结果非有关器械或玻璃瓶中混有塑料成分而带来的假阳性结果,实验中设置了阴性对照。将镊子等不锈钢器械置于玻璃瓶中,加入纯水剧烈搅动并静置过夜,之后将所得液体全部通过同样程序的微塑料检测分析,结果显示除微量的PA66 被检出外(平均检出量为0.035 9 mg/kg,远低于痛风石样品中的检出量313.912 mg/kg),无其余微塑料检出,表明痛风石样品中的微塑料非有关器械或玻璃瓶接触污染所得。阴性对照检测结果见图2。此外,为了确保检出结果并非Py-GC/MS 仪器检测时带来的假阳性结果,每次于样品检测前,均进行空白检测,均未检出微塑料。上样前空白检测结果见图3。通过上述的阴性对照来确保检出的结果可信,而非污染所得。
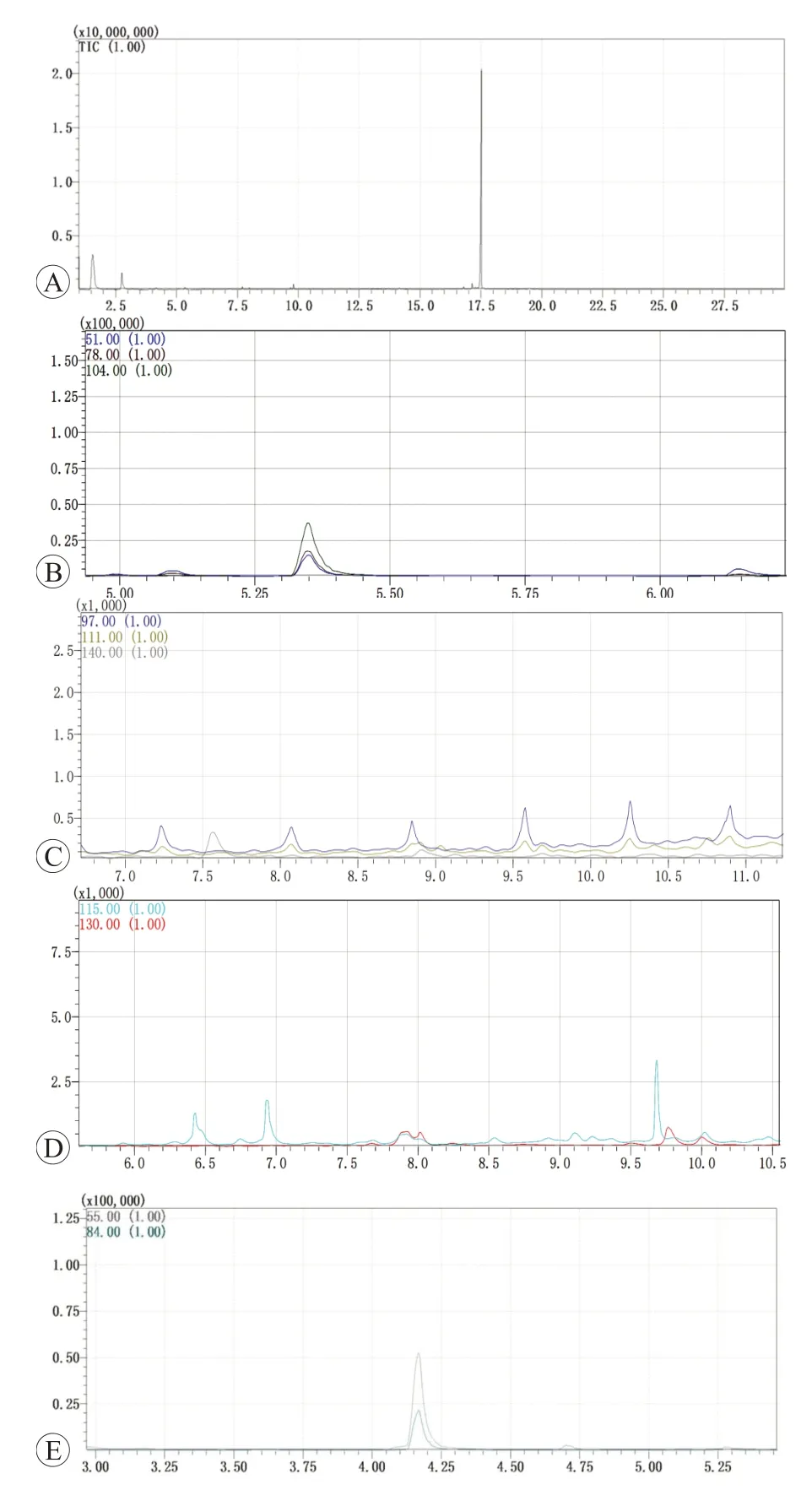
图2 阴性对照的Py-GC/MS微塑料分析结果

图3 上样前空白仪器的Py-GC/MS微塑料分析结果(无微塑料检出)
2.3 痛风石样品的Py-GC/MS微塑料检测分析
Py-GC/MS微塑料检测分析的结果显示,5名患者中4 名患者的痛风石样品中共检出4 种微塑料(PS、PE、PVC、PA66)。部分样品谱图见图4、图5。痛风石中微塑料检出率为80%。此外,因5 名患者的痛风石样品共分为9份,且其中8份检出微塑料,故在9份样品中微塑料检出率为88.89%。检出后,根据峰面积计算对应的含量,结果3 名患者的5 份样品里检出PS,平均含量为20.300 mg/kg;3名患者的5份样品里检出PE,平均含量为115.157 mg/kg;1 名患者的2 份样品里检出PVC,平均含量为95.6247 mg/kg;1 名患者的1份样品中检出PA66,含量为313.912 mg/kg。柱状图见图6,样品微塑料检出情况见表2。
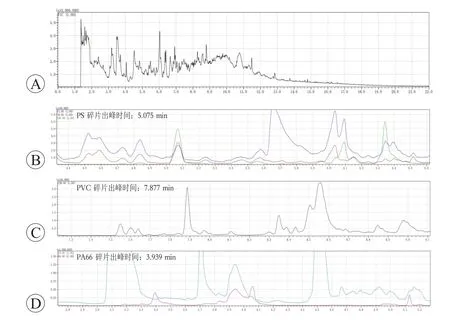
图4 样品1a的Py-GC/MS微塑料分析结果
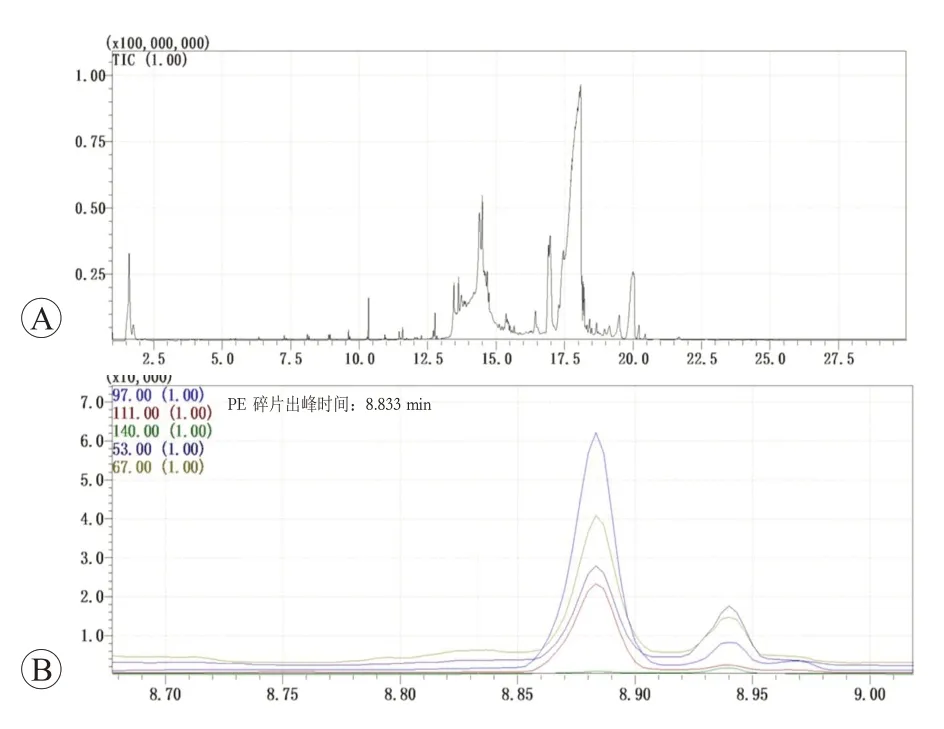
图5 样品4a的Py-GC/MS微塑料分析结果(检出PE)
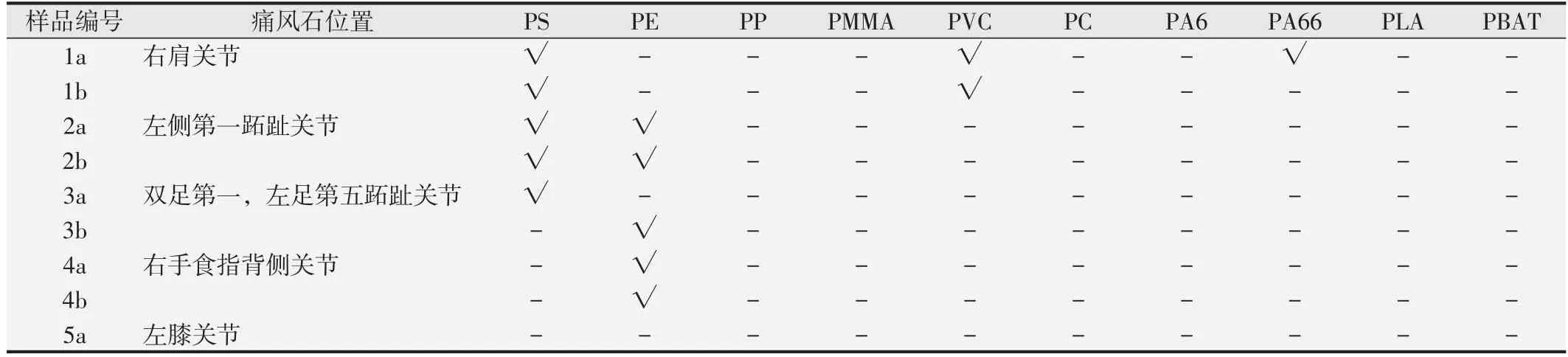
表2 患者痛风石样品中微塑料检出情况
结果显示,部分样品尽管来自于同一患者,其检测结果也可能并不一致(如患者1 的样品1a 中检出PA66、PS、PVC,而1b 却仅检出PS、PVC),这可能是因为微塑料是不可溶的固体成分,在痛风石中无法均匀分布,且我们在分割样品时为随机分割,因此可能导致来自于同一患者的两个样品的检测结果存在差异。此外,结果显示患者5 的样品中也无微塑料检出,推测可能是手术提供的样品较小,由于微塑料为不可溶的固体成分,非均匀分布,此份样品无微塑料检出。
本研究以数据证据率先证明了微塑料可以于人类痛风石中检出,表明不可溶的微塑料可以在人类关节处累积并提示其可能参与痛风石形成。
3 讨论
痛风石在关节软骨、滑膜、韧带等部位的堆积是中、重度痛风最主要的病理特征之一。在过去的几十年里,不同科学团队使用多种检测方法对痛风石成分进行分析,发现其主要由单钠尿酸盐晶体、包裹晶体的免疫细胞和结缔组织组成,但仍有成分尚未鉴定出[15]。例如在2022年发表的一项研究称,痛风石中还存在少量的非晶态成分未被鉴定出,并推测痛风石在形成过程中可能有其他易沉淀物质的附着和参与[16]。本研究于痛风石中检出一定量的微塑料,并且鉴定出其为PS、PE、PVC、PA66,进一步揭示了当下痛风石组成的可能性。
长期以来,塑料被认为是一种惰性物质,在进入人体后,会经过胃肠道、胆道排泄出体外。然而,有动物研究表明,小于10 μm的微塑料可以穿过细胞膜进入循环系统并在多种组织中堆积[17]。同样,人体样本中已有不同种类的塑料成分被鉴定出来:痰液中主要鉴定出聚氨酯(PU)、聚对苯二甲酸乙二醇酯(PET)、氯化聚乙烯(CPE)等;胎盘、乳汁、胎粪中主要鉴定出PA、PU;血液中主要鉴定出PET、PS、PE、PP、PMMA 等[4,18]。而本研究除了PS、PE 之外,进一步发现了PVC、PA66在人类组织中的存在,丰富了人体中现有检出微塑料的种类。另痛风石中检出的PS、PE、PVC常用于生产食品或饮用水的包装材料及运输水的管道材料,而PA66 广泛应用于汽车工业、仪器壳体以及其他需要有抗冲击性和高强度要求的产品,也可用于制作纺织品。这表明较少用于制作与食品及水直接接触的塑料成分PA66 同样存在侵入人体并在人体部位残留的风险。
本研究仅验证了人类痛风石中能检出微塑料,并未回答微塑料在痛风石形成过程中充当什么角色这一问题:它是痛风石形成的“发起者”(或之一),还是痛风石形成的“加剧者”,亦或是二者皆有,再或者是充当其他角色?一方面,作为痛风石堆积的“始作俑者”——尿酸盐,它能在关节处形成结晶可能需要“发起者”,即关键因素或诱导因子(如低温等)[19]。虽然目前仍未鉴定出确切的“发起者”,但是微塑料作为人体的“外来物”——其粒径微小、不可溶且具有独特的表面特性(如粗糙、多孔及化学属性),可能通过以下几种作用而充当“发起者”的角色:①诱导尿酸盐聚集。微塑料在关节腔滞留后,可能使得尿酸盐晶体容易附着在其粗糙表面或多孔内部,从而导致尿酸盐晶体堆积并后续形成痛风石。这种效果可能与尿路异物导致膀胱结石形成这一临床发现相类似,有临床发现,丝线、稻草等外源性异物通过尿道进入人的膀胱后,长此以往使泌尿系统的结晶附着,从而形成结石[20-21]。②增加关节面磨损。微塑料作为外来不可溶异物,可能增加关节摩擦形成微小的凹凸损伤。这些损伤(或局部炎症)一方面可能使尿酸盐结晶更容易析出形成痛风石,另一方面可能使个体即便在正常的尿酸盐浓度范围内,这些损伤也带来了类似于痛风的痛楚感受。这种假说或许解释了为什么当下有相当部分的患者血尿酸保持在正常范围内,却仍然会遭受痛风样的痛楚[10,22]。③改变关节腔微环境。除了上述的通过磨损关节面改变微环境外,微塑料或其微量的析出物可能改变了其附近微环境,使得尿酸盐更容易析出。目前已有报道,用于治疗目的的外源性材料(如骨钉、硅胶、膨体)会对其附近带来一定的诸如pH、温度等方面改变。那么,同样作为外源性异物的微塑料,是否也会改变关节腔微环境,从而使得尿酸盐更容易析出呢,该可能性有待后续研究验证。
另一方面,我们认为,除了上述“发起者”的角色之外,微塑料可能又进一步加剧了痛风石的形成。目前有科学家推测尿酸盐结晶诱发的炎症反应(如中性粒细胞胞外网状陷阱,NETs)有可能是痛风石形成并加剧的生理学机制[23]。而近年的研究表明,微塑料会导致小鼠等动物身体局部产生炎症反应,此外,如前所述,动物研究表明微塑料可能促进关节炎的疾病进程。那么结合本研究发现,完全有理由猜测微塑料导致的炎症反应可能进一步影响了痛风石的形成。
需要指出的是,上述假设在未来如果被验证成立,那么及时将人体关节堆积的微塑料(连同其附着的尿酸盐晶体)排出且及时对微塑料带来的关节磨损予以修复,可能是减缓乃至消除痛风石堆积的干预手段之一。由关节滑囊和腱鞘的滑液膜分泌的关节滑液,就起着排出毒素和滋润修复关节的多重作用[24]。因此我们推测,或许可以通过摄入氨基葡萄糖硫酸软骨素、盐酸氨基葡萄糖等成分来强化滑膜液功能性[25],从而一定程度增加了关节腔环境润滑度,减少尿酸盐等对关节面的磨损,同时促进包括微塑料在内的关节毒素的排出,进而降低痛风石形成的可能性、减少痛风发作或痛风样痛楚发生、及维持关节正常功能。
此外,有研究发现,用100 ℃蒸馏水浸泡一次性塑料餐具,并将浸出液连续饲喂小鼠10 d,可导致骨髓嗜多染红细胞微核率、精子畸变率、肝细胞DNA拖尾率显著增加,即表明对小鼠有致突变作用[26]。最新研究发现,饲喂含低浓度聚苯乙烯微塑料的饮用水可导致小鼠睾丸发育障碍和精子发生功能障碍[27]。由此可见,摄入塑料(或微塑料)对动物机体存在致畸变、突变的风险。但是由于此2 项研究一方面基于雄性小鼠实验,另一方面均未直接检测小鼠体内是否含有微塑料,而本研究则直接证实了人体内环境(痛风石)微塑料的检出,且鉴于检出微塑料的痛风石来自于52~65 岁中老年个体,他们暴露于微塑料的时间理应较久,或许微塑料已给他们带来多种负面健康影响。因此,未来需要有更多更深的研究来论证微塑料污染对人体的致突变和致畸变影响。总而言之,于人体痛风石中检出微塑料这一发现一方面给我们再次敲响了警钟,微塑料对人体健康的影响或许比我们想象得更加深远,另一方面该发现在揭示痛风石形成的生理学机制及临床上进一步治疗痛风性关节炎提供了一定理论支撑。
(致谢:感谢上海微谱检测科技集团股份有限公司提供检测服务及技术指导)
