小麦HP基因家族鉴定和分析
2023-10-20娄渊根李晶晶邢国珍路亚南郑文明
娄渊根, 李 闯,李晶晶, 邢国珍, 路亚南, 郑文明,*
(1. 河南护理职业学院,河南 安阳 455000;2. 河南农业大学 生命科学学院/小麦玉米作物学国家重点实验室,河南 郑州 450002)
细胞分裂素是一类重要的植物激素,通过一系列的信号传导途径参与调控植物生长发育以及对非生物胁迫的响应等生物学过程[1-3]。组氨酸转运蛋白(histidine phosphotransfer proteins, HP)是细胞分裂素信号通路中的关键因子,属于通路中的正向调控蛋白[4]。受体组氨酸蛋白激酶(histidine kinases, HK)与细胞分裂素在细胞质中结合并完成磷酸化,HP蛋白的保守组氨酸位点能识别HK蛋白的磷酸基团,将磷酸基团从细胞质转移至细胞核,最终激活下游相关基因,从而调控植物的生长发育过程[5]。近年来越来越多的证据表明,HP蛋白是植物应答非生物胁迫途径中的重要功能因子。
拟南芥AHP2、AHP3 和AHP5参与对干旱胁迫和冷胁迫的抗性调控[4,6]。水稻OsAHP1 和OsAHP2 的RNAi 转基因株对盐敏感且对干旱耐性增强[7]。小麦TaHP1 基因被发现参与调控小麦叶片衰老[8]。此外,HP基因具有复杂的调控机制,不同HP基因的表达模式在不同环境条件下差异很大,同时具有很强的组织特异性表达特征。拟南芥HP基因在调控主根、侧根生长发育及花药壁发育等生物过程中展示了较强的组织特异性[9-11]。OsAHP1和OsAHP2基因在受到盐和干旱的诱导表达中显著不同[7]。小麦TaHP4基因在多种逆境胁迫条件下,包括盐、干旱、脱落酸和细胞分裂素,受到显著抑制表达;TaHP4基因并具有明显的组织特异性,在根组织表达量很低,然而在叶、穗、茎等地上部高表达[12]。因此,深入解析HP基因特征及参与逆境胁迫的调控过程,对挖掘种质资源从而推动抗逆性育种非常重要。
植物基因组测序技术的快速发展为抗逆相关的重要基因家族的鉴定分析提供了重要资源。白菜[13]、茭白[14]、黄瓜[15]、萝卜[16]、茎瘤芥[17]等全基因组水平的HP基因家族鉴定有助于物种抗逆基因资源的开发。目前小麦HP基因家族全基因组水平的鉴定和比较分析尚未见报道。本研究利用中国春小麦基因组数据,对HP基因家族进行系统注释,并分析了其理化性质、基因复制、基因结构、保守序列、顺式作用元件以及在非生物胁迫条件下的表达模式,为进一步探究小麦HP家族基因的进化特征和在非生物胁迫下的应答机制提供理论基础。
1 材料与方法
1.1 材料
本试验材料为小麦品种郑麦9023。用10%过氧化氢溶液对小麦种子消毒10 min,再将种子于灭菌蒸馏水中清洗4~5次,之后放置于25 ℃培养箱进行萌发。待小麦到二叶期进行低磷(10 μmol·L-1KH2PO4)水培处理,分别在0 h、12 h、24 h、48 h、72 h、7 d和14 d取根部样品,每个时期的样品为3个生物学重复,材料于-80 ℃ 冰箱中保存备用。采用Trizol法对样品进行RNA提取,反转录合成cDNA使用HiScript®ⅡQ RT SuperMix for qPCR反转录试剂盒(南京)。
1.2 方法
1.2.1 小麦HP家族基因注释和序列特征
以HPt结构域PF01627(http://pfam.xfam.org/)为种子文件,利用HMMER 3.2.1软件[18]的hmmscan程序搜索小麦基因组数据库的蛋白组(RefSeq v2.1,https://www.wheatgenome.org/)[19]。将注释的HP蛋白与拟南芥HP蛋白(https://www.arabidopsis.org/)通过BLASTP[20]比对,依据每个基因的最佳比对结果命名小麦HP家族基因。通过ExPASy(https://www.expasy.org/)分析HP家族基因的理化性质,并通过CELLO(http://cello.life.nctu.edu.tw/)[21]预测亚细胞定位。利用GSDS 2.0(http://gsds.gao-lab.org/)[22]分析HP家族的基因结构。使用PROSITE软件(https://prosite.expasy.org/)[23]预测分析蛋白结构。利用MEME软件(http://meme-suite.org/)[24]预测保守基序,基序设置为5。
1.2.2 氨基酸序列比对与进化树构建
拟南芥HP蛋白包括AHP1(AT3G21510.1)、AHP2(AT3G29350.1)、AHP3(AT5G39340.2)、AHP4(AT3G16360.2)、AHP5(AT1G03430.2)、AHP6(AT1G80100.3)。其他植物的HP蛋白从NCBI数据库下载,包括水稻Os_HP2(NP_001390867.1)、玉米Zm_HP2(NP_001104850.1)、大麦Hv_HP2(XP_044979355.1)、二穗短柄草Bd_HP2(XP_003578675.1)、节节麦Aet_HP2(XP_020168581.1)、乌拉尔图小麦Tu_HP2(XP_048569068.1)。使用DNAMAN软件执行HP蛋白的多序列比对。通过MEGAX软件[25]的最大似然法(maximum likelihood)构建系统发育树,bootstrap值设置为1 000。
1.2.3 顺式作用元件预测
选取HP基因上游的 2 000 bp序列,利用PlantCare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)[26]进行启动子的顺式作用元件预测,并通过TBtools 软件[27]进行归类和可视化。
1.2.4 基因表达模式分析
利用小麦表达数据库expVIP网站(http://www.wheat-expression.com/)[28],通过分析所有HP基因的tpm(transcripts per million)值计算表达量并绘制基因表达热图。利用Applied Biosystems荧光定量PCR仪进行 qRT-PCR 反应,程序设置为95 ℃ 10 min,95 ℃ 10 s,60 ℃ 30 s,40个循环。利用 2-ΔΔCT方法对基因表达水平进行相对定量分析。以小麦26S基因Ta26S为内参基因[29]。 qRT-PCR 引物序列如表1中所示。
2 结果与分析
2.1 小麦HP基因家族鉴定
以中国春小麦的全基因组蛋白序列为依据,基于HPt结构域(PF01627)的隐马模型共鉴定到31个HP家族基因。通过小麦HP家族编码蛋白和拟南芥HP蛋白序列的比对,依据最佳比对结果所对应的拟南芥同源基因命名小麦HP基因家族成员(表2)。根据基因注释信息,发现HP家族的27个基因位于11条染色体上,呈现不均匀分布,其中A组染色体丢失同源基因数量最多。在每条染色体上,共发现1对同源基因(TaHP1-4D;3-TaHP1-4D;4)经历串联复制,6对同源基因(TaHP1-4D;1-TaHP1-4D;2、TaHP1-4A;1-TaHP1-4A;2、TaHP1-1B;1-TaHP1-1B;2、TaHP1-4A;2-TaHP1-4A;3、TaHP5-6D;1-TaHP5-6D;2 和TaHP5-4B-TaHP1-4B;2)经历片段复制。
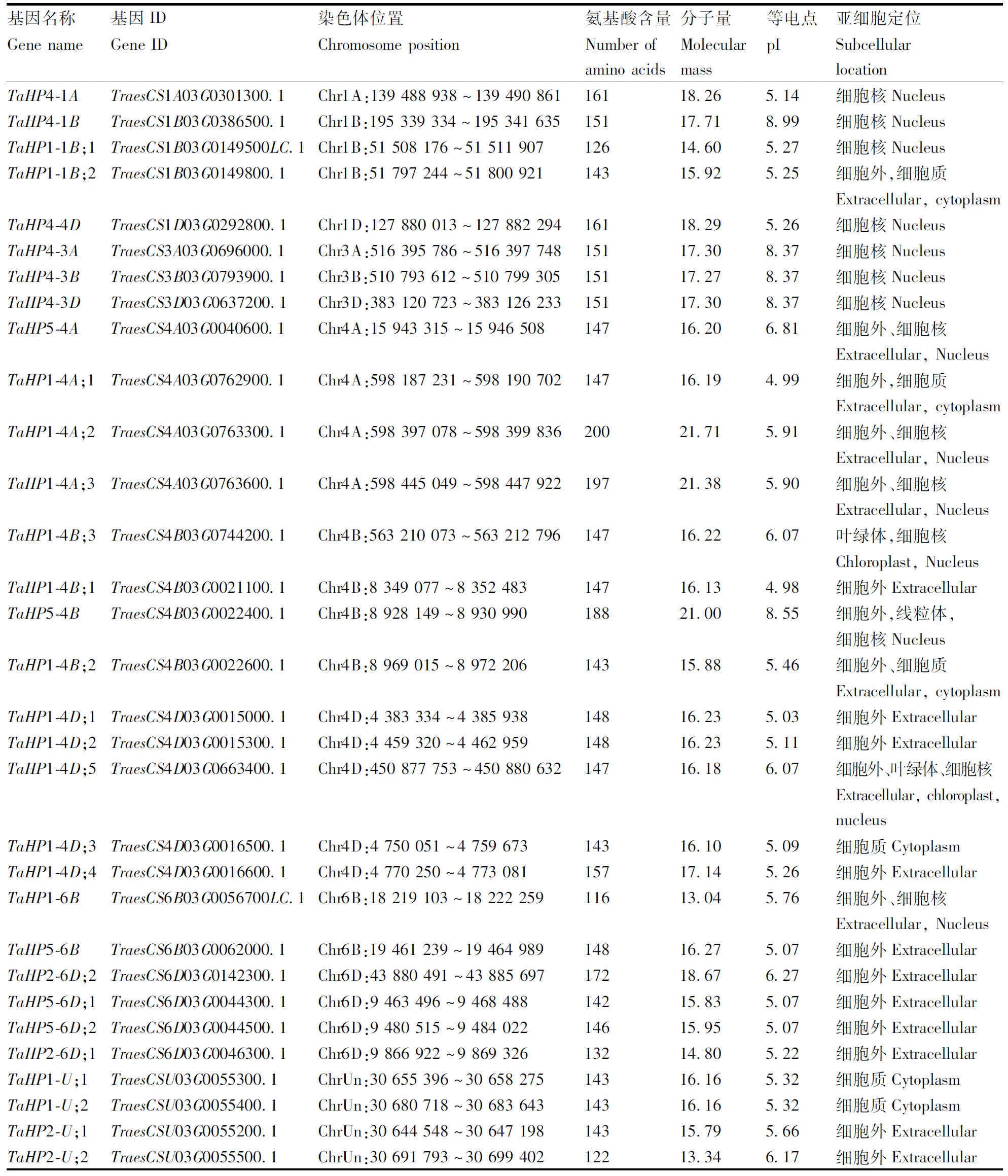
表2 小麦HP基因家族成员的基本特征
小麦HP家族蛋白的氨基酸个数为116~200,蛋白相对分子量大小范围为13.4~21.71 ku。31个HP蛋白的等电点范围为4.98~8.99,26个基因的蛋白质等电点小于7,说明HP家族大部分成员是偏酸性。亚细胞定位预测表明,20个基因蛋白质定位在细胞外,14个蛋白定位在细胞核。这些结果说明HP蛋白成员的基因组组成存在保守性,又存在很大差异。
2.2 小麦HP家族蛋白的保守性
HPt 结构域(histidine-containing phosphotransfer domain profile),即组氨酸磷酸转移域,是传递磷酸基团的核心结构域。使用PROSIT软件分析小麦HP家族的蛋白结构,发现8个蛋白(TaHP1-4A;2、TaHP1-4A;3、TaHP1-4B;2、TaHP1-6B、TaHP2-6D;2、TaHP2-6D;1、TaHP5-6D;1和TaHP5-6D;2)缺失完整的HPt结构域,其他23个蛋白都包括一个HPt结构域,无其他结构域。这些结果表明,尽管HPt 结构域具有保守性,但在进化过程中受到环境等因素的影响导致氨基酸序列变异,蛋白功能可能具有多样性。
对小麦HP家族的31个蛋白和拟南芥、水稻、玉米、大麦、二穗短柄草、节节麦以及乌拉尔图小麦的12个HP蛋白,通过DNAMAN软件进行多序列比对。8种植物的多序列比对结果(图1)发现,HP蛋白结构域的序列相似度高于其他区域 ,说明HPt结构域序列是保守的。9个HP蛋白结构域的磷酸化位点缺失,包括TaHP1-6B、TaHP2-6D;2、TaHP2-6D;1、TaHP4-3A、TaHP4-3B、TaHP4-3D、TaHP5-6D;1、TaHP5-6D;2和TaHP5-4B,暗示这些蛋白受到了强烈的环境进化压力。TaHP1-1B;1和TaHP1-6B蛋白相对于其他蛋白缺失部分保守序列,可能与它们快速变异适应环境有关。总之,和其他植物相比,小麦HP蛋白具有更多的变异位点,可能与HP蛋白参与更复杂的生物学过程调控有关。

蓝色箭头代表磷酸化位点。Bule arrow represents phosphorylation site.图1 小麦和其他植物的HP蛋白序列的比对结果Fig.1 Multiple alignment of HP proteins in wheat and other plants
2.3 小麦HP家族基因的结构特征
对小麦HP家族蛋白构建系统进化树,并分析其基因结构和保守基序(图2)。进化树拓扑结构表明,HP家族蛋白在进化分支上较为分散,存在多个分支。HP1~HP6各个蛋白亚家族未能聚类在同一分支,可能与每个基因的变异以承受的环境进化压力不同有关。

A,进化关系;B,基因结构;C,保守基序。A, Evolutionary relationship; B, Gene structure; C, Conserved motif.图2 小麦HP家族的系统进化和基因结构Fig.2 Phylogenetic evolution and gene structure of HP family in wheat
基因结构分析发现,31个HP基因的外显子数目范围为4~8个,24个基因包含 6个外显子。内含子序列扩张是部分HP基因长度延伸的主要因素。在相同的进化分支上,受到内含子结构影响,HP家族基因并未具有相似的外显子-内含子结构。然而在相同的进化分支上,大多数基因成员的编码序列(外显子)却分布相似。基因结构的相对保守性说明HP基因功能可能具有保守性。
进一步分析小麦HP家族蛋白的保守结构,结果发现,5个保守基序分布于此家族。21个基因包含4个相同的保守基序。TaHP5-6D;2、TaHP5-6D;1、TaHP1-6B和TaHP5-6B具有特异性基序,使它们在同一进化分支上。HP家族的大部分成员的基序数量和类型分布说明基序结构的保守性,这可能与HPt结构域的生物学功能有关。
2.4 小麦HP家族基因的顺式作用元件分析
为探究小麦HP家族基因可能参与的生物过程,对其家族成员的启动子的顺式作用元件进行注释分析。图3结果表明,HP家族基因的启动子区域的注释功能主要涉及多种逆境,包括光、激素、低温、干旱等。激素响应元件包括脱落酸、木质素、赤霉素相关元件。此外,厌氧诱导、分生组织表达、昼夜节律调控等应答元件也被发现。每个基因都包含光响应元件。大部分基因包含植物激素响应元件。26个基因包含茉莉酸甲酯响应元件,28个基因包含脱落酸响应元件,26个基因包含厌氧响应元件,26个基因包含木质素响应元件,23个基因包含低温响应元件,20个基因包含干旱响应元件,19个基因包含赤霉素响应元件。以上结果表明,小麦HP家族基因在应答非生物逆境胁迫的生物过程中可能发挥多方面功能,说明此基因家族在小麦生物学过程中可能具有复杂的调控机制。

图3 小麦HP家族基因的顺式作用元件分析Fig.3 Analysis of cis-acting elements of HP family genes in wheat
2.5 小麦HP家族基因的表达模式分析
为了解小麦HP家族基因在不同环境条件下的表达变化,利用expVIP数据库[28]的36个条件(包括非生物胁迫和生物胁迫)下的表达数据分析HP家族基因的表达模式。图4结果显示,在不同生长发育时期和调控条件下,HP家族的各个基因的表达情况存在很大差异,呈现多样化。TaHP1-4B;1、TaHP1-4A;1、TaHP1-4D;2基因在各个条件下均具有较高表达水平。15个基因表达量很低或者未检测到表达。TaHP2-6D;2、TaHP4-3A、TaHP4-3B、TaHP4-3D、TaHP4-1B、TaHP4-4D和TaHP5-6B基因在不同的环境条件表达量较高,但存在很大差异。以上结果说明,小麦HP家族基因在应答环境胁迫中表达模式存在显著的多样性。
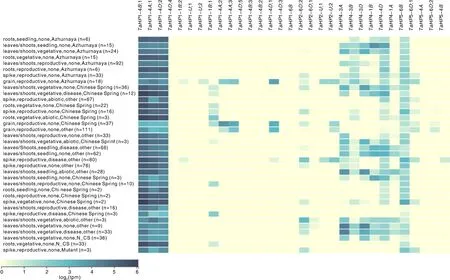
log2(tpm) 颜色从左到右表示基因表达量从低到高。log2(tpm) color from left to right represents the gene expression level from low to high.图4 热图分析展示小麦HP家族基因的表达模式Fig.4 Heatmap analysis showing the expression patterns of HP family genes in wheat
磷在植物生长发育中具有关键作用,磷胁迫是植物非生物胁迫的重要因素之一。为解析HP基因在小麦磷胁迫中的调控机制,进一步分析HP家族基因在低磷胁迫条件下的表达情况。研究通过qRT-PCR试验评价了在表达谱分析中表达量显著的TaHP1-4B;1等6个基因的表达趋势。图5结果显示,各个时间展示的基因表达量存在很大差异说明这些基因在应答低磷胁迫中可能具有复杂的基因表达调控机制。TaHP1-4B;1在24 h内受到诱导表达,在24 h后受到抑制表达。TaHP1-4A;1、TaHP1-4D;2、TaHP2-6D;2、TaHP4-4D和TaHP5-6B在12 h表达量下降,说明这些基因受到抑制表达。TaHP5-6B在低磷胁迫12~72 h表达水平明显上调,说明受到强烈的诱导表达,暗示其在应答低磷胁迫过程中可能发挥更重要的作用。
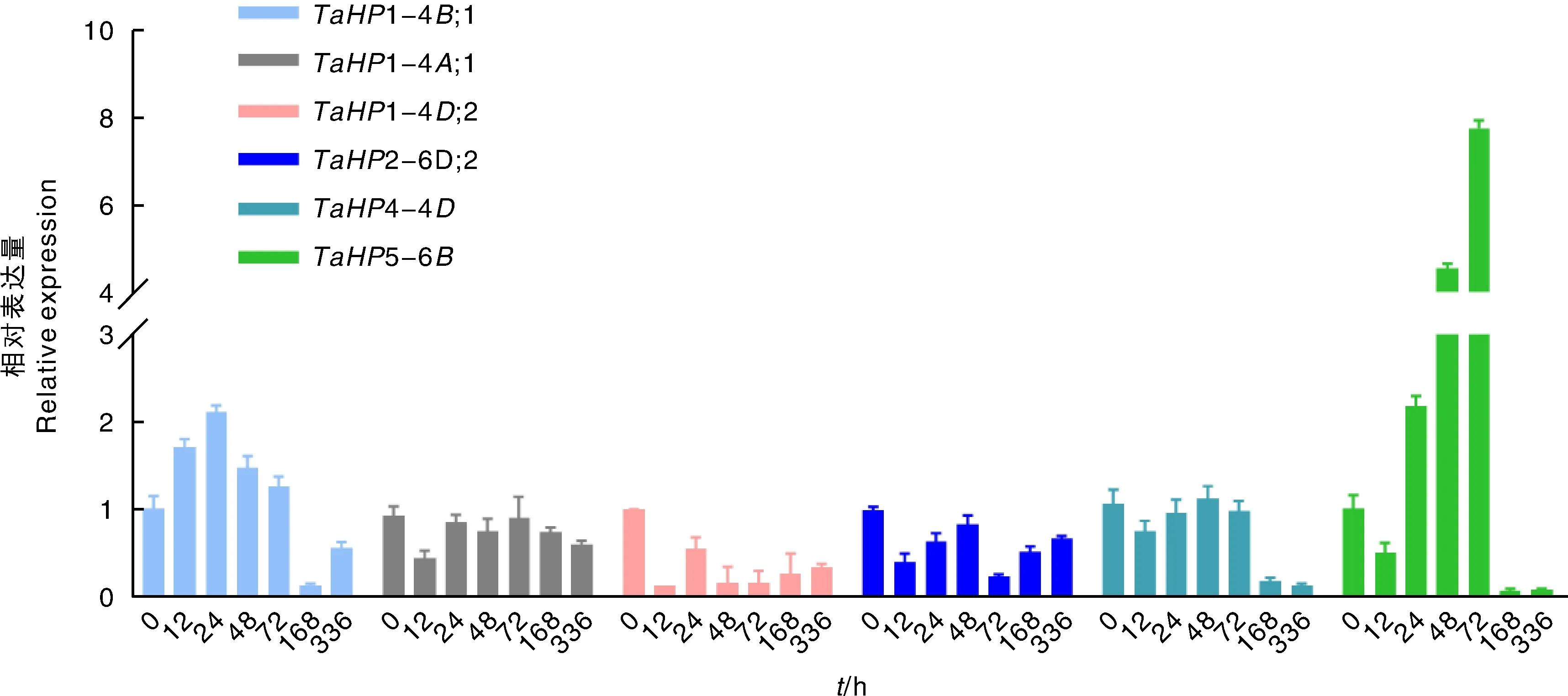
图5 小麦HP家族的6个基因在低磷条件下的表达水平Fig.5 Relative expression levels of six HP genes under low phosphorus supply
3 讨论与结论
高通量测序技术的发展促使植物基因组信息不断完善,为挖掘重要性状的基因资源以及其进化特征提供了数据支撑[15-17,19,30-33]。本研究利用生物信息方法从更新的普通小麦基因组中共鉴定出31个HP家族基因。每个基因均包含了保守的HPt结构域,但在进化过程中存在很多氨基酸序列变异,说明此家族基因可能受到逆境胁迫的进化压力影响。每个基因的编码氨基酸数量为116~200个,大部分在140个左右。小麦和其他7种植物的HP蛋白序列比较分析表明,HP蛋白的结构域序列在植物中是高度保守的;基因结构和保守基序分析同样支持了HP家族基因的保守性,这符合其他相关研究的植物HP家族基因在进化上保守性的结果[12,15-17]。
植物HP基因的不同成员在应答非生物胁迫的生物学过程中可能扮演着不同的重要角色[12-13,15,17]。顺式作用元件分析表明,小麦HP家族基因的调控区域包含大量的与光反应、激素、干旱、低温等非生物胁迫响应相关的调控元件,说明小麦HP基因的进化及参与的生物过程可能受到非生物胁迫的显著影响。利用多种胁迫条件下的基因表达谱分析发现,HP家族基因在应答非生物胁迫过程中的基因表达模式存在多样性,说明HP基因可能具有复杂的表达调控机制。因此,小麦HP家族基因与非生物胁迫响应存在相关性。
磷胁迫响应是植物抵御非生物胁迫的重要环节,低磷应答基因的鉴定有助于培育磷营养高效的作物。研究发现,MYB-CC[34]、SPX[35]、MADS-box[36]、SAP[33]等基因家族成员是小麦磷胁迫响应的重要基因资源。本研究从表达谱数据中筛选到在非生物胁迫下的6个高表达基因,通过qRT-PCR分析发现它们在低磷胁迫条件下不同时期的表达水平同样存在差异。TaHP5-6B在非生物胁迫的多种条件和不同组织中表达量较高,qRT-PCR分析显示在低磷胁迫下受到强烈的诱导表达。因此,这些HP家族成员可能与低磷胁迫响应密切相关。
综上,本研究鉴定到普通小麦的31个HP家族基因,HP家族序列具有保守性;基因启动子涉及多种与逆境胁迫相关的顺式作用元件;在非生物胁迫条件下的基因表达模式存在多样性。HP家族基因的解析为探究HP基因在小麦逆境响应中的生物学功能提供重要信息,有助于为分子育种提供抗逆基因资源。
