桉蝙蛾幼虫实时荧光定量PCR内参基因的筛选
2023-10-20邱峙嵩苏小燕曹丽沙杨振德
陈 晓,邱峙嵩,苏小燕,许 原,曹丽沙,杨振德,胡 平
(广西大学林学院,南宁 530004)
桉蝙蛾EndoclitasigniferWalker(鳞翅目Lepidoptera蝙蝠蛾科Hepialidae)是桉树上的一种重要蛀干性害虫之一。近年来,随着我国南方速生桉人工林大面积的规模化种植,桉蝙蛾危害范围逐渐扩大,已成为影响桉树产业发展的主要钻蛀性害虫(杨秀好等, 2021)。桉蝙蛾雌虫交配后,多将卵随机散产于1~3年生的桉树幼林内;幼虫3龄以前,营地栖生活,3~5龄幼虫上树蛀干,此后营树栖生活,直至12龄末期于所蛀孔洞内化蛹(于永辉, 2012)。受桉蝙蛾危害的桉树生长发育减缓,材积减少、材质下降,且易风折、枯死(杨秀好, 2013)。目前,针对桉蝙蛾的研究主要集中在生物生态学特性(曹书阁等, 2011; 杨秀好等, 2012;Yangetal., 2013; Zhengetal., 2016; 胡平等, 2021)、生物防治(蓝霞等, 2014; 邹东霞等, 2016)以及遗传与生理学(Yangetal., 2016; Zhangetal., 2021)等方面,而对桉蝙蛾幼虫内参基因的研究尚未见报道。
实时荧光定量PCR(Quantitative real-time PCR,RT-qPCR)是检测生物体中基因表达差异常用的核酸定量检测技术之一,而RT-qPCR结果的可靠与否,依赖于内参基因这一重要因素。常用的内参基因包括延伸因子(Elongation factors,EF)、肌动蛋白基因(Actin,ACTIN)、核糖体蛋白基因(Ribosomal protein,RIB)、微管蛋白基因(Tubulin,TUB)和甘油醛-3-磷酸脱氢酶基因(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)等基因(Luetal., 2018)。内参基因一般选择参与细胞基本生命活动、在生物体内的各个部位和不同的实验处理下均能稳定表达的基因。然而,研究表明内参基因的稳定是相对的,随着实验处理的改变,在不同生理状态下,内参基因的表达存在差异(Zhangetal., 2014; Shakeeletal., 2018)。因此,在利用RT-qPCR进行目的基因表达水平研究时,必须使用合适的内参基因对RT-qPCR数据进行分析校正和标准化处理,以减少样本之间由RNA提取、cDNA定量、转录和扩增所带来的误差,从而得出正确的判断(Gueninetal., 2009)。
本文通过RT-qPCR技术检测桉蝙蛾幼虫不同龄期(3龄、5龄、9龄、12龄)、不同体节(头、胸、腹)和全样品处理下的候选内参基因表达量,并利用GeNorm、NormFinder、BestKeeper和RefFinder等计算程序对5个候选内参基因的稳定性进行评估,为桉蝙蛾幼虫基因表达的研究提供参考依据。
1 材料与方法
1.1 供试虫源及样本采集
桉蝙蛾幼虫于2019年6月-2020年9月采自广西壮族自治区国有高峰林场(N 22°941′, E 108°336′)的桉树寄主上。将受害木段锯下带回实验室内,劈开木段后取出幼虫,于-80℃下冷冻保存。参考王缉健等(2015)的龄期划分方法,取3龄和5龄(地栖或初转树栖,低龄幼虫)、9龄(树栖,中龄幼虫)、12龄(越冬,老龄幼虫)桉蝙蛾幼虫,用解剖手术剪沿腹部中线剪开幼虫胸腹部表皮,清除脂肪和肠道后,分别剪下头、胸、腹,作为不同体节与不同龄期的样品,所有样品作为全样品处理。每个龄期和体节各重复3次。
1.2 总RNA提取和cDNA合成
采用RNeasy©Plus Mini Kit试剂盒(No.74134; Qiagen, Hilden, Germany)提取所有样本总RNA,具体步骤参照RNeasy©Plus Mini Kit试剂盒说明书。取1 μL RNA样品,使用NanoDrop 8000(Thermo, Waltham, MA, USA)测定OD260/OD280与OD260/OD230,当各自的比值在1.8~2.1之间,且通过琼脂糖凝胶电泳检测能获得清晰条带的样品用于cDNA合成。取1 μL RNA的量,按照反转录试剂盒TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix(TranGen Biotech)的步骤合成cDNA。
1.3 内参基因选择及RT-qPCR引物设计
参考其他昆虫常用的内参基因,选取桉蝙蛾幼虫转录组(Zhangetal., 2021)中鉴定的ACTIN、GAPDH、TUB、RIB、EF作为候选内参基因(表1)。利用引物设计工具Primer 3(https:// primer3.ut.ee/)设计RT-qPCR引物(表1)。引物由北京TSINGKE公司合成。
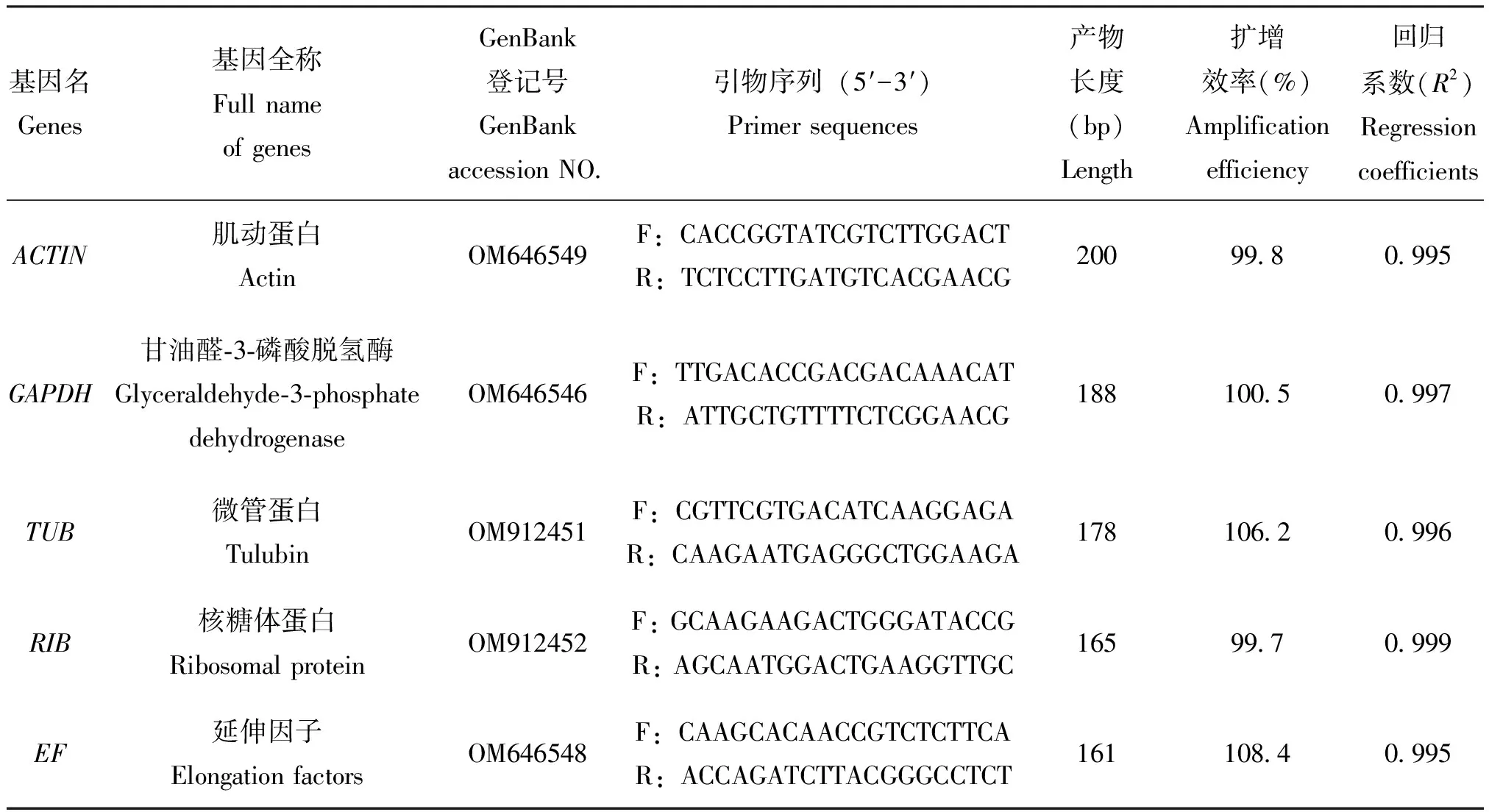
表1 桉蝙蛾幼虫样本中5个候选内参基因的引物序列和扩增子特征
1.4 标准曲线制作和RT-qPCR分析
将样品cDNA模板梯度稀释1/10、1/100、1/500、1/1 000、1/1 500进行反应,在冰上进行反应体系的配制,RT-qPCR反应体系(25 μL)如下:Genious 2X SYBR Green Fast qPCR Mix(No ROX)(ABclonal Technology)12.5 μL,上下游引物(10 μmol/L)各1 μL,cDNA稀释液2.0 μL,Nuclease-free H2O 8.5 μL,在Ligh Cycler 480 II(Roche,USA)上进行反应。PCR程序:95℃预变性3 min,95℃变性5 s,60℃退火和延伸共30 s,40个循环;95℃ 15 s,60℃ 60 s,95℃ 15 s形成熔解曲线。通过熔解曲线与梯度浓度扩增的标准曲线,检测每对引物的扩增特异性、扩增效率及标准曲线的回归系数R2(表1)。每个cDNA样品设置3次技术性重复和3次生物学重复。
1.5 候选内参基因表达稳定性分析
分别利用内参基因评估软件GeNorm、BestKeeper和NormFinder软件及RefFinder在线网站(https://www.heartcure.com.au/reffinder)评价候选内参基因在桉蝙蛾幼虫不同龄期与不同体节中的表达稳定性。在利用GeNorm分析时,表达稳定值M<1.5且数值越小,表示该基因相较其他候选内参基因更能在当前实验处理下稳定表达;而配对差异值Vn/(n+1)<0.15时则表示最佳的内参基因数目为n个,不需再增加其数量,否则加入新基因,直至Vn/(n+1)<0.15(Vandesompeleetal., 2002)。Normfinder通过计算不同样本组内和组间的变化来评估候选内参基因表达稳定值(Stability value,SV),该值越小表示基因越稳定(Andersenetal., 2004)。BestKeeper直接使用Ct值进行计算,主要通过标准偏差(Standard deviation,SD)来评估候选内参基因的稳定性,当SD<1且SD数值越小时,认为该基因的表达越是稳定(Pfaffletal., 2004)。最后,通过常用的RefFinder对3种软件得出的内参基因稳定性进行综合排名,即加权几何平均值越小越稳定(Xieetal., 2012)。
2 结果与分析
2.1 引物扩增效率及特异性
所有基因的扩增条带清晰而单一,且扩增产物长度与预期一致(图1);同时,基于候选内参基因不同浓度的cDNA获得的标准曲线具有良好的回归系数(R2>0.995),PCR扩增效率在99.7%~108.4%之间(表1),表明各候选内参基因的引物设计合理,可用于相应基因的定量检测。
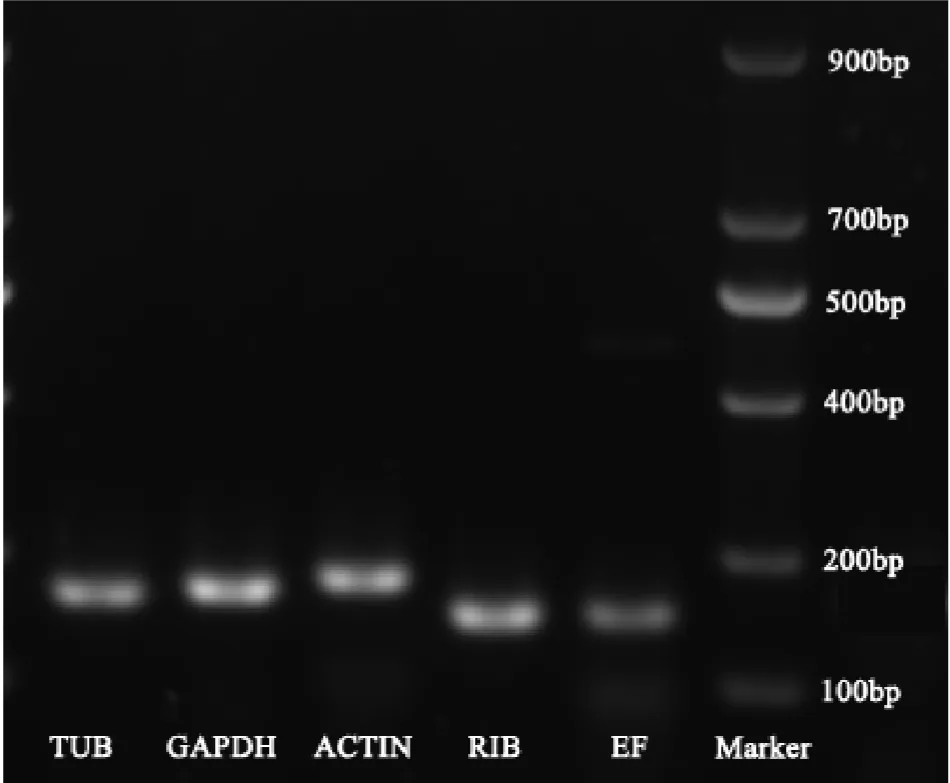
图1 引物的PCR扩增条带Fig.1 PCR amplification bands of primers
2.2 不同候选内参基因在样品中的表达水平差异
RT-qPCR分析桉蝙蛾5个候选内参基因的表达水平显示,在所有样品中,各基因的Ct平均值在24.13~28.84之间,表明所有候选内参基因在各处理中均有较高的表达量,且在不同处理的表达量均存在差异。其中,ACTIN的平均表达丰度最大(24.13)、表达水平差异最小(SD=2.40);而TUB的表达水平差异(SD=6.48)最大,其次为EF(SD=3.30)、GAPDH(SD=3.21)、RIB(SD=2.84)(图2)。
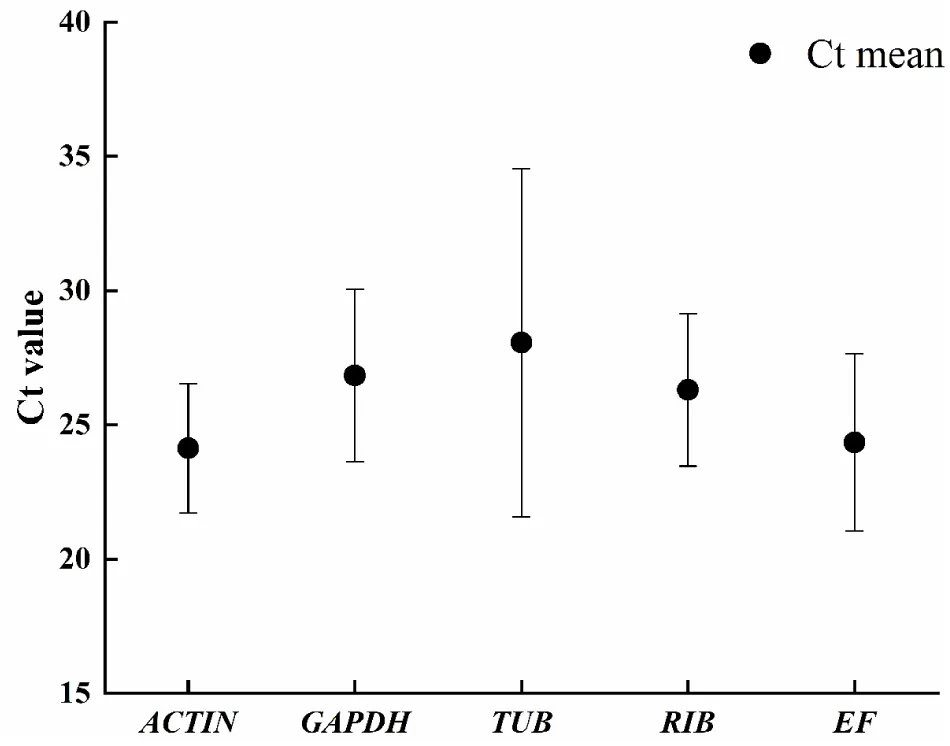
图2 不同候选内参基因在桉蝙蛾幼虫样本中的表达水平(Ct值)Fig.2 Expression levels of different candidate reference genes in the samples of Endoclita signifer larvae (Ct value)注:点为Ct平均值,中垂线的上下限为标准偏差。Note: The point represent the Ct mean value, and the upper and lower limits of the midline represent the standard deviation.
2.2 候选内参基因在不同处理下的稳定性分析
2.2.1BestKeeper软件分析
在3龄幼虫的不同体节中,所有基因的SD值均大于1,均不适于作为内参基因;RIB和EF在5龄幼虫的不同体节中具有良好的表达稳定性,而ACTIN、GAPDH和TUB的SD值均大于1,显示较差的稳定性;9龄幼虫的不同体节中,表达最稳定的基因为EF,其次为GAPDH、RIB,而ACTIN最不稳定;相反,ACTIN在12龄幼虫的不同体节中的表达最稳定,EF次之,而GAPDH、RIB和TUB不适于作为内参基因(SD>1)。在不同龄期幼虫的胸部中仅GAPDH能稳定表达(SD=0.688<1),其余4个候选内参基因均不适于作为内参基因(SD>1);所有基因在不同龄期幼虫的头部和腹部中的表达均不稳定(SD>1)。没有任何一个基因能在所有处理中稳定表达。特别是TUB在所有处理中均被认为是不稳定的基因(SD>1)(表2)。
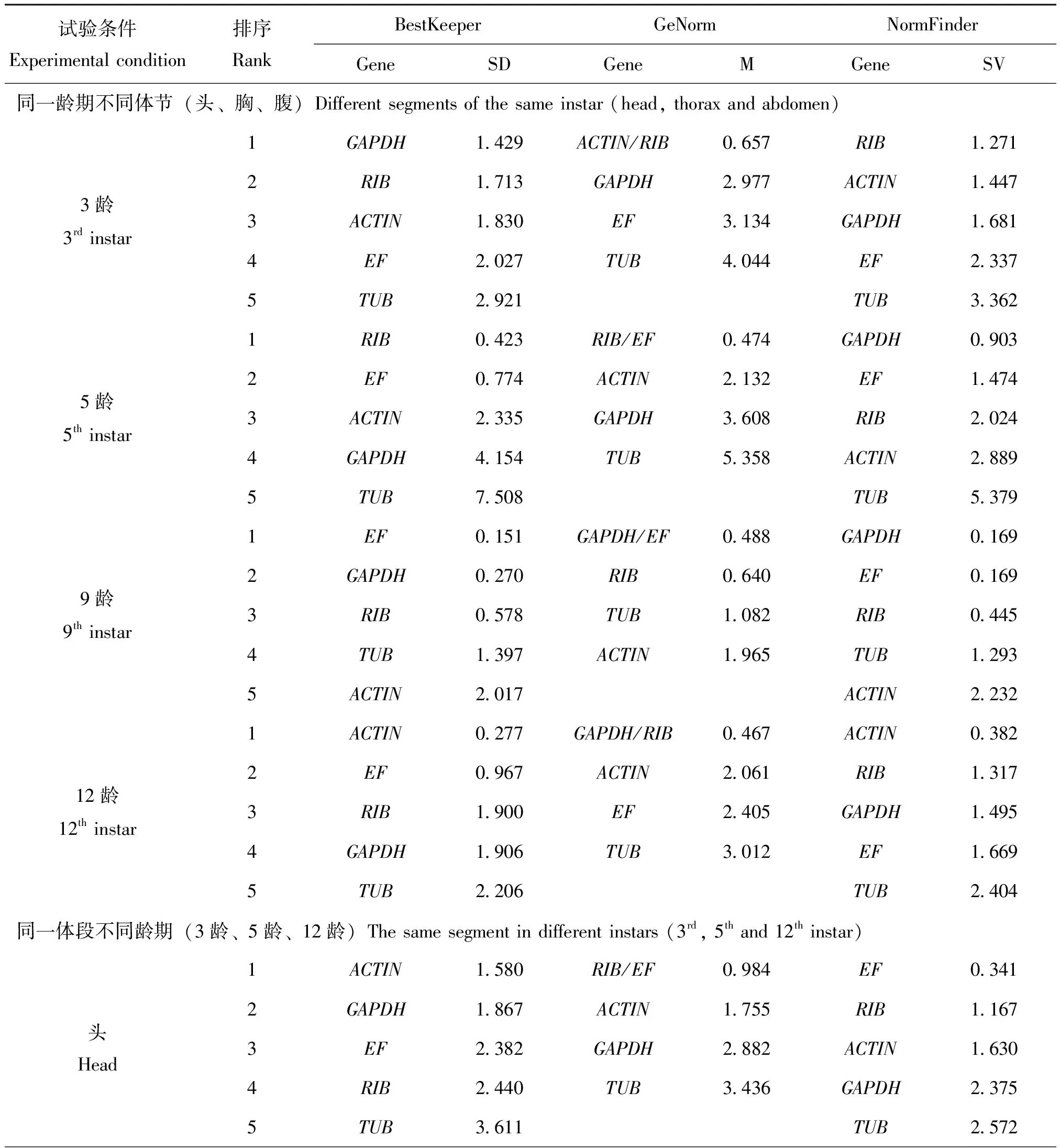
表2 不同处理下候选内参基因的表达稳定性
2.2.2GeNorm软件分析
在3龄、5龄、9龄和12龄幼虫的不同体节中,最稳定的一对基因分别为ACTIN/RIB、RIB/EF、GAPDH/EF和GAPDH/RIB,其中ACTIN在9龄幼虫的不同体节中表达最不稳定,TUB在3龄、5龄和12龄幼虫的不同体节中均被认为是最不稳定的基因;在不同龄期幼虫的头部中仅RIB和EF能稳定表达,而在不同龄期幼虫的胸部、腹部和全样品处理中,所有基因的M值均大于1.5,认为在这3个处理中无任一基因可作为内参基因(表2)。
2.2.3NormFinder软件分析
3龄幼虫的不同体节中的基因稳定性排序为RIB>ACTIN>GAPDH>EF>TUB,RIB、TUB分别为最稳定、最不稳定的基因。5龄和9龄幼虫的不同体节中,稳定性较高的前3个基因同为GAPDH>EF>RIB,而ACTIN和TUB被认为稳定性较低;ACTIN在12龄幼虫的不同体节中稳定性最高,TUB仍是稳定性最低的基因;EF是不同龄期幼虫的头部中表达最稳定的基因,而RIB是不同龄期幼虫的胸部、腹部及全样品处理中表达最稳定的基因。同样地,所有样本中最不稳定的基因均为TUB,这与BestKeeper的结果一致(表2)。
2.2.4RefFinder综合分析
3龄和12龄幼虫的不同体节、不同龄期幼虫的胸部以及全样品中,RIB、ACTIN和GAPDH是稳定性排序前3的基因,排序分别为RIB>ACTIN>GAPDH和ACTIN>RIB>GAPDH、RIB>GAPDH>ACTIN以及RIB>ACTIN>GAPDH;而EF和TUB
为稳定性较低的一对基因,其中TUB在这些处理中均为最不稳定的基因。5龄和9龄幼虫的不同体节中,排列前3的基因同为EF、RIB、GAPDH,排序分别为EF>RIB>GAPDH、GAPDH>EF>RIB;而ACTIN和TUB的稳定性较差,5龄、9龄幼虫的不同体节中最不稳定的基因分别为TUB、ACTIN。不同龄期幼虫的头部和胸部中稳定性排序均为EF>RIB>ACTIN>GAPDH>TUB(图3)。
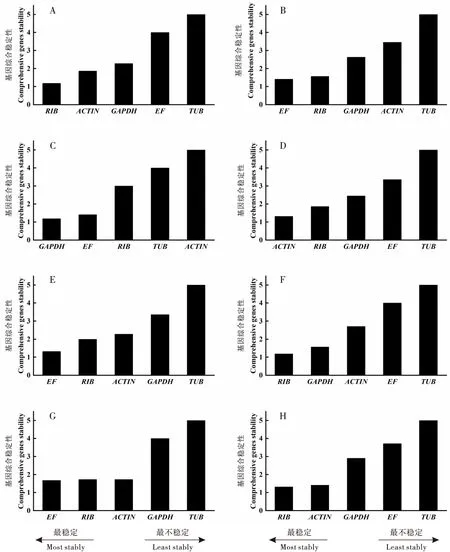
图3 基于RefFinder软件分析候选内参基因的表达稳定性Fig.3 Expression stability of the candidate reference genes was analyzed by RefFinder software注:A.、B、C、D分别为3龄、5龄、9龄、12龄幼虫的不同体节;E、F、G分别为不同龄期幼虫的头部、胸部、腹部;H为全样品。Note: A, B, C and D represented the different segments of the 3rd, 5th, 9th and 12th instar larvae, respectively; E, F and G represented the head, thorax and abdomen of different instars; H was for all samples.
2.2.5最适内参基因的确定
在8种处理中,各处理的Vn/(n+1)值均大于0.15(图4),说明通过配对变异值不能完全确定内参基因的最佳数目,但可根据Vn/(n+1)值的变化趋势,选择表达稳定性最好的2~3个基因作为最适内参基因。在5龄和9龄幼虫的不同体节、不同龄期幼虫的头部和胸部中,加入第3个内参基因会使得Vn/(n+1)值增大,故这4个处理的内参基因最佳数目均为2个;相反,在3龄和12龄幼虫的不同体节、不同龄期幼虫的腹部及全样品处理中,引入第3个内参基因会减小Vn/(n+1)值,因此这3个处理中的内参基因最佳数目均为3个。
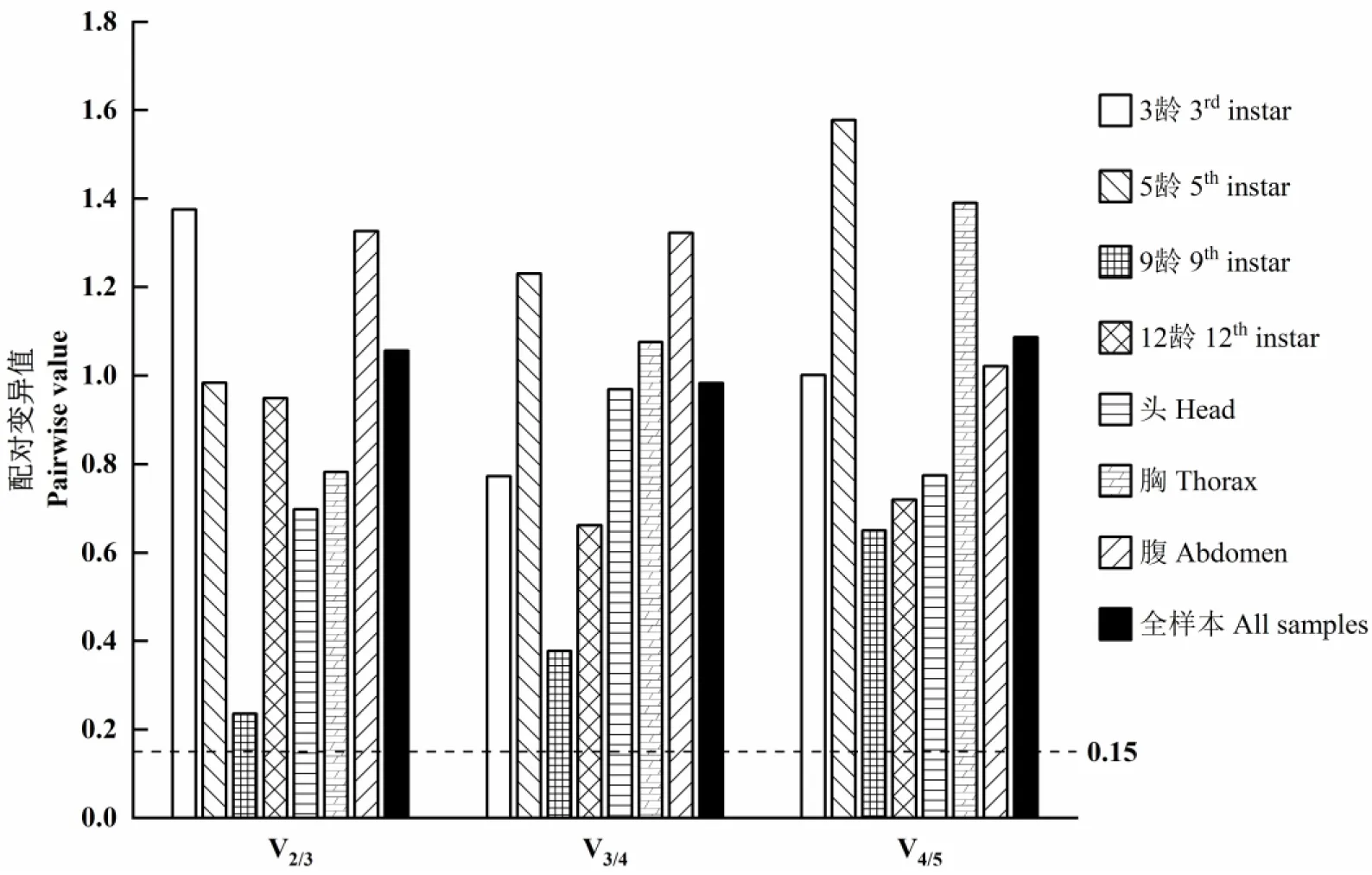
图4 基于GeNorm软件分析不同处理下所需内参基因的最适数目Fig.4 Optimal number of reference genes under different conditions was analyzed based on GeNorm software
结合RefFinder综合排序的分析(图3),3龄、12龄幼虫的不同体节及全样本中最稳定的内参基因组合为ACTIN+RIB+GAPDH;5龄幼虫的不同体节和不同龄期幼虫的头部中,EF+RIB为最稳定的内参基因组合;在9龄幼虫的不同体节、不同龄期幼虫的胸部和腹部中,可分别选择GAPDH+EF、RIB+GAPDH和EF+RIB+ACTIN作为最稳定的内参基因组合(表3)。

表3 不同处理下最佳的内参基因组合
3 结论与讨论
RT-qPCR技术是基因表达与转录分析中最常用的技术手段之一,其中内参基因的稳定性直接影响着RT-qPCR的实验结果,选择合适的内参基因是保证RT-qPCR结果可靠性的重要基础(Dundas and Ling, 2012)。迄今为止,没有任何一个内参基因在所有实验处理下保持恒定的表达水平,因此在进行RT-qPCR前,有必要进行内参基因的筛选(Shi and Zhang, 2016)。
候选内参基因的稳定性评价常采用多个方法依据相关参数进行综合分析,并根据候选内参基因的稳定性高低进行排序。在单独采用3种方法进行排序的情况下,发现在桉蝙蛾幼虫不同龄期和不同体节中通过3种方法给出的最稳定内参基因及其排序并不完全一致。如在桉蝙蛾12龄幼虫的不同体节中,BestKeeper认为ACTIN是最稳定的基因,其次为EF、RIB,GeNorm认为稳定性排序为RIB=GAPDH>ACTIN>EF>TUB,而NormFinder则认为ACTIN是最稳定的基因,其次为RIB、GAPDH(表2)。在其他昆虫的内参基因筛选中也存在类似情况(陈立华等, 2014; Yangetal., 2017),这可能与3种方法的计算方法及评价指标不同有关。因此,最终使用RefFinder对各候选内参基因的稳定性进行综合排序,以减少各软件间的结果差异。
通常以GeNorm软件给出的基因配对变异值Vn/(n+1)<0.15为参考,来确定所需内参基因的数目。但在桉蝙蛾幼虫不同龄期与不同体节中,各处理的所有配对变异值Vn/(n+1)>0.15(图4)。这种情况在许多研究中也有出现,如在二化螟Chilosuppressalis的不同龄期、不同组织和混合样品中(Xuetal., 2019),在柑橘大实蝇Bactroceraminax的不同虫体、成虫不同组织中(王佳等, 2014),在小菜蛾Plutellaxylostella的Bt毒素诱导处理中(符伟等, 2012)等。针对这种现象,GeNorm使用说明中建议,当配对变异值Vn/(n+1)>0.15时,可根据配对变异值趋势变化,选择2~3个最稳定的内参基因(Vandesompeleetal., 2002);同时,过多地引入内参基因会导致更多的不稳定因素,因此最适内参基因的数目不应超过3个(Zhuetal., 2014)。据此,在桉蝙蛾5龄和9龄幼虫的不同体节、不同龄期幼虫的头部和胸部中不应引入第3个基因使得配对变异值Vn/(n+1)增大,故内参基因的最佳数目为2;而在3龄和12龄幼虫的不同体节、不同龄期幼虫的腹部及全样本中,第3个内参基因的引入能使Vn/(n+1)值减小,故内参基因的最佳数目为3(图4)。
桉蝙蛾3龄、12龄幼虫的不同体节及全样品处理中,RIB显示出较好的稳定性(表3)。RIB是调控细胞核糖体的合成、参与细胞翻译过程的重要管家基因。与核糖体调控相关的基因在许多研究中被认为是最稳定的内参基因,如桃蛀螟Conogethespunctiferails中,RP49在不同发育时期和不同组织中最稳定(杨苓等, 2017);粘虫Mythimnaseparata幼虫不同组织中最稳定的基因为RPL12(Lietal., 2018);RPS15和RPL13可作为棉铃虫Helicoverpaarmigera幼虫不同组织中的一组内参基因(Zhangetal., 2015)。在桉蝙蛾5龄幼虫不同体节和不同龄期幼虫的头部、腹部中,EF有良好的表达稳定性(表3)。EF在虫草钩蝠蛾Thitarodesarmoricanus幼虫(Liuetal., 2016)和羽衣袖蝶Heliconiusnumata的不同组织与不同发育阶段中也均可作为最稳定的内参基因(Panetal., 2015),显示EF对这些昆虫发育阶段和组织的变化可能不敏感。在桉蝙蛾9龄幼虫的不同体节中,最稳定的内参基因为GAPDH(表3)。GAPDH(Glyceraldehyde-3-phosphate dehydrogenase)是调控糖酵解、糖异生等能量代谢过程中的一种关键酶。在大螟Sesamiainferens、甜菜夜蛾Spodopteraexigua和斜纹夜蛾Spodopteralitura的不同发育阶段中(Luetal., 2013; Zhuetal., 2014; Luetal., 2015),GAPDH是最稳定的内参基因。同样地,GAPDH在桉蝙蛾不同龄期幼虫的腹部中具有较高的稳定性,表明同一基因在不同昆虫同一实验处理下的研究结果具有一定的参考价值。在桉蝙蛾12龄幼虫的不同体节中,最佳的内参基因是ACTIN(表3)。ACTIN(β-Actin)参与细胞分裂、染色体运动、细胞器运动、胞质流动等几乎所有的真核细胞生理过程,是常用的内参基因(Chapman and Waldenstrom, 2015)。但是,ACTIN在桉蝙蛾幼虫3龄和9龄的不同体节中呈现不稳定的基因表达,这与草原毛虫属Gynaephora种群在不同海拔处理(Zhangetal., 2017)、美国白蛾Hyphantriacunea在不同温度处理(陶蓉等, 2019)下得出的结果一致,说明内参基因的使用率与内参基因的稳定性之间没有绝对的因果关系,突出针对特定昆虫与具体的实验处理进行内参基因筛选的必要性。
TUB(Tubulin)编码的微管蛋白参与包括构建和维持细胞形态、胞内运输、染色体运动与细胞分裂等许多生理过程,也常被认为是最稳定的内参基因之一。如在舞毒蛾Lymantriadispar的不同发育阶段(Yinetal., 2020)、二化螟Chilosuppressalis幼虫(Xuetal., 2019)和朱红毛斑蛾Phaudaflammans(陈炼等, 2021)的不同组织中,TUB均是最稳定的内参基因。特别地,在桉蝙蛾幼虫不同龄期和不同体节中,TUB均被认为是不稳定的基因(表3),这支持在所有实验处理中任一内参基因均不能恒定表达的观点。
从桉蝙蛾幼虫不同龄期与不同体节中,即使在同一昆虫个体内,5个基因的表达稳定性都随着虫龄和体节的变化而变化(表2、图3),并不存在绝对稳定表达的内参基因。全样品处理中的结果表明,当综合考虑桉蝙蛾幼虫的龄期与取样部位2个因素的影响时,可选择RIB和ACTIN作为内参基因。
在同一龄期不同体节中,ACTIN在12龄幼虫的不同体节中表达最稳定,但在5龄和9龄幼虫的不同体节中却不稳定;同样地,EF在不同龄期幼虫的腹部中表达不稳定,但在不同龄期幼虫的头部和腹部中表达最稳定(图3)。这表明幼虫虫龄与取样组织对内参基因筛选的结果具有较大影响,须针对特定龄期和取样组织选择合适的内参基因。桉蝙蛾幼虫的龄级较多(1~12龄),各龄期幼虫体型差异巨大,且生活史复杂,存在地栖(1~3龄或5龄,低龄幼虫)与树栖(5~12龄,中、老龄幼虫)两个截然不同的生长发育阶段,并以幼虫形态(12龄,老熟幼虫)越冬(王缉健等, 2015),推测桉蝙蛾不同龄期幼虫之间、不同幼虫体节之间的基因表达存在着较大差异,需区分特定的幼虫龄期与体节进行研究,而本研究的结果也证明了其必要性。
当然,本研究推荐了在桉蝙蛾幼虫不同龄期(3龄、5龄、9龄、12龄)与不同体节(头、胸、腹)中适用的内参基因组合,可为相似实验处理下桉蝙蛾幼虫基因表达的研究提供参考,但更多不同的实验处理未必符合这些设定,故仍需针对具体的实验处理进行最适内参基因的筛选;同时,虽然在本研究中针对多种处理而筛选出了多组内参基因,但也局限了各内参基因的应用范围,后续可进一步发掘在桉蝙蛾幼虫基因表达研究中更为广谱的内参基因。
本研究结果表明,桉蝙蛾5龄和9龄幼虫的不同体节、不同龄期幼虫的头部和胸部中选择 2个稳定表达的内参基因较为合适,而3龄和12龄幼虫的不同体节、不同龄期幼虫的腹部及全样本中需选择3个稳定表达的基因作为内参。在3龄、5龄、9龄和12龄幼虫的不同体节中,可选择ACTIN+RIB+GAPDH、EF+RIB、GAPDH+EF和ACTIN+RIB+GAPDH作为内参;不同龄期幼虫头部、胸部和腹部推荐的内参基因组合分别为EF+RIB、RIB+GAPDH和EF+GAPDH+ACTIN;同时考虑桉蝙蛾幼虫不同龄期与不同体节的因素时,推荐RIB、ACTIN和GAPDH作为内参基因。
