马立克病基因工程疫苗研究进展
2023-10-19张志会滕蔓郑鹿平刘金玲王培增王伟东张文凯樊剑鸣罗俊
张志会,滕蔓,郑鹿平,刘金玲,王培增,王伟东,张文凯,5,樊剑鸣,罗俊,5*
(1. 郑州大学公共卫生学院,河南 郑州 450001;2. 河南省农业科学院动物免疫学重点实验室/农业农村部动物免疫学重点实验室/河南省动物免疫学重点实验室,河南 郑州 450002;3. 河南省农业科学院中英禽病国际研究中心,河南 郑州 450002;4. 清丰县农业农村局,河南 清丰 457300;5. 河南科技大学动物科技学院,河南 洛阳 471003)
马立克病(Marek’s disease,MD)是由马立克病病毒(Marek’s disease virus,MDV)感染引起的一种重要的家禽免疫抑制病与肿瘤病,临床感染发病鸡主要表现为严重的免疫器官萎缩、神经损伤和内脏多发性T细胞淋巴瘤,最终导致感染鸡群大批死亡,每年给我国和世界养禽业造成巨大经济损失[1]。MDV属于α疱疹病毒亚科、马立克病病毒属,根据离株抗原性的差异,此前曾将MDV分为3种不同的血清型,包括对宿主具有致病性和致瘤性的血清1型(MDV-1),对宿主完全无致病性的血清2型(MDV-2)和血清3型(MDV-3),后者也被称为火鸡疱疹病毒(herpesvirus of turkeys,HVT)。在最新的病毒学分类中,MDV-1,MDV-2和HVT已被分别重新归类为禽α疱疹病毒2型(Gallidalphaherpesvirus2,GaAHV-2),禽α疱疹病毒3型(Gallidalphaherpesvirus3,GaAHV-3)和火鸡α疱疹病毒1型(Meleagridalphaherpesvirus1,MeAHV-1)[2]。根据对宿主鸡的致病性差异,Witter(1997)提出将MDV-1分离株又进一步分为多种不同毒力的致病型,包括弱毒MDV(mild MDV,mMDV),强毒MDV(virulent MDV,vMDV),超强毒MDV(very virulent MDV,vvMDV)和特超强毒MDV(very virulent plus MDV,vv+MDV)。
为了预防和控制MD的流行和疫情发生,MD疫苗自上世纪70年代首次研制成功后,便开始在鸡群中得到广泛应用,对MD的早期防控做出了巨大贡献。这不仅是世界上首个用疫苗成功预防肿瘤性疾病发生的案例,而且在很大程度上保障了世界家禽养殖业的健康发展。然而,自MD疫苗问世至今长达50年的广泛应用和免疫压力下,MDV的毒力也在持续增强。近年来,部分流行毒株的遗传进化和变异,更是已经突破了传统MD商品疫苗株如HVT、SB-1和CVI988/Rispens(CVI988)的免疫保护,导致我国和全球MD疫情频发[3-6]。显然,为了更好地保障世界养禽业健康发展尽快研发新一代安全高效的MD疫苗已势在必行。因此,本文回顾了MD传统疫苗的研究发展史及已取得的重大历史成就,重点对当前国内外各种新型MD疫苗、尤其是基因工程疫苗和基因编辑疫苗的最新研究进展进行了综述,同时对今后面临的重大挑战和发展前景进行了展望,以期为MD新型疫苗的创制及MD的有效防控提供重要参考。
1 MD传统疫苗
20世纪60年代,英国霍顿家禽研究站(Houghton Poultry Research Station,HPRS)的科学家Churchill(1969)首次发现,从罗德岛红鸡中分离出来的MDV-1毒株 HPRS-16可用于MD的免疫和预防。HPRS-16的首次使用,证明了用疫苗预防MD的可能性,但很快被非致病性HVT疫苗株FC-126所取代。1970年,Witter(1970)从火鸡体内分离获得HVT FC-126,该毒株对鸡完全无致病性,并且被证明对MDV的感染具有很好的免疫保护作用。作为首个商业化生产和广泛应用的MD疫苗,HVT疫苗为应对早期的MD暴发流行及有效防控发挥了关键作用,至今仍在全球使用,为世界养禽业的健康发展做出了巨大贡献。1972年,Rispens(1972a)发现荷兰某商业鸡群中未发生MD疫情但却呈现抗体阳性,随后从中分离出一个低致病性的MDV-1毒株并命名为CVI988。CVI988可通过直接接触传播,接种宿主鸡后可立即产生高度的免疫保护,体外培养时表现出完全无毒力的同时还保留了抗原性和扩散能力,并且无母源抗体的易感雏鸡接种MDV初期也只引起较弱的病变。同时,Rispens(1972b)发现安全性和效力试验也证实接种CVI988仅具有极低的早期死亡率,对鸡群的体重和产蛋等生产性能指标也无负面影响。1973年至今,CVI988已在全球许多国家获得批准上市。在过去的数十年中,CVI988一度被认为是预防MD效果最好的疫苗,被称为MD疫苗的“金标准”。为了纪念Rispens的巨大贡献,该疫苗又被称为CVI988/Rispens。1978年,Schat(1978)又分离出SB毒株并获得其克隆株SB-1,它们的体外生长特征与其他非致病性毒株明显不同。在血清学上SB毒株可与致病性的MDV-1毒株和非致病性的HVT区分开,因而将其划分为MDV-2。研究发现,SB不会引起MD病变,是一个非致瘤性毒株,并且SB-1可保护鸡免受MDV-1强毒的攻击。在我国,20世纪80年代之前仅使用过非致病性的MDV-2和MDV-3疫苗,但在东北地区暴发MD疫情后,中国农业科学院哈尔滨兽医研究所童昆周(1984)从连续多年无MD发病症状的某鸡场健康鸡群中分离获得814毒株。814是中国特有的MDV-1自然弱毒株,具有抗母源抗体干扰的能力且性能较稳定,是中国使用的第一个国产MD疫苗株,至今仍在广泛使用。
综上所述,20世纪70和80年代(图1和表1),国内外科学家研发的MD经典疫苗为全球各国MD的有效防控做出了巨大贡献。然而,近年来随着MDV毒力不断增强,尤其是vvMDV、vv+MDV和变异毒株的出现,现有MD商品疫苗对部分流行毒株已不能提供良好的免疫保护,亟需研发新的疫苗或调整免疫方案来更好地应对新的挑战。因此,有研究者如Calnek(1983)、Witter(1987)、徐宜为(1990)和Umthong[7]等,尝试将现有的经典疫苗株进行组合,生产二价或三价MD疫苗如HVT+SB-1、HVT+CVI988、HVT+CVI988+SB-1等,这些多价疫苗对MDV的感染和攻击表现出了不同效力的免疫保护,但却依然不能提供完全保护。除此之外,Schat(1985)研究表明通过连续传代衰减,可有效降低MDV体内病毒滴度以及传染能力,美国科学院院士Witter教授在20世纪80年代开始也曾尝试将不同MDV-1毒株在CEF上连续传代致弱、以提高其对MD的免疫保护效力,但在将近20年的研究中并未发现任何毒株优于CVI988。因此,除了利用基因工程方法研发新的MD疫苗之外,常规的病毒学方法已难以获得比CVI988更好的疫苗株[8]。鉴于经典的MD疫苗对当前流行的MDV毒株的免疫保护效力明显降低,迫切需要利用新技术新方法来研发安全可靠的新型高效疫苗,如重组载体疫苗或基因编辑工程疫苗等,以更好地应对新发vv+MDV和变异株带来的严峻挑战。
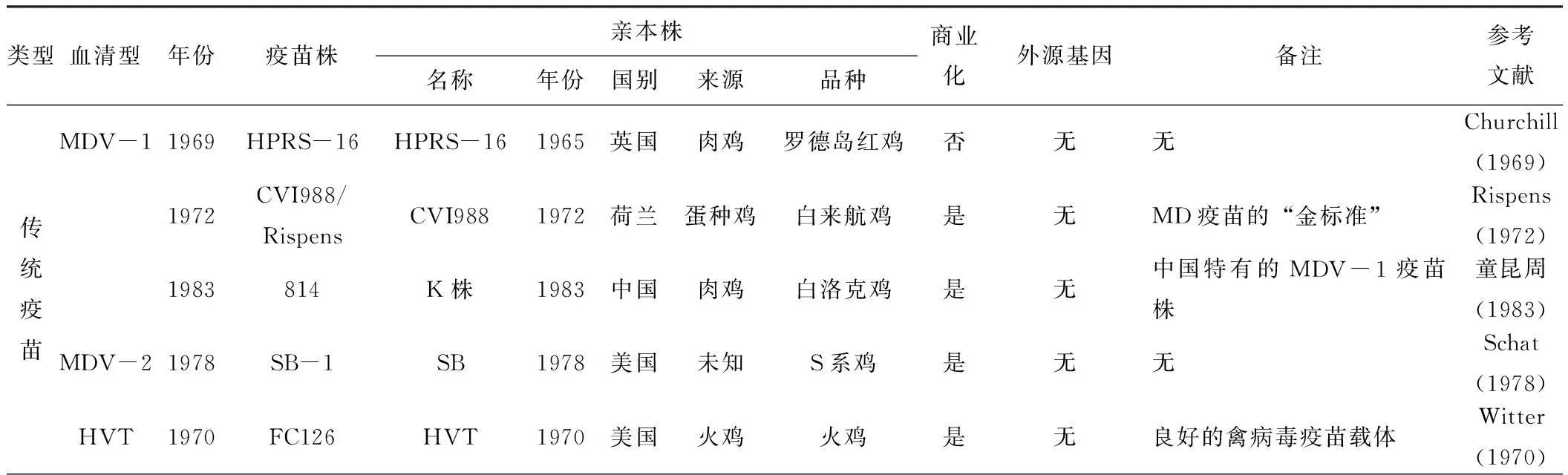
表1 MD经典疫苗和新型疫苗候选毒株背景信息
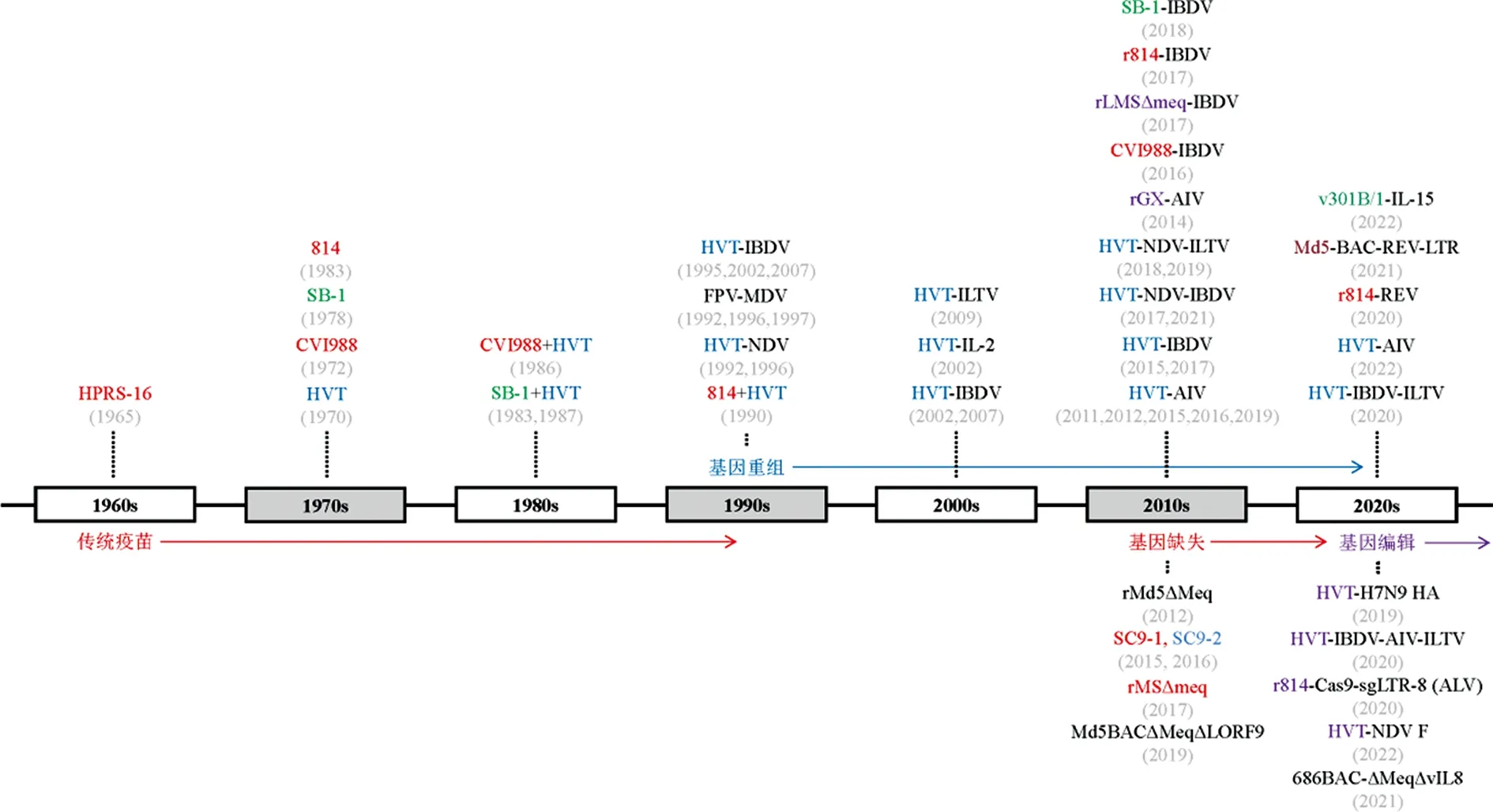
图1 过去50年MD经典疫苗和基因工程疫苗研究发展史
2 MD基因重组疫苗
MD基因重组疫苗,是将外源基因整合在对病毒增殖或传染性非必需的区域上,利用非致病性的MDV活病毒载体,在宿主体内同时表达一种或多种外源病毒抗原基因的重组载体疫苗。此类疫苗具有一剂免疫预防多种疾病、降低养殖成本、提升免疫效果的优势。早在20 世纪 90 年代,就有学者如Nazerian(1996)和Heine(1997),将禽痘病毒(fowl pox virus,FPV)作为载体表达MDV编码的单个基因(如gC、gD、UL47、UL48)或者同时表达多个基因(如gB、gE和gI或gB、gE、gI和UL32),从而达到免疫保护效果,但这些疫苗免疫效果不如CVI988,并且鸡体存在的 FPV 母源抗体会产生抑制疫苗免疫的效果,因而不具备商业化价值[9]。后续研究发现,由于 HVT不受母源抗体干扰,可以刺激体液免疫和细胞免疫并诱导终身保护,将其作为病毒载体表达外源抗原蛋白多数表现出较好的免疫效果。因此,作为家禽使用最广泛且安全有效的MD疫苗之一,HVT被认为是表达其他禽类病原体保护性抗原蛋白的良好病毒载体[10]。自20世纪90年代至今(图1和表1),HVT已被广泛用于研究和开发家禽重大传染病如禽流感(avian influenza,AI),新城疫(Newcastle disease,ND),传染性法氏囊病(infectious bursal disease,IBD),传染性喉气管炎 (infectious laryngotracheitis,ILT)等的重组载体疫苗[11-14],以期赋予家禽出色持久的免疫保护。早期认为,同时接种多种HVT载体疫苗或许可以同时应对多种病毒感染。但事实证明,不同的HVT载体疫苗之间会产生相互干扰,仅通过多种疫苗的简单组合难以实现强大的多重免疫保护目的[15],这可能是由于不同疫苗株在宿主体内增殖速度不同所致[8]。为解决此问题,Gergen等[16]将 NDV的融合蛋白(F)基因和来自ILTV的 gD 和 gI 基因插入到HVT基因组非必需区域US2中构建了双重重组病毒(HVT-NDV-ILT),在细胞培养和感染鸡中连续传代后,该重组病毒在遗传和表型上均完全稳定,证明HVT作为病毒载体有能力接受多个外源基因的插入,可以用于开发针对多种不同家禽疫病的HVT载体疫苗。之后,通过US2基因位点,还有研究人员构建出一种同时含有NDV-F基因和IBDV-VP2基因的双重HVT重组疫苗(HVT-ND-IBD),该疫苗可以同时抵抗MDV、NDV和IBDV的攻击,进一步证实外源基因的插入并未改变HVT载体的安全性[17]。如表1 列示,这种可同时表达多种外源基因或抗原蛋白的HVT载体疫苗[18-24],为MD基因工程重组疫苗的研发打开了新的思路,这也是通过改变疫苗研发策略来控制家禽传染病的重大技术创新之一。
最近10年,一些科学家也开始尝试利用MDV-1疫苗株或候选毒株(如CVI988、814、GX0101Δmeq、rLMSΔMeq)和MDV-2疫苗株(如SB-1和v301B/1)作为病毒载体(表1 和图1)研发MD基因重组疫苗[25-30]。为了便于读者更好地理解,本文对用于上述研究的3种不同血清型MDV载体的相关基因区域进行了汇总(图2和表2)。目前,部分HVT 载体疫苗,如Vectormune-ND(诗华)、Innovax-ILT、Innovax-ND-IBD和Innovax-ND-ILT(英特威)、Vaxxitek®HVT+IBD(vHVT-013-69株)、Vaxxitek®HVT+IBD+ND和 Vaxxitek®HVT+IBD+ILT(勃林格殷格翰)等已得到商业化许可和推广应用[31]。2022年,勃林格殷格翰动物保健(美国)有限公司(Gainesville生产厂)生产的HVT-IBD疫苗(vHVT-013-69株)在我国的变更注册刚刚获得农业农村部的正式批准。

表2 MD基因重组疫苗外源基因插入位点及候选疫苗株列表

图2 MD基因重组疫苗候选毒株外源基因插入位点示意图
3 MD基因缺失疫苗
利用传统的基因同源重组系统(homologous recombination system,HRS),黏粒(cosmid)或 F 黏粒(fosmid)基因组文库技术,细菌人工染色体(bacterial artificial chromosome,BAC)和基因同源重组技术,可以有效地对MDV基因组中特定的基因或位点进行操作获得重组病毒,如敲除MDV编码的关键基因pp38[32]、vTR[33]和vIL-8[34]等,但获得的相关疫苗候选株对鸡仍存在一定致病性,未能商业化应用。meq基因是MDV特有的致瘤基因,Jones(1992)提出其表达的Meq蛋白结构与肿瘤蛋白FOS结构相似,被认为是一种致瘤蛋白和转录激活因子。Lupiani等[35]在敲除MDV强毒株的meq基因后,发现病毒虽然不再具有致瘤作用,并且在meq回复表达后病毒显示出与亲本毒相似的特性,表明meq在MDV致瘤中发挥关键作用。因此,将meq基因进行敲除,构建一系列的MD基因缺失疫苗候选株,在本世纪的第一个10年已成为新的研究热点(图1和表1)。随着对meq基因缺失毒株的深入研究,发现虽然其致瘤性丧失,但仍具有一定程度的诱导宿主淋巴器官萎缩的免疫抑制能力。为解决这一问题,2012年Lee等[36]将MDV基因缺失毒株rMd5Δmeq进行传代致弱,以减弱meq基因缺失毒株导致的淋巴器官萎缩。有趣的是,经过传代致弱,虽然meq基因缺失疫苗的安全性得以提升,但其应对vv+MDV的保护作用却显著降低。因此,如何平衡MD疫苗的安全性和有效应对vv+MDV的感染,是一个亟待解决的问题。2019年,Sun等[37]根据前期研究发现lorf9基因缺失或可抵消这种淋巴器官萎缩的提示,进一步构建了meq和lorf9双基因缺失的MDV毒株Md5BAC ΔMeqΔLORF9,结果发现该候选疫苗株成功消除了诱导宿主淋巴器官萎缩的能力。2021年,Liao等[38]在敲除vv+MDV分离株meq基因的基础上进一步敲除vIL8基因,获得了双基因缺失毒株686BAC-ΔMeqΔvIL8,该基因缺失毒株不仅表现出与CVI988相当的免疫保护能力,而且与单独缺失meq基因的毒株相比,诱导宿主淋巴器官萎缩的能力显著减弱。此外,还有研究发现在meq基因缺失的基础上,继续敲除MDV编码的胸苷激酶(thymidine kinase,TK)基因,虽然也可减轻感染宿主的淋巴器官萎缩但其免疫保护效果并不好[39]。上述研究结果为今后开发更加高效、安全的MD疫苗候选株提供了可能。同时,为了更好地应对MDV流行毒株的感染和攻击,消除meq基因缺失毒株的宿主免疫抑制能力,也是今后疫苗研究的另一项关键任务。
目前,我国已有2个具有自主知识产权的meq基因缺失毒株生产的MD疫苗获得国家新兽药注册证书,分别为SC9-1和rMDV-MS-Δmeq毒株。其中,Li等[40]在vvMDV国内分离株GX0101(2001年分离自广西省发病鸡群)的BAC克隆基础上,通过同源重组敲除meq基因,从而获得重组毒株GX0101Δmeq。Su等[41]进一步敲除该毒株携带的卡那霉素抗性基因,从而获得疫苗株SC9-1(即GX0101ΔmeqΔkal)。研究表明,SC9-1对Md5的攻毒免疫保护效果均优于CVI988,并且SC9-1的meq基因敲除具有很好的遗传稳定性,各项试验均表明SC9-1具备良好的免疫保护效果[42]。随后,Su等[43]又在SC9-1疫苗株的基础上,利用Cre-LoxP系统敲除病毒基因组中重组的BAC序列,进一步获得SC9-2候选疫苗株。然而,SC9-2虽然具有免疫保护作用,但其可对宿主产生免疫抑制,暂不具备作为最佳疫苗候选株的条件。随后为了消除SC9-2引起的宿主免疫抑制,将其在细胞上连续传代致弱,得到第10代及第40代毒株并分别命名为SC9-2/10和SC9-2/40,最终动物试验结果发现SC9-2/40对SPF鸡的保护作用优于CVI988[44],表明MD疫苗候选株对宿主的免疫抑制作用可通过传代致弱消除,从而生产一种安全有效的MD疫苗,这与Lee等[45]此前的研究结论一致。2017年,张艳萍等[46]以体内外复制速度较快的MDV-1分离株LMS(2007年分离自中国西南发病鸡群)为亲本毒株[47],通过BAC克隆和两次同源重组获得疫苗候选株rMSΔmeq。进一步的研究证实,该基因缺失毒株可有效应对vvMDV标准毒株Md5和部分中国变异株(如LCC和LTS)的攻毒并提供良好免疫保护。至今,上述2种meq基因缺失疫苗均已实现科技成果转化、商业化生产和推广应用。但与传统的MD经典疫苗尤其是液氮苗相比,它们目前的市场占有率仍较小,对我国鸡群MD防控成效仍有待进一步观察。
4 MD基因编辑疫苗
成簇的规律性间隔短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPR)和Cas9蛋白组成的CRISPR/Cas9基因编辑系统,自2013年Cong等[48]首次成功用于真核细胞的基因编辑以来,近年来也广泛应用于病毒基因组的改造,特别是一些致瘤性病毒和疱疹病毒,已成为病毒学研究的热点,如人类乙肝病毒(hepatitis B virus,HBV)[49],高危人乳头瘤病毒(high-risk human papillomavirus,HR-HPV)[50]以及鸡疱疹病毒,鸭肠炎病毒(duck enteritis virus,DEV)[51],猪伪狂犬病病毒(pseudorabies virus,PRV)[52]等。在CRISPR/Cas9系统中,向导RNA(gRNA)几乎可介导Cas9蛋白酶靶向编辑任何基因或位点,从而实现基因组的定点突变、敲除或插入。在病毒学研究领域尤其是大基因组DNA病毒的基因编辑中,利用该项技术已取得了一系列重要的研究进展[53-55],其中包括MDV的基因编辑、功能研究、抗体筛选及疫苗研发等[56-60],均展现出了极好的技术优势。
2016年,Yao等[61]首次报道利用CRISPR/Cas9系统改造家禽疱疹病毒的基因组,在HVT中引入靶向突变,快速高效地构建相应的HVT疫苗载体。最近几年,国内外陆续报道了多项利用CRISPR/Cas9系统构建MDV基因编辑毒株的研究,比如以Md5、GX0101等超强毒株或CVI988疫苗株为对象,敲除其全部或部分meq基因,或者以HVT疫苗株FC-126为载体靶向插入外源病毒基因构建重组疫苗株。2019年,Chang等[62]利用基因编辑和同源定向修复(homologous directed repair,HDR)将H7N9 HA表达盒插入HVT基因组的UL45/46位点(图2),构建了HVT-H7N9 HA二价疫苗株(表2),并首次利用CRISPR/Cas9编辑病毒表达的AIV HA蛋白可与红细胞结合的特性,来优化候选疫苗株的筛选效率。因此,作为稳定的疫苗载体平台之一,HVT疫苗株与新型基因编辑技术相结合,可能会进一步提高基因重组疫苗的实用性。
在最新的研究中(图1、图2和表2),研究人员利用非同源末端连接(non-homology end joining,NHEJ),CRISPR/Cas9和Cre-LoxP系统3种方法结合的途径,将NDV的F蛋白基因插入到HVT基因组UL45/46基因间区,构建的重组病毒rHVT-F可成功应对基因XII型NDV野毒株的攻毒[63]。此类利用多种新型技术构建HVT基因编辑的重组疫苗,不仅为病毒载体疫苗研究打开了新的视野,也为更实用更稳定的MD疫苗研发开辟了新方向。有趣的是,Tang等[64-65]利用CRISPR/Cas9系统,成功的将ILTV-gD-gI和H9N2-AIVHA表达盒分别插入到重组病毒HVT-IBDV-VP2基因组的HVT065/066和US2位点,构建了三重插入的HVT-VP2-gDgI-HA重组疫苗株。这是首个成功制备的三重重组HVT疫苗候选株,免疫后具有可同时保护家禽的4种主要病毒病如MD、IBD、AI和ILT的潜力。
更有趣的是,2021年Challagulla等[66]通过CRISPR/Cas9基因编辑技术,培育出一种可稳定表达靶向MDV编码的病毒基因ICP4的转基因鸡。研究发现,表达ICP4-gRNAs/Cas9的转基因鸡,与仅转染Cas9基因的野生型对照鸡相比,攻毒后体内的MDV复制水平明显减少,说明CRISPR/Cas9系统或可用于MD的抗病育种,具有潜在的应用前景。此外,Liu等[67]使用MDV-1疫苗株814来递送靶向J亚型禽白血病病毒(avian leukosis virus subgroup J,ALV-J)长末端重复序列区(long terminal repeat,LTR)的Cas9/sgRNA,成功构建了r814-Cas9-sgLTR-8疫苗株。这是首次使用疱疹病毒作为CRISPR/Cas9系统的体内递送载体,用于抗病毒基因治疗或免疫的报道。这种基于CRISPR/Cas9系统、通过MDV递送并在体内进行ALV-J靶向切除的可行性及有效性,为鸡慢性病毒感染的基因治疗提供了新思路。上述研究充分利用了CRISPR/Cas9基因编辑系统所具备的快速、高效、简便的特点,为MD疫苗研究及抗病毒治疗开辟了新的途径。
5 其他新型疫苗
除了前述的MD基因重组疫苗、基因缺失疫苗和基因编辑疫苗之外,科学家们也一直在尝试通过不同的方式插入某些特定的外援基因或病毒序列,以期获得具有特定生物学功能的疫苗,以期提供更好的免疫保护效果。此前研究发现,国内分离株GX0101是一株基因组中自然重组了禽网状内皮组织增生症病毒(reticuloendotheliosis virus,REV)LTR基因片段的MDV-1流行毒株,并且REV-LTR的重组插入可显著增强MDV的水平传播能力,具备提升候选疫苗株免疫效果的潜力。2021年,Ellington等[68]将REV-LTR插入到MDV强毒株rMd5的基因组中获得了Md5-BAC-REV-LTR株,但与早期研究结果相似,插入REV-LTR应对MDV强毒攻击的免疫保护效果并不理想[69-70]。此后,该研究团队将Md5-BAC-REV-LTR连续传代40次,然后发现此时的传代病毒在感染宿主的早期和晚期均未引起免疫抑制,对MDV强毒的早期攻击也具有高度保护性。这一结果与Song等[71]将REV-LTR插入到CVI988疫苗株基因组中获得的研究结果基本一致。 REV-LTR的插入显著改变了MDV的部分生物学特征,比如水平传播力,但其具体的机制仍有待进一步深入研究。此外,也有研究人员尝试从利用宿主细胞因子的角度来提升MD疫苗的免疫效力。最近,Kim等[29]在MD疫苗株v301B/1基因组的UL3.5/UL4位点插入了鸡白介素-15(IL-15,一种可促进T细胞增殖并增强T细胞反应的宿主细胞因子),从而构建了重组疫苗株v301B/1-IL-15,并将双价苗HVT+v301B/1-IL-15与HVT+v301B/1进行了比较。结果发现,虽然两组疫苗之间在免疫保护效果上不存在显著差异,但插入IL-15具有减少MDV在胸腺复制或从羽毛囊脱落的潜力,这为今后MD疫苗的进一步优化或根据需要调整MD双价苗组合策略提供了新思路。
6 总结与展望
MD是世界上首个使用疫苗成功预防肿瘤性疾病发生的案例,自20世纪70年代至今,MD疫苗的创制及广泛应用已为全球家禽养殖业挽回了巨大的经济损失。随着MDV的不断进化、毒力增强、毒株变异以及新兴生物科学技术的快速发展,MD新型疫苗的研究和开发一直是该领域的热点。目前,全球市场销售的商业化MD疫苗,不仅有经典的单价苗HVT、SB-1、CVI988、814、MDV-CVTR(肇庆大华农,http://www.moa.gov.cn/nybgb/2021/202110/202112/t20211207_6384100.htm)等,还有通过各种技术手段制备的MD多价苗,如HVT重组载体疫苗株Vectormune-ND(诗华),Innovax-ILT(英特威),Innovax-ND-IBD(英特威),Innovax-ND-ILT(英特威),Vaxxitek®HVT+IBD(又称vHVT-013-69,勃林格殷格翰),Vaxxitek®HVT+IBD+ND(勃林格殷格翰)和Vaxxitek®HVT+IBD+ILT(勃林格殷格翰)等,基因缺失疫苗SC9-1和rMDV-MS-Δmeq,以及二价苗HVT+SB-1、CVI988+HVT、CVI988+814、814+HVT、CVI988+vHVT-013-69等。值得一提的是,利用新一代CRISPR/Cas9 基因编辑技术构建MD基因重组疫苗、基因缺失疫苗或者病毒载体疫苗,均已取得了良好进展。从不同的角度和采用不同的策略,尝试提升疫苗株抗原性及免疫效力,将成为未来数年间MD疫苗研究中最受关注的方向和内容。
然而,在现代生物学技术飞速发展的背景下,虽然MD疫苗研究已取得了很多重要进展,但当前全球MD的防控仍存在诸多亟待解决的问题。众所周知,MD疫苗只能预防野毒感染诱发的肿瘤形成、神经病变以及免疫抑制,但无法阻断MDV的感染和传播,不完美的疫苗免疫保护甚至可能促进病毒的毒力增强及传播[72],过去50年随着MD传统疫苗广泛持久的应用,MDV不断向毒性更强的方向进化或变异,在疫苗株和野毒株之间也已发生基因重组并形成新的MDV流行毒株[73]。更重要的是,已有研究表明经典的MD单价苗及多价苗,在预防vv+MDV 感染和攻击中并未显示出明显优势[74],而最新分离的一些MDV野毒株也已经突破了现有主流MD疫苗产品的免疫保护[4,75-76]。显然,vv+MDV、自然重组毒株、尤其是MDV变异株的相继出现和流行,进一步增加了MD临床诊断、免疫预防和有效控制的难度。
当前的MD免疫失败,究其原因可能与以下几个主要因素有关。首先,在过去的20年尤其是最近5~10年间,在巨大的MD疫苗免疫压力下,中国鸡群流行的MDV超强毒株和变异株在遗传进化路线上,已与传统的MD疫苗株产生了巨大的遗传距离[3],这很可能导致传统疫苗株的抗原性对当前流行毒株或变异株匹配不足。其次,MDV的毒力增强,往往会导致流行毒株的增殖速度加快、潜伏期缩短,而MDV变异株的低水平复制则可能导致其免疫逃逸能力增强和病程延长,这两种情况均会增加MD疫苗免疫空窗期野毒感染的机率。最近几年,对市场销售的MD传统疫苗质量评估和监测结果显示,在使用环节,部分疫苗尤其是HVT冻干疫苗,活病毒效价未达到国标要求,实际应用效果令人堪忧[77],这在一定程度上导致免疫失败及MD疫情频繁发生[5]。
鉴于上述情况,若想获得更好的免疫防控效果,今后在疫苗研发和使用上需要很好把握如下关键问题:一是要尽可能使用最新分离自我国鸡群的优势流行毒株作为亲本株,开发具有自主知识产权的MD新型疫苗。无论是基因重组疫苗、病毒载体疫苗,还是基因缺失疫苗,均需要在平衡好疫苗安全性和免疫效力的同时,尽快实现疫苗株或载体病毒的迭代升级,扩大疫苗免疫保护范围,更好地应对MDV毒力增强和毒株变异带来的新挑战。二是充分发挥现有MD商品疫苗的免疫潜力,在加强流行病学监测、流行毒株致病性分析和疫苗免疫保护效果评价的前提下,调整免疫程序和接种方式,针对不同品系鸡制定最佳的疫苗接种方案,取得最好的免疫防控效果。由于MDV具有严格的宿主细胞结合性,MD疫苗必须以活细胞为载体进行保存、运输和接种,这无形中增大了MD疫苗在生产、储存、解冻、稀释和管理条件等方面的难度。因此,还需要进一步研究提高MD疫苗的生产工艺和操作程序,确保最佳的疫苗效力。MD特超强毒株和变异株的不断出现,迫切需要尽快研发出高效、稳定、安全的MD新型疫苗以应对未来MD免疫防控更加艰巨的挑战。
