pH 响应壳聚糖马来酸盐水凝胶制备及其缓释性能
2023-10-19王洪玲陈思远丁俊阳刘长霞
李 英,李 煦,王洪玲,陈思远,丁俊阳,刘长霞
(沧州师范学院化学与化工系,河北沧州 061000)
水凝胶是一种具有三维网络结构、良好溶胀性能和响应性能的功能软物质,在药物缓释、组织工程、抗菌材料等领域应用广泛[1-2]。响应性水凝胶能够感应外界环境刺激(如pH、温度、酶、离子等),控制药物释放[3-4]。其中,pH 响应型水凝胶在药物缓释体系中研究最广泛,主要由于人体生理环境、病灶区域的pH 变化,水凝胶产生溶胀或收缩,进而缓释药物。pH 响应型水凝胶网络结构中一般含有pH 敏感的酸性、碱性基团(羧基、磺酸基或氨基等)或基于pH 响应的动态共价键。根据响应型基团又可分为阴离子型、阳离子型和两性离子型pH 响应性水凝胶药物缓释体系[5]。
壳聚糖是甲壳素脱乙酰化产物,自然界中存在的唯一碱性多糖,含有大量的氨基和羟基活性基团,具有良好的生物相容性、成膜性、凝胶性和吸附性等,为其功能化提供方便[6-9]。离子交联壳聚糖制备的聚阳离子型水凝胶在酸性介质中展现良好的溶胀性能[10-12];羧甲基改性壳聚糖制备的阴离子型水凝胶在碱性介质中展现良好溶胀性能[13]。接枝聚合物-丙烯酸壳聚糖分子结构包含酸性和碱性基团,其在酸性、碱性介质中比中性介质中的溶胀度大,表现出两性离子型特性[14]。Panda 等利用分子结构中同时存在酸性、碱性基团的小分子二肽自组装构筑的水凝胶在酸性、碱性介质中释药能力高于中性介质[15],展现了两性离子型水凝胶特性。两性离子型水凝胶由于其独特的pH 响应性能,在药物缓释、组织工程、传感器研究等方面应用范围更加广泛[16]。然而,两性离子型pH 响应壳聚糖水凝胶在药物缓释方面的研究未见报道。
马来酸在食品、医药等方面应用广泛[17]。本课题组对壳聚糖马来酸盐(CS–Ma)的研究表明,马来酸作为一种不饱和二元酸,一个羧基使壳聚糖氨基质子化,二者发生静电作用;另一个羧基与氨基发生氢键作用,不饱和二元酸分子交联两个壳聚糖分子链,马来酸分子间π–π作用促进超分子自组装[18]。CS–Ma分子结构中存在羧基、氨基等酸性、碱性基团,有望构筑两性离子型pH 响应壳聚糖水凝胶。有些保健食品或营养素微溶于水,易溶于碱性溶液,分子结构中可能存在酚羟基、氨基和羧基等基团。利用Na2CO3溶液调控CS-Ma 分子间氢键、静电等非共价键作用使其胶凝化过程中,不仅可以改善这类物质的溶解性能,使其良好地分散在水凝胶中,而且可能改善其缓释性能。以阿莫西林(Am)为模型,研究CS-Ma 凝胶体系的溶胀性能、缓释性能的pH 响应性,为开发新型壳聚糖基pH 响应缓释载体提供理论依据和实验基础。
1 材料与方法
1.1 材料与仪器
壳聚糖 脱乙酰度85.7%,粘度200 cps,济南海得贝海洋生物工程有限公司;马来酸 分析纯,天津市化学试剂一厂;pH 缓冲剂 上海伟业仪器厂;阿莫西林 分析纯,上海衡山药业有限公司。
Nicolet is5 傅里叶变换红外光谱仪 美国赛默飞世尔科技有限公司;UV-2600 紫外可见分光光度计 日本岛津企业管理有限公司;TM3030 台式扫描电子显微镜 日本株式会社日立高新技术那珂事业所;LGJ–18 真空冷冻干燥机 北京松源华兴科技发展有限公司。
1.2 实验方法
1.2.1 CS–Ma–Gel 制备方法
1.2.1.1 CS–Ma 浓度对凝胶的影响 根据文献[18]方法制备CS-Ma。分别称取2.5、5.0、10.0、20.0、25.0 mg CS-Ma 置于5 mL 螺口瓶中,加入1.0 mL 蒸馏水,搅拌至溶解。然后,分别加入0.5 mL 质量分数4%的Na2CO3溶液,室温下搅拌0.5 h,利用“倒管”实验[19]观察CS-Ma 浓度对凝胶行为的影响。
1.2.1.2 Na2CO3浓度对凝胶的影响 称取20.0 mg CS-Ma 置于5 mL 螺口瓶中,加入1.0 mL 蒸馏水,搅拌至溶解,然后分别加入0.5 mL 质量分数为0.5%、1.0%、2.0%、3.0%、4.0%、5.0%的Na2CO3溶液,室温下搅拌0.5 h,利用“倒管”实验观察Na2CO3溶液浓度对凝胶行为的影响。
1.2.2 载药CS-Ma-Gel 的制备方法 称取0.20 g CS–Ma 置于 50 mL 烧杯中,加入10 mL 蒸馏水,充分搅拌至全部溶解,再加入0.02 g 阿莫西林(Am),搅拌均匀,最后加入5 mL 质量分数4%的Na2CO3溶液,室温下搅拌0.5 h,得到包埋Am 的壳聚糖水凝胶(Am/CS-Ma-Gel),冷冻干燥,备用。
1.2.3 测试与表征
1.2.3.1 结构表征方法 a.红外光谱(FT–IR)分析:分别取少量的CS-Ma、Am,冷冻干燥的CS-Ma-Gel、Am/CS-Ma-Gel 和适量KBr 粉末混合,充分研磨,装入模具,15 MPa 下压片1 min,测绘红外光谱[12]。采集参数:扫描范围4000~500 cm-1,分辨率4 cm-1,扫描次数16 次。
b.扫描电子显微镜(SEM)观察:将CS-Ma-Gel、Am/CS-Ma-Gel 样品分别放入无水乙醇中,充分搅拌分散,转移到单晶硅片上,真空干燥24 h,喷金60 s,利用SEM 观察形貌,放大倍率18000 倍。
c.紫外光谱(UV)分析:分别取2 mL CS-Ma 溶液、Am 溶液于1 cm 比色皿中,测绘紫外光谱。分别取少量CS–Ma–Gel、Am/CS-Ma-Gel 于0.1 cm 的比色皿中,测绘紫外光谱[19]。设置扫描波长范围为200~400 nm。
1.2.3.2 CS-Ma-Gel 溶胀性能测定 分别取pH2.00(HCl 溶液)、4.00、6.86 和9.18 的标准缓冲溶液25 mL于50 mL 烧杯中,称量后的干凝胶片置入其中,每隔一段时间取出凝胶片,用滤纸将表面水擦干,称重,记录,重复以上操作,每个实验平行三次,计算平均值,按下式计算干凝胶溶胀率(SR,%)[19]:
式中:m0表示干CS-Ma-Gel 质量,g;mt表示溶胀后的CS-Ma-Gel 质量,g。
1.2.3.3 Am/CS-Ma-Gel 药物释放率测定 称取0.01 g干Am/CS-Ma-Gel,装入无纺布袋中,浸入不同pH的介质中,每间隔一定时间,取出2 mL 溶液于比色皿中,测定吸光度值,利用相应的标准曲线计算Am 浓度,每个实验平行三次,计算平均值,按下式计算累计释放率(Q,%)[20]:
式中:Q 表示Am 释放率,%;Cn表示第n 次溶液中Am 的浓度,mg/mL;V 表示浸泡溶液的体积,mL;m0表示Am/CS-Ma-Gel 中Am 的质量,mg。
1.3 数据处理
采用Origin 8.5 软件,多曲线叠加绘制红外、紫外光谱图,溶胀和药物释放测定实验重复3 次,数据结果用“平均值±标准差”表示并绘制图谱。
2 结果与分析
2.1 CS-Ma-Gel 制备
2.1.1 CS-Ma 浓度对凝胶的影响 按照实验方法“1.2.1.1”,“倒管”实验结果如图1 所示。由图1 可以看出,当瓶中CS–Ma 浓度为6.7 mg/mL 时,凝胶开始形成;浓度为13.3 mg/mL 时,凝胶完全。因此,CS–Ma 临界成胶浓度为13.3 mg/mL。

图1 CS–Ma 浓度对胶凝行为的影响Fig.1 Effect of CS-Ma solution concentration on CS–Ma gelation
2.1.2 Na2CO3溶液浓度对凝胶的影响 按照实验方法“1.2.1.2”,“倒管”实验结果如图2 所示。

图2 Na2CO3 溶液浓度对凝胶行为的影响Fig.2 Effect of NaCO3 solution concentration on CS–Ma gelation
凝胶是凝胶因子的溶解与沉淀达到平衡时的介稳状态[21]。由图2 可知,当Na2CO3溶液浓度为1.36%时凝胶完全,可能是由于壳聚糖的–NH3+部分去质子 化–NH2,马来酸的–COOH 部分离子化–COO–,该条件下壳聚糖与马来酸之间的静电作用(–NH3+···–COO–)、氢键作用(–COOH···–NH2)较强,有利于分子间的超分子组装,凝胶形成。
通过以上实验可知,CS–Ma 的临界成胶浓度为13.3 mg/mL,Na2CO3溶液质量分数为1.36%。
2.2 CS–Ma–Gel 结构表征
2.2.1 红外光谱分析结果 由CS–Ma 的红外光谱(图3(a))可知:1659 cm-1处为马来酸C=C 双键与壳聚糖酰胺I 带(νC=O)的重叠峰;CS–Ma 在1451 cm-1,610 cm-1处出现马来酸=C–H 伸缩振动和变形振动峰;在CS–Ma 红外光谱中,壳聚糖1595 cm-1处的酰胺II 带(δN-H)和氨基(δN-H)弯曲振动峰质子化后红移至1562 cm-1而且加强;CS–Ma 在1400 cm-1处出现–COO–特征振动峰,而且在1713 cm-1处仍然保留–COOH 振动峰,以上现象表明,壳聚糖分子链上成功引入马来酸分子,壳聚糖的–NH3+与马来酸–COO–发生静电作用[18]。由CS–Ma–Gel 的红外光谱(图3(b))可知,CS–Ma 凝胶后,1562 cm-1处振动峰蓝移,1713 cm-1处–COOH 振动峰减弱,1520 cm-1出现新特征峰,主要是壳聚糖的–NH3+部分去质子化–NH2,马来酸的–COOH 部分离子化–COO–,它们之间发生静电、氢键等作用[12,22-23],交联凝胶形成。由Am/CS–Ma–Gel 的红外光谱(图3(c))可知,在1624 cm-1,1400 cm-1处出现–COO–伸缩振动峰[24],在1172~891 cm-1区间(图3 斜线阴影区)出现糖环中C–O–C 和C–O 振动峰和β糖苷键的特征峰[25],在1620~1200 cm-1区间(图3 方格阴影区)内出现Am(图3(d))复杂的振动峰;Am(图3(d))3534 cm-1,3374 cm-1,3463 cm-1处的氨基,羟基振动峰,在Am/CS–Ma–Gel 的红外光谱图(图3(c))中发生明显变化。以上变化表明Am 与壳聚糖之间发生氢键、静电作用,可能发生共组装。

图3 凝胶及原料红外光谱Fig.3 FT-IR spectra of xerogel and raw material powder
2.2.2 紫外光谱表征 由图4(a)表明,CS–Ma 溶液在211 nm 处最大吸收峰归属于马来酸的不饱和双键特征峰[17];在CS–Ma–Gel 中,该吸收峰加宽而且发生红移,并在260 nm 附近产生新的吸收峰(图4(c)),表明在CS–Ma–Gel 形成过程中,分子间发生π–π超分子相互作用[18]。Am 溶液在248 和290 nm 特征吸收峰归属于苯酚特征峰(图4(b)),在Am/CS–Ma–Gel 中,Am 溶液290 nm 处的特征吸收峰蓝移至280 nm(图4(d)),说明Am 发色团在凝胶过程中发生H–聚集[26]。

图4 原料溶液及凝胶的紫外光谱Fig.4 UV spectra of gels and raw material solution
2.2.3 电子扫描显微镜表征 由图5(a)可以看出,CS–Ma–Gel 微观形貌为纤维状。正如红外光谱(图3)、紫外光谱(图4)表征表明,CS–Ma–Gel 形成过程中分子间发生氢键、静电、π–π堆积等非共价键作用,壳聚糖分子链间通过马来酸分子交联进行超分子有序组装,形成纤维结构(图6)。由图5(b)可以看出,载药凝胶Am/CS–Ma–Gel 微观结构为片状,结构均匀,没有分相现象。红外光谱(图3)、紫外光谱(图4)表明,Am 与壳聚糖分子之间存在氢键、静电作用而且自身发生H–聚集。以上结果表明,Am 较好地分散在CS–Ma–Gel 的网状结构中而且参与了超分子组装(图6),微观结构由CS–Ma–Gel 较细的纤维结构变成Am/CS–Ma–Gel 的片状结构。

图5 CS–Ma–Gel 和Am/CS–Ma–Gel 的电子扫描显微镜图Fig.5 SEM images of CS–Ma–Gel and Am/CS–Ma–Gel

图6 Am/CS–Ma–Gel 组装机理示意图Fig.6 Diagram of Am/CS-Ma-Gel assembly mechanism
2.3 CS–Ma–Gel 溶胀性能
在不同pH 介质中,CS–Ma–Gel 溶胀性能如图7所示。由图7 可知,在pH2.00 酸性介质中,CS–Ma–Gel 的溶胀率先增大后减小;由凝胶照片可以看出,凝胶体积先增大又不断减小,在酸性环境中,壳聚糖分子溶胀后不断溶解的结果。在pH4.00 的介质中,随着时间的延长,CS–Ma–Gel 的溶胀率不断增加,最后趋于平衡,最大溶胀率为2200%。由凝胶照片可以看出,当CS–Ma–Gel 达到溶胀饱和时,凝胶片体积增大,仍能保持原来形状,可能是由于该pH 条件下,壳聚糖氨基以–NH2和质子化–NH3+形式存在,马来酸羧基以–COOH 和离子化–COO–形式存在,不仅使CS–Ma–Gel 网络中有充分的电荷,具有较强的亲水性能和较高的渗透压[27],而且还具有较强的静电作用和氢键作用,保持凝胶网络不被破坏,使CS–Ma–Gel只溶胀不溶解。在pH6.86 的介质中,随着时间的延长,CS–Ma–Gel 的溶胀率先增加后减小,然后趋于平衡。由凝胶照片可以看出,CS–Ma–Gel 达到最大溶胀率760%后,凝胶体积又开始缩小,但没有发现溶解迹象,平衡溶胀率为410%。壳聚糖氨基的pKa为6.2~6.8[28],在中性条件下,壳聚糖质子化–NH3+不断去质子化,凝胶网络带电性逐渐降低,渗透压减小,外界缓冲溶液渗透压大于凝胶内部渗透压,凝胶网络中的水不断渗出,溶胀性能减小。在pH9.18 的介质中,随着时间的延长,CS–Ma–Gel 的溶胀率先增加后减小,然后趋于平衡。由凝胶照片可以看出,CS–Ma–Gel 达到最大溶胀率1300%后,凝胶体积又开始缩小,但没有发现溶解迹象,平衡溶胀率为820%。碱性条件下,壳聚糖质子化–NH3+不断去质子化,凝胶网络正电荷减少,导致壳聚糖分子链伸展能力和渗透压降低,因而溶胀能力下降;然而,马来酸的pKa2为6.23,在碱性条件下马来酸的第二个–COOH 离子化–COO–,负电荷增加,凝胶网络带电性得到一定补偿,渗透压被保持,最后平衡溶胀率820%,明显高于中性条件下的平衡溶胀率410%。
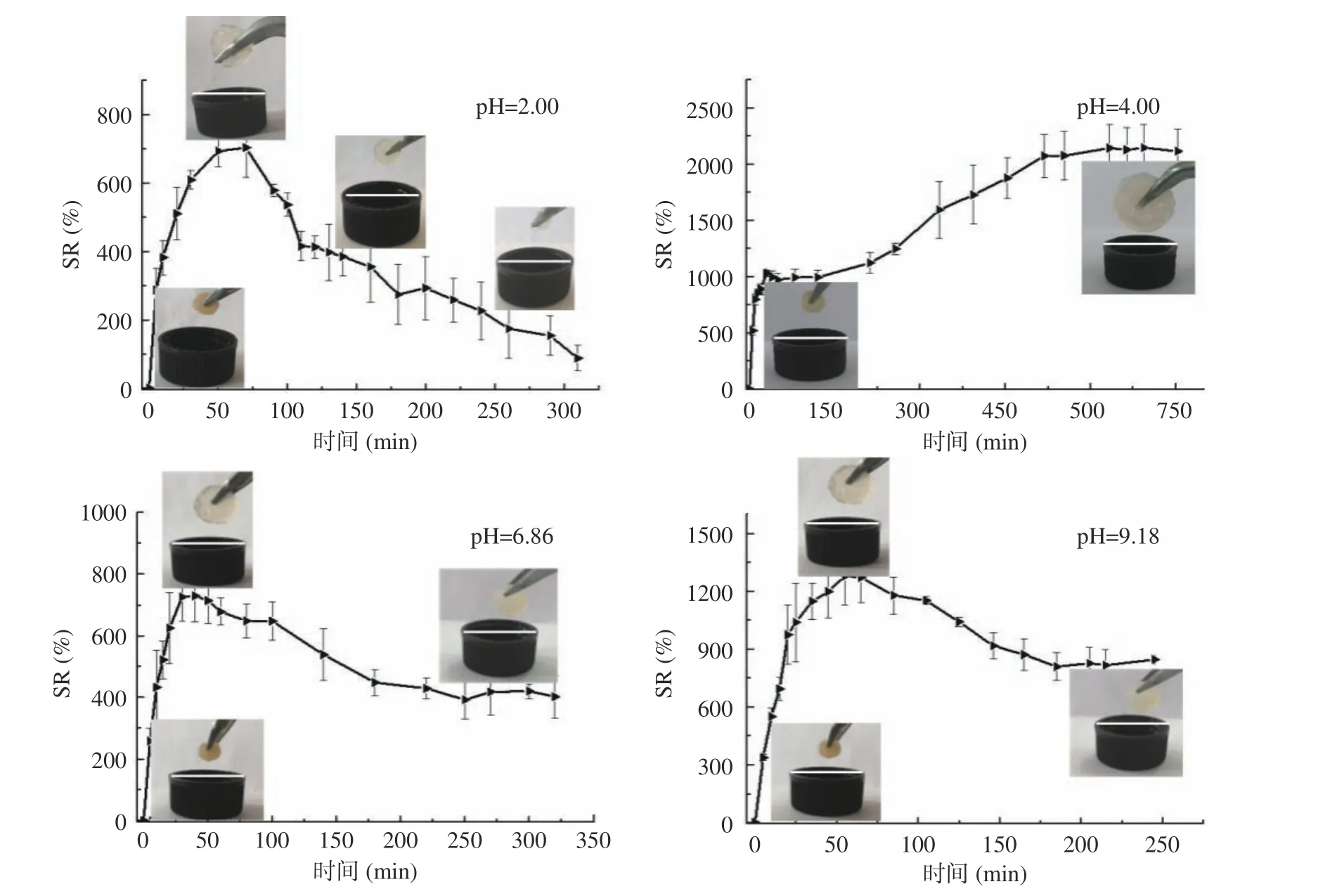
图7 CS–Ma–Gel 在不同pH 介质中溶胀曲线(n=3)Fig.7 Swelling ratio curves of CS–Ma–Gel in different pH media (n=3)
在不同pH 介质中,开始阶段CS–Ma–Gel 的溶胀率均快速增加,这主要由于离子型凝胶接触水后,凝胶网络内渗透压大,水被吸入[27],壳聚糖高分子链上质子化–NH3+互相排斥,分子链伸展,凝胶溶胀。在pH2.00、4.00、6.86 和9.18 的介质中,CS–Ma–Gel最大溶胀率分别为800%、2200%、760%和1300%,这主要是由于随着介质pH 的变化,壳聚糖–NH2和质子化–NH3+、马来酸-COOH 和离子化–COO–以不同形式存在,使CS–Ma–Gel 网络中电荷、亲水性能和渗透压大小不断变化导致凝胶溶胀性能变化。在酸性、碱性介质下,CS–Ma–Gel 的溶胀性能比中性介质强,展现了两性离子型pH 响应性水凝胶的特点,有望扩宽其在药物缓释体系中的应用[5]。
2.4 Am/CS–Ma–Gel 药物释放行为
在不同pH 介质中,Am/CS–Ma–Gel 药物释放行为如图8 所示。由图8 可知,在pH2.00、4.00、6.86和9.18 的介质中,Am/CS–Ma–Gel 42 h 累计释药率分别为24.6%、70.4%、35.7%和50.4%,展现了pH响应性能。Am/CS–Ma–Gel 最大释药率与CS–Ma–Gel的最大溶胀率呈正相关(图9)。在pH4.00 酸性和pH9.18 碱性环境下,Am/CS–Ma–Gel 的药物释放性能比pH6.86 中性介质效果好,具有两性离子型pH响应水凝胶特性,主要因为CS–Ma–Gel 凝胶网络中存在酸、碱基团(如氨基和羧基),当环境pH 发生变化时,水凝胶的溶胀或收缩实现靶向释药[29]。
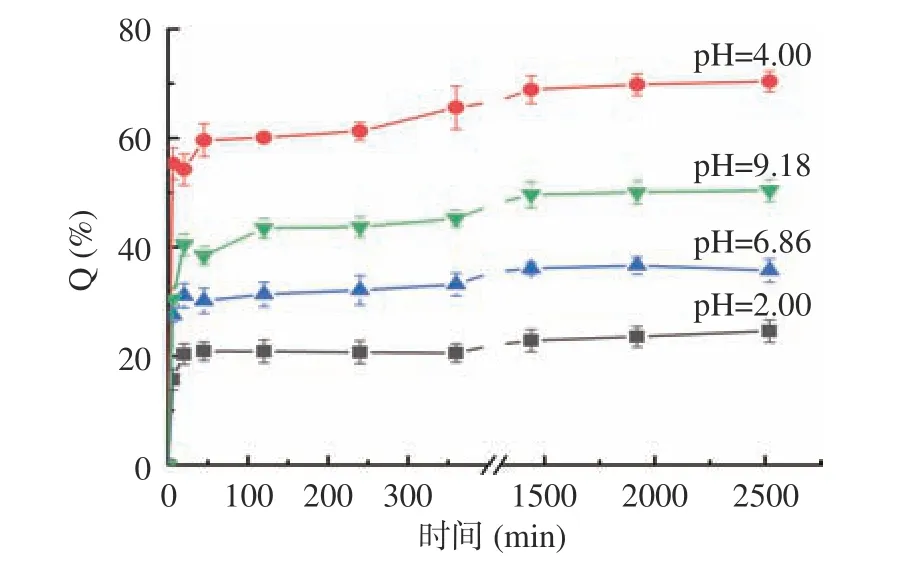
图8 不同pH 介质中药物释放曲线(n=3)Fig.8 Drug release curves in different pH media (n=3)

图9 不同pH 介质中最大溶胀率与药物最大释放率关系图Fig.9 Correlation curves between maximum swelling rate and maximum drug release rate
由图8 可知,在pH2.00、4.00、6.86 和9.18 的介质中,Am/CS–Ma–Gel 在开始药物释放速率均较快,一方面是由于凝胶表面的Am 释放到溶液中,另一方面是由于开始阶段CS–Ma–Gel 溶胀速率快,随着时间的延长,溶胀能力逐渐减小(pH6.86、pH9.18)或溶胀速率减缓(pH4.00)(如图7),因而药物释放速率降低。在pH4.00 酸性环境下,Am/CS–Ma–Gel 具有最好的药物释放和缓释性能。由CS–Ma–Gel 溶胀曲线(图7)所示,开始50 min 快速溶胀,然后缓慢溶胀,10 h 才达到溶胀平衡。Chen 等[30]认为载药凝胶的释放分为三步,第一步是黏附于表面的药物释放,释放速率快;而后凝胶内部的药物基于溶胀药物释放,属于缓释阶段;最后是溶胀的凝胶由外向内被浸蚀,药物释放。在pH4.00 介质中,Am 释放过程符合该释放模型。在pH2.00 酸性介质中,该凝胶释药量和释药速率均最小,这可能是由于较强酸性条件下,壳聚糖溶解,溶液粘稠,被包封的Am 药物分子不能被释放出来。
马来酸交联壳聚糖构筑的CS–Ma–Gel 展现了独特的pH 响应性能,在弱酸性和碱性介质中均能展现较好的药物缓释性能,有利于其在特殊环境下的药物靶向释放。目前,离子交联和动态共价键交联的pH 响应壳聚糖水凝胶,在药物缓释过程主要表现在酸性条件下缓释性能较好[10,31-32],酸性、碱性条件下药物释放率高于中性条件下的两性离子型pH 响应壳聚糖水凝胶未见文献报道。CS–Ma–Gel 凝胶的溶胀特点和Am 参与凝胶共组装共同克服了离子交联壳聚糖水凝胶(如三聚磷酸盐)的药物突释行为,10 min 释药100%[33],实现了载药凝胶的药物缓释性能和pH 响应性。
3 结论
以马来酸为离子交联剂,利用Na2CO3溶液调控分子间氢键作用、静电作用等超分子组装驱动力,构筑了离子交联的壳聚糖水凝胶。CS–Ma–Gel 形成过程中,马来酸交联壳聚糖分子链有序组装成均匀纤维状结构,Am 较好地分散在CS–Ma–Gel 中并参与了超分子组装。在pH2.00、4.00、6.86 和9.18 的缓冲溶液中,CS–Ma–Gel 溶胀率分别为800%、2200%、760%和1300%,酸性和碱性介质中溶胀率高于中性条件下的溶胀率,展现了两性离子型pH 响应水凝胶的特点。在pH2.00、4.00、6.86 和9.18 的缓冲溶液中,Am/CS–Ma–Gel 42 h 累计释药率分别为24.6%、70.4%、35.7%和50.4%,释药行为与溶胀性能呈现正相关,表明高分子凝胶的溶胀性能直接影响着其药物释放能力。CS–Ma–Gel 制备方法简单、绿色,具有良好环境响应性,为两性离子型pH 响应水凝胶的构筑提供简单方法,为开发壳聚糖新型药物缓释材料奠定了理论和实验基础。
