乳源性血管紧张素转换酶抑制肽的研究进展
2023-10-19陈舒柔许华根潘家丽姜铁民董新红
陈舒柔,许华根,潘家丽,李 静,李 霞,姜铁民,董新红,
(1.桂林理工大学化学与生物工程学院,广西桂林 541000;2.桂林理工大学国家母婴乳品健康工程技术研究中心南亚分中心,广西桂林 541000)
高血压(Hypertension)是当前我国乃至全世界最为常见的一种慢性疾病,也是各种心脑血管疾病最主要的诱发因素[1-2]。高血压患者通常需要长期服用降压药物,但传统降压药物在控制血压的同时,会有一定的毒副作用,例如不利于血管健康,会使得尿酸升高和加重肝肾负担等等。血管紧张素转换酶抑制肽,即ACE 抑制肽(Antihypertensive peptides,ACE),又称为降血压肽,是一类具有显著降压作用的多肽片段[3]。科学家Ferreira 在1965 年首次从蝮蛇体内提取了具有血管紧张素抑制的多肽分子[4-5],这一发现激发了研究者对ACE 抑制肽的研究兴趣。
据报道,国外已有运用化学方法合成ACE 抑制肽并投入到临床使用[6],而化学合成的ACE 抑制肽会引起喉咙肿胀、肾脏损伤、丧失味觉等副作用,不宜长期服用[7-8]。随着人们日常保健意识和对食品药品安全意识的日渐增强,通过非药物方法预防、治疗疾病越来越普遍。因此开发天然食品来源的ACE抑制肽来控制、缓解和辅助治疗高血压,成为功能食品和心血管领域研发的重点方向[9]。近年来,在对乳源活性肽的研究方面,具有生物活性的发酵乳制品的开发和乳制品中生物活性肽的筛选正逐渐成为国内外的研究热点。本文通过对乳源性ACE 抑制肽的制备方法、分离纯化、构效关系和应用研究进行综述,旨在提高对乳源性ACE 抑制肽的认识,推动对乳源性ACE 抑制肽的研究。
1 乳源性ACE 抑制肽的制备
乳制品在生产生物活性肽方面有着巨大的潜力,在营养和药物应用方面具有良好的健康效益。乳源中的肽通常以无活性形式存在于蛋白质中,然而当蛋白质经过酶解或微生物发酵等作用后,无活性的蛋白质可以释放出具有降血压作用的ACE 抑制肽[10]。制备ACE 抑制肽的方法大致有4 种:体外酶解法[11]、微生物发酵法[12]、化学合成法[13]和重组DNA 法[14]。鉴于化学合成肽和重组DNA 活性肽在生产成本、安全性及应用性方面的一些不足,目前研究较多的是采用体外酶解法和微生物发酵法制备ACE 抑制肽。
1.1 体外酶解法制备ACE 抑制肽
酶法水解制备ACE 抑制肽具有条件相对温和,对蛋白质的营养价值破坏小,蛋白质的水解过程容易控制等优点,可以通过对蛋白质进行定位水解进而产生人们所需要的特定肽类[15]。因此,对乳源蛋白进行酶法水解已经成为一种重要的ACE 抑制肽的制备方式。
酶的选择是ACE 抑制肽生产的关键,因为不同蛋白酶水解能产生具有不同活性的多肽,ACE 抑制肽具有一定的氨基酸组成和结构序列。因此,需要根据酶的特异性对多种蛋白酶进行筛选[16]。目前用于生产ACE 抑制肽的蛋白质水解酶有碱性蛋白酶[17]、中性蛋白酶[18]、胃蛋白酶[19]、胰蛋白酶[19]、胶原蛋白酶[20]、嗜热菌蛋白酶[21]、胰凝乳蛋白酶[22]、胰糜蛋白酶[22]等。根据不同的蛋白质来源可以选择不同的水解酶类,而不同的酶类需要选择不同的水解条件[23]。
乳源酪蛋白是酶解制备ACE 抑制肽的常用原料来源。如Jiang 等[24]使用中性蛋白酶AS1.398 水解牛奶酪蛋白,产生了新型的ACE 抑制肽RYPSYG和DERF。Chen 等[25]通过使用一种复合酶水解羊奶酪蛋白,获得了高活性的ACE 抑制肽组分。但更多的是以乳源中乳清蛋白为底物来酶解制备ACE抑制肽。乳清作为干酪的生产过程中的副产物,含有大量的蛋白质,营养价值很高。但乳清的排放不但造成营养资源浪费而且污染环境,因此研究酶解乳清来制备ACE 抑制肽具有重要意义。Pan 等[26]采用胰蛋白酶水解乳清蛋白纯化出具有降血压活性的二肽LL(Leu-Leu)。经分子对接发现,降压肽通过疏水作用与Ala 354、Ala 356、Phe 391、Phe 512、Val 518 残基接触,通过亲水作用与His 353、383、387、410、513、Glu 384、411、Arg 522 残基接触。Guo等[27]用藻酸钠固定化的瑞士乳杆菌LB 10 生产的蛋白酶水解乳清蛋白,得到具有降血压活性的二肽(KA、LF、EN)和三肽(DIS、EVD、AIV 和VFK)。马莹[28]利用胰蛋白酶和胃蛋白酶双酶水解乳清蛋白来制备ACE 抑制肽,经纯化后得到具有良好的ACE 抑制活性的多肽(LIVTQTMK),其IC50值为248.1 μg/mL。综上所述,乳清蛋白酶解后的产物制备出的ACE 抑制肽活性显著,因此,体外酶解法制备ACE 抑制肽以其专一高效性被广泛应用。但缺点是由于原料蛋白质一级结构的未知和差异性,并且ACE 抑制肽也没有固定结构等特点,酶解产生的ACE 抑制肽的制备过程存在一定盲目性。
1.2 微生物发酵法制备ACE 抑制肽
Sathya 等[30]采用嗜酸乳杆菌(MTCC 10307)、植物乳杆菌(NCDC 379)、干酪乳杆菌(NCDC 017)、保加利亚乳杆菌(NCDC 253)、副干酪乳杆菌亚种(NCDC 022)、鼠李糖乳杆菌(MTCC 8712)和瑞士乳杆菌(NCDC 192)七种不同的乳酸菌来发酵山羊奶,发现用NCDC 379 发酵的牛奶的ACE 抑制活性最高,其分子量为1.4 kg/mol。李响等[31]选择了5 株乳酸菌菌株、3 株霉菌菌株和1 株枯草芽孢杆菌菌株发酵大豆分离蛋白,结果显示产生强ACE 抑制活性肽的乳酸菌菌株是保加利亚乳杆菌,其ACE 抑制水平和肽含量分别为57.93%和3.27 mg/mL。吕卉卉等[32]对瑞士乳杆菌发酵乳清蛋白ACE 抑制肽的工艺条件进行了优化,在最佳工艺参数下,活性肽的ACE 抑制率为89.337%。Nejati 等[33]采用乳酸乳球菌DIBCA 2 发酵新鲜牛乳,再用高效液相色谱分离发酵乳中的多肽,测得IC50为5 μg/mL。上述研究结果均显示发酵乳中含有具有ACE 抑制活性的多肽。微生物发酵法由于反应进程不易控制,因而多用于乳源ACE 抑制肽的研究中。
2 乳源ACE 抑制肽的分离纯化和鉴定
ACE 抑制肽在母体蛋白中无活性,酶水解可以将其分子片段和活性从母体蛋白中释放出来。但由于水解产物中活性肽的含量很低,酶液组分复杂,传统分离技术难以进行有效分离,因此关于活性肽分离纯化的工艺和技术研究也是一个重点方向[34]。随着色谱、微孔膜、光谱技术等分离纯化技术的发展,在活性肽的分离纯化过程中可以根据活性肽的不同来源、酶解产物的不同特征选择不同的分离技术。
目前,离子交换层析(IEC)、凝胶过滤色谱(GPC)、超滤(UF)、毛细管电泳法(CE)、凝胶电泳法(PAGE)和高效液相色谱(HPLC)广泛用于生物活性肽的分离和纯化,这些技术可以根据ACE 抑制肽的分子量、电荷、亲和力、极性、疏水性和亲水性特征分离ACE 抑制肽[9,35-36]。
为达到更好的纯化目的,通常分离过程中还会采用几种方法相结合使用[37]。如可以先利用活性炭吸附除去高分子量和未水解的蛋白质,用超滤技术去除高分子量蛋白质和不溶性底物,最后将混合物通过凝胶过滤层析柱根据分子大小进行分离[37],由于ACE 抑制肽的结构相似,分子量差异很小,因此还需要与离子交换层析柱串联使用[38]。Uluko 等[39]采用中性酶水解浓缩牛奶蛋白(MPC)产生活性较高的ACE 抑制肽,分别采用截留分子质量为8 和3.5 kDa膜进行超滤,再用0.2 kDa 膜进行纳米过滤,得到4 个组分,结果表明3.5 kDa 膜分离产物中具有较高活性的ACE 抑制肽。代永刚等[40]用碱性蛋白酶酶解酪蛋白后得到的ACE 抑制肽产物进行超滤预分离,得到分子量低于4000 U 的组分,再利用凝胶柱Sephadex G-25 进一步纯化,得到的分子量在1500 U以下组分的ACE 抑制活性可达62.78%,比原酶解物的ACE 抑制活性高了24.77%。宋礼等[41]研究了牦牛乳酪蛋白ACE 抑制肽的分离纯化工艺,通过液相色谱及质谱检测相结合,得到序列片段为HQGLPQEVLNENLLR/AVPYPQR 和 TKVIPYVR的ACE 抑制肽。包春菊[42]采用酶解脱脂牛、羊乳制备具有调节高血压功效的ACE 抑制肽,脱脂牛、羊乳酶解液经超滤、大孔树脂DA201-C 分离纯化后,其ACE 抑制率分别达到91.90%±0.36%和92.07%±0.06%,通过反向高效液相色谱进一步分离各组分,并采用质谱鉴定出其ACE 抑制肽序列,脱脂牛乳酶解液的G2-1、G2-2 组分中分离鉴定出了10 和8 种肽;脱脂羊乳酶解液的F2-2 组分中分离鉴定出了11 种肽。脱脂牛、羊乳分离纯化后的酶解液均发现新的ACE 抑制肽序列,其氨基酸的分子量主要分布在650~1050 Da 之间,所得ACE 抑制肽新的氨基酸序列主要是含5~9 个氨基酸残基的短肽。这些已报道的纯化方法大多用于实验室研究,对纯肽的大规模生产研究有限。为了使ACE 抑制肽作为功能性食品或补充剂的广泛应用成为可能,未来的研究可能会探索适合工业应用的肽的成本效益和高效纯化方法。
3 乳源性ACE 抑制肽的构效关系研究
蛋白质和肽的一级结构即氨基酸的组成及排列顺序,直接决定了ACE 抑制肽的高级结构和功能特性。因此,对蛋白质或肽的一级结构的分析是进行其构效关系研究不可缺少的部分。通过对ACE 抑制肽的进一步研究,已经确定了许多源自乳制品的ACE 抑制肽的氨基酸序列[43],乳源降压肽的降压活性与其相对分子质量、氨基酸组成、C 端氨基酸和N 端氨基酸密切相关。虽然ACE 抑制肽的特异性结构和活性之间的关系尚未得到很好地确立,但已发现一些共同的特点。
3.1 乳源ACE 抑制肽的活性与分子量大小的关系
ACE 抑制肽通常含有2 到12 个氨基酸,但也有超过27 个氨基酸的肽段[44]。Jiang 等[24]用超滤膜对AS1.398 中性蛋白酶水解的牛乳酪蛋白水解物进行超滤膜分离,发现相对截留分子量小于10 kU、3 k~10 kU 和小于3 kU 酶解产物的IC50值分别为0.610±0.007、0.568±0.016 和0.461±0.009 mg/mL,说明酶解产物的相对分子质量越小,降压作用越好,ACE 抑制肽片段的相对分子量主要集中于3 kU 以下;Ruiz-Giménez 等[45]、Tavares 等[46]均发现相对分子量小于3 kU 的乳蛋白酶解产物具有很强的ACE 抑制活性,说明酶解产物中相对分子量小于3 kU 的组分具有更高的ACE 抑制活性;Pan 等[47]采用超滤法分离乳清蛋白胰蛋白酶水解物,分别测定了相对分子量在6 kU 以下、6 k~10 kU 和10 kU 以上的酶解产物的ACE 抑制率,发现相对分子量在6 kU 以下的组分对ACE 的抑制率最高,为64.26%。
综上所述,乳源降压肽的降压活性与其相对分子质量有关,低分子量的小肽通常具有更高的降血压活性。然而,相对分子质量并不是影响乳源降压肽活性的唯一因素,多肽的氨基酸序列、末端氨基酸种类和氨基酸的疏水性也会影响其降血压活性。
3.2 乳源ACE 抑制肽的活性与C-末端和N-末端氨基酸的关系
ACE 抑制肽的主要结构和氨基酸组成与它的抑制活性密切相关。多肽与ACE 的相互作用受多肽C 端区域三个氨基酸序列的影响显著[26,43,48]。研究表明,肽的C-末端的氨基酸(e-氨基正电荷)和精氨酸(胍正电荷)可以促进ACE 抑制活性[49]。此外,C-末端具有较强亲和力的Pro 能促进与ACE 抑制肽的结合[50]。研究发现若C 端氨基酸是芳香族或碱性氨基酸,则ACE 抑制肽的抑制活性更高[51]。ACE抑制肽N 端的芳香或碱性氨基酸也可以提高其ACE 抑制活性。也有报道说,含有N-末端亮氨酸、异亮氨酸和缬氨酸的多肽表现出良好的抗高血压活性,但在ACE 抑制肽的N 端含有脯氨酸时,ACE 抑制活性降低[52]。
据自然正家的数据统计,在服务过程中换用公司自发研制的清洁套组后,员工的工作效率提升了17%,客户满意率达到98%以上。好品质的清洁套组和高口碑的服务在客户群中口口相传,公司的订单也就越来越多。
3.2.1 C-末端氨基酸为赖氨酸或精氨酸的影响 与其他肽相比,C-末端带有精氨酸的肽(Ala-Leu-Pro-Met-His-Ile-Arg)的ACE 活性比其他多肽更强[53]。另外,C 端有赖氨酸的Ala-Ile-Tyr-Lys 也有更高的活性。Ryan 等[53]研究发现C 端残基中带正电荷的氨基酸,如赖氨酸(ε-氨基)和精氨酸(胍基),能显著提高ACE 抑制肽的抑制活性。Li 等[54]在对于合浦珠母贝蛋白源ACE 抑制肽的研究中发现,含有一种带正电的精氨酸四肽FRVW 表现出更好的AC 抑制活性。由此可以有力的反映出C-末端氨基酸为赖氨酸或精氨酸时,ACE 抑制肽活性显著提高。Kobayashi 等[55]研究发现当ACE 抑制肽C 末端含赖氨酸或精氨酸时,能显著提高ACE 抑制活性能力,因此推测赖氨酸和精氨酸侧链上的ε-氨基或胍基的正电荷可以提高ACE 抑制活性。
3.2.2 末端氨基酸为Pro 的影响 研究表明,C 端Pro 对活性部位有很强的亲和力,可以促进与ACE的结合[50]。Zhao 等[56]认为ACE 抑制肽的C 端有Pro时,活性比其他氨基酸出现在C 端时更好;Miyoshi 等[57]从玉米蛋白水解产物中分离出9 种ACE 抑制肽,其中6 种ACE 抑制肽具有Pro C 端,并测定了ACE 抑制肽Leu-Gln-Pro 和Leu-Gln-Gln 的IC50,发现前者的IC50远低于后者,分别为1.9 和10 μmol/L;Mizuno 等[58]从酪蛋白水解产物中提取的高活性ACE 抑制肽序列主要是X-Pro 和X-Pro-Pro,并在动物实验中被证明具有极强的降压效果。
3.2.3 N-末端氨基酸为芳香族氨基酸或碱性氨基酸的影响 Otte 等[59]研究表明绝大部分N 端存在芳香环氨基酸或者碱性氨基酸的乳源降压肽的活性比较高,研究分离了四种肽,其中两种活性最强的肽分子量在2000 Da 左右,IC50值为4~5 μmol/L。即肽的N 端具有芳香环氨基酸或碱性氨基酸时,被发现对ACE 有特别强的抑制作用。Kohmura 等[60]在更精确的构效关系中研究发现,当C 末端倒数第二个氨基酸或C 末端氨基酸为脂肪族氨基酸(如Ile、Val)、芳香族和碱性氨基酸(如Phe、Tyr)时,多肽具有较高的ACE 抑制活性。总之,具有较高ACE 抑制活性的多肽通常在N 端具有芳香族或碱性氨基酸,在C 端具有更多疏水性和带正电荷的氨基酸。即ACE 抑制肽的生物活性除与末端氨基酸种类有关,还与氨基酸的疏水和亲水性有关。
3.3 乳源ACE 抑制肽的活性与氨基酸的亲水性和疏水性的关系
多肽的疏水和亲水特性是影响其活性的另一个重要因素。C 端氨基酸的疏水性与ACE 抑制活性之间存在正相关关系[61-62]。高亲水性使多肽难以接近ACE 活性位点,导致活性减弱。表1 显示了C 末端疏水氨基酸的质量百分比与ACE 抑制活性之间的关系。可以看出,在ACE 抑制肽的一级结构中存在大量的疏水性氨基酸,特别是在C 末端中。疏水性氨基酸的含量与ACE 抑制活性的关系表明,ACE抑制肽的降血压作用大多符合上述规律。
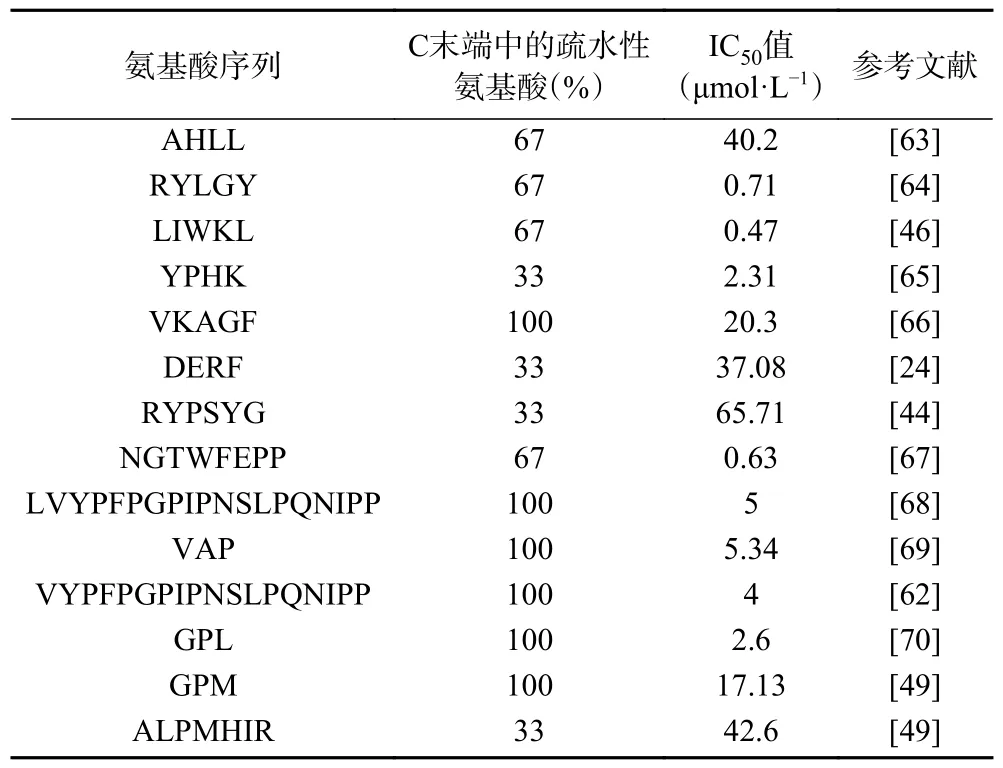
表1 C 末端中疏水性氨基酸的百分比与ACE抑制活性的关系Table 1 Relationship between percentage of the hydrophobic amino acids in C-terminal and ACE inhibitory activity
此外,研究表明,侧链中的N 端疏水性氨基酸或脂肪族氨基酸可以促进多肽与ACE 的结合[71]。从表1 可以看出,具有疏水性氨基酸的多肽在C 端具有较高的ACE 抑制活性,但活性不会随着疏水性氨基酸的百分比增加而增加。相同比例的不同疏水性氨基酸具有不同的活性。两个亮氨酸的疏水性氨基酸占67%的AHLL 的IC50为40.2 μmol/L;两个脯氨酸的疏水性氨基酸占67%的NGTWFEPP 的IC50为0.63 μmol/L。这说明C 端三肽中疏水性氨基酸的百分比不是影响ACE 抑制活性的唯一因素,C 端氨基酸的种类和肽的长度也起着重要作用。
3.4 乳源ACE 抑制肽的定量构效关系研究
定量构效关系(Quantitative Structure Activity Relationship,QSAR)是研究有机小分子与生物大分子的相互作用以及有机小分子在体内的摄取、分布、代谢和排泄的方法。QSAR 可以进行ACE 抑制肽的生物活性与分子结构之间的定量关联模型的开发,以及有效的药物模型的测试和开发,是ACE 抑制肽研究的主要领域。
刘静等[72]通过对收集的20 种天然氨基酸进行主成分分析(Principal component analysis,PCA),根据其疏水性、电学特性、氢键贡献和立体特性进行分类,得到了一个新的氨基酸残基结构描述符SVHEHS。该描述符分别表征了血管紧张素转换酶抑制剂的二肽、三肽和四肽序列,并用于生物活性建立偏最小二乘(Partial least square regression,PLS)。实验表明,此描述符可用于ACE 抑制肽的活性预测和分子设计,并能深入研究ACE 抑制肽的活性机制。
张艳萍等[73]以自组建的食源性ACE 抑制二肽为模型,采用氨基酸描述子VHSE(Principal component score vector of hydrophilicity,steric,and electronic properties)对ACE 抑制二肽进行表征后,采用PLS、支持向量机、主成分分析-支持向量机进行建模,结果发现,3 个模型均能预测食源性ACE 抑制二肽的活性。支持向量机和主成分分析-支持向量机的预测能力相对更强。
李玲霄[74]使用主成分分析确定20 种氨基酸的初始构象,使用三个描述符类别的前6、3、6 个分量对氨基酸进行结构表征,替换原始矩阵SVGMW。研究了ACE 抑制剂、苦味二肽和后叶催产素,并且发现SVGMW 可以系统地区分多肽的结构和生物活性信息,47 个几何描述符、44 个特征值信息、41 个分子几何反比度信息用相同的方法筛选出来,并将结构表示重命名为SVGER。研究发现,SVGER 还可以系统地表征多肽的结构和生物活性信息,应用范围广泛,不受外界影响。
4 乳源ACE 抑制肽的应用研究
乳源ACE 抑制肽的安全性渐渐受到了大家的关注,理论上,从牛奶中提取的ACE 抑制肽有利于人体心血管健康,它可以直接被人体吸收,而没有毒性和副作用,即乳源ACE 抑制肽有一定安全性。目前多系列体外基因毒性试验和体内毒理学研究表明乳源ACE 抑制肽是安全的。Aihara 等[75]研究发现,40 例高血压患者受试者在连续4 周服用含ACE 抑制肽的发酵奶粉后,血压明显降低,脉搏率、血清生化指标等并未出现明显变化。Kajimoto 等[76]也观察到高血压患者受试者在连续8 周服用一定剂量含ACE 抑制肽的酸奶饮料后,并未出现不良反应,尿酸水平和血清标记物等指标均无明显变化。
Phelan 等[77]对乳源生物活性肽的安全性问题研究进行了总结,并无研究证明乳源生物活性肽有毒副作用。因此,通常摄入一定剂量的乳源ACE 抑制肽是安全的,但在应用研究过程中还是应该注重乳源ACE 抑制肽生产过程中避免各种加工方法对质量、稳定性和安全性的潜在不利影响。
4.1 乳源ACE 抑制肽在食品加工中的应用
作为功能食品的一种活性成分,ACE 抑制肽大多作为食品的一部分被消费,可用于生产降血压功能性食品或药品的开发及商业化,可开发新的功能性食品及保健品供人们服用。最常见的是通过加工发酵乳制品进而从乳源食品蛋白中提取到含更高活性的ACE 抑制肽。日本“可尔必思”乳酸菌饮料是一种含有三种氨基酸肽的乳酸菌发酵脱脂牛奶,序列分别为Val-Pro-Pro,Ile-Pro-Pro,具有很明显的降血压作用[78]。并且有研究发现[79],当高血压患者连续服用含有这种三肽的酸奶4 至8 周时,这些患者的血压会明显降低。欧洲市场上第一个降血压益生菌乳制品-Evolus 采用特殊菌种-瑞士乳杆菌发酵的酸奶制品经严格科学的工艺控制,可以得到高含量的降血压短肽,从而起到降血压效果[80]。
目前,虽然从乳制品中得到的ACE 抑制肽不能成为药物,但是可以作为心血管疾病、肾脏疾病[81]患者日常饮食中的保健品或功能性食品。
4.2 乳源ACE 抑制肽的临床应用
近年来,大量的动物试验充分证明了ACE 抑制肽治疗心血管疾病的价值。Xia 等[82]从植物乳杆菌QS670 发酵产生的乳清蛋白中分离纯化出IC50值为1.26 mg/mL 的ACE 抑制肽,经过动物实验表明该肽可以控制血压并保持血压稳定。姜晔等[83]将瑞士乳杆菌(1004、15019)和嗜热链球菌(13957)三种菌混合发酵10%脱脂乳。并观察其对原发性高血压大鼠(SHR)血压的影响。结果显示,大鼠血压随时间的变化会逐渐降低,约在4~10 h 达到最低点。乳源ACE 抑制肽因其天然、无毒的特性而受到了消费者的信赖,从蛋白酶水解或微生物发酵中提取的ACE抑制肽不仅能降低高血压患者的血压,而且对身体没有副作用,可以让患者长期服用。
目前乳源ACE 抑制肽的研究处在临床研究和少量应用阶段。一些动物实验在进一步的临床研究证明其对人类的降压作用之前,用于评估ACE 抑制肽的生物活性和生物利用率。Yamamoto 等[84]研究发现在动物试验中,用L.helveticusCP 790 发酵的酸奶产品表现出良好的降压效果,并证实了这种血压抑制肽是由L.helveticusCP790 的胞外蛋白酶水解产生的。Chen 等[85]通过遗传鉴定以一种新的植物乳杆菌L69 发酵山羊乳酪蛋白,利用响应面法优化发酵条件,超滤得到的发酵产物的ACE 抑制活性为91.62%。体内胃肠道模拟试验表明,L69 发酵山羊奶在胃肠道内成功存活,并保持了较高的ACE 抑制活性。
临床试验是评估乳源ACE 抑制肽的功效和健康影响的最准确的方法。Crippa 等[86]在一项随机、双盲安慰剂对照的试验中研究了所有服用半脂奶酪Grana Padano 奶酪的患者血压均显著降低,24 h 平均收缩压下降3.5 mm Hg,舒张压下降2.4 mm Hg(相对于安慰剂)。洪泽生[87]选取了88 例冠心病患者作为研究对象,实验组在对照组的基础上使用适量ACE 抑制剂进行治疗,结果显示采用ACE 抑制剂能够明显改善患者的临床症状。ACE 抑制剂不仅可以缓解高血压病人的症状,而且可以显著降低高血压病人病死率、防止病变。随着进一步的研究ACE抑制剂必能在临床应用上得以更广泛的推广。
迄今为止,大多数研究涉及乳源ACE 抑制肽,而动物和植物源ACE 抑制肽在临床试验中几乎没有得到证实。在人类的血液循环中已经检测到几种乳源ACE 抑制肽[88-89],并显示出明显的降压效果[57,90-91]。
5 展望
食源性营养成分在高血压的防治中发挥着重要作用,这也是研究人员致力于开发具有降血压作用的食品的原因。牛奶具有特殊的营养价值,对人和动物具有独特的免疫保护和生长调节功能,各成分比例适当是哺乳动物的最佳营养物质,通过酶水解或微生物发酵获得的乳源ACE 抑制肽不仅具有更高的消化吸收率、耐酸性和耐热性,并具有多种生理调节功能。基于以上优势,研究人员积极开发具有特定健康和营养价值,患有高血压的人长期服用可达到预防、控制和辅助治疗高血压的目的地功能性食品。含有乳源ACE 抑制肽的功能性食品或产品在被开发的过程中,必须不断提高其感官特性和稳定性使其能够最大程度地发挥自身作用,因为它具有降压药无法比拟的独特功效,因此,未来乳源ACE 抑制肽定能成为防治高血压的一种有力的辅助手段。
