不同分子量澳洲坚果多肽制备工艺与抗氧化活性
2023-10-19付镓榕胡小静马尚玄郭刚军黄克昌杨悦雪贺熙勇
付镓榕,胡小静,马尚玄,王 芳,郭刚军,,黄克昌,杨悦雪,贺熙勇,
(1.云南省热带作物科学研究所,云南景洪 666100;2.云南省澳洲坚果农业工程研究中心,云南景洪 666100;3.文山学院三七医药学院,云南文山壮族苗族自治州 663099)
澳洲坚果(MacadamiaSPP.)为山龙眼科澳洲坚果属的常绿乔木果树,原产于澳大利亚昆士兰东南部和新南威尔士东北部沿岸的亚热带雨林地区,别称夏威夷果、澳洲核桃等[1]。澳洲坚果果仁蛋白质丰富,含量在8%~20%之间[2],澳洲坚果果仁中氨基酸的总含量平均为81.82 mg/g,种类齐全,共富含17 种氨基酸,其中包括7 种人体必需氨基酸[3-4]。近年来,澳洲坚果产业发展迅猛,2020 年末我国澳洲坚果种植面积为26.61 万hm2,云南省澳洲坚果种植面积为23.53 万hm2,含水量10%的壳果产量为7.50 万吨[5],澳洲坚果油将成为主要的产品形式[6],榨油后的副产物澳洲坚果粕营养价值较高,其含有蛋白质32.25%、氨基酸25.05%、脂肪21.11%、膳食纤维20.98%、碳水化合物17.92%、总糖14.50%、还原糖2.80%、粗多糖0.90%[7]。
蛋白质经蛋白酶水解可获得许多具有生物功能的生物活性肽,具有降血压、抗氧化和抑菌等生理活性[4,8-9]。不同蛋白酶作用肽键位点的不同,通过酶解得到的肽段长度、氨基酸序列不同,致使多肽的分子量、疏水性不同[10-11],且分子量、疏水性也会影响多肽的生物活性[12-13],因此,选择适宜的酶是制备高活性抗氧化肽的前提条件。蛋白质酶解液中含有多糖、游离氨基酸、无机盐、不同分子质量的肽、蛋白质等,均会影响多肽的生物活性,因此需要对酶解液进行分离纯化,文献研究表明,超滤、纳滤、大孔树脂吸附等方法可以有效的对多肽进行分离纯化[14-16]。目前,利用生物酶法制备澳洲坚果多肽,研究其抑菌活性、抗氧化活性的研究已有少量报道[17],但有关不同分子量澳洲坚果多肽组分的分离纯化工艺及其抗氧化活性还未见报道。为此,本研究采用了不同蛋白酶水解澳洲坚果粕制备多肽,以ABTS+自由基的清除能力为指标筛选适宜的蛋白酶,利用大孔树脂吸附、超滤分级技术进行分离纯化,通过测定不同分子量澳洲坚果多肽对DPPH、羟基、ABTS+自由基清除能力及还原能力评价其抗氧化能力,旨在筛选得到抗氧化活性较高的多肽组分,为澳洲坚果多肽的深度研究及产品的开发利用提供数据支撑。
1 材料与方法
1.1 材料与仪器
液压压榨澳洲坚果粕 西双版纳云垦澳洲坚果科技开发有限公司;酸性蛋白酶(20 万U/g)、中性蛋白酶(30 万U/g)、碱性蛋白酶(20 万U/g)、木瓜蛋白酶(20 万U/g)、菠萝蛋白酶(20 万U/g)、复配蛋白酶(20 万U/g)南宁东恒华道生物科技有限责任公司;DA201-C 大孔树脂 郑州和成新材料科技有限公司;还原型谷胱甘肽 上海金穗生物科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS)美国Sigma 公司;氢氧化钠、三氯乙酸、酒石酸钾钠、苯酚、硫酸等试剂 国药集团化学试剂有限公司。
RV10 型旋转蒸发仪 艾卡仪器设备有限公司;ME204E 型电子分析天平 梅特勒-托利多仪器有限公司;DLSB-5L 型低温冷却液循环泵 巩义市予华仪器有限责任公司;HHS 型电热恒温水浴锅 上海博迅实业有限公司;UV754N 型紫外可见分光光度计 上海精风仪器有限公司;TGL-16C 型离心机上海安亭科学仪器厂;FiveEasy 型pH 计、HS7 型磁力搅拌器、FiveEasy 型电导仪 梅特勒托利多仪器有限公司;114B 型粉碎机 浙江瑞安市永历制药机械有限公司;DBS-160 型部分收集器 上海嘉鹏科技有限公司;JLCLM9003 型超滤杯 杭州九龄科技有限公司;玻璃层析柱(φ 3.0 cm×30 cm)江苏三爱思科学仪器有限公司。
1.2 实验方法
1.2.1 酶解工艺及蛋白酶的筛选 参照蛋白酶使用说明书及郭刚军等[7]的实验结果制定酶解工艺条件如表1 所示。澳洲坚果粕的酶解工艺参照郭刚军等[7]的实验方法,将液压压榨的澳洲坚果果粕进行粉碎过60 目筛(孔径0.25 mm),取筛下物加水调浆,沸水浴10 min 后冷却至酶适合温度,加入蛋白酶并将pH 调至酶解条件,然后进行恒温酶解,酶解完成后沸水浴15 min 灭酶,冷却至室温后4000 r/min 离心20 min,取上清液调pH 至4.6(澳洲坚果蛋白等电点)静置30 min,4000 r/min 离心10 min,取上清液调pH 至7.0 为多肽液备用。将多肽液统一浓度为2.0 mg/mL后进行ABTS+自由基清除率测定,筛选出适宜的蛋白酶。
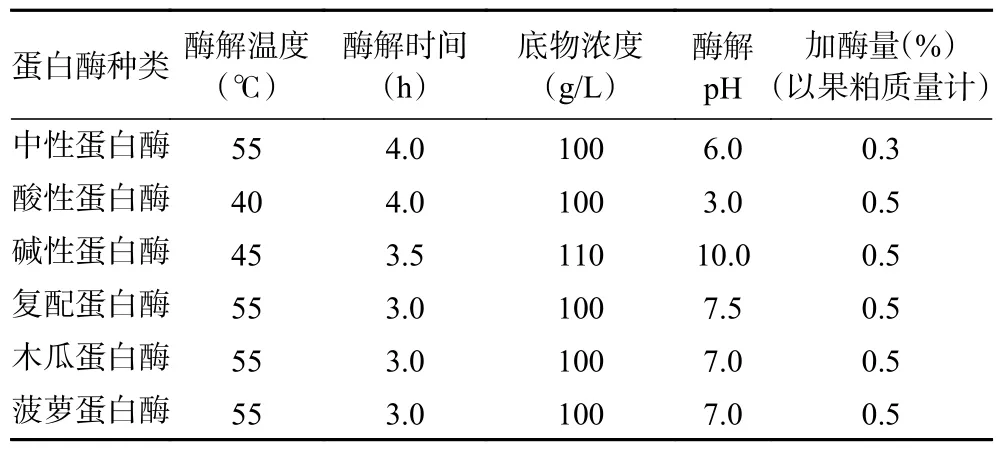
表1 不同蛋白酶酶解澳洲坚果粕的工艺条件Table 1 Enzymatic hydrolysis process conditions of macadamia nut meal by different proteases
1.2.2 多肽浓度的测定 参照郭刚军等[18]的方法,采用双缩脲法进行测定,以酪蛋白为标准品制作标准曲线,得出吸光值为纵坐标(Y),酪蛋白质量浓度为横坐标(X)的回归方程为Y=0.0461X+0.0053(R2=0.9995)。将样液与等体积的10%三氯乙酸(TCA)混合,静置30 min,在4000 r/min 下离心20 min,以除去不溶性的蛋白质和长肽链,取1 mL 上清液于试管中,加入4 mL 双缩脲试剂,混匀后在室温下静置30 min,于540 nm 波长处测定吸光值,代入回归方程计算得到上清液中的多肽浓度。
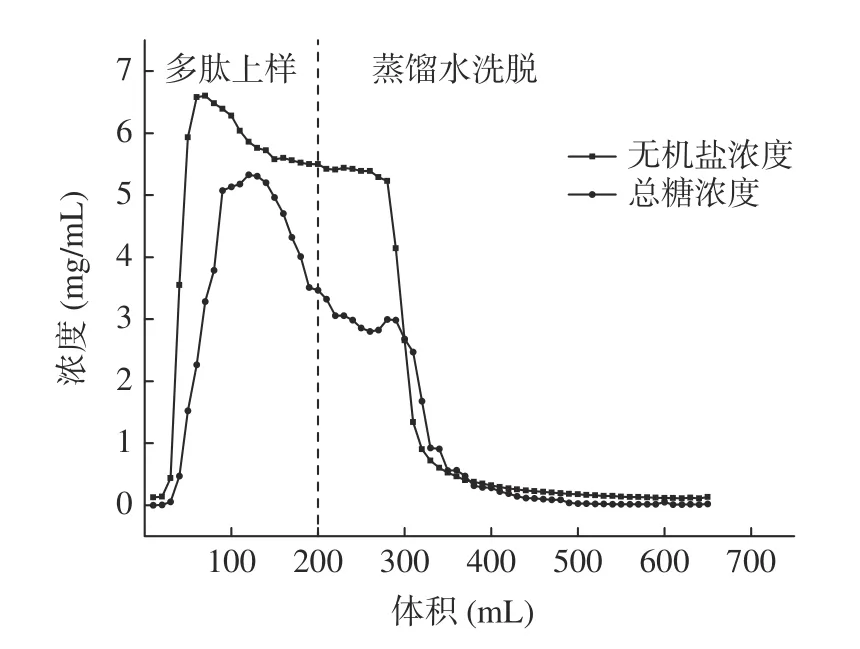
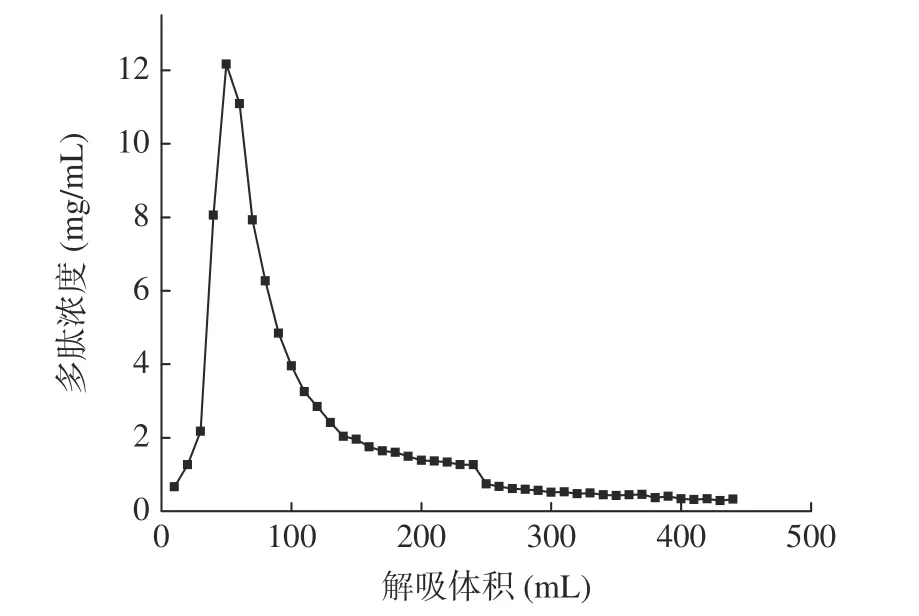
1.2.3 大孔树脂动态吸附纯化 用大孔树脂对“1.2.1”水解澳洲坚果粕制备的多肽液进行脱糖、脱盐纯化。大孔树脂采用湿法装柱,参照张巧智等[19]的方法稍作修改,上样及水洗脱工艺条件为:上样流速1 mL/min、上样浓度15 mg/mL,上样体积200 mL;水洗脱流速2 mL/min,水洗脱体积400 mL。流出液每10 mL 收集为1 管,测定总糖、无机盐含量(总糖含量测定采用苯酚-硫酸法[20],无机盐含量采用电导仪直接测定),直至总糖含量及无机盐含量趋于稳定。用400 mL 体积分数为75%的乙醇溶液进行解吸,流速为2 mL/min,解吸液每10 mL 收集1 管,测定解吸液的多肽浓度判定解吸是否完成,收集的解吸液减压浓缩后备用。
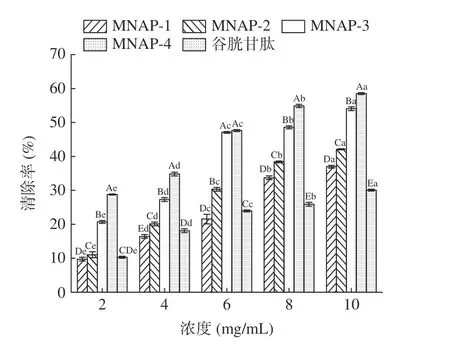
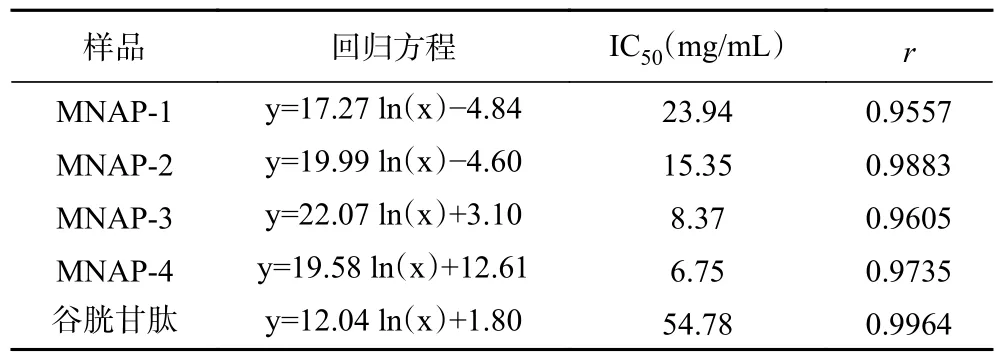
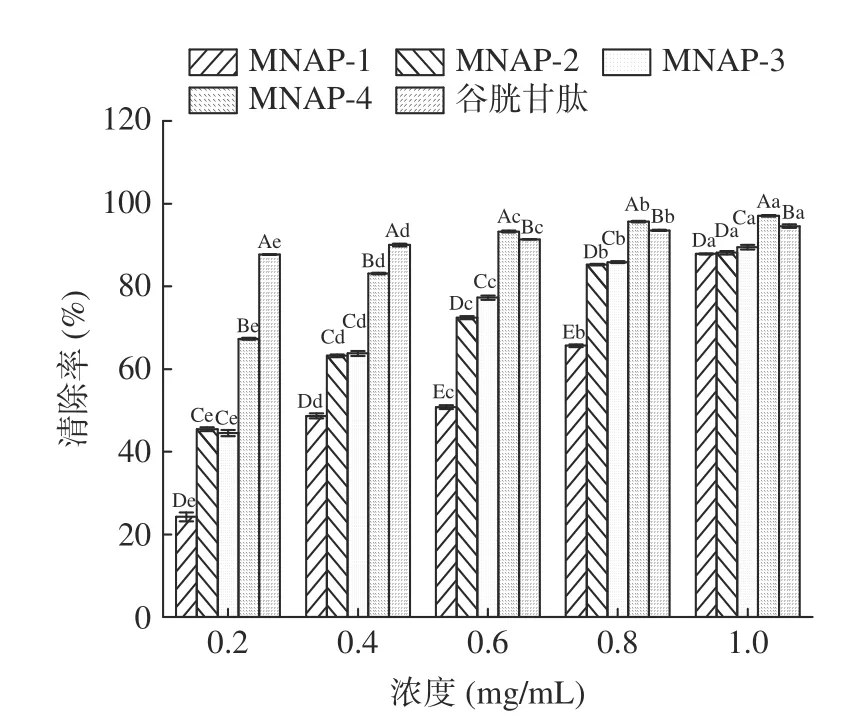
1.2.4 超滤分级 将“1.2.3”中经大孔树脂纯化的多肽液用10000、5000、1000 Da 分子量的超滤膜分级,超滤压力为0.25 MPa,温度为25 ℃,得到MNAP-1(Mw>10000 Da)、MNAP-2(5000 Da 1.2.5 澳洲坚果多肽的抗氧化活性测定 1.2.5.1 DPPH 自由基清除率测定 参照Sethi 等[21]的方法稍作修改。用无水乙醇配制DPPH 溶液0.2 mmol/L,避光保存。精确量取样液2 mL 于试管中,加入2 mL 的DPPH 溶液并摇匀,在室温避光反应30 min,在517 nm 波长下测其吸光度为A1,用2 mL 无水乙醇代替DPPH 溶液,测其吸光度为A2,用2 mL 蒸馏水代替样液,测其吸光度为A0。按照公式(1)计算DPPH 自由基清除率。 式中:A0表示空白组的吸光值;A1表示多肽液的吸光值;A2表示对照组的吸光值。 1.2.5.2 羟基自由基清除率的测定 参照Li 等[22]的方法稍作修改。取1 mL 样液于试管中,加入1 mL 9 mmol/L 水杨酸-乙醇溶液,1 mL 9 mmol/L FeSO4溶液,再加入1 mL 8.8 mmol/L H2O2,启动Fenton 反应,37 ℃水浴30 min,在510 nm 波长下测其吸光度为A1;用1 mL 蒸馏水代替H2O2,反应后测其吸光度为A2;用1 mL 蒸馏水替代样液,反应后测其吸光度为A0。按照公式(1)计算羟基自由基清除率。 1.2.5.3 ABTS+自由基清除率的测定 参照Lu 等[23]的方法稍作修改。将配制好的140 mmol/L 过硫酸钾440 μL 加入到25 mL 7 mmol/L 的ABTS 溶液中,得到ABTS+自由基工作液,避光反应12~16 h。使用时,用95%的乙醇稀释,使其吸光度在0.7±0.02。取2.85 mL ABTS 稀释液加入0.15 mL 样液,在734 nm波长下测其吸光度为A1,2.85 mL ABTS 稀释液加入0.15 mL 乙醇溶液,测其吸光度为A0。按照公式(2)计算ABTS+自由基清除率。 式中:A0表示空白组的吸光值;A1表示多肽液的吸光值。 1.2.5.4 还原能力的测定 参照卢柏山等[24]的方法。量取1 mL 样液(空白用1 mL 蒸馏水代替,其他试剂依次同下)于烧杯中,依次加入2.5 mL pH6.6的磷酸盐缓冲溶液和2.5 mL 1%的铁氰化钾溶液,混匀后于50 ℃水浴反应20 min,加入2.5 mL 10%的三氯乙酸溶液,混匀后4000 r/min 离心10 min,取2.5 mL 上清液于试管中,依次加入0.5 mL 0.1%的FeCl3溶液和2.5 mL 蒸馏水,摇匀静置15 min 后在700 nm 波长下测其吸光度。吸光度与样品的还原能力有关,A 值越大则样品的还原能力越强。 1.2.5.5 抗氧化能力评价指标的计算 以样品的质量浓度为横坐标,抗氧化能力为纵坐标,计算得出线性回归方程及相关系数r(r值越接近1,相关性越好),利用回归方程计算50%的清除率对应的样品浓度为半抑制浓度(half maximal inhibitory concentration,IC50)(IC50越小,抗氧化能力越强),回归方程中的斜率越大则抗氧化能力随质量浓度增加越快[25]。 所有实验重复三次,结果用平均值±标准差(mean±SD)表示。采用Microsoft Excel 2019 进行数据录入、处理与计算线性回归方程;采用SPSS 27.0 统计软件进行数据分析,组间差异用多重比较分析(LSD)、单因素方差分析(One-way ANOVA)进行处理,P<0.05 表示差异显著;用皮尔森法(Pearson’s)进行相关性分析,P<0.01 为极显著性相关。使用Origin 2021 对进行作图。 多肽C 端具有大分子疏水性氨基酸会使其具有较高的抗氧化活性,不同蛋白酶对肽键的作用位点不同,产生的多肽C 端、N 端及相对分子质量不尽相同,所以对蛋白酶进行筛选是极为重要的[26]。如图1所示,复配蛋白酶制备的粗多肽对ABTS+自由基的清除率为96.23%±0.57%,显著高于其它蛋白酶(P<0.05);其次是碱性蛋白酶、中性蛋白酶和菠萝蛋白酶,清除率分别为91.87%±0.76%、91.57%±1.07%、92.46%±0.31%,它们之间差异不显著(P>0.05);酸性蛋白酶和木瓜蛋白酶的清除率最低,分别为88.79%±0.56%、89.24%±0.45%,两者之间无显著性差异(P>0.05)。因此选择复配蛋白酶水解制备澳洲坚果粗多肽。 2.2.1 大孔树脂吸附过程中多糖和无机盐的变化不同型号的树脂适用于分离不同极性的物质,实验中采用对多肽吸附能力较好的DA201-C 大孔吸附树脂[19]。如图2 所示,在多肽上样及蒸馏水洗脱过程中,流出液的总糖及无机盐含量均为先上升后下降的一个趋势,当蒸馏水洗脱体积达到300 mL 时,流出液中总糖及无机盐含量分别为0.03、0.16 mg/mL,且趋于稳定。 图2 DA201-C 大孔树脂对澳洲坚果多肽的动态吸附曲线Fig.2 Dynamic adsorption curve of macadamia nut polypeptides on DA201-C macroporous resin 2.2.2 大孔树脂解吸过程中多肽含量的变化 多肽液经吸附平衡、蒸馏水洗涤层析柱除去无机盐和糖类物质后,用乙醇溶液进行解吸,流出液每10 mL 收集为1 管测定其多肽含量,多肽含量变化曲线如图3所示。从图3 可以看出,解吸体积为250 mL 时,解吸液中多肽浓度小于1.0 mg/mL,且趋于稳定。陈丽丽等[27]在利用大孔树脂对草鱼蛋白水解液纯化处理中认为解吸曲线拖尾的原因是部分多肽组分不能很好的溶解在乙醇溶液中,因此在本实验中将洗脱体积选择为400 mL,这样既能避免多肽的损失保证多肽的回收,也能减少解吸液的体积。DA201-C 大孔树脂对澳洲坚果多肽具有较好的吸附效果,本研究的纯化工艺可用于澳洲坚果多肽的纯化,可以有效去除酶解液中的多糖和无机盐。 图3 DA201-C 大孔树脂对澳洲坚果多肽的动态解吸曲线Fig.3 Dynamic desorption curve of macadamia nut polypeptides on DA201-C macroporous resin 以谷胱甘肽标准品作为对照,利用多重抗氧化评估体系(DPPH、羟基、ABTS+自由基清除率、还原能力)研究不同分子量澳洲坚果多肽的抗氧化活性。 2.3.1 不同分子量澳洲坚果多肽对DPPH 自由基的清除作用 DPPH 自由基的清除能力广泛应用于研究物质的体外抗氧化活性[28]。由图4 及表2 可见,4 种不同分子量的多肽及谷胱甘肽对DPPH 自由基均有较强的清除作用,且清除率随着样品浓度的增加而增强,有较好的量-效关系。在相同浓度下,MNAP-4的清除能力优于MNAP-1、MNAP-2、MNAP-3,4 种不同分子量的多肽对DPPH 的清除率具有显著性差异(P<0.05),且均低于谷胱甘肽。在浓度0.2 mg/mL时,MNAP-4 的清除率最优为35.29%±0.13%,其后依次为MNAP-3(34.77%±0.17%)、MNAP-2(32.35%±0.14%)、MNAP-1(30.72%±0.51%)。随着浓度的增加,MNAP-4 清除率的增加速率高于其它组分及谷胱甘肽。当浓度达到1.0 mg/mL 时,MNAP-4 的清除率最优为82.55%±0.22%。从评价样品对自由基清除能力的IC50值来看,不同分子量多肽及谷胱甘肽对DPPH 自由基清除能力大小顺序为:谷胱甘肽(IC500.01 mg/mL)>MNAP-4(IC500.36 mg/mL)>MNAP-3(IC500.37 mg/mL)>MNAP-2(IC500.45 mg/mL)>MNAP-1(IC500.55 mg/mL),不同分子量多肽对DPPH 自由基的清除能力不同,分子量越小清除能力越强。分子量较小的多肽因其具有较小的空间位阻,能更好的与自由基发生反应,表现出较好的DPPH 自由基清除率,这与不同分子量的核桃、红花籽多肽的抗氧化活性研究结果相同,均表现为分子量较小的多肽对DPPH 自由基清除效果较好[29-30]。 图4 不同分子量多肽对DPPH 自由基的清除率Fig.4 Scavenging rates of different molecular weight polypeptides on DPPH radical 表2 不同分子量多肽对DPPH 自由基清除率的回归方程分析Table 2 Regression equation on scavenging rates of DPPH radical of different molecular weight polypeptides 2.3.2 不同分子量澳洲坚果多肽对羟基自由基的清除作用 羟基自由基是广泛存在于生物体内的一种自由基,是氧自由基中最活泼的自由基,羟基自由基会引起生物体损伤,羟基自由基清除率是反映物质抗氧化作用的重要指标[31]。从图5 及表3 可以看出,4 种不同分子量的多肽及谷胱甘肽对羟基自由基有较强的清除能力,且清除率与其浓度呈正相关。MNAP-4 对羟基自由基的清除率最大,在浓度2.0 mg/mL 时,MNAP-4 的清除率最优为28.78%±0.16%,MNAP-1、谷胱甘肽的清除率最低分别为9.75%±0.56%、10.31%±0.28%,且两者之间无显著性差异(P>0.05)。随着浓度的增加,清除率的增加速率大小顺序为MNAP-3、MNAP-2、MNAP-4、MNAP-1、谷胱甘肽。当浓度达到10.0 mg/mL,4 种多肽的清除率均高于谷胱甘肽且具有显著性差异(P<0.05),MNAP-4 的清除率最优为58.50%±0.28%。从评价样品对自由基清除能力的IC50值来看,不同分子量多肽及谷胱甘肽对羟基自由基清除能力大小顺序为:MNAP-4(IC506.75 mg/mL)>MNAP-3(IC508.37 mg/mL)>MNAP-2(IC5015.35 mg/mL)>MNAP-1(IC5023.94 mg/mL)>谷胱甘肽(IC5054.78 mg/mL),不同分子量多肽对羟基自由基的清除能力不同,分子量越小清除能力越强,这与桃仁多肽的研究结果相同[32],这是由于分子量较小的多肽可阻断自由基链式反应,促使自由基转化成更加稳定的物质,表现出更好的羟基自由基清除能力。 图5 不同分子量多肽对羟基自由基的清除率Fig.5 Scavenging rates of different molecular weight polypeptides on hydroxyl radical 表3 不同分子量多肽对羟基自由基清除率的回归方程分析Table 3 Regression equation on scavenging rates of hydroxyl radical of different molecular weight polypeptides 2.3.3 不同分子量澳洲坚果多肽对ABTS+自由基的清除作用 ABTS+自由基清除率广泛运用于体外抗氧化活性的评价[33-34]。由图6 及表4 可见,4 种不同分子量的多肽及谷胱甘肽对ABTS+自由基的清除能力均随样品质量浓度的增加而增大。MNAP-4、谷胱甘肽的清除率高于MNAP-1、MNAP-2、MNAP-3,浓度为0.2、0.4 mg/mL 时,4 种不同分子量多肽的清除率低于谷胱甘肽,MNAP-2 与MNAP-3 的清除率无显著差异(P>0.05)。随着浓度的增加,清除率的增加速率大小顺序为MNAP-3、MNAP-2、MNAP-1、MNAP-4、谷胱甘肽。当浓度达到0.6 mg/mL 时,MNAP-4 的清除率为93.25%±0.25%,高于谷胱甘肽的清除率91.37%±0.08%。当浓度达到1.0 mg/mL 时,MNAP-4 的清除率为97.05%±0.18%优于其它评价样品,MNAP-2 与MNAP-3 的清除率分别为88.14%±0.42%、89.47%±0.58%,两者之间无显著性差异(P>0.05)。从评价样品对自由基清除能力的IC50值来看,不同分子量多肽及谷胱甘肽对ABTS+自由基清除能力大小顺序为:谷胱甘肽(IC500.00003 mg/mL)>MNAP-4(IC500.08 mg/mL)>MNAP-2、MNAP-3(IC500.24 mg/mL)>MNAP-1(IC500.45 mg/mL),MNAP-4对ABTS+自由基的清除能力最强,这可能是由于ABTS+自由基是一种亲水性自由基,分子量小的多肽的亲水性较好,更易与ABTS+自由基发生反应,从而表现出更好的ABTS+自由基清除能力,这与油茶饼粕多肽的研究结果相同[35]。MNAP-2、MNAP-3 的清除能力相近,这可能是由于MNAP-2、MNAP-3 两者的亲水性相似,导致两者对ABTS+自由基的清除能力相近[36]。 图6 不同分子量多肽对ABTS+自由基的清除率Fig.6 Scavenging rates of different molecular weight polypeptides on ABTS+ radical 表4 不同分子量多肽对ABTS+自由基清除率的回归方程分析Table 4 Regression equation on scavenging rates of ABTS+radical of different molecular weight polypeptides 2.3.4 不同分子量澳洲坚果多肽还原能力分析 还原能力是指其将Fe3+还原为Fe2+的能力,也是评估抗氧化活性的重要指标之一,吸光值越大还原力越强[37]。从图7 及表5 可以看出,不同分子量的多肽及谷胱甘肽均具有还原能力,还原能力与浓度呈正相关。MNAP-4 的还原能力优于MNAP-1、MNAP-2、MNAP-3 及谷胱甘肽。在浓度2.0 mg/mL 时,MNAP-4的还原能力为0.366±0.001,优于其它评价样品,谷胱甘肽还原能力最弱为0.224±0.002。随着浓度的增加,还原能力的增加速率大小顺序为MNAP-4、MNAP-3、谷胱甘肽、MNAP-1、MNAP-2。当浓度达到10.0 mg/mL 时,4 种不同分子量多肽的还原能力均优于谷胱甘肽,MNAP-4 的还原能力最优为1.006±0.003,MNAP-1、MNAP-2 的还原能力分别为0.880±0.005、0.885±0.003,两者之间无显著性差异(P>0.05)。从评价样品对自由基清除能力的IC50值来看,不同分子量多肽及谷胱甘肽还原能力大小顺序为:MNAP-4(IC503.19 mg/mL)>MNAP-2(IC503.45 mg/mL)>MNAP-3(IC503.61 mg/mL)>MNAP-1(IC504.08 mg/mL)>谷胱甘肽(IC504.35 mg/mL),MNAP-4 表现出最强的还原能力,这是由于肽段越短使具有较多电子的基团暴露越充分,因此还原能力最强,这与松仁、核桃、桃仁等多种植物蛋白的研究结果相同[16,29,32]。而分子质量相对较高的MNAP-2 可能是因为具有较多电子致密的基团暴露在外,转移电子的能力也较强而表现出高于MNAP-3 的还原能力[32]。 图7 不同分子量多肽的还原能力Fig.7 Reducing power of different molecular weight polypeptides 表5 不同分子量多肽还原能力的回归方程分析Table 5 Regression equation on reducing power of different molecular weight polypeptides 用皮尔森法(Pearson’s)对不同分子量澳洲坚果多肽与抗氧化活性指标的IC50值进行相关性分析。结果如表6 所示,不同分子量澳洲坚果多肽与清除DPPH 自由基(r=0.947,P<0.01)、羟基自由基(r=0.964,P<0.01)、ABTS+自由基(r=0.948,P<0.01)及还原能力(r=0.856,P<0.01)之间存在极显著相关。多肽分子量的大小对其抗氧化活性影响巨大,结合2.3 中的分析可知分子量小于1000 Da 的澳洲坚果多肽抗氧化活性最好,这可能是分子量小的多肽空间位阻较小,活性基团(巯基、酚羟基)暴露,更好的与自由基发生反应,表现出更好的抗氧化活性。Feng 等[38]认为多肽的抗氧化活性与分子量大小、氨基酸组成种类及排列顺序有关,Lin 等[39]研究水解蛋清蛋白发现分子质量小于1000 Da 的组分抗氧化活性明显高于其他分子质量组,Zou 等[40]发现的不同来源的42 种抗氧化肽在1000 Da 以下的3~6 肽具有更好的自由基清除活性。 本文研究了不同蛋白酶酶解澳洲坚果粕的ABTS+自由基清除能力,采用DA201-C 大孔吸附树脂、超滤分级等技术对澳洲坚果多肽进行分离纯化得到不同分子量多肽,考察其清除DPPH、羟基、ABTS+自由基能力及还原能力,分析得出不同分子量多肽与抗氧化活性之间存在显著相关性。筛选得到了抗氧化活性高的多肽组分MNAP-4(Mw<1000 Da),后续可对其进一步纯化,研究其多肽结构及体内抗氧化活性,为新型抗氧化肽功能性产品的开发与工业化应用提供理论依据,促进澳洲坚果产业的发展。1.3 数据处理
2 结果与分析
2.1 蛋白酶种类的筛选
2.2 DA201-C 大孔树脂对澳洲坚果多肽的纯化效果
2.3 不同分子量澳洲坚果多肽的抗氧化活性





2.4 不同分子量澳洲坚果多肽与抗氧化活性相关性分析
3 结论
