肉苁蓉总苷对HepG2 细胞增殖、凋亡及Wnt/β-Catenin 通路相关蛋白表达的影响
2023-10-19蒋勇军周士琦闫文杰
冯 朵,王 靖,蒋勇军,周士琦,段 昊,郭 豫,赵 建,闫文杰,
(1.北京联合大学生物化学工程学院,生物活性物质与功能食品北京市重点实验室,北京 100023;2.农业农村部食物与营养发展研究所,北京 100081;3.内蒙古三口生物科技有限公司,内蒙古鄂尔多斯 017000)
肉苁蓉属于药食同源物质,是列当科多年生草本寄生植物,具有抗氧化、抗疲劳、抗衰老、抗肿瘤、保肝护肝、调理内分泌、提高记忆能力和抗骨质疏松等功效[1],有“沙漠人参”之称。自2018 年确认荒漠肉苁蓉成为药食同源类物质后,备受人们关注,它既可发挥中草药临床应用价值,又会影响食物营养干预作用,在新型抗肝癌天然产物开发中也显示出巨大的潜力[2-3],对于肉苁蓉食物的营养研究及功能效果越来越深入[4]。
近几年,有报道提出,肉苁蓉具有抗肿瘤的作用,Ye 等[5]研究发现从盐生肉苁蓉中提取的松果菊苷可以通过降低TREM2 的表达和阻滞PI3K/AKT 信号通路来抑制HepG2 细胞的增殖;有学者发现肉苁蓉苯乙醇苷可以抑制HepG2 细胞的增殖作用[6];松果菊苷对肾癌786-O 细胞[7]、SW480 结肠癌细胞[8]的增殖均有一定的抑制作用;在另一项研究中,肉苁蓉苯乙醇总苷已被证明可以减少H22 荷瘤小鼠的肝损伤,并通过降低AFP 水平来改善免疫功能,从而对肿瘤生长产生不利影响[9]。肉苁蓉煎煮物[10]和多糖[11]均可以通过Wnt/β-catenin 信号通路改善帕金森大鼠的临床症状,发挥神经保护作用。此外,有研究发现松果菊苷可以通过抑制Wnt/β-catenin 信号通路发挥抗乳腺癌的作用[12];另外,它也可以降低人类急性白血病THP-1 细胞中β-catenin 蛋白表达[13]。一直以来,Wnt/β-catenin 信号通路备受人们的关注[14],据报道,在20%~35%的肝细胞癌(hepatocellular carcinoma,HCC)病例[15]中可观察到β-catenin 的激活。越来越多的证据表明,Wnt/β-catenin 信号通路在肝癌的发生发展中起着重要作用[16],但肉苁蓉总苷是否通过调节Wnt/β-catenin 信号通路起到抗肝癌作用报道较少。
肉苁蓉提取物总苷,包括苯乙醇苷类和其他苷类[17],本实验通过研究肉苁蓉总苷(total glycosides ofCistanche deserticola,TG)对HepG2 细胞的增殖作用、凋亡、迁移以及相关蛋白表达水平的影响等,探讨TG 抑制肝癌的机制,解释肉苁蓉总苷抗肝癌的潜在机理,为进一步充实肉苁蓉在肝癌领域的临床应用提供一定的科学依据。
1 材料与方法
1.1 材料与仪器
人肝癌HepG2(human hepatoellular carcinomas)细胞 中国协和医科大学基础医学研究所细胞中心;肉苁蓉总苷(质量分数≥75%,以松果菊苷和毛蕊花糖苷合计)内蒙古三口生物科技有限公司,用DMEM 培养基溶解至相应浓度的TG,用于后续实验;胎牛血清 美国Gibco;抗体(青霉素-链霉素-庆大霉素混合液)、DMEM-H 培养基、细胞凋亡与细胞周期检测试剂盒、Annexin V-FITC/染液、细胞凋亡-Hoechst 33342/PI 染液 北京鼎国昌盛生物技术有限责任公司;0.25%胰蛋白酶消化液(-EDTA)、BCA蛋白浓度测定试剂盒 北京鼎国昌盛生物技术有限公司;兔抗β-catenin 抗体 ABclonal 有限公司;兔抗Dsh(ADAR1)抗体 Bioss 公司;兔抗GSK3β抗体、兔抗AFP 抗体 Affinity 公司。
Innova CO-170 CO2细胞培养箱 New brunswick scientific 公司;3K15 低温高速台式离心机 德国Sigma 离心机公司;INFINITE M NANO 多功能酶标仪 TECAN 公司;C-SHG1 荧光显微镜、TE2000-U倒置光学显微镜 日本Nikon公司;FACSCalibur 流式细胞仪 美国BD 公司;EN027015 电泳装置、043BR57802 转膜装置 美国BIO-RAD 公司。
1.2 实验方法
1.2.1 细胞传代 HepG2 细胞采用含有10%胎牛血清和1%三抗(100 U/mL 青霉素、100 mg/mL 链霉素和庆大霉素)的DMEM 完全培养基,置于37 ℃、5% CO2细胞培养箱中培养,待细胞生长至汇合度为80%~90%,用0.25%胰蛋白酶(-EDTA)消化后按1:2~4 传代,待细胞生长2~3 d 后,取对数生长期细胞进行传代培养或者后续实验。
1.2.2 TG 对HepG2 细胞形态的影响 取对数生长期的HepG2 细胞,接种于24 孔板中,每孔细胞浓度为5×104个/mL,待细胞贴壁后,加入TG 至终浓度为0、3.5、10.5、21、31.5、42 μg/mL,每孔0.5 mL,培养24 h,于倒置光学显微镜下观察各组别细胞形态。
1.2.3 TG 对HepG2 细胞的增殖影响 取对数生长期的HepG2 细胞,调整细胞浓度为1×104个/孔,接种于96 孔板中,每孔加入100 μL,在细胞培养箱中培养。待细胞贴壁后,按照上述1.2.2 进行药物处理,每组六个复孔,培养24 h。采用CCK8 法检测细胞存活率,在波长450 nm 处测定吸光度值(OD),并按下式计算细胞存活率和细胞抑制率。
式中,空白组只含CCK8 液,对照组为0 μg/mL处理组,实验组为3.5、10.5、21、31.5、42 μg/mL 处理组。
1.2.4 TG 对HepG2 细胞周期的影响 取对数生长期的细胞,按5×105个/孔的细胞密度接种于六孔板中,每孔2 mL 的体系中含有5×105个细胞,放入培养箱中,按上述1.2.2 进行药物处理,培养结束后,根据试剂盒说明书进行后续操作。
1.2.5 TG 对HepG2 细胞迁移的影响 选取对数生长期的细胞,将细胞铺在六孔板中,每孔2 mL 的体系中含有6×105个细胞,待细胞贴壁及细胞汇合度为90%以上时,取出六孔板。按上述1.2.2 进行药物处理,0 h 时在显微镜下随机选取5 个视野进行拍照,放入培养箱中继续培养24 h,于光学显微镜下拍照,使用Image J 软件分析细胞刮痕,按下述公式(2)计算24 h 迁移率[18]。
1.2.6 Hoechst 33342/PI 双染法检测细胞凋亡 选取对数生长期的细胞铺在24 孔板中,每孔0.5 mL的体系中含有3×104个细胞,按上述1.2.2 进行药物处理,加入1 mL 细胞染色缓冲液,之后加入5 μL Hoechst 33342 染液和5 μL PI 染液进行染色。37 ℃避光孵育7~10 min,取出24 孔板,PBS 润洗后利用荧光显微镜拍照观察。
1.2.7 Annexin V-FITC/PI 双染检测HepG2 细胞的凋亡 选取对数生长期的细胞铺在六孔板中,每孔2 mL 的体系中含有2×105个细胞,按上述“1.2.2”进行药物处理,根据试剂盒说明书进行后续操作,加入5 μL Annexin V-FITC 和5μL PI 染液,4 ℃避光孵育后置于流式细胞仪进行细胞凋亡检测。
1.2.8 TG 对HepG2 细胞蛋白表达的影响 取按2×106个细胞/培养皿按照上述1.2.2 进行药物处理,采用80 μL 裂解液(RIPA:PMSF=100:1)裂解蛋白质,然后利用SDS-PAGE 电泳分离各蛋白样品(每孔上样量为50 μg),在冰浴中完成蛋白至PVDF 膜的转移,用1×TBST 缓冲液清洗条带,BSA 室温摇床慢速封闭1 h,按比例加入一抗(AFP、GSK3-β、β-catenin、Dsh),4 ℃孵育过夜,之后将PVDF 膜与二抗(按1:1000 的比例采用5% BSA 稀释)在室温下温育1~2 h,GAPDH 作为内参,PVDF 膜经过显影、定影后观察目标蛋白表达变化[6]。
1.3 数据分析
采用SPSS 25.0 统计软件进行ANONA 单因素显著性分析,以平均值±标准差()表示;流式细胞仪实验数据采用Flowjo 分析;使用Graphpad prism 8.0.2 作图。P<0.05 表示差异具有统计学意义,P<0.01表示存在极显著性差异。
2 结果与分析
2.1 TG 对HepG2 细胞形态的影响
在发生凋亡的过程中,首先其体积会慢慢变小,发生变形,然后贴壁细胞会慢慢发生皱缩、变圆、脱落以及胞内染色体固缩等过程,部分细胞核出现断裂、边缘化和凋亡小泡的形成。由图1 观察到,3.5 和10.5 μg/mL TG 处理的HepG2 细胞时,细胞体积逐渐变小;之后直观地观察到21 μg/mL 时细胞核开始皱缩,体积变小;31.5 μg/mL 时细胞伴有漂浮及细胞碎片的出现;42 μg/mL 时细胞膜彻底破裂,细胞发生裂解,出现坏死现象,边界不清,处在即将崩裂、死亡的状态。
2.2 TG 对HepG2 细胞的增殖影响
由图2 可知,不同浓度的TG 处理24 h 后,HepG2细胞的增殖受到不同程度的限制,与对照组细胞存活率相比,加药处理组随着浓度升高呈现下降趋势,分别为96.95%、92.59%、92.78%、77.24%、31.04%,浓度为3.5、10.5、21 μg/mL 没有显著性差异,且下降幅度较小,而31.5 和42 μg/mL 时具有极显著差异(P<0.01),经TG 处理的IC50为37.77 μg/mL。CCK8试验结果说明当TG 浓度为21 μg/mL 以上时,对HepG2 细胞抑制效果更佳。

图2 TG 对HepG2 细胞的增殖影响Fig.2 Effect of TG on the proliferation of HepG2 cells
2.3 TG 对HepG2 细胞周期的影响
如图3 所示,经不同浓度TG 处理24 h 之后,发现随着浓度的升高,G0/G1期逐渐减小,占比分别为59.9%、56.7%、56%、54%、33.4%、29.1%,均显著下降;S 期占比分别为14.3%、15.8%、16.8%、18.7%、25.1%、27.6%,均有不同程度的上升;与对照组(23.88%)相比,3.5~21 μg/mL 时,G2/M 期变化不大,占比分别为25.85%、24.92%、25.33%,当TG 为31.5和42 μg/mL 时显著升高(P<0.05),分别为37.89%、39.42%。该试验发现TG 在低浓度(3.5~21 μg/mL)时,不以影响细胞周期的主要方式抑制细胞分裂增殖,在高浓度(31.5 和42 μg/mL)时,会诱导细胞阻滞于S 期和G2/M 期,从而抑制细胞的增殖。同时当TG 为31.5 和42 μg/mL 时,subG1也有所增加,这与Sun 等[19]研究发现青蒿素衍生物在高浓度可以提高HepG2 细胞subG1峰的结果一致,他还发现随着青蒿素浓度的提高,G2/M 期细胞比例升高。细胞周期结果说明TG 可能是促进细胞周期进程抑制,进而诱导细胞凋亡。
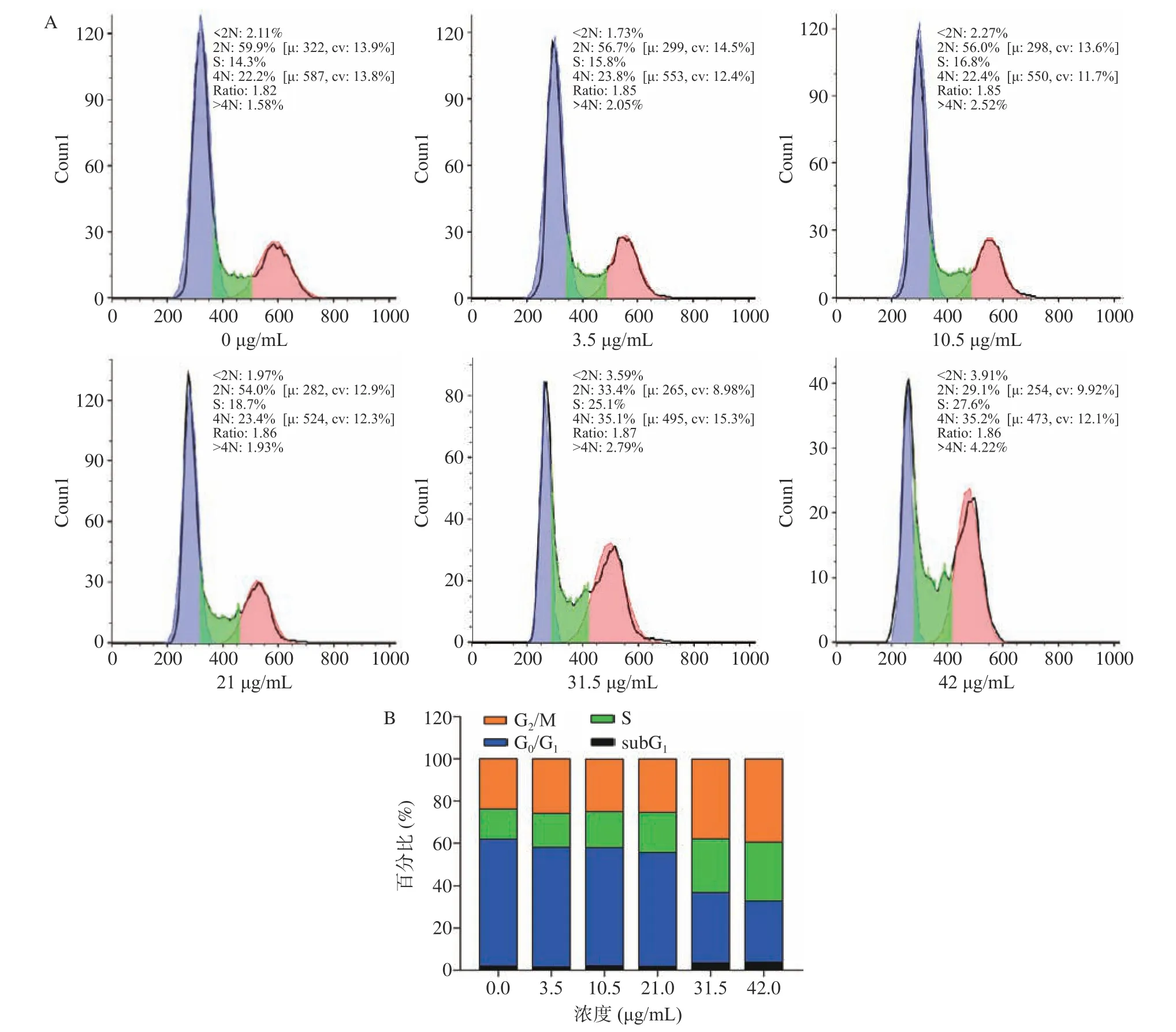
图3 不同浓度TG 对HepG2 细胞周期的影响Fig.3 Effects of different concentrations of TG on the cell cycle of HepG2 cells
2.4 TG 对HepG2 细胞迁移的影响
癌细胞转移是肿瘤治疗的关键之一,癌症的复发也与之有密切联系,为了探讨TG 是否可以抑制HepG2 细胞的迁移,采用划痕法来观察细胞迁移情况。如图4 所示,随着TG 浓度的升高,24 h 迁移率逐渐降低,抑制迁移效果越明显,迁移率分别为14.82%、13.42%、12.66%、10.11%、8.46%、7.24%,21 μg/mL 呈显著性差异(P<0.05),31.5 和42 μg/mL呈极显著差异(P<0.01)。该试验结果表明TG 可以抑制肝癌细胞的迁移,从而限制癌症转移至其他组织。
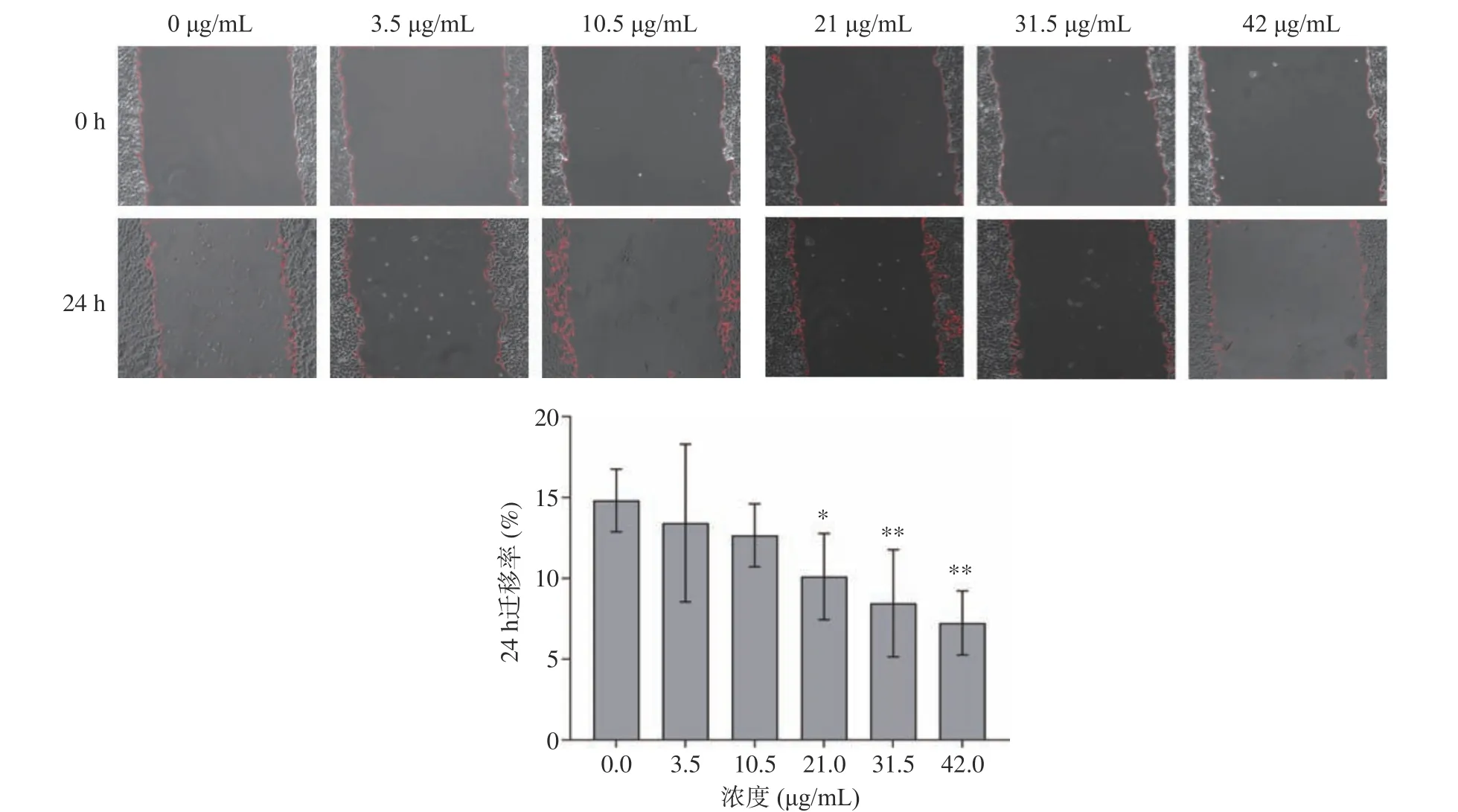
图4 不同浓度TG 对HepG2 细胞迁移的影响Fig.4 Effects of different concentrations of TG on HepG2 cell migration
2.5 Hoechst 33342/PI 双染法检测细胞凋亡
用Hoechst 33342 进行核染色,检测染色质凝结[20],正常细胞显低蓝色,凋亡细胞显高蓝色/低红色,坏死细胞显低蓝色/高红色,由图5 可知,与对照组相比,TG 处理组细胞染色质浓缩和细胞核碎片化,同时,观察到当TG 处在3.5~21 μg/mL 范围内,蓝色荧光逐渐增强,推测TG 在低浓度时主要以细胞凋亡方式来抑制细胞的增殖;而高于21 μg/mL 时,红色荧光增强,推测TG 在较高浓度时主要以损伤、破坏细胞结构杀死细胞。该试验结果说明经TG 处理,可以使HepG2 细胞发生凋亡直至坏死。

图5 不同浓度TG 对HepG2 细胞Hoechst 33342/PI 的影响Fig.5 Effects of different concentrations of TG on Hoechst 33342/PI in HepG2 cells
2.6 Annexin V-FITC/PI 双染检测TG 对HepG2 细胞凋亡的影响
为了进一步确定TG 对HepG2 细胞的凋亡诱导作用,采用Annexin V-FITC/PI 双染法对HepG2细胞进行染色。如图6 所示,随着浓度的升高,细胞凋亡率呈上升趋势,0、3.5、21、42 μg/mL 的凋亡率分别是5.63%、7.65%、10.93%、32.44%,具有剂量依赖性,结果表明TG 可通过破坏HepG2 细胞的膜完整性来诱导细胞凋亡。此结果与齐鑫鑫等[6]讨论肉苁蓉苯乙醇苷对于HepG2 细胞的AV/PI 染色结果一致。

图6 TG 对HepG2 细胞AV/PI 双染的影响Fig.6 Effect of TG on AV/ PI double staining of HepG2 cells
2.7 TG 对HepG2 细胞蛋白表达的影响
α-甲胎蛋白(α-fetoprotein,AFP)作为原发性肝癌的血清标志物,用于肝癌的诊断及疗效检测[21]。由图7 可知,与对照组相比,AFP 在处理组中表达水平均有所降低,推测TG 一定程度上可以抑制肝癌的发生,但逆转肝癌的概率微乎其微。另外,Dsh、βcatenin 水平随药物浓度的升高呈下降水平,且呈线性关系;GSK-3β逐渐升高,但不具有剂量依赖性。因此推测TG 可以调节Dsh、β-catenin 和GSK-3β相对表达情况,通过Wnt/β-catenin 经典信号通路来诱导HepG2 细胞凋亡。
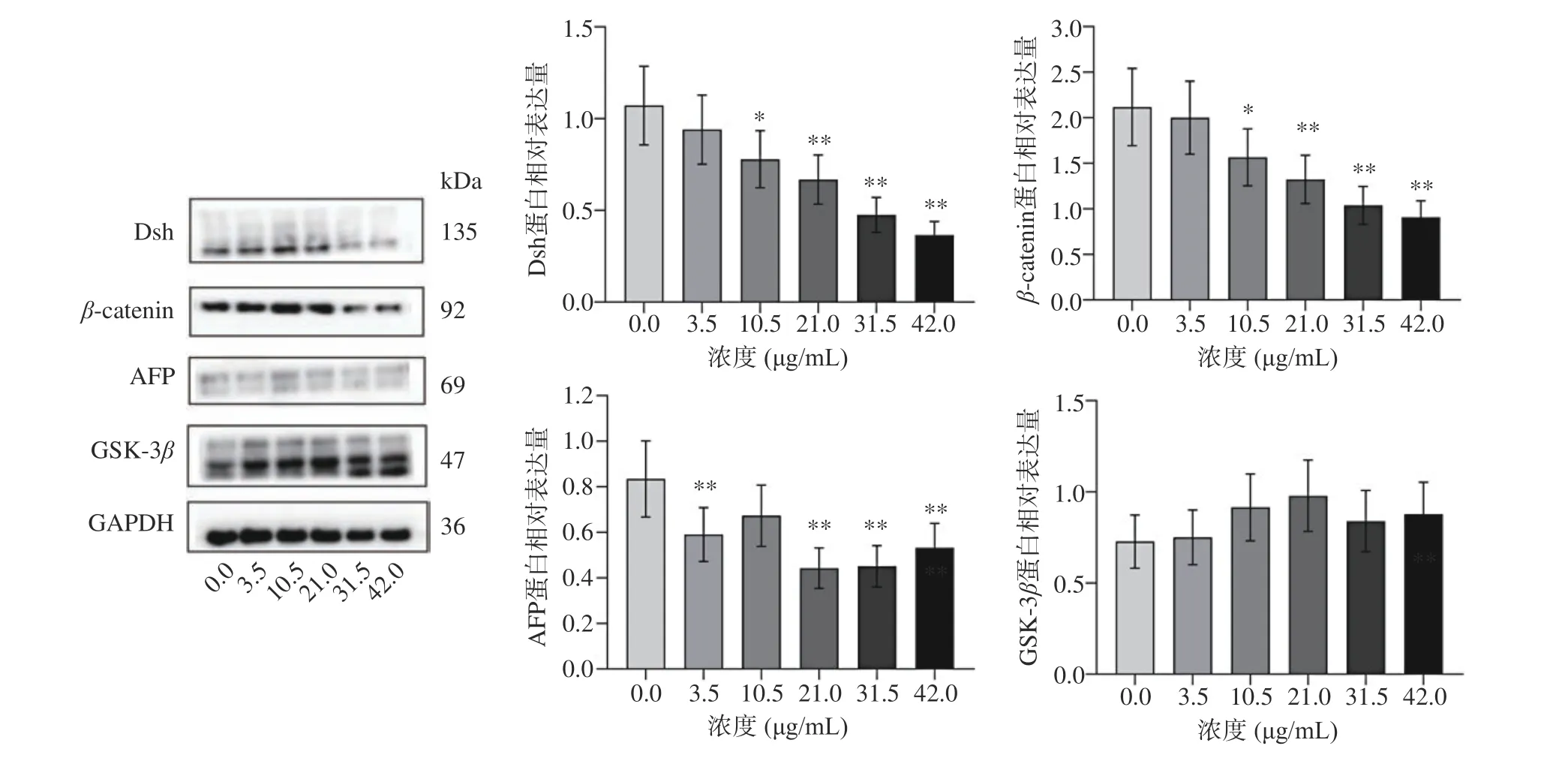
图7 不同浓度TG 处理HepG2 细胞蛋白表达情况Fig.7 Protein expression in HepG2 cells treated with different concentrations of TG
3 讨论与结论
肝癌是我国最常见的恶性肿瘤之一,也是死亡率位列前三的疾病[2],肝癌的主要治疗手段包括手术切除、肝移植、化放疗和免疫治疗等[22-24]。有报道表明,2016 年中国肝癌发病率为9.57%,死亡率高达13.92%[25]。由于早期肝癌症状无特异性,一旦出现症状多为中、晚期,所以对于肝癌,人们更积极的采用中医治疗[26]。人们认为天然化合物的分子毒性最小,并证明对肝癌的治疗有益处,所以积极地筛选新的抗肝癌天然化合物。近几年,肉苁蓉的多种功效备受人们的关注,逐渐成为保健食品开发和药物研究的热点之一,细胞形态和CCK-8 试验证实,一定浓度的TG 可以破坏细胞形态、抑制HepG2 细胞的生长和增殖能力,浓度与细胞抑制率成正比关系。
细胞周期是指细胞从一次有丝分裂完成开始到下一次分裂结束所经历的全过程,分为间期和分裂期两个阶段。流式细胞仪利用荧光染料区分G0/G1期、S 期和G2/M 期,通过细胞周期检测发现经不同浓度TG 处理之后,发现TG 在高浓度(31.5 μg/mL和42 μg/mL)时,可以阻滞细胞处在S 期和G2/M 期影响HepG2 细胞活性,产生细胞毒性,从而抑制细胞的增殖。
在癌症进展过程中,来自原发肿瘤的癌细胞侵袭邻近的正常组织,转移到远处,并形成新的菌落。据估计,总共有90%的癌症相关死亡率是由于转移性[27]。Wnt 信号通路参与了上皮细胞向间充质细胞转化和间充质细胞向上皮细胞的转变过程,以促进癌症转移,在HCC 进展过程中,高水平的β-catenin 与转移增强和预后不良相关[28]。本研究发现,经TG 处理24 h 后的HepG2 细胞迁移率随浓度的升高逐渐下降,具有浓度依赖性。这表明TG 可以控制癌细胞的迁移,阻止癌症的进一步扩散,可能是通过Wnt 信号通路降低β-catenin 的表达。
一般来说,受影响的细胞核显得较小;一些染色质在外围浓缩或聚集,而另一些则有核染色质碎片化、凋亡小体形成等典型特征[29-30]。Hoechst 33342是一种可以穿透细胞膜的蓝色荧光染料,对细胞的毒性较低,有研究发现经Hoechst 33342 染色的HepG2细胞中观察到凋亡细胞的形态学特征,包括核凝结和碎裂[31]。本实验发现经TG 处理24 h 后,具有染色质凝结和荧光核碎片的细胞比例以浓度依赖的方式增加,这与Yang 等[32]研究姜辣素诱导HepG2 细胞凋亡结果一致。利用Annexin V-FITC/PI 双染法检测TG 处理HepG2 细胞24 h 后,发现随着浓度的升高,细胞的凋亡率逐渐上升。
Dsh、β-catenin 和GSK-3β是典型Wnt/β-catenin信号通路中重要的调节因子,Dishevelled(Dvl/Dsh)是Wnt 信号通路上的关键蛋白,它能将Wnt 信号传递到下游的效应因子上[33]。经典Wnt 信号通路中,Dsh 被受体Frizzled 召集到细胞膜上,它作为一种原癌基因,与体轴抑制因子(Axin)、结直肠腺瘤性息肉基因(adenomatous polyposis coli gene,APC)、GSK-3β结合形成降解复合物,抑制GSK-3β对β-catenin的磷酸化降解作用,从而使得β-catenin 进入细胞核发挥作用[33-35]。β-catenin 在正常细胞中主要在细胞膜中表达,与细胞黏附有关,它还参与Wnt 信号通路的信息传递,调节细胞的增生、分化,当Wnt 信号通路异常激活后,β-catenin 发生了重新分布,这可能是肿瘤发生的原因之一[36]。据报道,在20%~35%的HCC 病例[15]中可观察到β-catenin 的激活。同时,还可通过抑制Wnt/β-catenin 信号通路激活自噬抑制HepG2 细胞的增殖[37]。该研究发现,TG 处理后的HepG2 细胞,Dsh、β-catenin 水平随药物浓度的升高呈下降水平,且呈线性关系;GSK-3β逐渐升高,但不具有剂量依赖性。因此可以推断TG 通过Wnt/βcatenin 信号通路来诱导HepG2 细胞凋亡。
世界范围内最广泛使用的原发性肝癌生物标志物是AFP[38]。AFP 在原发性肝癌患者的早期监测、病理分类、治疗选择和预后中具有重要作用。无论哪种治疗方式,当AFP 水平高于400 ng/mL 时,都会导致较差的存活率[39]。通过检测TG 处理细胞后AFP 蛋白表达水平,发现TG 可以有效减弱AFP 的表达量,表明TG 可以在肝癌早期时就起到抑制肝癌细胞的作用。
综上所述,肉苁蓉总苷通过影响细胞周期进展、破坏细胞结构、促进细胞凋亡、限制细胞迁移来抑制HepG2 细胞增殖生长,其作用机制可能是通过Wnt/β-catenin 信号通路,激活GSK-3β 降解β-catenin来实现肝癌抑制作用的,但需要进一步的深入研究。未来,专家学者可以深入探索肉苁蓉在Wnt/β-catenin信号通路上游及下游蛋白分子,验证作用靶基因,进一步探讨肉苁蓉总苷抗HepG2 细胞的作用机制。另外,肉苁蓉作为药食同源物质[40],日常饮食中食用可以起到预防和治疗同时兼顾的作用,也为践行大食物观,推进“健康中国”建设,提高人民健康水平提供一定的理论依据。
