鲜核桃致病菌分离鉴定及二氧化氯对其抑制效应研究
2023-10-19孟文彦万杨卓群张东莉刘方玥马惠玲
孟文彦,万杨卓群,张东莉,刘方玥,马惠玲
(西北农林科技大学生命科学学院,陕西杨凌 712100)
核桃又名万岁果,羌桃,是胡桃科胡桃属的植物(Juglansspp.)。核桃脂肪组分中约90%为不饱和脂肪酸,对增强大脑的思维能力和记忆力、降低心脑血管疾病发病率具有重要作用[1],并且核桃中富含蛋白质、视黄素、生育酚、维生素B6 等丰富的营养成分,十分有利于人体健康[2]。‘清香’核桃个体大、果壳薄、取仁容易、耐贮藏,是我国中晚熟核桃品种中的佼佼者,深受广大消费者的喜爱[3]。随着核桃产品的多元化,每年8~10 月以青皮核桃、脱皮鲜核桃等形式销售的产品在西北和西南地区市场中随处可见[4]。然而,鲜核桃贮存期易发生霉变,货架寿命短,25 ℃以上只有2~3 d[5-6],难以适应较长货架期或远距离的销售,降低其市场竞争力。因此,研发高效的鲜核桃流通或货架期保鲜技术具有十分重要的生产实践意义。
二氧化氯(Chlorine dioxide,ClO2)因其强的杀菌能力且不影响食品风味等优点,广泛应用于果蔬保鲜、畜禽制品、水产品、乳制品、啤酒和饮料等食品行业杀菌保鲜方面[7],被世界卫生组织(WHO)定为A1 级高效安全消毒剂[8]。ClO2可阻断蛋氨酸向乙烯的转化,且能氧化分解已合成的乙烯,延缓果蔬衰老和腐败,起到良好的保鲜作用;低浓度的ClO2杀菌机理与抑制病毒、细菌、霉菌中蛋白质的合成有关,高浓度ClO2则通过软化和破坏病原菌细胞壁或病毒包膜而杀菌[9]。目前,ClO2在核桃贮藏保鲜中的作用逐渐得到关注,ClO2处理后的青皮核桃在贮藏期腐烂率和褐变指数均显著下降,延缓了核桃果实的褐变[10]。低浓度ClO2浸果后结合真空包装抑制了鲜核桃仁腐烂,降低呼吸强度,有效保持贮藏期核桃仁的品质[11]。ClO2熏蒸结合气调包装也延长了脱皮鲜核桃的低温保鲜期[4]。然而,前人研究也发现高浓度(80 mg/L)的ClO2处理在抑制和杀灭核桃仁表面的微生物的同时,可能激发鲜核桃自身的生理性劣变[12],因此果实对不同浓度的ClO2承受能力差异较大,这也是困扰保鲜行业的一个难题[13]。并且ClO2对鲜核桃室温下(25 ℃左右)保鲜效果鲜有报道,对鲜核桃病原菌的鉴定及ClO2对其单独的抑制效应也少有研究。
核桃青皮提取液(GE)是近年来兴起的一种抑菌剂,前人对GE 的研究进行了大量报道[14],包括对其活性物质及含量的测定[15],在果蔬保鲜方面的应用。但少有应用于鲜核桃保鲜的文献,本研究依据科赫法则[16]分离了鲜核桃表面致病菌,通过形态学和分子生物学方法对各菌株进行分类与鉴定。采用离体和活体抑菌试验筛选和验证了ClO2对各菌的抑制效应,并比较它与GE 叠加处理的效应。研究旨在揭示ClO2在鲜核桃霉变控制中的作用特点和适宜剂量,为开发新型无公害鲜核桃防腐保鲜剂提供理论与技术支撑。
1 材料与方法
1.1 材料与仪器
‘清香’核桃(Juglans regiacv.Qingxiang)2021年8 月28 日(约雌花盛开后125~130 d)采摘于陕西省周至县专一‘清香’核桃园;二氧化氯(ClO2)缓释剂有效成分含量5%,粉剂(500 g/包装),订制于山东临朐华威生物科技有限公司;P3 保鲜袋 改良透气性的PE 袋(单层厚20 μm,25 cm×20 cm),西安海宏包装有限公司;三氯乙酸、硫代巴比妥酸、碳酸钠、蒽酮、葡萄糖和次氯酸钠 均为分析纯,国药集团化学试剂有限公司;无水乙醇 分析纯,科隆化学品有限公司;Luria-Bertani(LB)培养基 北京陆桥技术有限责任公司;马铃薯葡萄糖琼脂培养基(PDA)奥博星生物技术有限公司;Triton X-100 分析纯,登峰化学试剂厂;硫酸 分析纯,西陇科学有限公司;酵母基因组DNA 提取试剂盒 天根生化科技(北京)有限公司;凝胶回收试剂盒 奥科生物科技有限公司。
DH4000 电热恒温培养箱 天津市泰斯特仪器有限公司;SW-CJ-2F 超净工作台 苏州安泰空气技术有限公司;QYC-2102C 恒温振荡培养箱 上海福玛实验设备有限公司;SX-700 高压灭菌锅 TOMY KOGYO CO.,LTD;SW350T 光学显微镜 麦克奥迪实业集团有限公司;CR-400 色差仪 柯尼卡美能达(中国)投资有限公司[Konica Minolta(China)Investment Ltd];ABI3730-XL 测序仪 北京北嘉美仪生物科技有限公司。
1.2 实验方法
1.2.1 ‘清香’核桃处理 青皮核桃表皮无明显的病虫斑和机械损伤,部分有轻度裂纹,但未开裂。采回的青皮核桃在室温下放置12 h 以散去田间热,置于5±0.5 ℃冷库保存备用。每批试验用果时,对青皮核桃手工剥去青皮、自来水洗刷至表面洁净,并用去离子水冲洗3 次,室温吹晾1~2 h 至表面湿气挥发,得到新鲜脱青皮的(湿)鲜坚果,即鲜核桃,用作本研究材料。
1.2.2 青皮提取液(GE)的获取 采用索氏提取器法提取。将10 g 鲜青皮切成边长为0.2~0.3 cm 小块,包入滤纸,投入索氏提取器,加100 mL 75%乙醇,85 ℃提取4 h 后,用三层纱布过滤得到滤液,之后使用旋转薄膜蒸发仪蒸干圆底烧瓶乙醇(至1 mL 以下浆状物),用去离子水洗入100 mL 容量瓶中,定容得到100 mg/mL 的GE,当天制备当天用。
1.2.3 致病菌分离鉴定
1.2.3.1 真菌的分离 将鲜核桃堆积于30 ℃下,彩条无纺布覆盖,保湿至相对湿度(RH)≥90%。存放10 d 以上,待核桃发生严重霉变,挑选其中带有典型不同颜色霉菌病症的核桃,用接种针分别挑取各种霉菌菌块,划线法涂抹在PDA 培养基(ø=90 mm)进行初步分离。28 ℃培养3 d 后,挑取同一培养皿内不同形状与色泽的菌落分别接入新的培养基继续培养,重复3~4 次,直到每个培养皿只长出单一菌落,并连续两次不再分离后作为纯化菌株保存,留待测定。
1.2.3.2 细菌的分离 将鲜核桃堆积于25 ℃下,同1.2.3.1 中的操作进行保湿覆盖。待核桃表面呈现典型细菌滋生症状,即表面黏湿,局部颜色发黄时(约6~7 d),并呈现肉眼可见霉变症状时选取果壳上带霉菌的坚果3 个,分别放入100 mL 无菌水中浸泡,摇动5 min,使核桃表面的微生物脱离,制备菌悬液。吸取100 μL 菌悬液均匀涂抹到细菌培养基(LB)上,37 ℃培养2 d 后,按照上述真菌操作方法分离纯化培养直至得到单一菌株。
1.2.3.3 霉菌的回接 挑选12 个表面清洁、完整健康、大小整齐的新鲜核桃,并用蒸馏水冲洗3 次,备用。从上述纯化的两种霉菌菌落各挑取一个接种环左右面积的菌块涂抹至鲜核桃表面,每个核桃沿纵向左侧中部接种,之后将未接种一侧朝下,用灭菌卫生棉垫置广口组培瓶内,以使坚果位置固定,防止霉菌孢子的任意沾涂。每瓶摆放一个核桃,每种菌接种4 个核桃,4 个不接种作对照,盖盖,置于28 ℃培养箱中进行培养,每天观察,7 d 时坚果感菌症状明显,取出观察、拍照。
1.2.3.4 细菌的回接 用上述霉菌相同的方法获取12 个清洁完好的鲜核桃,每4 个坚果接种同一细菌菌株,4 个不接种作对照。同上置于培养瓶内,37 ℃培养3 d,每个核桃投入盛有100 mL 无菌水的烧杯中浸泡并轻微摇晃5 min,使核桃表面细菌脱离,制备菌悬液。按照GB4789.2-2022 方法测定每个核桃表面微生物数量[17]。
1.2.4 病原菌的分子鉴定 以上分离纯化得到的4 种致病菌,每种挑选生长旺盛的平板3 个,送杨凌天润奥柯生物科技有限公司进行菌种鉴定。霉菌鉴定方法为:采用酵母基因组DNA 提取试剂盒提取真菌基因组DNA,再以内转录间隔区ITS1/ITS4 引物(表1)扩增(PCR)18S rRNA 基因。PCR 体系组成:DNA 模板(50 ng/μL)1.0 μL,高保真DNA 聚合酶(2*Taq Master Mix)25.0 μL,正、反向引物(10 μmol/L)各1 μL,超纯水22.0 μL。反应流程为:98 ℃预变性30 s→98 ℃变性10 s→55 ℃退火30 s→72 ℃延伸1 min,循环30 次→72 ℃延伸5 min。PCR 产物使用奥科生物凝胶回收试剂盒回收;细菌则采用酚-氯仿法[18]提取基因组DNA,再以27F 和1492R通用引物扩增16S rRNA 基因。其PCR 体系组成为:基因组DNA(20 ng/μL)1.0 μL,高保真DNA 聚合酶(2X M5 HiPer plus Taq HiFi)15.0 μL,27F(10 μmol/L)、1492R(10 μmol/L)各1 μL,超纯水12.0 μL。同真菌操作流程获得和回收PCR 产物。
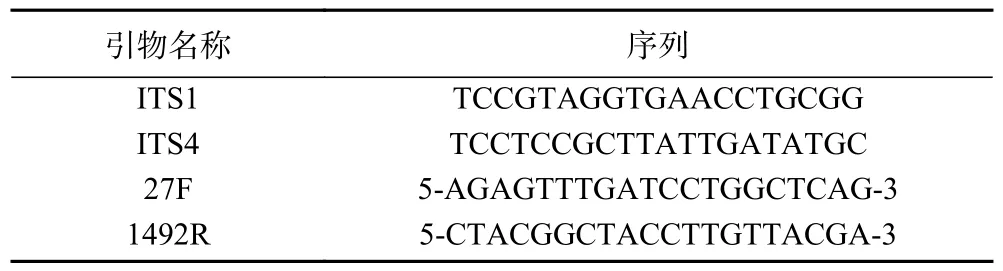
表1 引物名称及序列表Table 1 Primer name and sequence table
各菌株PCR 产物分别经ABI3730-XL 测序仪采取Sanger 技术测序,进行NCBI Blast(https://www.ncbi.nlm.nih.gov/)比对,相似率最高的种或属即为待测菌的鉴定结果。
1.2.5.1 ClO2缓释熏蒸剂对4 种致病菌作用的量效关系及半抑制浓度(IC50)测定 分别准备好霉菌的PDA 固体培养基和细菌的LB 固体培养基,根据培养基的体积,按照2、4、6、8、10、12、14、16、18、20、30、40 mg/L 的ClO2固体缓释熏蒸剂梯度剂量,将ClO2置入培养皿中央去除培养基的直径10 mm孔槽中,在孔槽之外均匀加入100 μL 菌悬液,涂布均匀后,霉菌在28 ℃下培养3 d,细菌在37 ℃下培养2 d,每种菌每个剂量ClO2重复进行3 次。以无药剂处理为对照,观测各皿中抑菌圈大小,换算为抑菌率(%)[19]。使用Igor Pro 软设置件分析数据,选取量效关系曲线模式,在指定抑菌率为0%~100%之间进行曲线拟合,并计算ClO2对4 种致病菌的半抑制浓度(IC50)的平均值及标准差[20]。
1.2.5.2 孢子萌发率和菌丝平均生长速率测定 用移液枪从28 ℃自然生长的霉菌PDA 平板上刮取适量孢子于无菌水中,多次吸打将孢子打散,充分摇匀,配制孢子悬浮液(107CFU/mL)。试验组于2 mL 离心管中加入含两种霉菌IC50浓度ClO2的900 μL PDA 液体培养基,然后加入100 μL 孢子悬浮液,于28 ℃,200 r/min 的恒温振荡培养箱中培养,分别于1、2、3、4、5 和6 d 时吸取培养液,显微镜下测定孢子萌发率[21]。每个处理至少观察100 个孢子,重复3 次。
1.2.5 离体抑菌实验
接种直径10 mm 的菌丝块于培养基中央,置于28 ℃培养箱中黑暗培养9 d。十字交叉法测定菌丝生长量,并计算菌丝生长速率[22]。
1.2.6 鲜核桃货架期保鲜试验
1.2.6.1 鲜核桃处理与包装 根据上述试验选取的ClO2剂量,按照每袋鲜核桃包装量(20 个,约0.37 kg),准备ClO2熏蒸药袋(0.48 g ClO2粉剂封入7 cm×5 cm无纺布袋)。以预试验中选取P3 保鲜袋(材料部分所述)为保湿包装,进行ClO2处理下鲜核桃货架期的霉变控制试验。设3 个处理:核桃青皮提取液(GE)处理(阳性对照),100 mg/mL GE 喷洒至核桃各个面湿润,晾干后密封;40 mg/kg ClO2熏蒸,20 个鲜核桃与ClO2药袋一起装入P3 袋,密封;复合处理,GE 喷洒并ClO2熏蒸。对照:洁净鲜核桃直接装入P3 袋密封。各处理均准备36 小袋,12 袋随机摆放于25 ℃货架,24 袋置于5 ℃货架。
1.2.6.2 抑霉效应 保存于25 ℃货架的核桃于0、6、12 d,5 ℃货架的于0、6、12、24、48 d 从各组随机抽取3 袋样品,观测鲜核桃表面霉变情况。每袋随机抽取3 个坚果,分别投入盛有100 mL 无菌水的烧杯,浸泡轻微摇晃5 min,使核桃表面微生物脱离,以制备菌悬液,按照GB4789.2-2022 测定微生物数量[17]。
1.2.6.3 品质评价 对25 和5 ℃货架各次所取的样品同步观测鲜核桃感观品质(仁色、香、脆、味、种衣剥离度),货架前和取样点分别对鲜核桃测定以下感观指标,每重复取4 个核桃,每处理共12 个。色泽:采用色差仪测定两瓣核桃仁间隔平整处的色泽亮度(L*);种皮剥离度:由评分小组10 人(均为大三学生,5 男5 女)手工剥取核桃仁的种衣,根据剥取的难易程度进行10~1 分间打分,评分标准如下(表2);消费者可接受度:参考Wang 等[6]的标准由同上10 人根据种皮感观色泽、核桃仁脆度和风味进行观测和品尝后在10~1 分之间综合打分,评分标准如下(表3)。

表2 种皮剥离度评分标准Table 2 Seed coat stripping degree scoring criteria

表3 消费者可接受度评分标准Table 3 Consumer acceptability rating criteria
1.3 数据处理
对离体和活体抑菌试验的数据、核桃保鲜结果观测值等采用统计分析软件SPSS22.0 进行正态分布与方差齐性检验,之后作单因素方差分析(ANOVA)和最小显著性差异法(LSD)进行多重比较,P<0.05为差异显著,P<0.01 为差异极显著。
2 结果与分析
2.1 鲜核桃致病菌分离与鉴定
2.1.1 致病真菌分离与感观验证 根据科赫法则,病原菌的类型及其致病性须培养分离和回接验证方可初步确定[16]。经对霉变核桃的真菌分离培养,得到黑色和绿色两种菌株,其纯化菌落特征如图1,初生菌丝均呈白色,老化至产生孢子期分别变为黑褐色和绿色。两种霉菌接种核桃均在接种部位产生了明显的黑霉或青霉症状;而右侧未接种部位果壳状态良好,虽然部分坚果的霉变已由左侧扩散至右侧,左右生霉量差异仍然明显,且霉变形态与货架期自然发生的一致,证明了两种霉菌对鲜核桃具有致病性。
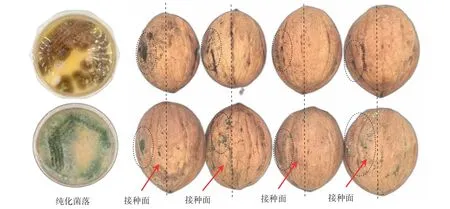
图1 鲜核桃分离的两种霉菌及其回接后的致霉效果Fig.1 Two sort of mold isolated from fresh walnut and their mildewing effect after reinfection
2.1.2 致病细菌分离与感观验证 对呈现细菌污染状的核桃进行细菌分离纯化同样得到两种菌株,其纯化菌落分别呈现白色和黄色(图2A、2B)。白菌表面光滑、湿润,黄菌略带粉质、并呈由边缘向中心逐渐加深的桔黄色。

图2 鲜核桃分离的白色(A)和黄色(B)细菌Fig.2 Separated white (A) and yellow (B) bacteria from fresh walnut
两种细菌分别回接核桃后测定发现,接种白菌引起核桃表面滋生白菌数量较对照增加了1 倍以上,差异极显著(P<0.01),黄菌数量差异不显著;接种黄菌引起核桃表面滋生黄菌数量较对照增加2.3 倍以上,差异亦达到极显著水平(P<0.01)。白菌数与对照差异不显著(表4)。可见,对照和接种组核桃的细菌污染均以黄菌和白菌为主,且接种细菌的核桃表面黏湿,颜色发黄,接种黄菌时细菌数量陡增,验证了黄菌是核桃发粘的主要致病细菌,白菌为次要致病细菌。
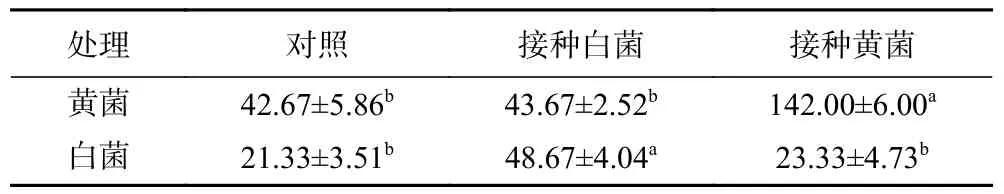
表4 细菌回接后鲜核桃表面微生物数量测定(×10 6 CFU/核桃)Table 4 Microbial quantity on the surface of fresh walnut after reinfection with bacteria (×10 6 CFU/walnut)
2.1.3 病原菌鉴定 将所观察到的病原菌形态与《真菌鉴定手册》[23]和《常见细菌系统鉴定手册》[24]等资料进行比对,发现黑霉与曲霉(Aspergillus)属,绿霉与青霉属(Penicillium)真菌外观形态大体相符。
进一步对4 种致病菌进行分子鉴定,如表5 所示,对两种霉菌的18S rRNA,内部转录间隔区1(ITS-1)、5.8S rRNA 和内转录间隔区2(ITS-2)基因完整序列,28S rRNA 部分序列比对,得出青霉菌株属于青霉属(Penicilliumsp),可信度为100%;黑霉菌株属于塔宾曲霉(Aspergillus tabinus),可信度也为100%。对白菌16SrRNA 部分序列(1020 bp)比对确定其为按树假单胞菌(Pseudomonas eucalypticola),可信度为99.85%,对黄菌16SrRNA 的部分序列(1395 bp)比对确定其为黄色微球菌(Micrococcus flavus),可信度为99.85%。即对‘青霉’只鉴定到青霉属,表观形态大致相符,黑霉鉴定到了种,两种细菌则全部鉴定到种。
前人研究提出生鲜水果病变主要是由霉菌引起的[11]。在鲜核桃保鲜领域,已鉴定出了部分品种的个别鲜核桃致病霉菌,其中青霉(Penicillium)是在不同核桃品种具有普遍致病效应的一种霉菌[25],这与本文中所得结论一致。除此之外,本研究从病变的‘清香’核桃上还分离出另一种致病霉菌—塔宾曲霉(Aspergillus tabinus)、及两种细菌(黄色微球菌和桉树假单胞菌),更加详细确定引起鲜核桃霉变和发粘的病原菌种类,为今后鲜核桃新型保鲜剂的开发提供了新的依据。
2.2 二氧化氯最适抑菌浓度的确定
2.2.1 二氧化氯缓释熏蒸剂对4 种病原菌作用的量效关系 当ClO2缓释熏蒸剂量由0 增加至40 mg/L时,4 种病原菌的抑制率均不断增加,表现出ClO2对4 种致病菌具有广谱的抑制效应,并且呈现显著的量效关系(图3)。在ClO2浓度为16 mg/L 时,对青霉的抑制率已达到100%,显著高于其它三种菌(P<0.05),但对黄色微球菌的抑制作用不强,仅不到40%。从ClO2浓度0~40 mg/L 全程来看,ClO2对青霉的抑制效应最强,对黄色微球菌的抑制效应最低,对塔宾曲霉和桉树假单胞菌的抑制效应较为相近,30 mg/L 的ClO2对塔宾曲霉的抑制率达到100%,40 mg/L 的ClO2对两种细菌的抑制率也达到100%,40 mg/L 的ClO2是作为共同抑制4 种病原菌的最低理论浓度。

图3 不同浓度二氧化氯缓释熏蒸剂对4 种病原菌的抑制作用Fig.3 Inhibition rates of different concentrations of chlorine dioxide fumigants on four pathogens
以20、40 mg/L ClO2缓释熏蒸剂作用为例,图示其对两种真菌的抑制效果(图4)可见,这两种剂量ClO2对青霉,40 mg/ LClO2对塔宾曲霉的抑制率均达到100%(图4B、C、F 所示),结果表明,ClO2对不同菌株的抑制能力有所差异,对青霉的抑制作用强于塔宾曲霉。
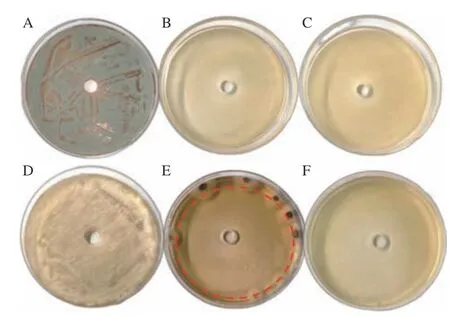
图4 ClO2 对青霉(上排)和塔宾曲霉(下排)抑制效果Fig.4 Inhibitory effect of ClO2 on Penicillium sp (top row) and Aspergillus tubingensis (lower raw)
前人报道适量的ClO2可降低低温自发气调贮藏鲜核桃的腐烂指数[4],本文进一步得出,这种防腐效应实际上是ClO2对青霉、曲霉和细菌共同抑制取得的。
2.2.2 二氧化氯缓释熏蒸剂对4 种病原菌作用的半抑制浓度(IC50)使用Igor Pro 软件分析数据,制作抑菌率与剂量对数的模拟曲线图,如图5 所示,在抑菌率0~100%之间,ClO2对4 种病菌的抑制率—剂量对数曲线均为典型的S 型。从曲线求得ClO2对4 种病菌的IC50分别为:青霉(A)7.357±0.451 mg/L、塔宾曲霉(B)12.943±0.693 mg/L、黄色微球菌(C)19.606±1.131 mg/L、桉树假单胞菌(D)13.022±1.131 mg/L。其中,青霉的IC50最低,黄色微球菌的最高,塔宾曲霉和桉树假单胞菌的IC50相近,说明ClO2缓释熏蒸剂对青霉的抑制作用最强,对黄色微球菌的抑制作用最弱,对塔宾曲霉和桉树假单胞菌的抑制效应较为相近,这非常适合ClO2缓释熏蒸剂应用于鲜核桃货架期保鲜,因为由肉眼可见,鲜核桃霉变症状中青霉霉变症状更为严重。

图5 二氧化氯对4 种致病菌的浓度效应曲线及IC50Fig.5 Dose-effect curve and IC50 of chlorine dioxide on four pathogens
2.3 各制剂对孢子萌发和菌丝生长的影响
以ClO2缓释熏蒸剂对两种霉菌各自的IC50作为供试浓度,分析ClO2对两种霉菌孢子萌发的抑制作用。由图6 可知,在6 d 之前ClO2对青霉和塔宾曲霉的孢子萌发均有显著的抑制作用,但是随着时间的推移该效应逐渐减弱。比较两种霉菌的孢子萌发率可知(图6A 和图6B),在2、3 d 时处理组的青霉孢子萌发率分别约为40%、60%,塔宾曲霉的孢子萌发率分别约为60%,80%。可见ClO2对青霉的孢子萌发抑制作用强于塔宾曲霉。

图6 IC50 水平的二氧化氯处理后青霉(A)和塔宾曲霉(B)的孢子萌发率Fig.6 Spore germination rate of Penicillium sp (A) and Aspergillus tubingensis (B) treated with chlorine dioxide at IC50 level
如表6 所示,ClO2极显著抑制了两种霉菌菌丝的生长(P<0.01),并且抑制率均大于50%,对青霉的抑制作用较塔宾曲霉更强。前人研究发现ClO2显著促进了指状青霉(Penicillium digitatum)的细胞凋亡,抑制了其菌丝体生长[26],本实验结果跟该研究趋于一致,Liu 等[26]采用了200~1800 mg/L 的ClO2,对4 种柑橘类果实的青霉病具有显著抑制作用,其离体抑菌实验的最低有效浓度为200 mg/L,本实验为40 mg/L,表明ClO2对核桃霉菌的抑制作用强于柑橘的致病霉菌,更适合用于核桃霉变控制。
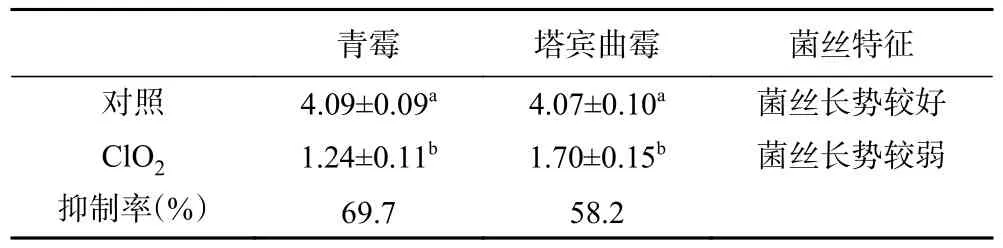
表6 不同处理下两种霉菌菌丝生长速率的变化(mm/d)Table 6 Growth rate of mycelium for two molds under ClO2 treatment (mm/d)
2.4 二氧化氯对货架期鲜核桃霉变的影响
在25 ℃货架6 d 和12 d 时,40 mg/L ClO2缓释熏蒸处理较对照均显著(P<0.05)减少了鲜核桃表面滋生真菌和细菌的数量(表7),且霉变起始期从对照的6 d 推迟至12 d,且12 d 时处理组的霉菌数量较对照组减少50.1%,细菌数较对照减少98.4%。对比图5 的离体抑菌试验的结果,在活体条件下ClO2对细菌的抑菌效果较真菌更强。在5 ℃下,ClO2处理将真菌与细菌的滋生天数由对照的12 d 延迟至24 d 以上,与25 ℃下相同,处理对细菌的抑制率高于真菌。从各组的观测数量上看,相同货架时间内,鲜核桃表面滋生的细菌较真菌多,表明活体条件下,细菌较真菌繁殖和生长更快,ClO2这种优先抑制细菌的效应更有利于鲜核桃病原菌的控制。由表7还可见,5 ℃下微生物发展慢于25 ℃,低温是抑制微生物滋生的最有效措施。国家对生鲜果实的微生物总量没有具体标准,参考《干果食品卫生标准》规定葡萄干,柿饼等鲜果干燥制成的干果食品不得有霉变[27]的标准,及《食品安全国家标准 糕点、面包》中对糕点、面包中菌落总数应<10000 CFU/g 的规定[28],ClO2处理鲜核桃5 ℃货架期24 d 完全符合食品卫生标准,而对照在25 ℃下6 d,5 ℃下12 d 均已出现微生物超标的情况。25 ℃下6 d 和12 d 的观测均得出,核桃青皮提取液(GE)的复合应用(P3+ClO2+GE)并没有较单独使用(P3+ClO2)增进对真菌和细菌的抑制作用。
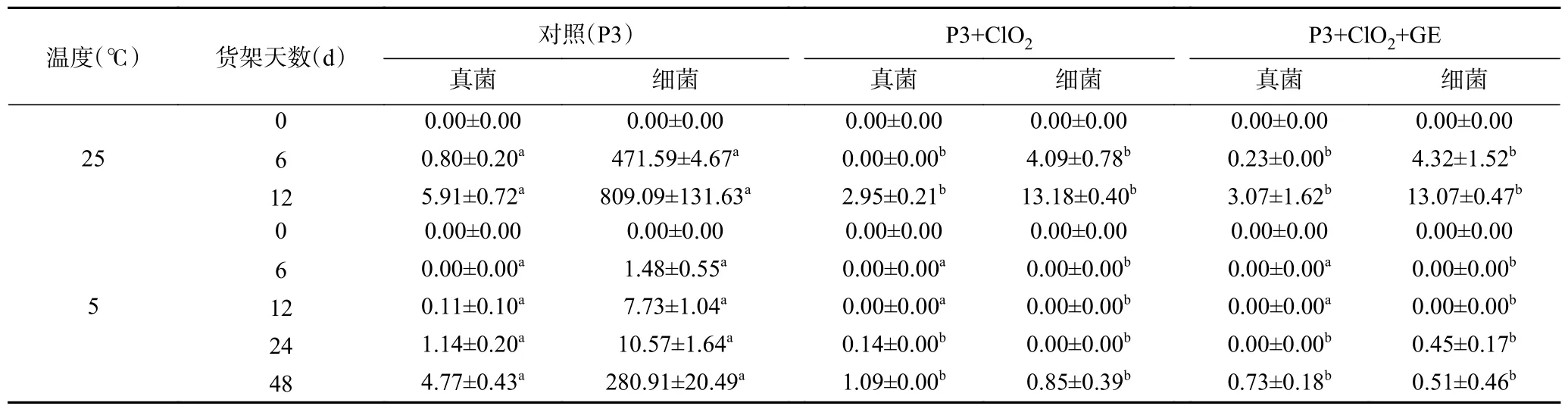
表7 货架期鲜核桃微生物数量变化(×104 CFU/g)Table 7 Changes of microbial quantity of fresh walnut during shelf life (×104 CFU/g)
2.5 二氧化氯对货架期鲜核桃感观品质的影响
25 ℃货架6 d 和5 ℃货架12 d 后剥去核桃壳后可见,各组核桃仁虽然均未出现肉眼可见的病变,然而感观色泽和新鲜度差别很大。如表8 所示,25 ℃下,随着货架时间的延长,核桃仁种衣褐变加剧,L*下降,6 d 时各组核桃仁L*均下降15%以上,两个处理下降量小于对照,但差异不显著(P>0.05)。12 d 时两个处理的L*显著高于对照(P<0.05)。5 ℃条件下,核桃仁种衣褐变大大延缓。两个处理进一步减少了种衣L*的下降量。在6~24 d 下降量均低于对照,差异均显著(P<0.05),48 d 时差距缩小,但是复合处理依然显著高于对照(P<0.05)。联系到上文观测到两处理显著的抑菌效果可知,ClO2或ClO2+GE 的复合处理通过抑制鲜核桃表面的微生物滋生,减缓了鲜核桃坚果整体品质劣变,抑制了核桃仁的褐变,以低温条件下的作用较室温下更强,复合处理较ClO2单独处理效果更显著。

表8 各抑菌剂处理后核桃仁的感官品质Table 8 Sensory quality of walnut kernel treated with various antibacterial agents
种皮剥离度方面,在25 ℃下,随着保鲜时间延长,核桃仁种皮剥离度大幅下降。6 d 时各组核桃仁种皮剥离度均下降20%以上,6~12 d 两个处理下降量小于对照,且差异显著(P<0.05)。5 ℃货架条件下,核桃仁种皮剥离度下降大大延缓。两个处理进一步减少了种皮剥离度的下降量。在6~24 d 下降量均低于对照,但差异不显著。消费者可接受度方面,25 ℃货架条件下,随着保鲜时间的加长,消费者可接受度迅速降低,12 d 时对照组的消费者可接受度仅为3.30,表明此时的核桃仁的品质(色、香、味)已低于可接受范围。6~12 d 两个处理的消费者可接受度均高于对照,差异显著(P<0.05)。5 ℃货架条件下,可延缓消费者可接受度的下降。6~24 d 两个处理的消费者可接受度仍高于对照,但差异不显著(P>0.05),48 d 时两个处理的消费者可接受度显著高于对照(P<0.05)。可见,ClO2增加了货架期鲜核桃的种皮剥离度,维持了较好感官品质,增大了消费者可接受度。GE 和ClO2复合处理在维持种皮亮度方面相比ClO2单独处理作用更强。
对25 ℃货架保鲜的鲜核桃仁进行0~12 d 外观形态拍摄记录,如图7 所示,对照组鲜核桃仁在6 d 时已出现明显的褐变,严重降低了核桃仁的品相和消费者可接受度。而ClO2处理组的核桃仁品相相差较小,出现轻度褐变,核桃仁色泽光亮,品相良好。对照组鲜核桃仁在12 d 时褐变进一步加重,呈深褐色,完全失去消费价值。而ClO2处理组虽然核桃仁表面有一定的褐变程度,但仍具有良好的品相,且表面无明显霉菌症状。

图7 鲜核桃仁于25 ℃下0、6、12 d 的外观状态Fig.7 Appearance of fresh walnut kernel at 25 ℃ for 0 d,6 d and 12 d
前人将含核桃青皮提取液(GE)复合涂膜剂成功用于鲜切苹果的保鲜[14],本研究用于鲜核桃病原菌离体抑菌效果却不明显(数据未显示),与ClO2复合使用于鲜核桃表现了部分活体抑菌效应。由于GE 富含各种多酚类物质[29],可推测GE 的主要效应不在于抑菌,而是抗氧化,从而减轻了货架期鲜核桃壳及其内部核桃仁品质下降,理论上也是鲜核桃保鲜中富于前景的功能性植物保鲜剂。只是,本文采用粗提液作用并不显著。通过优化GE 提取的工艺溶剂[30]和提取方法[31],有望进一步提高GE 的抑菌效果,为GE推广应用于鲜核桃寻找新的保鲜方法。
3 结论
从病变的核桃上分离纯化和鉴定出青霉(Penicilliumsp)、塔宾曲霉(Aspergillus tabinus)、桉树假单胞菌(Pseudomonas eucalyptus)和黄色微球菌(Micrococcus flavus)4 种菌株,是鲜核桃的主要致病菌。
ClO2熏蒸对4 种病原菌的抑制效应在0~40 mg/L 之间均具有量效关系,对两种真菌100%抑制的浓度为16~30 mg/L,对两种细菌为40 mg/L。40 mg/L ClO2处理下,25 和5 ℃货架期鲜核桃的真菌与细菌滋生数量均显著降低,霉变期延迟,减缓鲜核桃仁的感官品质下降,鲜核桃无可见霉变期分别保持6、24 d,核桃仁的消费者可接受期由对照的6、24 d 分别达到12、48 d。核桃青皮提取液复合使用仅对ClO25 ℃下的抑菌效应有所促进,对核桃仁感观品质略有提升。
综上得出,40 mg/L ClO2熏蒸是鲜核桃室温和低温货架保鲜均适用的措施,按药剂成本0.10 元/kg核桃,是经济又高效的保鲜方法,在生产中具有广泛的应用潜力。
