基于层次分析-熵权法优化刺五加多组分超声提取工艺
2023-10-19林亚美支红欣孙霁骧陈博宇刘胜凯刘志国
林亚美,支红欣,孙霁骧,陈博宇,刘胜凯,刘志国,
(1.东北林业大学化学化工与资源利用学院,黑龙江哈尔滨 150040;2.东北林业大学森林植物生态学教育部重点实验室,黑龙江哈尔滨 150040)
刺五加为药食同源植物,有抗疲劳、抗辐射、抗氧化、抗肿瘤、抗衰老、免疫调节等作用[1-2],还可用于治疗糖尿病、神经衰弱以及心脑血管疾病[3-4]。刺五加活性成分是其发挥药理作用的物质基础,紫丁香苷、刺五加苷E 常被视为重要研究对象。紫丁香苷有降血糖、保护心脏以及免疫调节作用[4-8];刺五加苷E 有抗炎、降血糖、保护脑缺血再灌注引起的损伤,恢复由于睡眠剥夺引起的认知行为损伤等作用[9-12]。刺五加其他化学成分也经证实存在一定药理作用,异嗪皮啶有抗肿瘤及抗炎作用[13-14];芝麻素对帕金森病运动迟缓以及抑郁行为有预防作用[15];绿原酸具有抗菌及抗氧化作用[16]。
植物基食品尤其是药食同源植物,富含多种活性成分而有益于人体健康,受到极大关注。由此可见,药食同源植物活性成分高效提取对人类健康有重大意义,亦可提高其资源利用,表明高效提取工艺开发至关重要。高效提取工艺开发有赖于定量分析方法的建立,超高效液相-质谱(ultra-high performance liquid chromatography-mas sspectrometry,UPLC-MS/MS)定量分析方法由于操作简便、精准高效、高通量等特点而被广泛应用[17-18]。Q ExactiveTMFocus 组合型四极杆OrbitrapTM质谱仪是近年新兴的一种高分辨质量分析器,其平行反应监测(Parallel Reaction Monitoring,PRM)定量模式由四极杆对目标化合物进行选择性通过,而后发生高能碰撞产生碎片离子,并在Orbitrap 进行高分辨扫描,故而选择高分辨的二级离子即可完成定量[19]。
中药药效往往是多种活性成分协同作用的结果,因此提取工艺优化不应以单一指标进行片面评价,而是倾向于多指标综合评价。目前国内外提出的综合评价方法不断丰富,总体归为主观赋权评价法和客观赋权评价两大类,已被广泛应用于活性化合物提取工艺的优化,疾病风险评估,中药质量研究,以及多种生物活性的综合比较[20-21]。层次分析法(analytic hierarchy process,AHP)为常用主观赋权法,而客观赋权法常见有熵权法(entropy weight method,EWM),两者优缺互补,形成的组合赋权法(AHP-EWM 法)更科学合理[22]。
超声波提取技术高效,安全且适用性广,已被广泛应用于中药提取。本研究拟开发刺五加根茎多组分UPLC-MS/MS 定量方法,并拟建多指标综合评价方法,以优化刺五加根茎多组分超声提取工艺。刺五加根茎多组分高效提取,为其资源利用以及药效基础研究奠定基础,具有实际指导意义。
1 材料与方法
1.1 材料与仪器
刺五加根茎 黑龙江省虎林市东方红林业局青山林场,经东北林业大学唐中华教授鉴定为五加科植物刺五加(Acanthopanax senticosus(Rupr.et Maxim.)Harms)的干燥根茎;紫丁香苷(≥98%)上海阿拉丁生化科技股份有限公司;绿原酸、刺五加苷E、异嗪皮啶、咖啡酸、芝麻素(≥98%)上海源叶生物科技有限公司;甲醇(质谱级)美国赛默飞世尔科技公司;甲酸(质谱级)北京百灵威科技有限公司;无水乙醇(分析纯)天津市富宇精细化工有限公司。
Vanquish 型超高效液相色谱仪配有Hypersil GOLDTMVANQUISH 色谱柱(1.9 μm×100 mm×2.1 mm)、Q Exactive Focus 型质谱仪配有加热电喷雾离子源(HESI)及Xcalibur 4.1 数据处理系统 美国赛默飞世尔科技公司;FCMCR-3S 型超声反应器 巩义市科瑞仪器有限公司;JSM-7500F 型扫描电子显微镜(scanning electron microscopy,SEM)日本电子株式会社。
1.2 实验方法
1.2.1 刺五加多组分超声提取工艺 参照料液比1:40 g:mL 称取2.5 g 过40 目筛网的刺五加根茎,加至100 mL 体积分数为60%的乙醇溶液中,置于超声探头下,设置超声功率360 W,提取时间20 min,以进行提取。
1.2.2 UPLC-MS/MS 定量方法建立
1.2.2.1 标准溶液配制 甲醇为溶剂,配制一定质量浓度的各标准溶液,并移取一定体积的各标准溶液配制得质量浓度为10 mg/L 的标准混合储备液。而后甲醇稀释得到一系列标准混合稀释液,供UPLCMS/MS 分析,质量浓度分别为25、50、100、200、400、1000 μg/L。
1.2.2.2 样品溶液配制 取1.2.1 所得刺五加根茎超声提取液进行适当倍数稀释,即得样品溶液,一次性注射器配合0.22 μm 滤膜将样品溶液移至液质专用进样瓶,供UPLC-MS/MS 分析。
1.2.2.3 色谱-质谱条件 UPLC 条件:流动相:0.1%甲酸水溶液(A)/甲醇(B),流速:0.35 mL/min,梯度洗脱程序:0~2 min,2% B;2~3 min,2%~98% B;3~7 min,98% B;7~7.1 min,98%~2% B;7.1~10 min,2% B,柱温:40 ℃,进样体积:5 μL。
MS/MS 条件:加热电喷雾离子源(HESI source)具体参数如下:鞘气,辅助气,吹扫气流速分别为40,10,0 单位N2,喷雾电压:3.0 kV,离子传输管温度:320 ℃,S-lens RF 水平:60,加热器(雾化)温度:350 ℃。数据采集:PRM 高分辨定量模式,正负切换扫描,采集时间与液相系统一致,参数见表1[23-25]。

表1 目标化合物PRM 参数Table 1 PRM parameters of the target compounds
1.2.2.4 方法学考察 对UPLC-MS/MS 定量方法进行方法学考察[18],对其线性、精密度、重复性、稳定性以及加标回收率进行验证,如下:
专属性及线性验证:比对标准品与样品的二级质谱图,确定各目标化合物的保留时间(retention time,RT)。由1.2.2.1 系列标准混合溶液稀释液进行线性验证,以质量浓度(μg/L)为横坐标(x),峰面积为纵坐标(y),绘制标准曲线,即得回归方程及相关系数。此外,检出限(limit of detection,LOD)对应信噪比为3 的标准溶液质量浓度,定量限(limit of quantitation,LOQ)对应信噪比为10 的标准溶液质量浓度。
精密度验证:取上述质量浓度为200 μg/L 的标准混合溶液稀释液作精密度验证测试液,连续进样6 次,以验证日内精密度,同时三天内分别进样,以验证日间精密度。
重复性验证:参照1.2.2.2 平行制备样品溶液6 份,作重复性验证测试液,以验证重复性。
稳定性验证:取重复性验证测试液的其中一份,每间隔2 h 进行测定,测定6 次以验证日内稳定性。同时,三天内分别进样,以验证日间稳定性。
加标回收率验证:取重复性验证测试液分别添加高低水平的标准混合溶液(低水平:50 μg/L,高水平:200 μg/L),以验证加标回收率。
1.2.3.1 AHP 本研究AHP 模型由两个层次组成,如图1 所示,顶层是模型目标(超声提取工艺优化),第二级为标准,即指标(各目标化合物含量)。
图1 层次分析法模型Fig.1 Model of analytic hierarchy process
式中,A 为判断矩阵,参照九级标度法(表2)创建,所得成对比较矩阵见表3;n 为指标数量;aij表示指标i 相对于指标j 的重要性。

表2 九级标度法标准Table 2 Standard for the nine-point scale
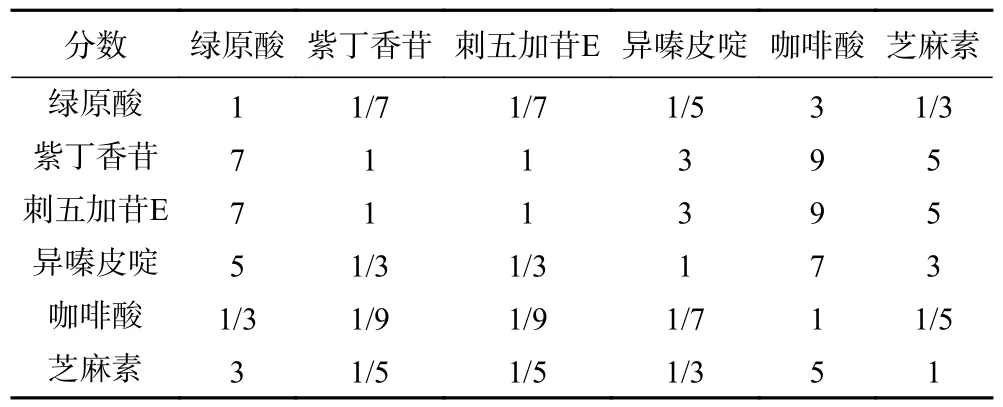
表3 成对比较矩阵Table 3 Pair-wise comparison matrix
1.2.3 AHP-EWM 法建立
AHP 法确定指标权重ri的过程如下[20-21]:
式中,λmax为矩阵最大特征根;CI 为一致性指标;CR 为一致性比率;RI 是相应的随机指数。CR 用于评估矩阵合理性,CR<0.1 表示矩阵内的评估是可接受的,反之则表示判断不科学[21]。
1.2.3.2 EWM 基于熵信息理论的EWM 可根据给定数据推断有用信息,当评价指标的给定信息具有重大意义时,熵值较低,此信息应被赋予高权重系数以表示其重要性[26]。EWM 法确定各指标权重的过程如下[27]:
式中,X 为创建的评估矩阵,m 为样本数量,n为标准变量数量,xij指第i 个样本中第j 个指标的值。
式中,rij为第i 个样本中第j 个指标的标准值;pij则为归一化后的值;ej为第j 个指标的熵值;dj为第j 个指标的信息熵冗余;wj为第j 个指标的熵权系数。
1.2.3.3 AHP-EWM AHP 与EWM 相结合,既能通过主观经验对指标重要性进行排序分配,又能客观反映指标信息,使得权重系数更加科学合理[28]。
式中,Fi为AHP-EWM 所得第i 个指标的最终权重;ri为AHP 法所得第i 个指标权重;wi为EWM所得的第i 个指标权重。
1.2.4 单因素实验 参照1.2.1,由单因素实验初步探究超声功率,超声时间,料液比,乙醇体积分数,原料粒径对刺五加提取综合得分的影响。
1.2.4.1 超声功率 参照料液比1:40 g:mL 称取2.5 g过40 目筛网的刺五加根茎,加至100 mL 体积分数为60%的乙醇溶液中,置于超声探头下,设置不同超声功率(180、360、540、720、900、1080 W),超声时间20 min,以进行提取。
1.2.4.2 超声时间 参照料液比1:40 g:mL 称取2.5 g 过40 目筛网的刺五加根茎,加至100 mL 体积分数为60%的乙醇溶液中,置于超声探头下,超声功率720 W,设置不同超声时间(5、10、15、20、25、30 min),以进行提取。
1.2.4.3 料液比 参照不同料液比(1:10、1:20、1:30、1:40、1:50、1:60 g:mL)称取一定量过40 目筛网的刺五加根茎,加至100 mL 体积分数为60%的乙醇溶液中,置于超声探头下,设置超声功率720 W,超声时间15 min,以进行提取。
1.2.4.4 乙醇体积分数 参照料液比1:40 g:mL 称取2.5 g 过40 目筛网的刺五加根茎,加至100 mL 不同体积分数的乙醇溶液(0%、20%、40%、60%、80%、100%)中,置于超声探头下,设置超声功率720 W,超声时间15 min,以进行提取。
1.2.4.5 原料粒径 参照料液比1:40 g:mL 称取2.5 g 不同粒径(以筛网目数为计量单位,20、40、60、80、100、120 目)的刺五加根茎,加至100 mL 体积分数为60%的乙醇溶液中,置于超声探头下,设置超声功率720 W,超声时间15 min,以进行提取。
1.2.5 响应面试验 基于单因素实验,选取刺五加提取综合得分主要影响因素-超声功率(A),超声时间(B)以及乙醇体积分数(C)这3 个因素为自变量,以试验中AHP-EWM 法所得综合得分(Y)为响应值,基于BBD 原理设计响应面实验,自变量因素及水平见表4。

表4 响应面试验因素及水平Table 4 Factors and levels of response surface experiments
1.2.6.1 刺五加多组分的测定及含量的计算 参照1.2.2 建立的UPLC-MS/MS 定量方法测定目标化合物含量,计算公式如下:
式中,Q 为含量,μg/g;K 为稀释倍数;C 为样品测试液质量浓度,μg/L;V 为提取液体积,L;m为刺五加根茎质量,g。
1.2.6 刺五加多组分含量及综合得分的计算
1.2.6.2 综合得分的计算
式中,Z 为综合得分;Qi为第i 个指标含量[29]。
1.2.7 刺五加根茎残渣SEM 分析 参照响应面法优选方案进行验证实验,并收集超声提取最佳工艺所得刺五加根茎残渣进行SEM 分析。SEM 分析:将刺五加根茎残渣干燥并喷金处理,而后由扫描电子显微镜在电压5 kV,电流10 μA 条件下对残渣进行形貌表征,放大倍数为1000 倍。
1.3 数据处理
所有试验平行3 次,结果取平均值和标准偏差;数据采用Origin 2021 进行统计整理和绘图;单因素ANOVA 分析采用SPSS 21 统计软件,P<0.05 表示具有显著性差异;分析响应面采用Design Expert 8.0.6软件进行处理。
2 结果与分析
2.1 UPLC-MS/MS 定量方法建立
2.1.1 专属性及线性验证 比对目标化合物标准品与样品的二级质谱图,其色谱提取及二级质谱图见图2,与已报道的HPLC 方法相比,分析时间大大缩短[30-31]。同时,各目标化合物RT,LOD 以及LOQ结果同线性验证结果一同汇总于表5,结果表明目标化合物在一定质量浓度范围内线性关系良好。
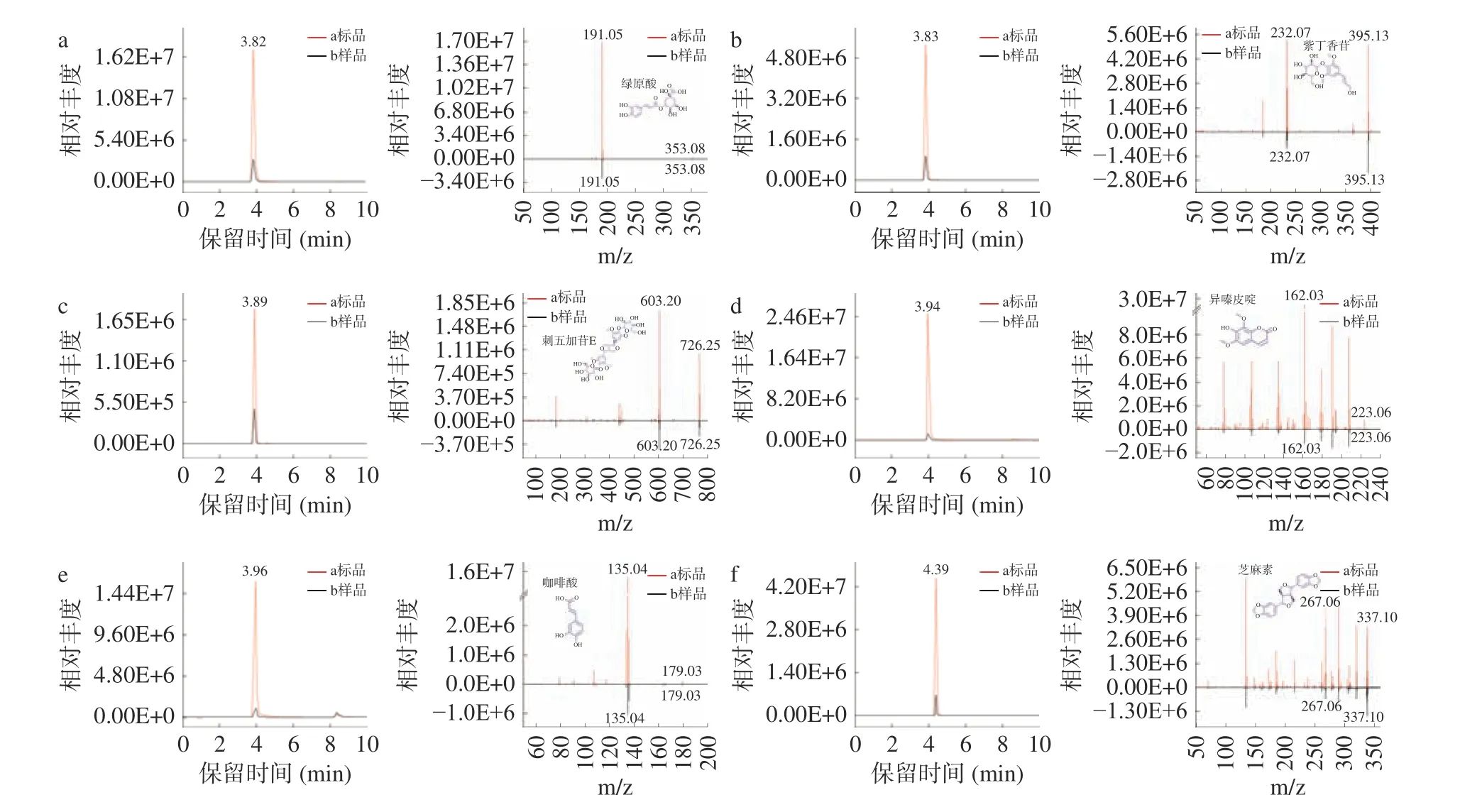
图2 目标化合物色谱及二级质谱图Fig.2 Chromatography and secondary mass spectrometry diagram of target compounds

表5 目标化合物线性验证结果Table 5 Linear verification results of the target compounds
2.1.2 精密度、重复性、稳定性验证 汇总目标化合物精密度,重复性及稳定性结果,对其保留时间(RT)及峰面积(PA)的RSD 进行分析,结果见表6。关于日内精密度,其RT 的RSD 范围为0.00%~0.17%,PA的RSD 范围为1.12%~1.94%;关于日间精密度,其RT 的RSD 范围为0.00%~0.15%,PA 的RSD 范围为1.23%~1.97%;关于重复性,其RT 的RSD 范围为0.12%~0.14%,PA 的RSD 范围为1.52%~2.57%;关于日内稳定性,其RT 的RSD 范围为0.00%~0.30%,PA 的RSD 范围为0.71%~1.94%;关于日间稳定性,其RT 的RSD 范围为0.00%~0.25%,PA 的RSD 范围为1.46%~2.59%。以上实验结果表明该定量方法精密度,重复性以及稳定性皆良好。
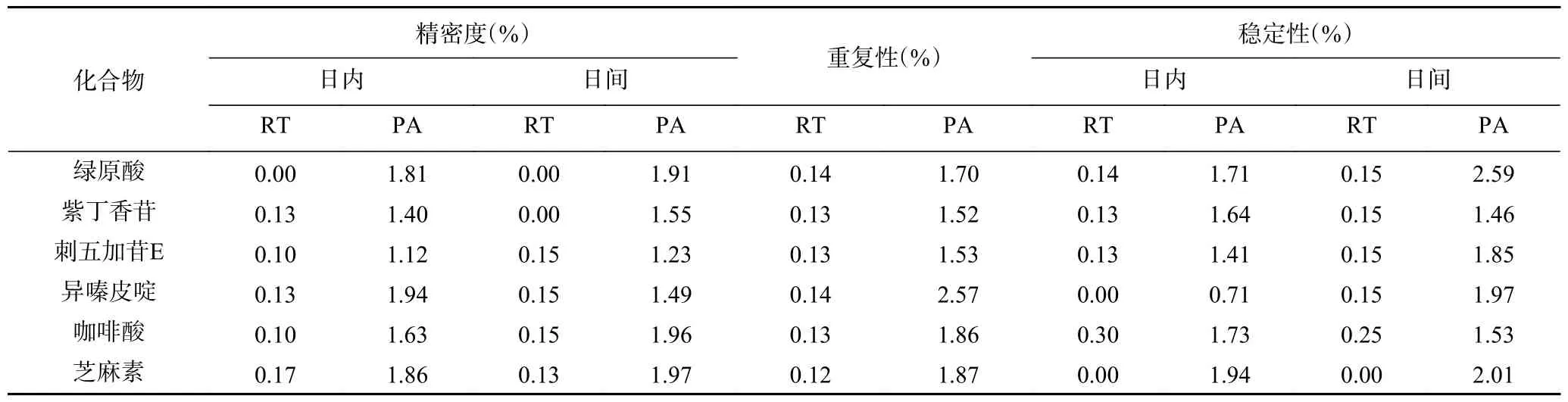
表6 目标化合物精密度,重复性及稳定性验证结果Table 6 Precision,reproducibility and stability verification results of the target compounds
2.1.3 加标回收率验证 汇总目标化合物加标回收率验证结果,分析其平均回收率以及RSD 值,见表7。低水平加标回收率范围为95.67%~98.79%,其RSD范围为2.01%~3.76%;高水平加标回收率范围为90.61%~105.69%,其RSD 范围为2.30%~3.75%。结果表明该定量分析方法加标回收率表现良好。

表7 目标化合物加标回收率试验结果Table 7 Standard addition recovery rate verification results of the target compounds
2.2 单因素实验
2.2.1 超声功率对刺五加多组分超声提取工艺的影响 由AHP 确定目标化合物(绿原酸、紫丁香苷、刺五加苷E、异嗪皮啶、咖啡酸、芝麻素)权重系数分别为0.044,0.342,0.342,0.164,0.024,0.084。λmax为6.277,由n=6 查表得RI=1.24[21],即得CR=0.04<0.1,表明矩阵具有一致性,数值设置以及权重系数可靠。
超声功率对提取过程起到至关重要的作用,本实验控制超声功率范围180~1080 W。基于实验结果,EWM 所得目标化合物权重系数分别为0.117,0.154,0.156,0.216,0.186,0.170;AHP-EWM 所得目标化合物权重系数分别为0.031,0.319,0.323,0.215,0.027,0.086;由此可知不同超声功率下刺五加多组分提取过程的综合得分。图3 反映超声功率显著影响刺五加多组分超声提取过程,随着超声功率的增大,目标化合物提取含量也显著增长。当功率达540 W后,目标化合物提取含量呈现或减小或缓慢增长趋势,而综合得分在功率达720 W 及1080 W 时都较佳,且与540 W 及900 W 处理组有显著差异(P<0.05),为节约能耗,确定超声功率为720 W 以进行后续的实验。同时,确定超声功率为影响刺五加提取综合得分的显著因素,并选择540,720,900 W 三个水平进行后续的响应面实验。
2.2.2 超声时间对刺五加多组分超声提取工艺的影响 图4 反映超声时间对提取过程的影响,可知目标化合物提取含量在0~15 min 内随提取时间增加而显著升高,15 min 后,部分目标化合物出现小幅度下降或不明显增长,综合得分在超声时间为15 min时最大。其显著性分析显示,15 min 处理组与10 min处理组存在极显著差异(P<0.05)。提取时间不同程度上影响目标化合物溶解扩散过程,提取时间短,目标化合物成分溶解不充分,提取效率低。提取时间长,温度不断上升,易使目标化合物在提取过程中发生降解而导致含量下降,同时增加能耗[32]。综合考虑,本研究采用15 min 作为单因素探究的最适提取时间,以进行后续的实验。同时,确定超声时间为影响刺五加提取综合得分的显著因素,并选择10,15,20 min 三个水平进行后续的响应面实验。

图4 超声时间对刺五加根茎超声提取的影响Fig.4 Effect of ultrasonic time on ultrasonic extraction of Acanthopanax senticosus rhizomes
2.2.3 料液比对刺五加多组分超声提取工艺的影响 图5 反映料液比对提取过程的影响,目标化合物提取含量初始随料液比变化而增大,这归因于提取基质与溶剂之间的表面接触增加,当料液比大于1:30 g:mL 时,超声波与原料作用减弱,目标化合物提取含量或缓慢增长或小幅度下降[32-33]。综合得分在料液比达1:40 g:mL 时最大,且与1:30 g:mL 处理组及1:50 g:mL 处理组无显著差异,故确定料液比为1:40 g:mL。
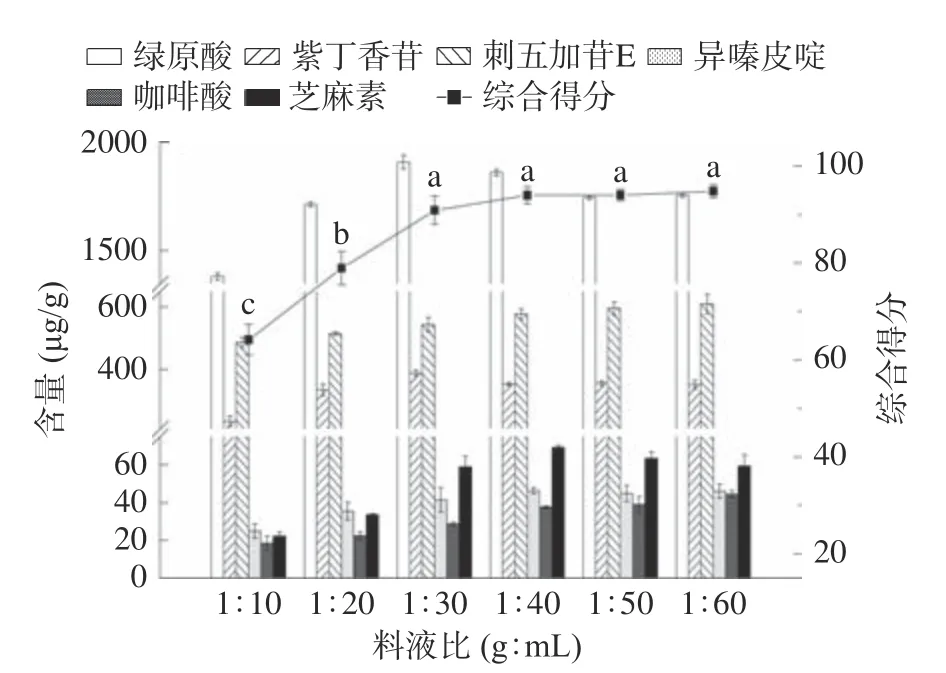
图5 料液比对刺五加根茎超声提取的影响Fig.5 Effect of solid-liquid ratio on ultrasonic extraction of Acanthopanax senticosus rhizomes
2.2.4 乙醇体积分数对刺五加多组分超声提取工艺的影响 图6 反映乙醇体积分数对提取过程的影响,不同目标化合物的脂溶性不同,因此在不同体积分数的乙醇溶液中其溶解性表现不同[33]。可知刺五加苷E 在乙醇体积分数为40%时提取效果最佳,绿原酸、紫丁香苷、咖啡酸在乙醇体积分数为60%时最佳,而异嗪皮啶、芝麻素则为80%。综合得分在乙醇体积为60%时最高,且与乙醇体积分数40%处理组及80%处理组存在极显著性差异(P<0.05),故选择60%乙醇体积分数继续后续的单因素实验。同时,确定乙醇体积分数为影响刺五加提取综合得分的显著因素,并选择40%,60%,80%三个水平进行后续的响应面实验。
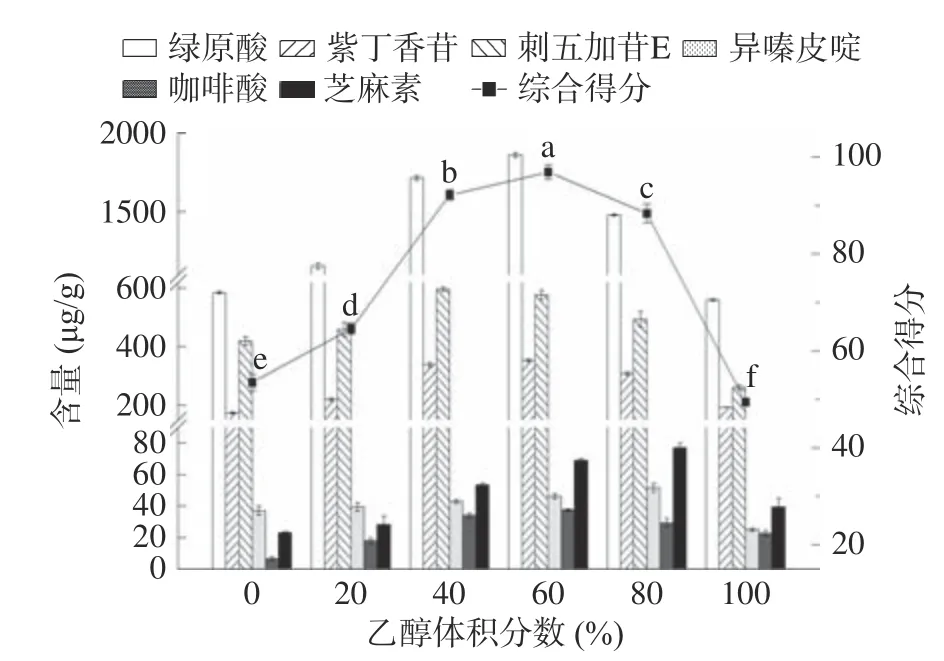
图6 乙醇体积分数对刺五加根茎超声提取的影响Fig.6 Effect of ethanol volume fraction on ultrasonic extraction of Acanthopanax senticosus rhizomes
2.2.5 原料粒径对刺五加多组分超声提取工艺的影响 图7 反映原料粒径对提取过程的影响,当粒径较大时,刺五加各目标化合物的提取效率比较小,反之,粒径小时,其提取含量增大。这是由于原料粒径大小直接影响提取基质与溶剂的接触面积,一般粒径越小,超声作用范围越大,提取效果越佳。但粒径升至一定值,表面能持续增加,阻碍了目标化合物的浸出,由此综合得分在原料粒径大于80 目时小幅度下降[34]。由显著性分析可知,原料粒径为80 目的处理组与60 目处理组及100 目处理组存在显著差异,但受筛网规格限制,无法细分粒径,不宜进一步优化。此外,小粒径原料的获取耗费更多的时间以及人力,且研磨机械产热亦有可能影响目标化合物稳定性,综合考虑确定原料粒径为80 目。
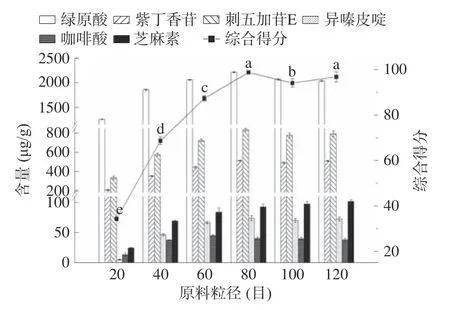
图7 原料粒径对刺五加根茎超声提取的影响Fig.7 Effect of raw material particle size on ultrasonic extraction of Acanthopanax senticosus rhizomes
2.3 响应面优化试验
2.3.1 响应面试验结果 基于响应面试验数据,由AHP-EWM 确定目标化合物综合权重系数,见表8。基于AHP-EWM 所得各目标化合物权重系数可计算综合得分,同实验结果汇总于表9。

表8 响应面实验目标化合物权重系数Table 8 Weight coefficient of the target compounds in response surface experiments

表9 响应面试验结果Table 9 Results of response surface experiments
2.3.2 回归模型的建立及分析 由Design Expert 8.0.6 软件对实验数据进行模型拟合,推荐采用二阶模型,其方差分析以及显著性检验见表10。方差分析显示模型极显著(P<0.0001),失拟项不显著(P=0.9446>0.05),表明可利用该模型进行后续的优化设计。此外,方差分析显示一次项(A,B,C),二次项(A2,B2,C2)对刺五加提取综合得分有极显著影响(P<0.01);交互项(AC)对目标化合物提取综合得分影响显著(P<0.05);交互项(AB,BC)对目标化合物提取综合得分影响不显著(P>0.05)。由见,各影响因素对刺五加提取综合得分的影响不是简单的线性关系,并由各因素F值可知其对综合得分的影响排序为B(超声时间)>A(超声功率)>C(乙醇体积分数)[33]。
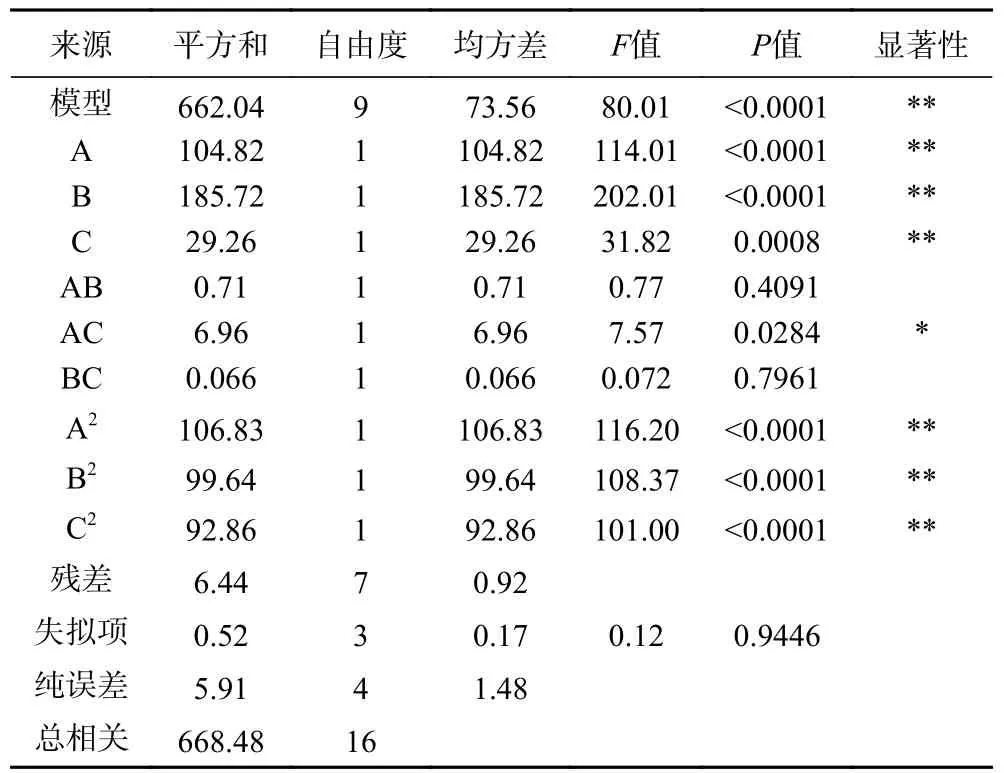
表10 模型方差分析及显著性检验Table 10 Variance analysis and significance test of the model
由回归模型得刺五加提取综合得分(Y)与超声功率(A,W),超声时间(B,min),乙醇体积分数(C,%)的回归方程,具体如下:
综合得分回归方程决定系数R2=0.9904,表明模型的拟合优度较高;校正相关系数R2adj=0.9780,预测相关系数R2pred=0.9736,两者值接近1 且差值小于0.2,表明模型能充分说明工艺过程[35];CV=1.09%<10%,表明实验可信度与精密度高;精密度(Adeq Precision)为24.366>4,表明该模型合理[36]。综上,所建模型及回归方程可用于预测分析刺五加提取综合得分变化,适应性好。
2.3.3 等高线及响应曲面分析 等高线图形状可以反映各因素交互作用的强弱,等高线越趋向椭圆表示因素交互作用越强,越趋向圆形则交互作用越弱。三维响应曲面图可以直观看到不同因素及其交互作用对响应值影响情况,曲面越陡,则影响越显著[37]。各因素交互作用对刺五加提取综合得分影响的等高线图及响应曲面图见图8。
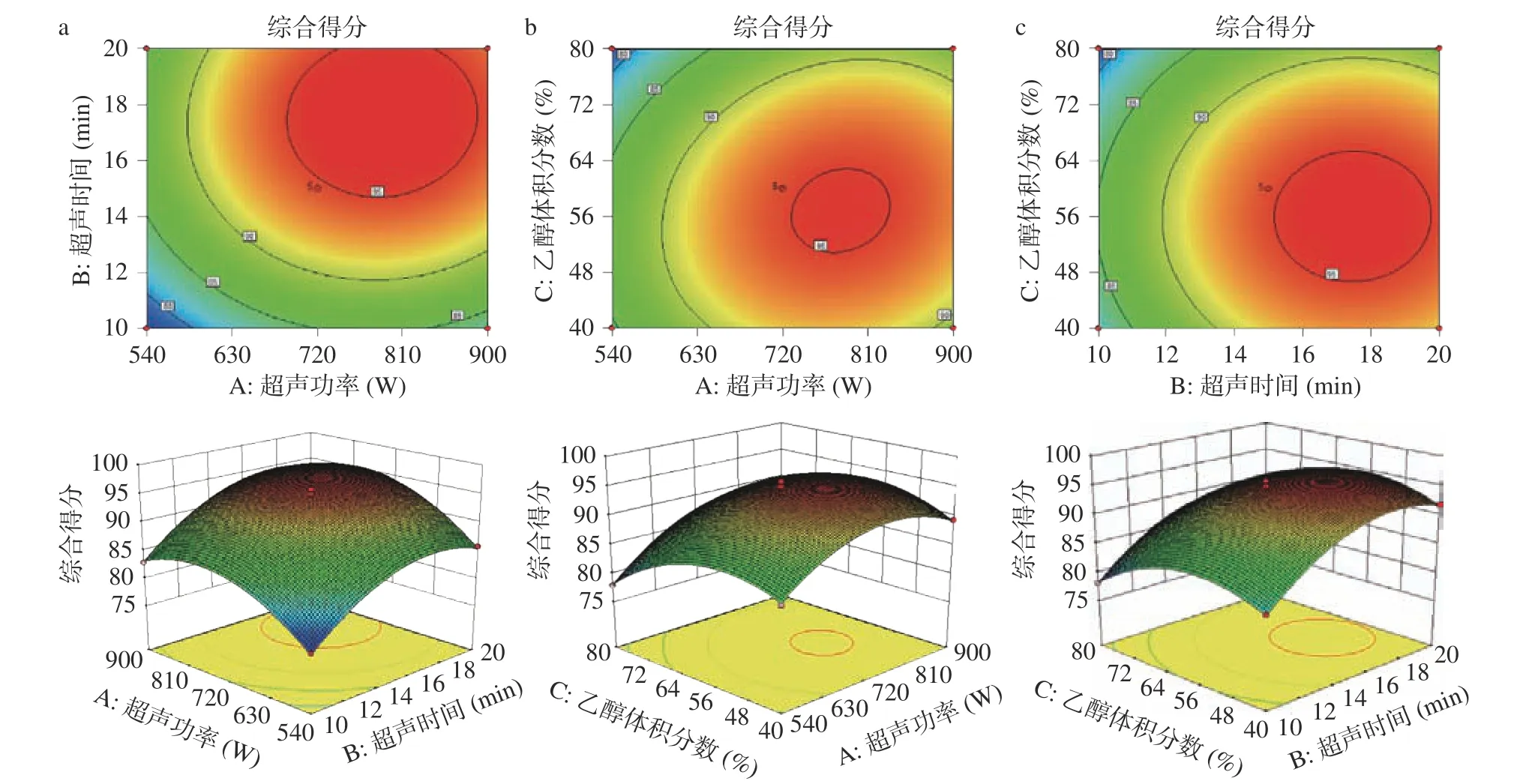
图8 提取因素交互作用对刺五加提取综合得分影响的等高线图及响应曲面图Fig.8 Contour plots and 3D surface graphs of the influence of interaction of extraction factors on the comprehensive score of Acanthopanax senticosus rhizomes extraction
如图8 等高线图所示,(a)(c)等高线趋向圆形,(b)等高线趋向椭圆,表明超声功率与乙醇体积分数交互作用显著,而超声功率与超声时间,及超声时间与乙醇体积分数交互作用不显著,这与方差分析结果一致。由图8 响应曲面图可知,随超声时间延长,刺五加提取综合得分随之增大,当超声时间延长至一定程度后,综合得分降低,造成这种现象的原因可能是超声仪工作产热增多导致目标化合物降解,从而降低综合得分;综合得分随超声功率的增大而增大,但当超声功率增加到一定比例后增加缓慢且有下降趋势;乙醇体积分数对综合得分影响趋势不如超声时间以及超声功率,响应曲面曲线变化比较平缓,这与方差分析结果亦一致。
2.3.4 最佳工艺验证 运用Design Expert 8.0.6 软件分析得响应面优化结果:超声功率784.92 W;超声时间17.55 min;乙醇体积分数57.09%。考虑实际操作,确定刺五加多组分超声提取最佳工艺:超声功率780 W;超声时间17.5 min;乙醇体积分数57%;料液比1:40 g:mL;原料粒径80 目。基于上述最佳提取工艺,平行制备3 份样品,进行目标化合物含量测定,结果可知绿原酸、紫丁香苷、刺五加苷E、异嗪皮啶、咖啡酸、芝麻素含量分别为2235.841±12.17、517.959±6.09、861.247±5.30、66.657±1.22、45.745±0.77、99.355±0.69 μg/g。3 次试验结果综合得分为95.21,96.01,95.14,平均值为95.45,RSD 为0.41%,与模型预测值96.67 之间差异较小,误差小于1.5%,充分说明实验结果与模型拟合良好,AHP-EWM 结合响应面法优化的参数准确可靠。
2.3.5 最佳工艺SEM 分析 对刺五加多组分超声提取最佳工艺所得刺五加根茎残渣进行SEM 分析,以未处理原料为对照,如图9 所示。图9a 为未处理原料,可以看到原料表面光滑,上面存在一些附着物,应该是粉碎过程产生的一些组织碎屑,图9b 为超声提取后收集的刺五加根茎残渣,可以看到残渣表面粗糙,且密被均匀小孔,说明超声提取一定程度破环刺五加根茎,促使物质溶出,是十分有效的提取技术,可广泛应用于中药提取。

图9 超声提取前后刺五加根茎的形貌比较(1000×)Fig.9 Morphological comparison of Acanthopanax senticosus rhizome before and after ultrasonic extraction (1000×)
3 结论
本研究为刺五加多组分含量测定建立了一种简单有效的超高效液相色谱-质谱(UPLC-MS/MS)定量方法,与已发布的高效液相色谱法相比,分析时间大大简短,专属性及灵敏度更高。由于药食同源植物大都通过多活性成分,多靶点协同发挥作用,因此通过多指标综合评价确定各评价指标的权重系数对其资源开发至关重要。主观赋权法与客观赋权法的结合,一定程度实现互补,既能避免主观臆断又能客观反映真实数据,是目前主流的综合评价方式。本文基于层次分析-熵权法(AHP-EWM 法),单因素结合基于BBD 的响应曲面法优化刺五加多组分超声提取工艺,优化得刺五加多组分最佳提取工艺为:超声功率780 W,超声时间17.5 min,乙醇体积分数57%,料液比1:40 g:mL,原料粒径80 目。由最佳工艺可得刺五加根茎中绿原酸、紫丁香苷、刺五加苷E、异嗪皮啶、芝麻素的含量分别为 2235.841±12.17、517.959±6.09、861.247±5.30、66.657±1.22、45.745±0.77、99.355±0.69 μg/g,且综合得分为95.34±0.39,与预测理论值接近。该研究为刺五加资源的高效利用提供了理论依据,并验证了多指标综合评价方法用于刺五加多组分超声提取的适用性,对刺五加的应用开发具有实际指导意义。
