极端红曲霉高粱发酵产物的抗氧化性和抗炎性
2023-10-19师建全郑羽西阴耕云
师建全,王 凯,肖 冬,郑羽西,阴耕云,李 焞
(1.云南中烟工业有限责任公司技术中心,云南昆明 650231;2.茅台学院,贵州仁怀 564500;3.上海全丽生物科技有限公司,上海 200000)
极端环境下生长的微生物,为了适应生存,经自然选择,通常具有独特的菌体结构、响应机制和代谢系统,以应答因强烈胁迫因子带来的高水平氧化应激(oxidative stress,OS)[1]。从生物技术的角度来看,这种代谢系统和基因表达的可塑性使得极端微生物应用前景广阔,因为它们能够适应不利的环境,并在特定条件下提供高效、丰富和独特的代谢产物[2]。极端微生物发酵产物在对抗环境胁迫诱导的OS 方面的巨大潜力,引起了全球学者的广泛关注,但是目前研究主要集中于环境领域[3-4]。
由于其独特的口感和高品质,酱香白酒(Moutaiflavor Baijiu,MFB)已成为中国最受欢迎的酒类种类,并成为了中国文化和日常生活中不可替代的一部分[5]。作为MFB 最著名的产地,中国贵州省茅台镇拥有持续数百年的酿酒历史。MFB 独特的胁迫式发酵工艺长期对本地酿酒微生物进行驯化,促成了以高盐度(酿造环境中由于底物的反复添加而导致盐分的富集)、高酸度和高酒精度为特征的酿酒微生态环境[6]中富集了多种独特的极端微生物,而这些特殊的菌群也赋予了MFB 独一无二的酱香风格。除此之外,这些极端微生物的发酵产物也被广泛报道含有大量的生物活性物质,如有机酸、多酚、黄酮、氨基酸、三萜类、维生素等[7-8],这些活性物质都被广泛应用于医药、化妆品、保健食品和其它健康产品。
通过深入挖掘MFB 酿造环境的微生物资源,在之前的研究中成功分离并报道了一株编号YX-1125的极端丝状真菌[6]。经真菌形态鉴定与ITS 和BenA序列分析,确定为丛毛红曲菌(Monascus pilosus)。值得注意的是,通过调节发酵条件至接近MFB 极端酿造环境,该菌种短链脂肪酸(SCFAs)产量(19.8 g/L)实现了目前同类文献报道最高水平[6]。许多文章证实了微生物来源的SCFAs 对人体的有益作用,包括缓解炎症和选择性抑制有害微生物生长等[9-11]。因此,在这篇研究中,基于该菌种与高粱发酵产物滤液(Monascusand Sorghum Fermentation Filtrate,MSFF)开发出了一种全新的抗氧化与抗炎症原料,并利用多项实验评估了该发酵滤液的成分、安全性与生物活性。据所知,这是极端微生物发酵产物作为生物活性成分首次被研究。
1 材料与方法
1.1 材料与仪器
高粱 仁怀市茅台镇产自被称为“红缨子”的有机糯高粱(贵州,中国),这种高粱是茅台镇生产酱香白酒的主要原料,总淀粉含量83.40%,其中96.27%为支链淀粉[12-13]。高粱在使用前一直保存于4 ℃,并被粉碎为目数100 的粉末待用;菌种YX-1125 获取于贵州省茅台镇MFB 酿造环境中[6],目前保藏于China General Microbiological Culture Center(编号CGMCC 21938);菌株YX-1125 马铃薯葡萄糖琼脂上30 ℃保存5 d 后,放入冰箱4 ℃(短期)或-20 ℃(长期)保存;植物乳杆菌(Lactobacillus plantarum,编号KN-819)保藏于茅台学院;α-淀粉酶(采用地衣芽孢杆菌诱变筛选的高产菌株,10000 U/g)山东隆大生物工程有限公司;复合糖化酶(由去除转苷酶的葡萄糖淀粉酶和普鲁兰酶组成的复合型糖化酶组成,其中糖化酶是由黑曲霉优良菌种经深层发酵精制提炼而成,普鲁兰酶是由地衣芽孢杆菌菌种经深层发酵提炼而成,100000 U/mL)山东隆大生物工程有限公司;人角质细胞(HaCaT 细胞)、小鼠单核巨噬细胞(RAW264.7,目录号BNCC342033)中科院细胞库;ELISA 试剂盒 美国Biolegend 公司;3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四唑(MTT)美国Sigma-Aldrich 公司;抗β-肌动蛋白、MMP-1 和MMP-9 的一抗 美国Abcam 公司;抗β-肌动蛋白、MMP-1 和MMP-9 的二抗 中国Proteintech 公司;研究中使用的所有其他化学物质 均为分析纯,阿拉丁生化科技有限公司。
TS-111B 恒温振荡培养箱 上海善志仪器设备有限公司;10QS 鼓泡生物反应器 上海保兴生物设备工程有限公司;Nicolet 6700 傅立叶红外光谱仪美国赛默飞世尔科技公司;Agilent 7890N 气相色谱联用 配有DB-WAX 毛细管柱(30 mm×0.25 mm,0.25 μm),采用安捷伦MSD ChemStation 软件进行数据分析、1290 Infinity II 高效液相色谱(High Performance Liquid Chromatography,HPLC)美国安捷伦科技有限公司;Hyperlab SMART 多参数生化分析仪 荷兰Biostream 公司;紫外交联仪CL-1000美国UVP 公司。
1.2 实验方法
1.2.1 菌种悬浮液的制备 每个月将菌株YX-1125(见图1)的孢子转移到新鲜PDA 培养基上保持活力。用无菌生理盐水洗PDA 培养基,得到新鲜的接种孢子悬液。将制备好的孢子悬液加入到无菌种子培养基(葡萄糖50 g/L,酵母浸出粉2.5%)中,添加无菌生理盐水将孢子浓度调节为106个孢子/mL。在经过30 ℃条件下不通气、不搅拌、不摇匀的8 h 种子培养以后,菌种YX-1125 的种子悬浮液将用于后续发酵的接种。菌种KN-819 同样筛选于贵州省茅台镇MFB 酿造环境中,因其具有极强的发酵产有机酸能力,被用于在预发酵为菌种YX-1125 模拟同MFB 酿造类似的酸性胁迫环境。菌种KN-819 平时保存于20%甘油的储存培养基中,使用前转入MRS培养基。在旋转摇床中维持30 ℃和150 r/min 进行12 h 的种子培养后,以14000×g 离心5 min,然后以无菌生理盐水洗涤1 次,得接种悬浮液。
图1 菌种YX-1125 的形态特征Fig.1 Morphological characteristic of strain YX-1125
1.2.2 MSFF 的生产 如图2 所示,MSFF 的生产总体来说需要液化、酸化和发酵三个阶段。第一阶段液化分为预糖化步骤和糖化步骤。简单地说,首先将蒸馏水与高粱粉末的混合物,固液比1:10(w/v)加入摇瓶中,温度控制在80 ℃水浴。随后,在制备的泥浆中添加浓度为140 U/g 的α-淀粉酶,并在旋转摇床中以100 r/min 的速度进行预糖化。经过2 h 的预糖化后,将浆液冷却到60 ℃,在振荡培养箱中以140 r/min 的速度用复合糖化酶(40 U/g)糖化8 h,充分释放支链淀粉中的可发酵糖。
酸化阶段的目的是通过菌种KN-819 为后续胁迫式发酵营造极端酸性环境。待糖化后泥浆冷却后,加入10%的KN-819 接种悬浮液,在42 ℃的严格静止条件下培养至pH 降至3.5 时终止,收集液体部分用于下一步发酵阶段。
最后使用发酵生产MSFF。依据之前的研究并做小幅改动[14-15],该阶段在一种改良的5 L 的鼓泡生物反应器中进行。该反应器安装了60 个矩阵单元形成蜂窝状结构用于丝状真菌YX-1125 的固定化。在进行24 h 的固定化培养后,种子培养基被替换为收集的酸化液体,并维持在35 ℃,曝气量0.5 vvm和搅拌速率160 r/min 的条件下培养。96 h 后,收集发酵液,并通过1000 Da 的纳滤膜过滤去除发酵液中的微生物和大分子杂质,得到MSFF。
1.2.3 MSFF 的成分分析
1.2.3.1 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)MSFF 在Nicolet 6700光谱仪上进行FTIR 分析。样品在透射模式下进行分析,光谱记录在4500~400 cm-1范围内。在4 cm的分辨率和1 cm/s 的扫描速度的条件下扫描被收集。依据Kadiroglu 等[16]的研究,在每次测量前收集背景光谱。
1.2.3.2 气质联用(Gas chromatography mass spectrometry,GC-MS)采用GC-MS 分析MSFF,特别是其中的有机酸构成,依据Mellinas 等[17]的研究并有一些改动。以二氯甲烷为溶剂进行液-液萃取,获取有机相。采用Agilent 7890N 气相色谱联用5977B四极质谱(MS),在电子冲击(EI)电离模式(70 eV)下进行MSFF 中活性物质的鉴定。通过与美国国家标准与技术研究院(National Institute of Standards and Technology,NIST)质谱数据库匹配,确定了样品中存在的生物活性物质。
1.2.3.3 酚类物质的定量方法 MSFF 中的四类主要的酚类化合物含量遵循之前报道过的方法被定量[18-20]:a.总可溶性酚酸(Total soluble phenolic acids),按没食子酸标准曲线计算,表示为每毫升MSFF 的mg 没食子酸当量,单位mg gallic acid eq/mL;b.总类黄酮,用懈皮素标准曲线定量,表示为每毫升MSFF的mg 懈皮素当量,单位为mg quercetin eq/mL;c.总单宁(Total tannins),用表儿茶素标准曲线测定,表示为mg 表儿茶素每毫升MSFF,单位为mg epicatechin eq/mL;d.总花青素,用分光光度法测定,表示为μg 葡萄糖苷每毫升MSFF,单位为μg cyanidin-3-glucoside eq/g。所有测量独立重复三次。
1.2.3.4 HPLC 和生化分析仪 通过HPLC 测定MSFF 中的维生素和氨基酸含量和构成。采用Shimpack GIST C18色谱柱(4.6 mm×250 mm,5 μm);流动相为乙腈与0.1 mol/L 磷酸二氢钾水溶液,比例为80:20;流速:1 mL/min;检测波长为246 nm,进样量10 μL,柱温40 ℃。氨基酸与维生素的鉴别通过与购买的商业标准品的保留时间对照进行确定。多参数生化分析仪被用于本实验中测量MSFF 中的乳酸、柠檬酸、酒石酸、苹果酸等多种羟基酸,如之前论文所述[14-15]。
1.2.4 MSFF 的抗氧化性分析 采用了五种不同的方法来评估抗氧化活性:a.抗氧化力测试(Ferric reducing antioxidant power,FRAP),单位为mmoL eq FeSO4/mL;b.DPPH 自由基清除活性;c.螯合铜和铁的能力;d.超氧自由基(·)清除活性;e.羟基自由基(·OH)去除活性[21]。
1.2.5 体外细胞实验
1.2.5.1 细胞培养 HaCaT 细胞和RAW264.7,培养在10% 胎牛血清和1%青霉素/链霉素的达尔伯克改良伊格尔培养基(Dulbecco’s modified Eagle’s medium,DMEM)中,于加湿的37 ℃和5% CO2的条件下。细胞按照1.5×104个/孔接种于96 孔板中,每孔100 μL,于37 ℃、5% CO2培养箱中培养。细胞孵育24 h 后,吸出培养基并用胎牛血清洗去残余培养液,对照组和空白组细胞加入100 μL DMEM,样品组细胞加入100 μL 的0.1%,0.5%和1.0%浓度的MSFF(DMEM 稀释),每组6 个平行,在培养箱中孵育18 h。随后被用1 μg/mL 脂多糖(Lipopolysaccharides,LPS)刺激或紫外线生成器照射至剂量5 mJ/cm2,用以诱导炎症反应。
1.2.5.2 细胞活性测试 使用磺酰罗丹明B 测定细胞活力[22]。孵育期后,用灭菌胎牛血清冲洗一次细胞,然后用250 μL 的10%(w/v)三氯乙酸(TCA)固定到每孔中,在4 ℃下孵育1 h。然后,用慢速自来水冲洗板,用纸巾除去多余的水,在室温下晾干(20~25 ℃)。每孔加入0.057%(w/v)磺酰罗丹明B 溶液250 μL,染色30 min。未结合的染料用1%(v/v)乙酸洗涤。蛋白结合染料溶解于250 μL 10 mmol/L三乙醇胺缓冲盐水溶液中,并转移100 μL 到96 孔板上,在酶标仪中测量510 nm 处的光密度值(optical density,OD)光通过被检测物,前后的能量差异即是被检测物吸收掉的能量,特定波长下细胞的浓度与被吸收的能量成定量关系,因此OD 值可用于代表细胞的存活,细胞活性(%)=样品吸光度/对照组吸光度×100。
1.2.5.3 细胞内活性氧的测定 细胞内的活性氧使用活性氧荧光探针(2’,7’-dichlorodihydrofluoresceindiacetate,DCF-DA)进行,该方法也被文献[23-24]采用。HaCaT 细胞在紫外线照射前预处理6 h,然后孵育2 h。孵育后,HaCaT 细胞用5 μmol/L 的DCF-DA在37 ℃下染色30 min,然后用胎牛血清冲洗两次,随后用90%的二甲基亚砜(DMSO)在胎牛血清中溶解细胞。荧光酶标仪在485/525 nm 的激发/发射波长下测量荧光增加倍数,以及确定总的氧化应激水平。
1.2.5.4 酶联免疫吸附试验(Enzyme linked immunosorbent assay,ELISA)根据制造商的产品说明书,用ELISA 试剂盒对培养液中IL-6 和IL-8 的产量进行定量。酶标仪在450 nm 处读取吸光度。
1.2.5.5 蛋白质印迹法 使用蛋白质印迹法检测蛋白表达[24]。收集处理后的细胞,用胎牛血清洗涤,然后用放射免疫沉淀法裂解得到全细胞裂解液。收集上清液用Bradford 蛋白法定量蛋白,测定标准曲线。利用十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离细胞裂解物,随后将蛋白质转移至NC 膜。用抗β-肌动蛋白、MMP-1 和MMP-9 的一抗在4 ℃下孵育过夜。最后,用三乙醇胺缓冲盐水溶液加吐温-20 洗涤膜3 次(每次洗涤5 min),去除一级抗体,然后与相应的偶联二抗体(Proteintech)在室温下孵育1 h。免疫反应蛋白通过化学发光检测(BeyoECL Plus,Millipore)显示条带。
1.2.5.6 安全性评估 RAW264.7 和HaCaT 细胞被用于评估MSFF 的细胞安全性。将细胞种在96 孔板中,200 μL 培养基(2.5×104个细胞/孔)。在附着过夜后,用不同浓度(0.1~50.0 mg/mL)所制备的提取物与1 μg/mL 的脂多糖处理细胞24 h。以不含MSFF和脂多糖的培养基为阴性对照,以不含脂多糖的培养基为阳性对照。采用3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四唑(MTT)法分析细胞活力,并根据490 nm 波长的吸光度测定[25-26]。
1.3 数据处理
统计数据使用GraphPad Prism software v6.0(GraphPad Software,San Diego,CA,USA)处理。参数方差分析(ANOVA)检验和Tukey 检验被用于进行样本分析[27]。
2 结果与分析
2.1 MSFF 的成分分析
2.1.1 FTIR 分析 FTIR 分析是一种简单易行的分析技术,用于鉴定和表征样品的主要化合物的官能团。图3 显示了MSFF 的FTIR 光谱。分析结果显示3359.55 cm-1附近出现的大吸收带对应强吸水性,伴随着H-O-H 拉伸振动。2938.32 cm-1处较小的信号归属于碳水化合物或有机酸类[28]的甲基和亚甲基的C-H 拉伸振动。有机酸是由在1735.40 cm-1和1675.01 cm-1处的C=O 拉伸振动确定的[29]。芳香化合物中苯基的C-C 拉伸振动谱带的值为1412.68 cm-1[30],而1215.49 cm-1处的信号与C-O 拉伸振动有关[29]。

图3 MSFF 的红外光谱Fig.3 Infrared spectra of the MSFF sample
结果表明,MSFF 样品的主要谱带分布在有机酸和酚类物质上,而这些主要生物活性成分均与高抗氧化活性有关。已经有很多研究报道了发酵液中的抗氧化活性与酚类物质含量呈正相关。例如,Verzelloni 等[31]肯定了红酒和传统香醋的抗氧化能力与它们的酚类和类黄酮含量高度相关。
2.1.2 有机酸构成分析 通过GC-MS 和多参数生物分析仪等设备分析了MSFF 中的小分子物质,其中有机酸的构成如图4 所示。总的来说,本工作中得到的有机酸构成与之前文献报道的菌种YX-1125代谢产物中的有机酸构成类似,均以短链脂肪酸(SCFAs)为主,占比达95%以上。在MSFF 的SCFAs中,占比最高的为丁酸(占总有机酸的60%以上)、其次为乳酸、丙酸和乙酸。SCFAs 目前主要发现于肠道益生菌发酵产物中,由于其与各种人类健康状况联系紧密而日益受到全球关注。此外,剩余有机酸主要构成为柠檬酸。

图4 MSFF 中不同化合物种类的定量数据Fig.4 Quantitative data regarding the different compound families in MSFF
对比了高粱-植物乳杆菌发酵产物和MSFF 的成分和生物活性,植物乳杆菌发酵产物以单一的乳酸为主,而MSFF 中以短链脂肪酸为主,导致了更好的抗炎效果,因此可以肯定相关结果是极端红曲霉作为主导,但植物乳杆菌确实也起到了重要辅助作用。此外,乳酸是极端红曲霉的主要发酵碳源之一[6],但由于篇幅有限,本文未展示对照试验结果,相关内容将会在后续文章中进行展示和讨论。
2.1.3 酚类物质构成分析 MSFF 中的酚类物质构成采用光谱学方法测量,结果如图4 所示。酚类物质中含量最高为单宁,含量为3.59 mg epicatechin eq/mL MSFF,占总酚类物质的50%以上,该结果与之前文献中报道的这类高粱中单宁含量较高吻合[12-13]。其次为类黄酮,含量为2.89 mg/mL,类黄酮中花色素苷经测定含量为0.05 mg/mL,为类黄酮总含量的1.8%。含量最低的是酚酸类,占总酚类物质含量的7.2%。
2.1.4 其它活性成分分析 通过HPLC 外标法分析,MSFF 中总共含有7.53 mg/mL 的17 种游离氨基酸(见图4)。其中酪氨酸0.25 mg/mL、精氨酸0.18 mg/mL、苯丙氨酸0.40 mg/mL、组氨酸0.11 mg/mL、蛋氨酸0.09 mg/mL、谷氨酸1.06 mg/mL、赖氨酸0.31 mg/mL、天门冬氨酸0.67 mg/mL、天门冬酰胺0.10 mg/mL、异亮氨酸0.50 mg/mL、亮氨酸0.65 mg/mL、苏氨酸0.33 mg/mL、缬氨酸0.61 mg/mL、脯氨酸0.90 mg/mL、丝氨酸0.49 mg/mL、丙氨酸0.46 mg/mL 和甘氨酸0.42 mg/mL。半胱氨酸、谷氨酰胺和色氨酸未检测出。除此之外,MSFF 还检测出维生素C 和维生素E,其含量分别为37.59 和53.72 μg/mL。综上,MSFF 中含有丰富和高浓度的生物活性物质。
SCFAs,特别是乙酸、丙酸和丁酸,目前主要发现于肠道益生菌发酵产物中。它们对人体生理有许多影响,包括作为细胞的能量来源,调节与修复屏障,影响炎症反应[32-33]。Wang 等[34]证实,SCFAs 能够有效抑制有害微生物的生长和炎症。在本研究中,同样的高水平SCFAs 也在MSFF 中被发现,这可能是导致MSFF 具有显著的抗炎症功效与细胞保护能力的原因。
酚类化合物是另一种被大量发现于MSFF 中的活性物质。来自植物的酚类化合物的抗氧化性能已在多篇文献中得到广泛报道[35]。酚类化合物是植物次生代谢产物,作为优秀的抗氧化剂和炎症阻断剂,提供显著的皮肤健康效果,并通过减缓炎症的损伤减弱炎症对机体的影响[36]。因其高水平抗氧化和抗菌活性、对炎症介导的损伤保护作用和对MMPs 的抑制作用,富含酚类化合物的保健食品和护肤配方创新成分已大规模上市。Hong 等[25]证实了高粱中富含酚类化合物,且具有强力的抗氧化活性和抗炎症活性。本研究揭示了MSFF 中也具有高水平的酚类化合物,可能是通过发酵等方式从高粱中释放了出来。而MSFF 中占主导的SCFAs 加酚类化合物的组合,可能是其能够有效抗氧化和抑制炎症的根源。
2.2 MSFF 的抗氧化性分析
通过多种检测方法评估了MSFF 的体外抗氧化潜力,结果如表1 所示。羟基自由基作为最常见活性氧自由基之一,其形成与过渡金属有关,特别是铜和铁。在没有这些离子的情况下,过氧化氢相当稳定。当这些金属的内稳态受到干扰时,就会通过芬顿反应形成羟基自由基[27]。羟基自由基被认为是活性氧中最具活性的,几乎可以与任何生物分子(如蛋白质和DNA)相互作用,导致有毒化合物的形成并导致细胞损伤[37]。实验观察到MSFF 同时具有较高的金属螯合能力(特别是铜)和羟基自由基清除能力。由于羟基自由基的清除活性在数值上远远高于金属螯合活性,推测MSFF 能够通过去除金属离子等多种机制在氧化起始阶段阻碍氧自由基的形成和级联反应。
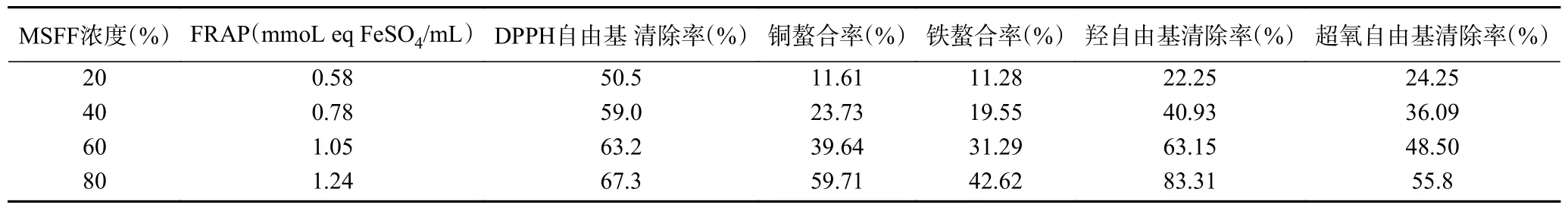
表1 MSFF 体外抗氧化活性试验评价结果Table 1 Evaluation results of in vitro antioxidant activity tests of MSFF
MSFF 在其它自由基清除方面也有较好的效果,80%的MSFF 的DPPH 自由基和O2-自由基清除率达到了67.3%和55.8%,证明了MSFF 全面的活性氧清除能力。此外,在抗氧化能力方面,MSFF 同样具有较高值,80% MSFF 的FRAP 值为1.24 mmol eq FeSO4/mL MSFF,相当于每升MSFF 中含有等效于102.8 g 的维生素C(以每100 mg 维生素C 的抗氧化活性为1.51 mmol eq FeSO4计)。MSFF 的高抗氧化能力可能和其含有高水平的酚类物质(如单宁和花青素)有关。以上测试结果均证明,MSFF 能够抑制自由基并可作用于细胞化合物的氧化起始阶段,是一种优秀的多重靶向抗氧化剂,具有巨大的抗氧化潜力。
2.3 体外细胞实验
2.3.1 MSFF 抑制炎症引起的细胞凋亡效果 采用磺酰罗丹明B 法测定MSFF 对巨噬细胞细胞活力的影响。用三种不同浓度的MSFF 处理RAW264.7 细胞(0.1%、0.5%和1%)。如图5A 所示,经处理后的RAW264.7 细胞活力与对照组相当,证实MSFF 在这些剂量下对该类细胞无细胞毒性(>80%细胞存活)。因此,使用这三种浓度的MSFF 进行进一步实验。为研究MSFF 对细胞活力的影响,用MSFF 预处理RWA264.7 细胞,再引起细胞的炎症反应。如图5B所示,与未产生炎症的细胞相比,炎症反应显著降低细胞的活力至55.4%。用0.5%的MSFF 预处理细胞,可使炎症细胞活力提高至81.4%。此外,细胞活力的提升呈浓度依赖性。因此,结果数据表明,MSFF 在1.0%浓度下无细胞毒性且可以有效地减少炎症引起的细胞凋亡。
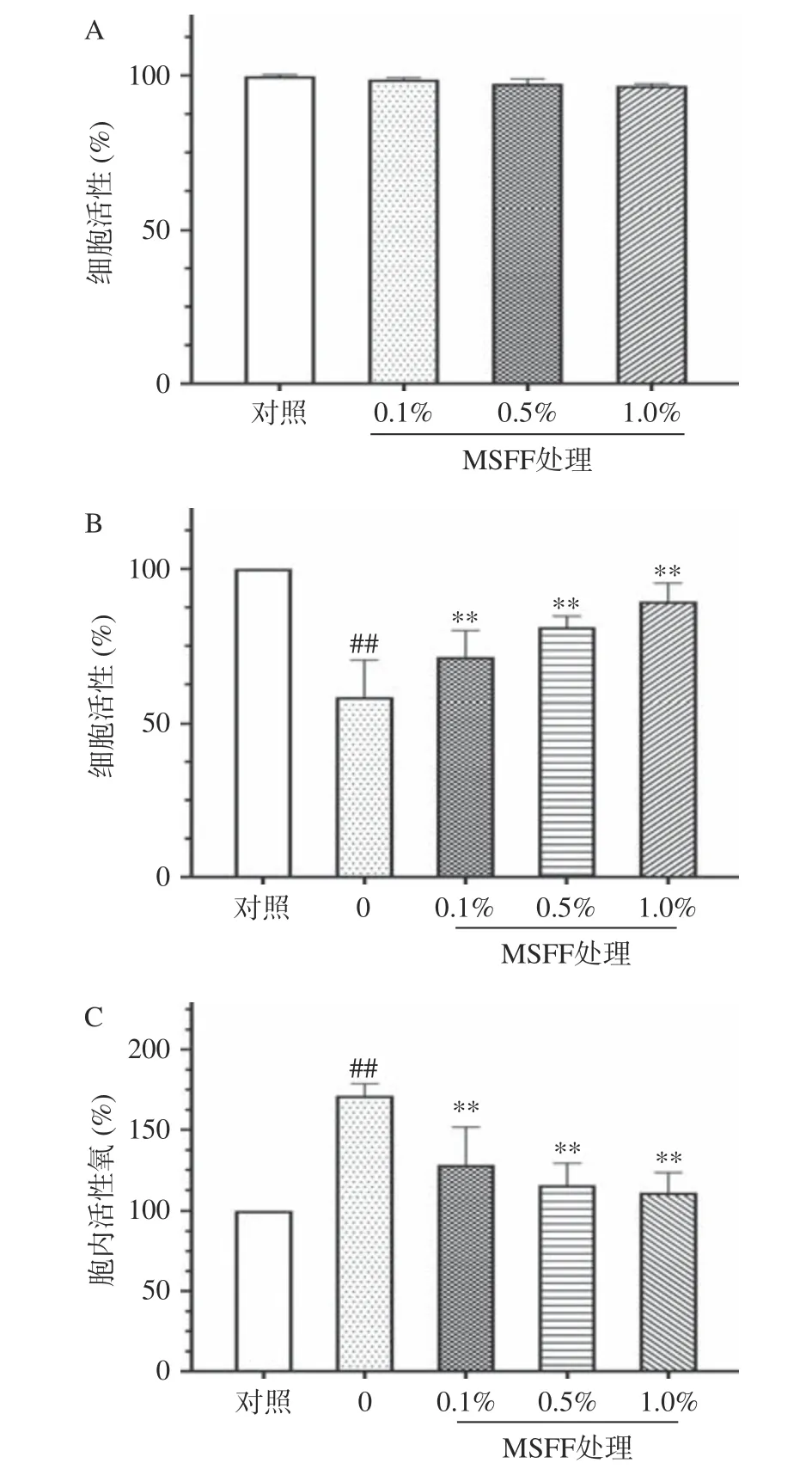
图5 体外评估MSFF 对被诱导炎症细胞的影响Fig.5 In vitro assessment of MSFF on cytotoxicity and antioxidant activity in cells
2.3.2 MSFF 对炎症产生的活性氧清除效果 炎症可诱导活性氧过度产生,进而激发光老化进程。因此,通过监测细胞内活性氧生成来研究MSFF 对炎症诱导的RAW264.7 细胞氧化应激的影响。采用DCF-DA 荧光探针检测细胞内活性氧的生成。如图5C 所示,炎症细胞的活性氧荧光强度(171.5%)明显高于非紫外线照射细胞(100%)。然而,MSFF 处理细胞后,炎症细胞内活性氧均减少到130%以下,且呈浓度依耐性。相比炎症细胞,1.0%的MSFF 处理细胞下降了35.8%(171.5% vs.110.1%)。这些结果表明,MSFF 具有减少细胞中活性氧生成的能力。该实验结果也与2.2 体外实验中MSFF 具有较强的抗氧化活性的结果一致。
2.3.3 MSFF 减少促炎症细胞因子的效果 长期炎症会增加促炎症介质的产生,如白细胞介素-1α(IL-1α)、IL-1β、IL-6、IL-8、前列腺素E2 和一氧化氮[38]。为了分析MSFF 是否能够抑制促炎症介质的产生,研究了LPS 刺激下IL-6、IL-8 等促炎症细胞因子的表达水平。总的来说,LPS 刺激上调了诱导炎症和光老化的促炎症细胞因子的表达,如图6A 和图6B 所示。与阴性对照相比,在RAW264.7 细胞中加入MSFF可以显著抑制LPS 刺激引发的IL-6 表达,且呈剂量依赖的方式,其中1.0%的MSFF 对IL-6 的抑制效果达到了83.2%。此外,MSFF 在0.1%、0.5%和1.0%的浓度下对LPS 引发的IL-8 的抑制作用也逐渐加强,呈现剂量依赖的现象。这些结果表明MSFF 可通过降低促炎症细胞因子含量有效抑制炎症的生成。

图6 MSFF 体外抗炎评价Fig.6 In vitro assessment of the anti-inflammatory of MSFF
2.3.4 MSFF 减少炎症引起的金属硫蛋白酶(Matrix metalloproteinases,MMPs)效果 实验评估了0.1%、0.5%和1.0%的MSFF 是否能够减弱UV 引起的MMP-1 和MMP-9 的表达来测试其对炎症引发的皱纹与皮肤结构破坏的缓解效果,并与视黄酸(Retinoic acid,RA)在10 μmol/L 剂量下进行对比。除了对照组,其余各组均用剂量为5 J/cm2的UV 照射处理。图6C 和图6D 显示了MMPs 的表达结果,MMP-1表达水平在UV 照射后显著提高至267.2%,但在MSFF 和RA 处理后UV 引起的MMP-1 的表达均有显著的下调(P<0.05)。总的来说,随着MSFF 浓度的增加,MMP-1 的表达逐渐降低。1.0% MSFF和RA 对应的MMP-1 均略高于无任何UV 照射的对照组水平。MMP-9 水平在UV 照射后显著提高至192.5%,但在用0.1%、0.5%、1.0%的MSFF 和RA处理后降低至110.7%,96.2%,89.6%和92.3%。在无UV 照射的正常条件下,MMP-9 的表达与0.5%MSFF 加UV 照射的MMP-9 表达相当。这些结果表明MSFF 能够有效减弱UV 引起的皱纹形成相关的MMPs 表达。
2.4 安全性测试
两种细胞系HaCaT 和RAW264.7 在MSFF 处理后,使用MTT 法在0.1~50.0 mg/mL 的浓度范围内评估其活力。以上两种细胞具有易于培养、成本低、易获取且具有代表性等优点,因此在本研究中被用于进行细胞活力测试。在评估的所有剂量下,两种提取物均未观察到显著影响(数据未显示,P>0.05),这表明MSFF 在这两种细胞中具有较高的细胞相容性。
3 讨论与结论
缓解炎症和氧自由基对身体损害一直是人们积极追求的目标。微生物发酵产物一直以来因其温和、安全和高功效而备受关注,并被广泛用于食品、药品或护肤品领域[39-40]。本文中,一种新型的极端微生物YX-1125 与高粱的发酵产物滤液(MSFF),因其具有抗氧化和抗炎症潜力而被研究。实验结果显示MSFF 因其高抗氧化活性,可以减少细胞凋亡、氧化还原失衡、促炎症细胞因子的产生和MMPs 的表达。该研究首次证实了极端微生物发酵产物能够应用于健康领域,用于抵御氧自由基和炎症对机体的损害。
炎症诱导可通过触发不同的细胞信号通路激活MAPKs 和NF-κB,从而触发MMPs 的表达。MMP负责降解细胞外基质(ECM)蛋白,如胶原蛋白、纤维连接蛋白、弹性蛋白和蛋白多糖,导致皮肤的老化与结果破坏[41]。MMPs 是一种内肽酶,在炎症过程中起着关键作,其中MMP-1(胶原酶)和MMP-9(明胶酶)分解了大部分ECM,其过量表达是老化、皱纹与疾病形成的主要原因[42-43]。本研究结果显示MMP-1和MMP-9 的表达在紫外照射以后的HaCaT 细胞中都提高了,但是在MSFF 与视黄酸(RA)处理以后均有显著性的下调(P<0.05)。这些结果表明MSFF 通过下调MMPs 的表达,来防止炎症导致的疾病和损害。类似的,许多以前的研究也致力于研究如何抑制MMPs 的表达。Lin 等[44]利用Pholiota nameko多糖(PNPs)降低了人真皮细胞中的MMP-1、MMP-3和MMP-9 的蛋白表达,显著减弱炎症诱导的细胞衰老,证明了其抗光老化潜力。Karapetsas 等[45]研究了希腊蜂蜜提取物对UVB 处理的HaCaT 细胞的影响,结果表明蜂蜜提取物能够显著提高MMPs 的表达,实现抗老化的目的,该结果也在重组皮肤模型中得到印证。
细胞凋亡是炎症的公认标志。炎症诱导的氧化应激过程中,细胞内氧化还原平衡的丧失导致细胞损伤,最终导致细胞凋亡。大量证据表明,炎症诱导皮肤细胞凋亡是由线粒体(内在)和死亡受体(外在)通路[46]共同作用的。Wang 等[47]测试了Prinsepiae Nux提取物对细胞炎症的影响,结果表明炎症诱导的核因子相关因子2(Nrf 2)和血红素氧合酶1(HO-1)缺失、活性氧过量产生以及促炎症介质基因上调均有不同程度的逆转,有效保护了细胞免受炎症的损伤。在本研究中,MSFF 同样被证明能够有效减少炎症诱导的细胞凋亡,降低IL-6、IL-8 等促炎症细胞因子的表达水平,且呈剂量依赖。1.0%的MSFF 可下调高达80%以上的UVB 引发的促炎症细胞因子,远远高于以上提到的所有文献,显示出MSFF 十分优秀的抗炎症潜力,这可能和MSFF含有丰富的SCFAs 和酚类物质等活性物质有关。
