血皮槭种子休眠特性及休眠原因*
2023-10-19何苏诚宋军阳
何苏诚 宋军阳
(西北农林科技大学风景园林艺术学院 咸阳 712100)
种子休眠是指健康完整有活力的种子在适合种子萌发的条件下不能完全发芽(Oraczet al., 2016),这是植物为了生存和繁衍,经过长期进化形成的一种自我保护特性,这种特性由遗传学、植物激素和环境影响因素决定(Finch-Savageet al., 2006;Nelsonet al.,2017;Tognaccaet al., 2019),对于大部分休眠的种子通常可以通过激素处理和低温层积来打破休眠(Pinfieldet al., 1990a)。
国外在种子休眠方面的研究比较早,Baskin 等(1998)把种子休眠分为生理休眠、形态休眠、形态生理休眠、物理休眠和复合休眠5 大类型。其中生理休眠又分为深度、中度、浅度,浅度生理休眠和部分中度生理休眠的种子可以通过GA3处理或者层积处理来打破种子休眠;深度生理休眠的种子自然环境下打破休眠的时间通常是几个月甚至几年,GA3对于这类种子往往不起作用,需要长时间低温层积才能打破休眠(Baskinet al., 1998;Baskinet al., 2004)。槭属(Acer)绝大部分植物种子具有休眠特性,通过低温层积,休眠种子中生长抑制物质浓度下降,生长促进物质浓度上升(Sinskaet al., 1984),从而促进种子的萌发。Pinfiel等(1985)将槭属种子休眠分为胚休眠(embryo dormancy,去除种皮,胚也不会发芽)和种皮强加休眠(testa-imposed,去除种皮,胚就能发芽)。通过低温层积可以打破一些种的休眠,比如挪威枫(Acer platanoides)(Pawłowski, 2009)、 欧 亚 槭 (Acer pseudoplatanus)(Pinfieldet al., 1990a)和巴尔干枫(Acer hyrcanum)(Naseriet al., 2018)等。物理休眠是由于种皮或者果皮的不透水性阻碍种子萌发引起,如意大利枫(Acer opalus)(Gleiseret al., 2004)、 深灰槭(Acer caesium)(Phartyalet al., 2003)、茶条枫(Acer ginnala)(Vordtriedeet al., 2012)等存在种子物理休眠。
具有休眠特性的种子在休眠到萌发的过程中,种子内多种物质发生显著变化,对种子休眠具有正调节或负调节的作用。部分槭属和豆科(Leguminosae)植物在种子萌发和生长过程中黄尿酸(xanthurenic acid)会分解产生大量尿囊素(Mothes,1961;Reinbothe,1962;Fujiharaet al., 1978),而尿囊素能促进一些植物种子的萌发,比如拟南芥(Arabidopsis thaliana)(Nourimandet al., 2019),尿囊素在植物应激保护中也发挥作用(Alamilloet al., 2010)。茉莉酸对不同植物种子具有不同的作用, 它能促进鞑靼槭(Acer tataricum)(Berestetzkyet al., 1991)、苹果(Malus communis)(Yildizet al., 2007)和西洋梨(Pyrus communis)(Yildizet al.,2008)休眠种子的萌发,但是对蒙古黄芪(Astragalus membranaceus)(Yanget al., 2018)、 苍耳(Xanthium pennsylvanicum)(Nojavan-Asghariet al., 1998)、向日葵(Helianthus annuus)(Corbineauet al., 1988)等具有抑制作用。脂肪酸在植物的整个生命过程中具有十分重要的作用(Fernández-Valverdeet al., 1993;Steinberget al., 2000;Fuldaet al., 2002;曹山等,2016)。2-羟基辛酸(Hydroxyoctanoic acid)能抑制中链酰基辅酶A 合成酶(medium chain acyl-CoA synthetase)的活性(Kasuyaet al., 1996),从而阻碍脂肪酸参与代谢。酚类物质对许多植物种子的萌发也具有抑制作用,如红花琉璃草(Cynoglossum officinale)(Qiet al., 1993)、燕麦(Avena sativa)(Corbineauet al., 1986)、 普通小麦(Triticum aestivum)(Konget al., 2008)和大麦(Hordeum vulgare)(Lenoiret al., 2010)等。在欧洲油菜(Brassica napus)(Kuras,1999)和深灰槭(Acer caesium)(Phartyalet al.,2003)种子萌发的过程中大量减少或消失。
血皮槭(Acer griseum)是无患子科(Sapindaceae)(Chaseet al., 2016)槭属落叶乔木,属于中国特有种和濒危种(汪松等,2004),其树皮赭褐色,自然分布于河南西南部、陕西南部、甘肃东南部、湖北西部和四川东部海拔1 500~2 000 m 的疏林中(中国科学院中国植物志编辑委员会,1981)。血皮槭空种率高,种子有翅,坚硬的外种皮包裹着内种皮和胚,阻碍种子的透气吸水;种子没有胚乳,子叶在打破休眠之前就已经具备基本形态,健康种子占比率仅为15.5%,且发芽率低。
目前,对血皮槭的研究主要集中在繁殖栽培技术(杜丽雁等,2005;陈丽等,2010)、生物学特征和休眠机制(张川红等,2012;郭幸飞等,2017;孙佳伟等,2022)、资源调查(陈朋等,2013;张川红等,2015)、分子遗传(孙圣,2014;王佳慧,2015;叶学敏,2017;Wanget al., 2017;付其迪,2020)等方面,尚没有关于基于代谢组学的血皮槭种子休眠的研究报道。
代谢组学可用于分析植物代谢途径中底物和产物(Lisecet al., 2006;Changet al., 2012),可检测种子在打破休眠过程中的一些物质变化,从分析导致种子休眠的内源性物质。本研究采用了代谢组学的分析方法,分析和鉴定与血皮槭胚休眠相关并可能调控其萌发的物质,旨在探索和揭示血皮槭种子休眠的机制。
1 材料与方法
1.1 试验材料
试验所用的血皮槭为野生种,采自陕西省安康市平利县八仙镇(32°09′ E,109°25′ N),采种母树胸径90 cm。试验所用的血皮槭种子分2 批采集,第1 批种子采于2018 年10 月,根据千粒质量,测算种子总量约35 000 粒。未经任何处理,直接播种于母树附近约30 m2的源生地土壤中,不采取任何人工干预措施。分别于2019 年春季和秋季、2020 年春季和秋季、2021 年春季挖取播种地样土观察。第2 批种子采于2020 年10 月,一部分做低温层积处理,另一部分风干后置于4 ℃冰箱中贮藏。抑制物测定试验所用对照材料为小麦(Triticum aestivum)(品种为“郑麦379”),购于杨凌华星绿色种苗有限公司。
1.2 血皮槭种子发芽试验
在发芽试验开始前,将血皮槭种子去除种翅(同下文中的种子),用0.5% KMnO4消毒15 min,用超纯水冲洗5 次。由于血皮槭单性结实的频率较高导致空种率高,因此进行漂浮处理去除空种。沙子过0.45 mm 孔径筛后的细沙,用1% NaClO 溶液浸泡1 h消毒,再用超纯水冲洗5 次,除去沙子中的氯后放置于烘箱中烘干水分。在90 mm 的玻璃培养皿中垫一张滤纸并加入30 g 烘干的细沙,加入15 mL 超纯水作为发芽床。
试验采用双因素设计(低温层积处理和切离胚处理),切离胚处理包括去除外种皮和内种皮,取出完整的胚,播种于发芽床中,定时喷水保持湿润。在低温层积处理中,沙子湿度保持60%,定期翻搅,4 ℃储存。低温层积时间为3~12 个月,每隔1 个月取出部分种子做发芽试验。每个因素有2 个层次(是否低温层积处理或切离胚处理),按以下组合进行:1) 不层积+不切离;2) 不层积+切离胚;3) 低温层积+不切离;4) 低温层积+切离胚。
为了验证外源性激素赤霉素对血皮槭种子打破休眠的影响,笔者另外增加了2 个种子处理组合:1) 不层积+不切离+赤霉素溶液浸泡;2) 不层积+切离胚+赤霉素溶液浸泡。赤霉素溶液的质量浓度设置了3 个梯度,分别为200、400 和800 mg·L–1。
在这些处理之后,在每个培养皿中用镊子均匀地摆放30 粒种子或30 个胚。将培养皿放入恒温培养箱中,周期性光照12 h·d-1,温度设置为27 ℃/19 ℃,空气相对湿度90%。每2 天观察记录萌发情况,并及时添加超纯水,保持发芽床的湿润,持续1 个月。当根尖从种皮中伸出时,认为种子已经发芽。试验设3 次重复。在试验结束时,打开未发芽的种子,检查是否为空种子或胚坏死。
式中:GE 为发芽势;GSN10为前10 天内正常发芽种子数;TSN 为供试种子总数;GR 为发芽率;GSN30为30天内正常发芽种子数;GI 为发芽指数;Gt 为第t 天发芽数,Dt 为发芽的天数(d)。
1.3 抑制性物质存在的部位
1.3.1 浸提液提取 按照种子休眠理论,血皮槭种子休眠的原因之一可能是种子里面抑制性物质的存在导致种子不能萌发。为探究抑制性物质主要存在于种子的哪个部分,笔者选取当年休眠的血皮槭种子,把种子分解为种翅、外种皮、内种皮和种胚4 个部分,研磨成粉末。取4 根试管,分别加入1 g 血皮槭种子各部分粉末和30 mL 超纯水,充分摇匀后置于25 ℃恒温条件下浸提72 h。将浸提好的各部分浸提液离心(12 000 r·min–1,2 min)使固液分离,取上方浸提液并用0.22 µm 滤头过滤。
1.3.2 发芽对照试验 用种子4 个部分的浸提液培养小麦种子,测定小麦种子萌发的发芽势和发芽率(根尖从种皮中伸出2 mm 时认为种子已经发芽),依此推断抑制血皮槭种子萌发的物质存在部位。试验设置4 个处理,A1 种翅浸提液,A2 外种皮浸提液,A3 内种皮浸提液,A4 种胚浸提液,用超纯水做对照(UP),每个处理(含对照)3 个生物学样本重复。
式中: GE 为发芽势;GSN3为前3 天内正常发芽种子数;TSN 为供试种子总数;GR 为发芽率;GSN7为7 天内正常发芽种子数;GI 为发芽指数;Gt 为第t 天发芽数,Dt 为发芽的天数(t)。
1.3.3 抑制物验证试验 验证抑制小麦种子发芽的物质是否跟种子休眠有关,试验设置3 个处理,A4 种胚浸提液,A5 打破休眠的种胚浸提液,用超纯水做对照(UP),每个处理(含对照)3 个重复。
1.4 代谢组学分析
1.4.1 代谢物提取 将血皮槭打破休眠的种子种胚(CK)和休眠的种子种胚(T)放在冰上解冻,分别将0.5 g 样品转移到EP 管中,加入1 000 µL 提取液(甲醇∶乙腈∶水=2∶2∶1(V/V),含同位素标记内标混合物)。35 Hz 研磨处理4 min,在冰水浴中超声5 min,-40 ℃静置1 h 沉淀蛋白,然后在4 ℃、12 000 r·min–1离心15 min。上清液转移到新鲜的2 mL LC/MS 玻璃瓶中进行UHPLC-QE-MS 分析。生物学样本重复3 次。质量控制(quality control, QC)样品的制备方法是将所有样品的上清液混合均匀。
1.4.2 LC-MS/MS 分析 LC-MS/MS 分析采用UHPLC系统(Vanquish, Thermo Fisher Scientific),通过Waters ACQUITYUPL C BEH Amide(2.1 mm×100 mm, 1.7 µm)液相色谱柱对目标化合物进行色谱分离。流动相由25 mmol·L-1乙酸铵(NH4OAc)和25 mmol·L-1氢氧化铵(NH4OH)水溶液(pH9.75)(A)和乙腈(B)组成。样品盘温度为4 ℃,进样量为3 µL。
1.4.3 一级、二级质谱数据采集 QE HFX 质谱仪在采集软件(Xcalibur, Thermo)的控制下进行,在这种模式下,采集软件持续评估全扫描质谱。ESI 源条件设置为: Sheath gas flow rate: 30 Arb, Aux gas flow rate: 25 Arb, Capillary temperature: 350 ℃, Full MS resolution:60 000, MS/MS resolution: 7 500, Collision energy:10/30/60 in NCE mode, Spray voltage: 3.6 kV(正离子)或-3.2 kV(负离子)。
1.4.4 数据预处理和注释 MS 原始数据文件(.raw)使用Proteo Wizard 转换为mzXML 格式文件,并使用内部程序进行处理,该程序使用R 开发,基于XCMS,用于峰值识别、提取、对齐和积分等处理。然后与BiotreeDB(V2.1)自建二级质谱数据库匹配进行物质注释,算法打分的Cutoff 值设为0.3。
为了提高代谢物覆盖率,提高检测效果,充分了解血皮槭种子打破休眠后种胚内代谢物的变化,笔者采用正离子(POS)和负离子(NEG)2 种模式检测代谢物。以质谱为基础,采用QC 样品进行质量控制(Dunnet al., 2011)。主成分分析(principal component analysis, PCA)采用R 语言gmodels(v2.18.1)(Warnes,2007)进行。QC 分布越密集,结果越可靠。对于差异代谢物的分析,变量投影重要性(variable importance in projection, VIP)阈值为1。初步筛选差异丰富的代谢物,采用Student’st检验,P<0.05, VIP≥1 作为鉴别这些代谢物的标准。
对于 KEGG(Kyoto encyclopedia of genes and genomes)(Kanehisaet al., 2000)注释和富集分析,已鉴定的代谢物使用KEGG Compound 数据库进行注释(http://www.kegg.jp/kegg/compound/)。将注释的代谢物映射到KEGG Pathway 数据库中(http://www.kegg.jp/kegg/pathway.html),然后将标记有显著调控代谢物的途径输入MSEA(代谢物集富集分析),通过超几何检验获得的P值来确定富集的意义。
利用R 进行样本间相关性计算,并用pheatmap(Koldeet al., 2018)绘制样本相关性热图。
2 结果与分析
2.1 血皮槭种子自然休眠特性
2018 年10 月采集的约35 000 粒种子播种在母树附近任其自然生长,笔者分别于2019 年春季和秋季、2020 年春季和秋季、2021 年春季观察出苗情况,并选取几个小面积样点,挖取播种地样土过筛,观察种子情况,观察完后随机把种子埋回样地。
2019 年春季观察时发现有大量种子被剥开只剩外种皮,坚硬的外种皮上有被咬过的痕迹,应被鸟类或者虫类所食。剥开完整的种子,没有任何发芽迹象。2019 年秋季观察时,原本坚硬的种壳已经开始变黑变软,可以轻松剥开,种胚完好无发芽迹象。2020 年春季和秋季观察时发现种子仍没有发芽迹象,但种子腐烂率明显提高,健康种子占比越来越少。2021 年春季(4 月初),在播种地观测到500 多株已经发芽出土的血皮槭幼苗。依据观察结果,发现血皮槭自然休眠时间长达29 个月,其种子自然出苗率大约仅有1.4%。血皮槭种子自身的限制因素加上自然环境下种子的损失率较高,制约其种群的自然更新,也使尽快保护繁育这一珍稀濒危植物显得尤为重要。
2.2 血皮槭种子发芽试验
采用双因素设计试验,对血皮槭种子进行低温层积处理和切离胚处理,在12 个月内的低温层积并不能打破其种子休眠,坚硬的外种皮可能在前期阻碍了种胚吸水,但当低温层积至6 个月时,种子坚硬的外种皮开始吸饱水分,可以轻松剥开。在去除种皮,切离胚培养的情况下,也未能实现种子萌发。
笔者尝试使用不同浓度的激素配合低温层积处理和切离胚处理来打破种子休眠,在前面双因素试验的每个处理基础上,增加3 种浓度的赤霉素溶液。由表1 可知,血皮槭种子不论是否经过3~12 个月的低温层积处理,不论是否去除内外种皮,在恒温培养箱中播种后均未能发芽;不同浓度的赤霉素溶液对其种子打破休眠也没有影响。打开种子观察,发现除了已经坏死的,健康的种子种胚和低温层积前并没有太大变化。

表1 低温层积处理、切离胚处理和不同浓度的赤霉素溶液处理对血皮槭种子打破休眠的影响①Tab. 1 Effects of low temperature stratification, embryo sectioning and different concentrations of gibberellin on the breaking of dormancy of A. griseum seeds
2.3 抑制性物质存在的部位
血皮槭种子4 个不同部分浸提液对小麦种子萌发影响结果如图1 和图3 所示。A4 处理下,小麦的萌发率最低(图1)。A1、A2、A3 这3 个处理与UP 差异不大。显著性分析结果(图3)表明,A4 处理与A1、A2、A3 和UP 在发芽势、发芽率和发芽指数上都存在极显著性差异(P<0.01);A1、A2、A3 之间没有极显著性差异,A1、A2、A3 与UP 也不存在极显著性差异。由以上结果可推测,抑制血皮槭种子萌发的抑制性物质存在于血皮槭种子的种胚中。(A1、A2 处理的小麦种子发芽势和发芽率反而高于对照(图3),说明血皮槭种子的种翅和外种皮含有一些促进种子发芽的营养物质。

图1 血皮槭种子4 个不同部分浸提液对小麦种子萌发的抑制作用比较Fig. 1 Comparison of inhibitory effects of four extracts from A. griseum seeds on wheat seeds germination
休眠血皮槭种子种胚浸提液明显抑制小麦种子的萌发,由此推测抑制血皮槭种子发芽的物质存在于种胚中。已经打破休眠的血皮槭种子的种胚浸提液(A5)处理小麦种子,试验结果如图2 和图3 所示:A5处理的发芽势、发芽率和发芽指数分别比A4(休眠种子种胚浸提液)提高了30.67%、22%和15.81%。由此可见,打破休眠后的血皮槭种子种胚中的内源抑制物得以减少。但是A5 处理的发芽势、发芽率和发芽指数仍然比超纯水(UP)处理的低,这可能是试验所用打破休眠的血皮槭种子未完全发芽,种胚中的内源抑制物还有余留。
2.4 代谢组学分析
2.4.1 数据质量控制和样本相关性热图 通过LCMS/MS 比较血皮槭休眠和打破休眠的种子种胚PCA检测峰值,PCA 评分由每个条件下6 个重复样品检测到的所有代谢物得出。由PCA 图(图4)可以看出来,在正离子模式(POS)和负离子模式(NEG)下,T 和CK 相同处理聚在一起,样本之间具有良好的重复性,QC 样本分布较密集,说明检测结果可靠。
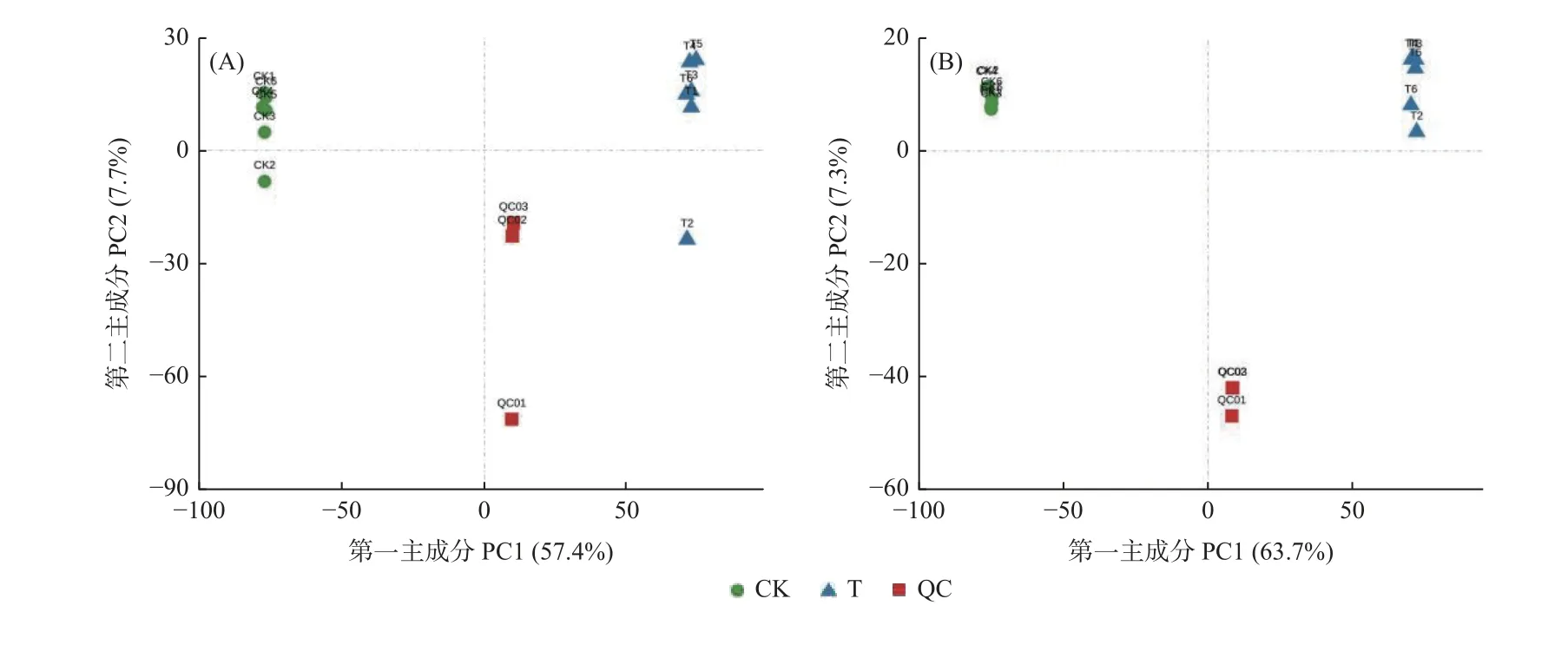
图4 质量控制主成分分析Fig. 4 Principal component analysis (PCA) of quality control
从样本相关性热图(图5)可以看出来,在正离子模式(POS)和负离子模式(NEG)下,T 的6 个重复之间相关系数均接近1,表明试验组样本间的代谢组成和丰度相似度高;CK 的6 个重复之间相关系数也均接近1,表明对照组样本间的代谢组成和丰度相似度也较高。

图5 样本相关性热图Fig. 5 Sample correlation heat map
在正离子模式(POS)和负离子模式(NEG)下,T的6 个重复和CK 的6 个重复之间相关系数均呈下降趋势,表明血皮槭种子打破休眠后,种胚内的代谢组成和丰度发生了明显变化。
2.4.2 差异代谢物分析 通过LC-MS/MS 分析比较T 和CK 的6 个重复样本,在正离子模式(POS)下共检测出8 384 个代谢物,负离子模式(NEG)下共检测出7 240 个代谢物。结合正交偏最小二乘法判别分析(orthogonal partial least-squares discrimination analysis)OPLS-DA 的VIP(variable importance in projection)值和单变量统计分析t-testP值来筛选不同比较组间的显著差异代谢物(图6)(Bylesjoet al., 2006;Saccentiet al.,2014;Thevenot, 2016),差异的阈值为:OPLS-DA 模型中VIP≥1 且t-testP<0.05。显著差异代谢物分别为289 个和215 个,在正离子模式(POS)下,T 组相对于CK 组上调和下调的代谢物数量分别为176 个和113 个;在负离子模式(NEG)下,T 组相对于CK 组上调和下调的代谢物数量分别为159 个和56 个。
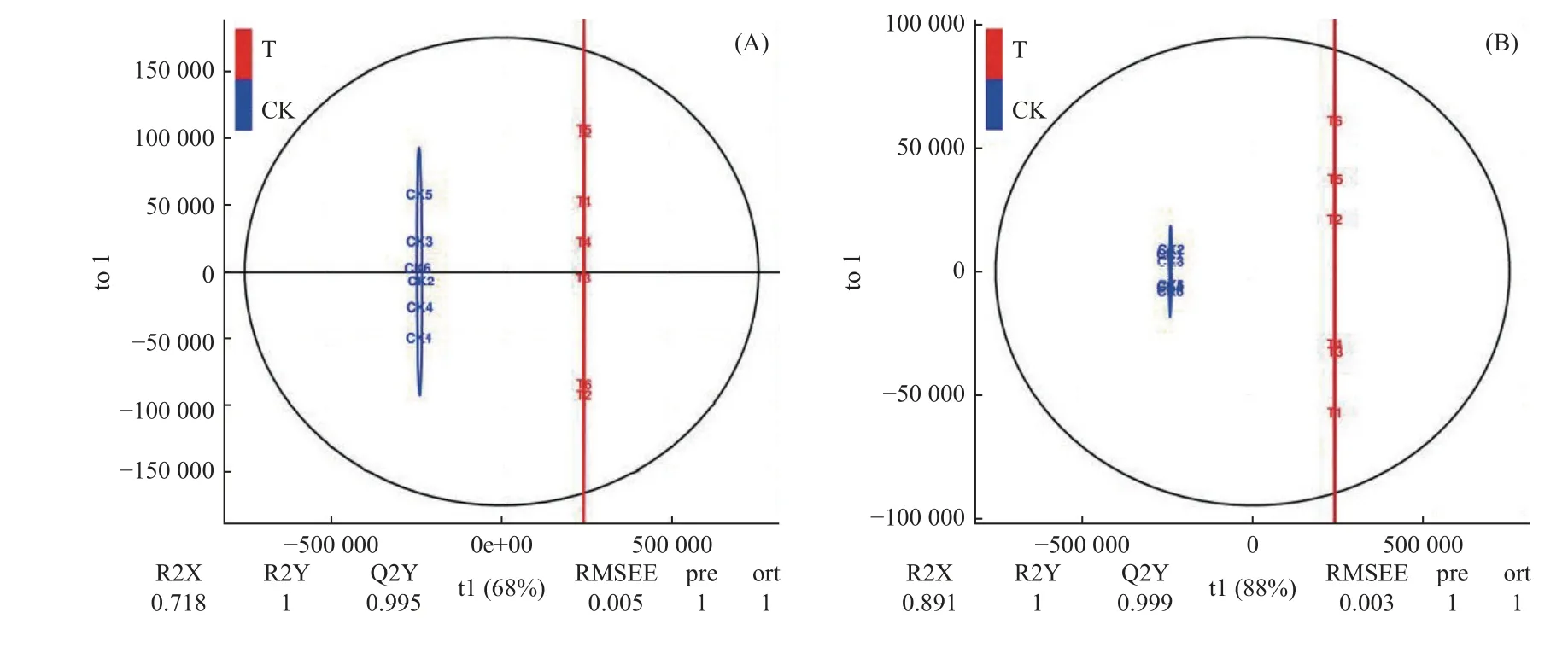
图6 OPLS-DA 得分Fig. 6 OPLS-DA score chart
对比分析T 和CK 中的显著差异代谢物,在代谢以及生物合成相关的KEGG 分类中显著富集(图7),显著富集的通路包括不饱和脂肪酸生物合成途径(biosynthesis of unsaturated fatty acids,ko01040)、组氨酸代谢(histidine metabolism,ko00340)、单菌素生物合成(monobactam biosynthesis,ko00261)、苯丙素的生物合成(phenylpropanoid biosynthesis,ko00940)、氨酰生物合成(aminoacyl-trna biosynthesis,ko00970)、丙氨酸,天冬氨酸,谷氨酸代谢(alanine, aspartate and glutamate metabolism,ko00250)、酪氨酸代谢(tyrosine metabolism,ko00350)、精氨酸和脯氨酸代谢(arginine and proline metabolism,ko00330)、氰基氨基酸代谢(cyanoamino acid metabolism,ko00460)、耐万古霉素(vancomycin resistance,ko01502)、ABC 转运蛋白(ABC transporters,ko02010)、D精氨酸和鸟氨酸代谢(D-arginine and Dornithine metabolism,ko00472)、泛醌等萜醌生物合成(ubiquinone and other terpenoid-quinone biosynthesis,ko00130)、 异喹啉生物碱生物合成(isoquinoline alkaloid biosynthesis,ko00950)、硫代葡萄糖苷生物合成(glucosinolate biosynthesis,ko00966)、苯丙氨酸代谢(phenylalanine metabolism,ko00360)、β-丙氨酸代谢(beta-alanine metabolism,ko00410)、碳青霉烯生物合成(carbapenem biosynthesis,ko00332)、脂肪酸生物合成(fatty acid biosynthesis, ko00061)、 丁酸代谢(butanoate metabolism,ko00650)。

图7 KEGG 富集圈Fig. 7 KEGG enrichment cycle chart
通过二级谱图(MS2)匹配这些显著差异代谢物,在正离子模式(POS)下有146 个,负离子模式(NEG)下有109 个。差异倍数(|log2FC|)最大的20 个代谢物中,只有1 个在种子打破休眠后丰度增加(图8、表2),它们主要分布在脂肪酰基(fatty acyls)和苯及其取代衍生物(benzene and substituted derivatives)这2 个分类中,占比分别为50%和15%。而通过一级谱图(MS1),可定性一类显著差异代谢物——酚磷酸(phenolic phosphate)。
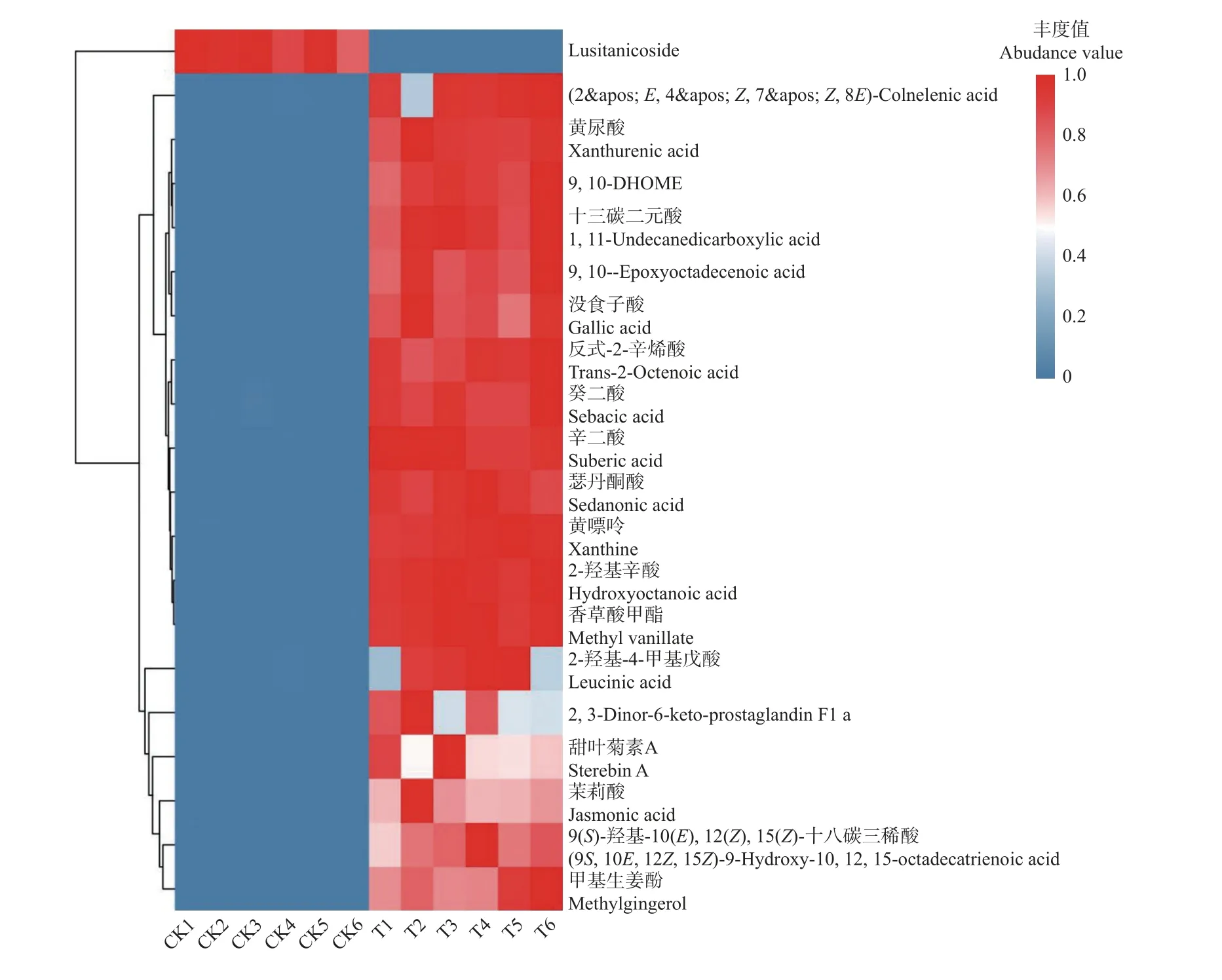
图8 差异倍数(|log2FC|)Top20 的代谢物聚类热图Fig. 8 Differences in multiples (| log2FC |) Top20 metabolites clustering heat map

表2 差异倍数(|log2FC|)Top20 的显著差异代谢物①Tab. 2 Different multiples (|log2FC|) Top20 significant differences metabolites
与T 相比,CK 中2-羟基辛酸(hydroxyoctanoic acid)、甲基生姜酚(methylgingerol)、黄尿酸(xanthurenic acid)、反式-2-辛烯酸(trans-2-octenoic acid)、茉莉酸(jasmonic acid)、十三碳二元酸(1,11-undecanedicarboxylic acid)和香草酸甲酯(methyl vanillate)含量在各个样本和QC 样本中的积分定量值均为0(表2),表明其随着种子打破休眠而大量减少或消失。差异代谢物分析结果表明,这7 种代谢物可能对血皮槭种子的休眠起到重要作用。
3 讨论
新鲜血皮槭种子坚硬的外种皮阻碍了种胚获得外界水分,一定程度上可能抑制了种子萌发。通过种子休眠特性试验和发芽试验发现,自然状态下的血皮槭种子打破休眠的时间至少为29 个月,加上种子空种率高,野外环境下容易被动物取食,种子后期腐烂率上升等多因素导致其发芽率低,野外更新困难。在人工干预下,不论是否经过3 个月至12 个月的低温层积处理,不论是否去除内外种皮,在恒温培养箱中播种后均未能发芽,不同浓度的赤霉素溶液处理对打破其种子休眠也没有影响。而当低温层积至6 个月左右,种子原本坚硬的外种皮便已吸饱水分并且可以轻松剥开,可见种皮障碍并不是造成其休眠的主要原因。结合Pinfield 和Dungey 对槭属植物种子休眠的分类以及Baskin 和Baskin 的种子休眠分类标准,血皮槭种子属于深度生理胚休眠( Pinfieldet al., 1985;Baskinet al., 1998;Baskinet al., 2004)。
有些槭属植物种子不仅种胚含有抑制种子萌发的物质,内种皮或外种皮也含有抑制种子发芽的物质,如糖槭(Acer saccharum)(Webbet al., 1969)、欧亚槭(Acer pseudoplatanus)(Webbet al., 1972)、绒毛槭(Acer velutinum)(Pinfieldet al., 1990b)和巴尔干枫(Acer hyrcanum)(Naseriet al., 2018)等。有趣的是,通过血皮槭种子抑制物测定试验,笔者发现其外种皮和内种皮不仅没有抑制种子发芽的物质,相反地,经其种翅和外种皮浸提液处理过的小麦种子平均发芽势和平均发芽率比超纯水处理的小麦种子高。这种现象说明血皮槭种子的种翅和外种皮中可能含有一些对种子萌发有益的营养物质(矿质元素),而抑制血皮槭种子发芽的物质都存在于种胚内。血皮槭打破休眠后的种子种胚浸提液比休眠种子种胚浸提液处理过的小麦种子发芽势、发芽率和发芽指数分别大幅提高30.67%、22%、15.81%,可见打破休眠后,血皮槭种子种胚内的抑制物减少。为了确认血皮槭种子种胚内的抑制物具体是什么,笔者通过代谢组学对比分析血皮槭休眠种子种胚和打破休眠种子种胚中的差异代谢物。经过二级谱图(MS2)匹配到了255 个显著差异代谢物,其中差异倍数TOP20 的显著差异代谢物里有50%属于脂肪酰基类,15%属于苯及其取代衍生物类,由此笔者推测这两类代谢物在导致血皮槭种子休眠中起到重要的作用。笔者筛选分析的7 种显著差异代谢物中有4 种属于脂肪酰基类,它们在种子打破休眠后含量大幅减少或消失,笔者推测这些代谢物可能对血皮槭种子的萌发起主要的抑制作用(图9)。

图9 血皮槭种子打破休眠的模式Fig. 9 Diagram of seed breaking dormancy pattern of A. griseum
休眠的血皮槭种子种胚内含有大量的2-羟基辛酸、甲基生姜酚、黄尿酸、反式-2-辛烯酸、茉莉酸、十三碳二元酸和香草酸甲酯,在种子打破休眠后,它们的含量在各个样本和QC 样本中的积分定量值均为0。2-羟基辛酸会抑制MACS 发挥作用,笔者推测在种子打破休眠后前者的大量减少让后者得以正常发挥作用,并使脂肪酸顺利参与种子的新陈代谢,促进种子萌发。黄尿酸在植物种子打破休眠的过程中会分解形成尿囊素和尿囊酸并积累,从而促进种子的萌发(Mothes, 1961; Reinbothe, 1962; Fujiharaet al., 1978;Nourimandet al., 2019),血皮槭休眠种子种胚中大量的黄尿酸在打破休眠的过程中可能也经历了同样的转化。茉莉酸已被证实能抑制一些种子的萌发(Corbineauet al., 1988; Nojavan-Asghariet al., 1998;Yanget al., 2018),它在一些植物中的抑制作用可能也同样发挥在血皮槭种子上,在打破休眠的代谢过程中,种胚内大量的茉莉酸转化成了其他对种子萌发起促进或没有抑制作用物质。而笔者筛选出的另外两种脂肪酰基类显著差异代谢物反式-2-辛烯酸和十三碳二元酸,目前尚未见其在种子休眠或者植物新陈代谢中作用的报道,笔者推测这两者会直接或间接抑制脂肪酸参与种子的新陈代谢,从而抑制种子萌发。
甲基生姜酚和香草酸甲酯这两种代谢物对植物种子休眠的具体影响目前尚不清楚,但两者都属于酚类物质(Ishimataet al., 2016)。笔者通过一级谱图(MS1)在显著差异代谢物中定性到的另一种酚类物质——酚磷酸,它们的含量在种子打破休眠后也显著减少。酚类物质在以往的诸多研究中已被证实能抑制多种植物种子的萌发(Qiet al., 1993;Corbineauet al., 1986;Konget al., 2008;Lenoiret al., 2010;Kuras,1999;Phartyalet al., 2003),休眠的血皮槭种子种胚内含有的这些大量酚类物质可能也抑制了种子萌发。植物中最常见的诱导和维持种子休眠的植物激素脱落酸(ABA)以及释放种子休眠的植物激素赤霉素(GA)和乙烯(ETH)(Finkelsteinet al., 2008;Gaoet al.,2014; Graeberet al., 2012; Holdsworthet al., 2008;Nonogaki,2014),笔者在差异阈值为VIP≥1 且t-testP<0.05 的显著差异代谢物中并未找到。当笔者忽略差异阈值时,可以筛选到脱落酸(VIP<0.5,log2FC<0.9),但它是否对血皮槭的休眠具有影响还有待论证。
4 结论
血皮槭种子存在深度生理胚休眠,抑制其种子发芽的物质存在于种胚中。种子休眠是一个复杂的生理现象,血皮槭种子休眠可能并非某一种或几种物质造成的,而是多种物质的互作、协作或者叠加所致。2-羟基辛酸、甲基生姜酚、黄尿酸、反式-2-辛烯酸、茉莉酸、十三碳二元酸和香草酸甲酯这7 个显著差异代谢物在血皮槭种子打破休眠后大量减少或消失,笔者推测这些物质可能与导致血皮槭种子休眠密切相关,它们通过在打破休眠的过程中调控自身或者其他物质发生作用和转化,从而抑制或促进血皮槭种子萌发。
