胃癌组织和远癌组织β-catenin 的表达及临床意义
2023-10-18陈海军孙梓程由光玉洪东宁
陈海军 孙梓程 刘 岩 由光玉 洪东宁
(南通市第六人民医院普外科,江苏 南通 226000;2.牡丹江市第一人民医院,黑龙江 牡丹江 157001)
本研究以临床肿瘤标本为研究对象,通过实时荧光定量PCR 及West-bloting 的方法对胃癌组织中Wnt 信号通路中β-catenin 蛋白的表达状况与临床病理因素之间的关系进行分析,探讨其在胃癌发生发展中的作用机制,为临床治疗提供可能的治疗靶点。
1 资料与方法
1.1 一般资料 随机选取我院手术切除的胃癌标本32 例为研究对象,其中男19 例,女13 例,中位年龄56 岁(39~79 岁),所有患者术前均未进行新辅助化疗。胃底贲门部肿瘤4 例,胃体部肿瘤8 例,胃窦部肿瘤20 例;pTNM 分期Ⅰ期,Ⅱ期共24 例,Ⅲ期,Ⅳ期共8 例;无淋巴结转移12 例,伴有胃周淋巴结转移20 例;低度分化8 例、中等分化16 例、高分化腺癌8例。取胃癌组织和距癌肿边缘5 cm 的远癌组织后迅速-80 ℃冻存并尽早检测。
1.2 实验仪器和试剂 ECL 发光试剂盒;KAPA SYBR FAST qPCR Kit;抗人β-catenin 单克隆抗体、内参GADPH 抗体、二抗SP 免疫组化试剂盒;TRIzol试剂、逆转录试剂盒;全蛋白提取试剂盒、BCA 蛋白定量试剂盒;BIO-RAD CFX96 实时定量PCR 仪;垂直电泳和水平电泳。操作步骤按说明进行。
1.3 方法 (1)RNA 提取及纯度测定:将得到胃癌组织及远癌组织分别称重,切碎,在液氮中研磨,并加以TRIzol 试剂进行裂解处理。加入氯仿200 μL,剧烈振荡,放置室温下。4 ℃条件下,以12000 rpm 转速离心15 min,收集上清(约500 uL),加入异丙醇混匀。冰上孵育。再次离心后弃去上清液。加入预冷的75 乙醇1 mL。4 ℃8000 rpm 离心10 min,弃上清。重复上述步骤,RNA 沉淀在室温下干燥,提取出总RNA。DEPC 处理的水溶液将RNA 溶解,核酸定量分析仪测RNA 纯度,OD260/280 比值在2.0 左右,-80 ℃冰箱冻存备用。根据逆转录试剂盒说明书将RNA 逆转录为cDNA,所得的cDNA 置于-20 ℃保存备用。(2)实时荧光定量PCR 检测β-catenin 基因表达:设计目的基因β-catenin 和内参基因GAPDH 引物序列并委托上海生物工程有限公司合成,采用非特异性SYBR Green 荧光染料法检测。先验证引物退火温度及特异性,选取特异性高的引物作为后续研究。反应体系配制:2×SYBR Green mix10μL,上游/下游引物(10 μmoL)各0.4μL,cDNA 1μL,补双蒸水至终体积为20 μL,加盖混匀,按照预变性:95 ℃,30 s;变性:95 ℃,5 s;退火延伸:60 ℃,30 s 反应条件进行扩增并构建溶解曲线。β-catenin:上游引物:5- GGACAAACCACAGGATTACA -3,下游引物:5-TCCACCACAGTGAAAAGAAC-3,长度180bp;GAPDH:上游引物:5-AGAAGGCTGGGGCTCATTTG-3,下游引物:5-AGGGGCCATCCACAGTCTTC-3,长度258bp。(3)West-blot 法检测β-catenin 蛋白的表达:分别取0.1 g 胃癌组织和远癌组织,经蛋白提取、定量后稀释成5 ug/uL 浓度,加入上样缓冲液Loading-Buffer 混匀煮沸5 min,上样,SDS-PDGE 胶电泳,转膜,将转膜后的PVDF 膜在5%脱脂奶粉封闭,分别加目的蛋白一抗及内参一抗(1:400)4 ℃冰箱过夜孵育,次日PBST洗膜3 次,5 min/次,用5%脱脂奶粉稀释的二抗(浓度1:2000)室温孵育1 h,PBST 洗膜3 次,5 min/次,ECL 发光,暗室胶片曝光。以GAPDH 为内参,采用仪器自带软件进行定量分析并记录其相对光密度值。
1.4 统计学方法 采用SPSS20.0 软件处理,计量数据以(±s)表示,用t 检验;计数资料用[n(%)]表示,用χ2检验或Fisher 确切概率法,组间比较用Kruskal-Wallis H 检验,其表达相关性用Spearman 秩相关性分析。
2 结果
2.1 RT-PCR 扩增产物的特异性 RT-PCR 采用两步法扩增,适宜退火延伸温度为60 ℃,熔解曲线示集中单峰,表明特异性较好;β-catenin 与GADPH 标准曲线斜率一致性较高,表示二者扩增效率基本一致。采用ΔΔC(t)法,以人GADPH 基因为内参,远癌组织β-catenin mRNA 相对表达量为1.000,胃癌组织中β-catenin mRNA 表达明显高于远癌组织,差异显著(P<0.05),β-catenin 基因PCR 扩增产物电泳结果:A.胃癌组织B.远癌组织,见图1。
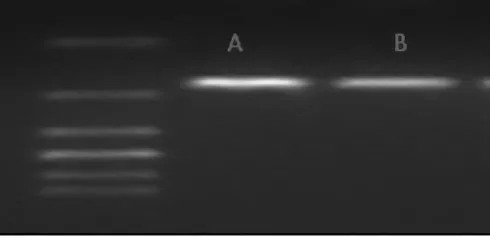
图1
2.2 β-catenin 蛋白的表达 West-bloting 结果显示:胃癌组织中β-catenin 蛋白表达量高于远癌组织表达量,差异显著(P<0.05)。West-bloting 法检测胃癌组织及远癌组织β-catenin 蛋白的表达情况,见图2。
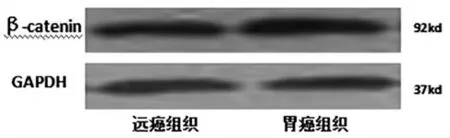
图2
2.3 远癌组织与胃癌组织β-catenin 基因与蛋白相对表达量统计 胃癌组织的β-catenin mRNA 和蛋白的表达量显著高于远癌组织表达量,差异显著(P<0.05),见表1。
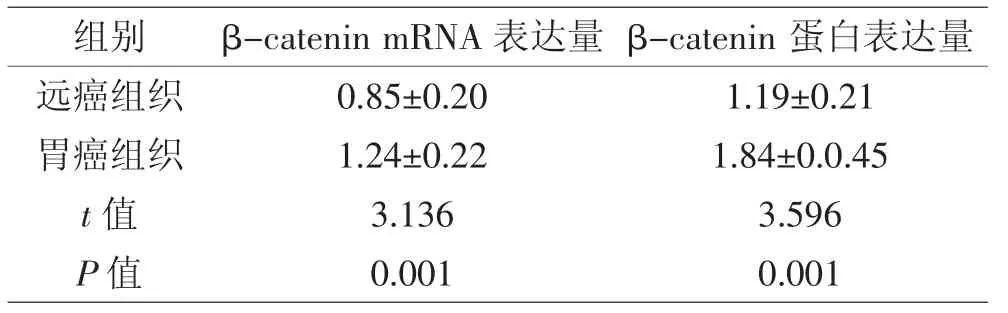
表1 远癌组织与胃癌组织β-catenin 基因
2.4 胃癌组织β-catenin 的表达与临床病理特征之间的关系 β-catenin 蛋白的阳性表达在低分化、晚期肿瘤及有淋巴结转移的胃癌组织中表达相对较高,但与年龄、性别、部位、分化程度、TNM 分期、淋巴结有无转移等临床病理特征之间无明显相关性(P>0.05),见表2。
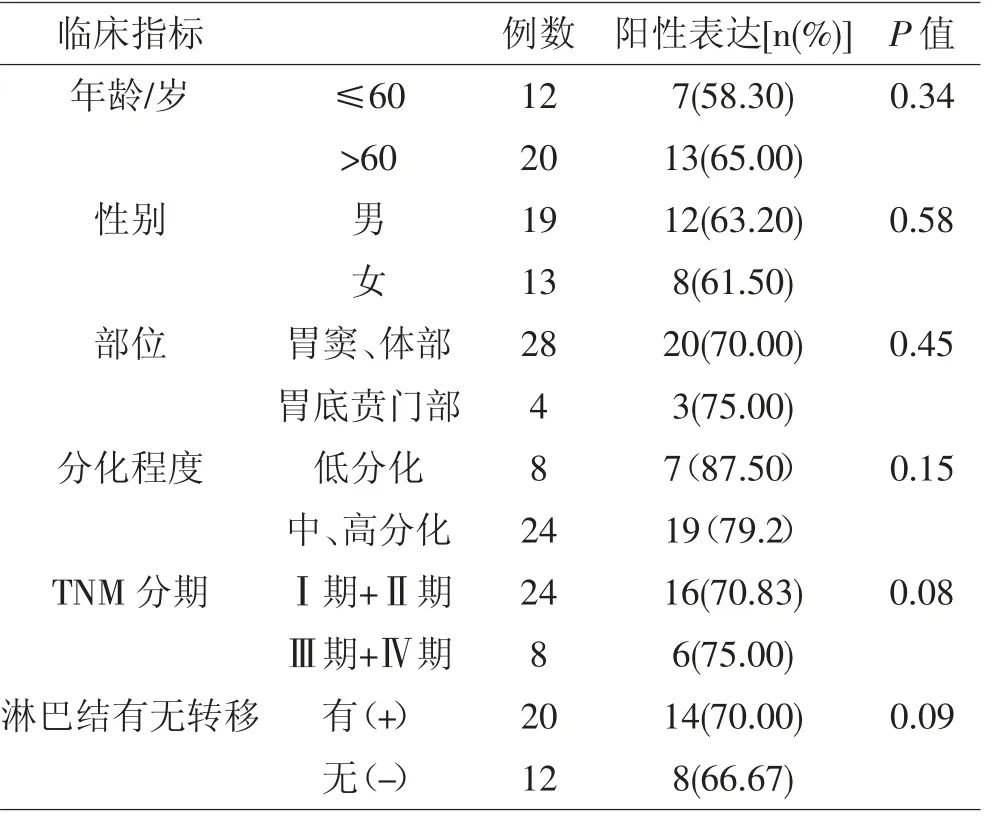
表2 胃癌组织β-catenin 的表达与临床病理
3 讨论
Wnt 信号通路是一条进化比较保守的信号传导途径,存在于各种动物体内,参与细胞增殖、分化和凋亡的调控,在胚胎发育和细胞命运的决定中发挥重要作用,它包括Wnt/β-catenin 信号通路、Wnt/Ca2+信号通路及由c-Jun N 端激酶(JNK)介导的细胞极性信号通路等细胞内信号通路[1]。Wnt/β-catenin 信号通路是Wnt 信号通路的经典通路,由Wnt 蛋白、跨膜受体、胞质蛋白、核内转录因子等,位于胞质内的散乱蛋白(Dsh)、结肠腺瘤样息肉病蛋白(APC)、糖原合成酶激酶3β(GSK-3β)、轴蛋白(Axin)及β-连接蛋白(βcatenin),核内转录因子如转录活化因子CBP 及T 细胞转录因子/淋巴样增强因子(TCF/LEF)等[2]。尽管Wnt 信号通路由多种蛋白构成,但β-catenin 在细胞内浓度可改变各种调节因子,使肿瘤细胞的迁移及侵袭能力加强。研究表明[3]细胞中β-catenin 的表达与肿瘤的转化和浸润密切相关。Ishigaki K[4]通过研究胃癌细胞和原发性胃癌β-catenin 基因突变和表达情况,发现基因的突变与β-catenin 蛋白在核内堆积有相关性,推测β-catenin 异常的细胞内分布与细胞恶性转化、增殖密切相关[5]。
多研究表明Wnt 信号通路激活与肿瘤转移存在一定关系[6]。β-catenin 是Wnt/β-catenin 信号通路关键信号分子,我们采用实时荧光定量PCR、West-bloting 的方法,比较胃癌组织和远癌组织标本β-catenin表达的水平,观察到远癌组织内β-catenin mRNA 及蛋白都呈低表达,而胃癌组织内的β-catenin mRNA及蛋白表达较远癌组织升高(P<0.05),提示β-catenin参与胃癌的发生与发展过程。Wnt/β-catenin 信号通路下游靶基因如原癌基因c-myc、细胞周期蛋白D1和金属蛋白酶等在肿瘤的发生和转移中扮演重要作用,而β-catenin 与下游靶基因之间构成了一个错综复杂的网络[7]。本研究中β-catenin 蛋白的阳性表达与肿瘤发生部位、分化程度、分期及有无淋巴结转移及患者性别、年龄因素无明显相关性(P>0.05),与上述结果不一致,提示我们β-catenin 在胃癌转移过程中的作用机制目前仍不清楚,随着分子生物学技术的不断发展,相信转录因子β-catenin 的功能将不断被发现,其作用机制及信号通路将会进一步被阐明,也为胃癌的临床诊疗提供一个新的靶点。
