D-二聚体/血小板比值对重症脑卒中患者下肢深静脉血栓的预测价值
2023-10-18李萌萌屈云云刘慧
李萌萌,屈云云,刘慧
(商丘市第三人民医院 检验科,河南 商丘 476000)
重症脑卒中患者长期处于昏迷、瘫痪状态,静脉壁受损、血流速度减慢、血液高凝等易导致下肢深静脉血栓[1]。脑卒中分为脑部缺血或出血性疾病,本研究纳入的缺血性脑卒中患者病因为静脉管腔阻塞,引起远端静脉高压,不及时干预会致残,甚至出现肺栓塞、脑梗死等,所以寻找灵敏的生物标志物行下肢深静脉血栓预测至关重要[2]。D-二聚体为交联纤维蛋白降解产物,可反映机体凝血状态,脑卒中患者D-二聚体水平升高[3]。血小板参与炎症和免疫反应。目前D-二聚体/血小板比值(D-dimer/platelet ratio,DPR)与重症脑卒中患者下肢深静脉血栓相关性的研究较少,本研究旨在分析D-二聚体/血小板预测的重症脑卒中患者下肢深静脉血栓临床价值,以期为早期筛查、预防提供更准确的参考。
1 对象与方法
1.1 研究对象
选取2019年1月至2022年6月商丘市第三人民医院收治的216例重症脑卒中患者为观察组。(1)纳入标准:①经MRI或头颅CT影像学检查明确符合《中国各类主要脑血管疾病诊断要点2019》[4]中重症缺血性脑卒中的诊断标准,伴神经、呼吸和循环系统功能损伤等;②入院后检查无下肢深静脉血栓;③患者家属签署研究同意书。(2)排除标准:①严重心、肝、肺、肾等全身性疾病;②严重下肢水肿;③血栓病史,出血性脑卒中或短暂性脑缺血暂时发作;④严重外周动脉梗阻、下肢动脉硬化、肺水肿、肺栓塞。选取100例同期健康体检者为健康对照组。选取标准:意识清楚,具有小学及以上受教育程度、可正确理解量表并作出回答;既往无精神病、脑卒中、无滥用药物史;知情同意、愿意合作。住院期间每7 d用多普勒超声筛查1次,检查是否出现下肢深静脉血栓,根据《深静脉血栓形成的诊断和治疗指南(第三版)》[5]中诊断标准评估有无下肢深静脉血栓形成,将重症脑卒中患者分为非下肢深静脉血栓组(120例)和下肢深静脉血栓组(96例)。本研究经商丘市第三人民医院医学伦理委员会审批,批准文号:商丘三院伦[2021]-5-16。
1.2 研究方法
1.2.1一般资料
收集包括性别、年龄、体重指数、合并症、疾病类型等资料。
1.2.2血小板参数
入院后即刻抽取5 mL空腹静脉血,3 000 r·min-1离心取血清,放置在冰箱中待检。采用SysmexXN-9000血液分析仪检验记录血小板参数,包括血小板计数(platelet count,PLT)、平均血小板体积(mean platelet volume,MPV)、血小板体积分布宽度(platelet volume distribution width,PDW)。
1.2.3凝血功能
入院后即刻抽取静脉血2 mL,加入含有109 mmol·L-1枸橼酸钠真空管中混匀,应用SYSMEX-CS5100全自动仪检测患者纤维蛋白原(fibrinogen,Fib)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶原时间(prothrombin time,PT)。采用免疫比浊法检测D-二聚体水平,计算DPR。
1.2.4Wells评分
入院后24 h内采用Wells评分[6]评估患者深静脉血栓风险,具体内容中卧床>3 d、下肢制动轻微偏瘫、下肢深静脉局限性压痛、全下肢肿胀、小腿增粗3 cm、凹陷性水肿、出现侧支浅静脉均计1分,DVT不确定为唯一诊断或不排除与DVT类似疾病计2分。0分或负值为低度危险,1~2分为中度,≥3分为高度。
1.2.5统计学方法
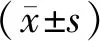
2 结果
2.1 一般资料
对照组中男74例,女26例;年龄40~74岁,平均(59.37±8.16)岁;体重指数17.69~30.81 kg·m-2,平均(26.53±3.22)kg·m-2。非下肢深静脉血栓组男78例,女42例;年龄39~75岁,平均(59.25±7.96)岁;体重指数17.94~30.15 kg·m-2,平均(26.75±3.53)kg·m-2;脑梗死82例、脑出血38例;高血压病史73例。下肢深静脉血栓组男61例,女35例;年龄38~73岁,平均(59.37±7.85)岁;体重指数18.02~30.23 kg·m-2,平均(26.89±3.41)kg·m-2;脑梗死68例、脑出血28例;高血压病史59例。3组性别、年龄及体重指数差异无统计学意义(χ2=0.049,F=0.927、1.134,P=0.824、0.789、0.616),非下肢深静脉血栓组与下肢深静脉血栓组脑卒中类型、合并高血压差异无统计学意义(χ2=0.157、0.009,P=0.692、0.925)。
2.2 3组凝血功能、血小板参数、DPR、Wells评分比较
下肢深静脉血栓组D-二聚体、PT、APTT、Fib、DPR、Wells评分高于非下肢深静脉血栓组、对照组,PLT、MPV、PDW低于非下肢深静脉血栓组、对照组(P<0.05);非下肢深静脉血栓组D-二聚体、PT、APTT、Fib、DPR高于对照组,PLT、MPV、PDW低于对照组(P<0.05),见表1。
表1 3组凝血功能、血小板参数、DPR、Wells评分比较
2.3 DPR预测重症脑卒中患者下肢深静脉血栓的ROC曲线参数
PLT、D-二聚体、DPR预测重症脑卒中患者下肢深静脉血栓的AUC>0.7,预测价值较好。见表2。
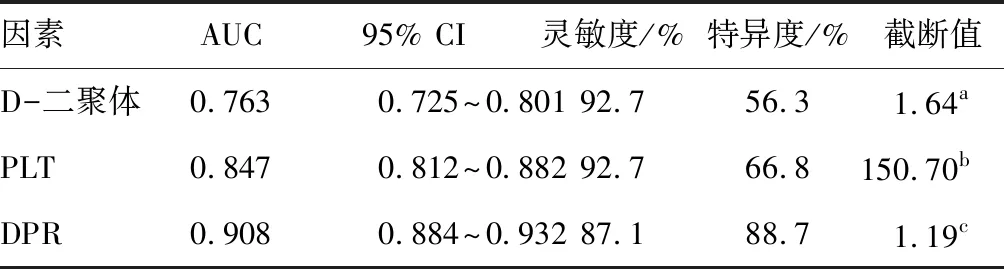
表2 DPR预测重症脑卒中患者下肢深静脉血栓的ROC曲线参数
2.4 重症脑卒中患者下肢深静脉血栓影响因素的多因素logistic回归分析
将重症脑卒中患者下肢深静脉血栓作为因变量(下肢深静脉血栓=1,未出现下肢深静脉血栓=0),并将性别、年龄、合并症、疾病类型、有无深静脉置管、D-二聚体、PT、APTT、Fib、DPR、Wells评分、PLT、MPV、PDW作为自变量进行多因素logistic回归分析,结果显示DPR≥1.19×10-2为重症脑卒中患者下肢深静脉血栓的危险因素之一(P<0.05),见表3。
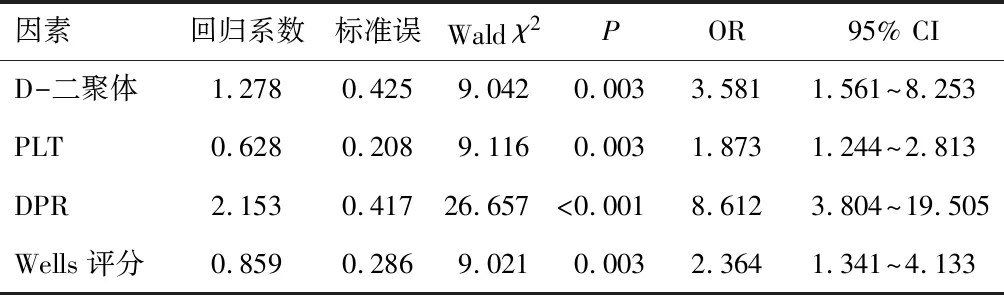
表3 重症脑卒中患者下肢深静脉血栓影响因素的多因素logistic回归分析
3 讨论
脑卒中为常见脑血管障碍性疾病,老年人群高发,患者脑血管堵塞、出血造成脑组织缺血缺氧坏死[7]。重症脑卒中患者脑组织受损面积大,易致脑疝,引起突发昏迷、肢体功能障碍、呼吸循环急性功能障碍等,病情危重、并发症多、预后差。其发病因素有动脉粥样硬化,与高血压、心脏病、糖尿病、高脂血症、吸烟等有关[8]。下肢深静脉血栓为深静脉血液异常凝结引起的静脉回流障碍性疾病,重症脑卒中患者下肢深静脉血栓发生率高达50%,多发于发病后1~2周,可增加患者致残、病死率[9]。下肢深静脉血栓早期缺乏特异性症状,出现症状时已形成血栓,尽早发现、诊断利于预防重症脑卒中患者下肢深静脉血栓。
本研究结果表明,下肢深静脉血栓组年龄高于非下肢深静脉血栓组和对照组,非下肢深静脉血栓组高于对照组。年龄、D-二聚体、卧床时间、既往DVT病史、凹陷性水肿、浅静脉侧支循环等均为下肢深静脉血栓的危险因素[9-10]。本研究结果表明,下肢深静脉血栓组D-二聚体、PT、APTT、Fib、DPR、Wells评分高于非下肢深静脉血栓组和对照组,PLT、MPV、PDW低于非下肢深静脉血栓组、对照组,非下肢深静脉血栓组D-二聚体、PT、APTT、Fib、DPR高于对照组,PLT、MPV、PDW低于对照组,提示重症脑卒中患者下肢深静脉血栓D-二聚体、Wells评分升高,PLT降低,所以DPR上升。有研究显示,急性缺血性脑卒中患者MPV、PDW、P-LCR、PCT等升高[11-12],表明血小板参数可为疾病早期识别、病情评估提供依据;脑出血患者凝血功能异常,D-二聚体、Fib升高,与本研究结果一致。另一项研究显示,PLT与淋巴细胞比值、D-二聚体与Fib比值可预测青年脑出血患者并发静脉血栓栓塞症[13],分析原因为:(1)D-二聚体可反映人体交联纤维蛋白、继发纤溶活性,健康机体浓度较低,血液中浓度升高[14-15]。血液高凝时,凝血酶刺激水解Fib释放纤维蛋白肽链,形成可溶性纤维蛋白单体和活化因子Ⅲ交联,生成D-二聚体[16]。D-二聚体水平可用于筛查早期下肢静脉血栓及肺栓塞,但特异性不高[17]。(2)血小板由造血组织巨核细胞产生,可维持血管内皮完整性,调节黏附、释放、聚集和促凝功能,PLT、体积变化反映血小板活化功能,与动脉粥样硬化、血栓形成有关[18-19]。相关信号刺激血小板激活,参与凝血酶介导的信号转导,诱发多种生物化学反应。血小板过度活跃和血管内皮细胞的相互作用增加,氧化型中间产物堆积导致局部炎症反应、微循环障碍,血流动力学改变,易形成血栓,血栓形成引起血小板消耗和破坏,且血小板参数获取简便、易于推广[20-21]。
本研究结果表明,DPR预测重症脑卒中患者下肢深静脉血栓的AUC为0.908(0.884~0.932),DPR高表达[OR(95% CI):8.612(3.804~19.505)]为重症脑卒中患者下肢深静脉血栓的相关因素之一,提示D-二聚体与PLT联合诊断的效能高于单一指标,DPR可作为预测重症脑卒中患者下肢深静脉血栓的可靠指标,诊断价值高。由于血小板在血栓形成过程中发挥重要生理作用,而D-二聚体为反映体内高凝状态及继发性纤溶亢进的标志物,DPR联合D-二聚体、PLT,其优于单独诊断,对脑卒中患者下肢深静脉血栓具有较好的预测性。
4 结论
重症脑卒中患者下肢深静脉血栓的D-二聚体升高,PLT降低,DPR高表达为重症脑卒中患者下肢深静脉血栓的危险因素,灵敏度、特异度高。
