葛根素抑制NF-κB/MAPK通路治疗雨蛙素诱导的小鼠急性胰腺炎
2023-10-18吴超俊王桂良邱萍徐林芳龚敏李兴文剑波
吴超俊,王桂良,邱萍,徐林芳,龚敏,李兴,文剑波
葛根素抑制NF-κB/MAPK通路治疗雨蛙素诱导的小鼠急性胰腺炎
吴超俊,王桂良,邱萍,徐林芳,龚敏,李兴,文剑波
萍乡市人民医院消化内科,江西萍乡 337000
探讨葛根素抑制核因子κB(nuclear factor κB,NF-κB)/丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路治疗雨蛙素诱导的小鼠急性胰腺炎的分子机制。将24只SPF级健康雄性C57BL/6小鼠随机分为四组:空白对照组、葛根素组、雨蛙素组、葛根素+雨蛙素组,观察四组小鼠的生物学行为变化,分析血清脂肪酶、淀粉酶、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-1β、IL-6、IL-10浓度及胰腺组织p-NF-κBp65、NF-κBp65、p-IκB-α、IκB-α、p-ERKl/2、ERKl/2、p-p38、p38、p-JNK和JNK蛋白水平。与空白对照组比较,葛根素组小鼠的生物学行为、生理特征、病理指数和血清脂肪酶、淀粉酶、TNF-α、IL-1β、IL-6、IL-10浓度及胰腺组织的p-NF-κBp65、NF-κBp65、p-IκB-α、IκB-α、p-ERKl/2、ERKl/2、p-p38、p38、p-JNK和JNK蛋白水平差异无统计学意义(>0.05),雨蛙素组小鼠的病理指数与血清脂肪酶、淀粉酶、TNF-α、IL-1β、IL-6、IL-10浓度及胰腺组织的p-NF-κBp65、p-IκB-α、p-ERKl/2、p-p38和p-JNK蛋白水平显著升高;与雨蛙素组比较,葛根素+雨蛙素组小鼠的症状缓解,病理指数和血清脂肪酶、淀粉酶、TNF-α、IL-6浓度及胰腺组织的p-NF-κBp65、p-IκB-α、p-ERKl/2、p-p38和p-JNK蛋白水平显著降低,血清IL-10浓度显著升高。葛根素可通过抑制NF-κB/MAPK信号通路治疗雨蛙素诱导的小鼠急性胰腺炎。
急性胰腺炎;葛根素;丝裂原活化蛋白激酶;核因子κB
急性胰腺炎是临床上常见的危重病,发病机制复杂,进展快[1]。炎症介质和细胞因子在发病过程中起重要作用,进入血液循环后进一步激活其他炎症细胞,释放更多的炎症介质,形成级联放大效应,加剧全身反应。丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)路径和核因子-κB(nuclear factor -κB,NF-κB)信号通路是影响急性胰腺炎发生和发展的非常重要的信号通路,通过调控多种炎症因子及炎性细胞的浸润促进胰腺组织炎症反应[2-3]。葛根素是从中药葛根中提取的一种异黄酮类化合物,化学名为4,7-二羟基8β-D-吡喃葡萄糖醛基异黄酮,分子式为C21H20O9,具有抗炎、介导免疫细胞激活、调节炎症因子表达及炎性信号通路转导等作用[4]。葛根素能通过多条信号通路发挥抗炎作用,本研究以NF-κB和p38MAPK信号通路为靶点,探索葛根素对雨蛙素诱导的小鼠急性胰腺炎的作用机制。
1 材料和方法
1.1 材料
动物SPF级健康雄性C57BL/6小鼠,体质量18~22g,购自江西中医药大学动物部。葛根素注射液(生产批号:1009056,生产单位:成都地奥九泓制药厂,规格:25mg/ml,2 ml/支);雨蛙素购自美国Sigma公司;SYBR-GREEN PCR Kit购自日本TAKARA公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-1β、IL-6和IL-10 酶联免疫吸附试验(enzyme-linked immunoadsordent assay,ELISA)检测试剂盒购自博士德生物工程有限公司;p-NF-κBp65、NF-κBp65、p-IκB-α、IκB-α、p-ERKl/2、ERKl/2、p-p38、p38、p-JNK、JNK和甘油醛-3-磷酸脱氢酶(recombinant glyceraldehyde-3-phosphatedehydrogenase,GAPDH)单克隆抗体购自美国Abcam公司。本研究经萍乡市人民医院实验动物福利伦理委员会审批通过(伦理审批号:2022A004-HS02)。
1.2 方法
1.2.1 动物建模与分组 24只C57BL/6小鼠,禁食12h,按照随机数表法分为四组:空白对照组、葛根素组、雨蛙素组、葛根素+雨蛙素组,每组6只。空白对照组腹腔注射生理盐水;葛根素组给予葛根素1.3ml/kg注射液腹腔注射;雨蛙素组给予腹腔注射雨蛙素50μg/kg,间隔1h注射1次,共7次,末次注射雨蛙素后腹腔注射脂多糖10mg/kg;葛根素+雨蛙素组给予腹腔注射50μg/kg雨蛙素,间隔1h注射1次,共7次,末次注射雨蛙素后腹腔注射脂多糖10mg/kg,1h后,给予葛根素注射液腹腔注射(1.3ml/kg)。48h后使用乙醚麻醉小鼠,采用眼球取血法,取血500~800μl,4℃静置过夜后离心机离心取上层血清,置于4℃冰箱保存。处死小鼠后无菌条件下解剖小鼠,取出胰腺组织,剖离外层结缔组织后,一部分置于–80℃冰箱,一部分放置于4%甲醛中。
1.2.2 病理形态学检测 取各组小鼠胰腺组织,经10%中性甲醛固定48h,梯度乙醇脱水,二甲苯透明,石蜡包埋,切片,苏木精–伊红(hematoxylin and eosin,HE)染色,在光学显微镜下,随机采集10处代表性图像进行病理学分析。按照水肿、炎症、出血、坏死程度评估胰腺组织的病理学损伤,参照 Amy法进行胰腺病理组织评分。评分标准:水肿>50%的叶间增宽并伴有破坏、分离的腺泡细胞计3分,20%~50%的广泛小叶间隙增宽计2分,<20%的小叶间隙局部增宽计1分,无以上特征计0分;炎性浸润:炎性细胞出现在胰腺实质>50%小叶计3分,<50%小叶计2分,炎性细胞出现在导管周围或导管区域计1分,无以上特征计0分;坏死:20%~50%的广泛胰腺实质坏死计3分,5%~20%的局灶性坏死计2分,>50%的导管周围坏死计1分。胰腺总损伤评分为3项评分的总和。
1.2.3 ELISA检测血清炎性因子水平 严格按照ELISA试剂盒说明书进行操作,用酶标仪在波长490nm处测定各样品吸光度值,计算血清中TNF-α、IL-lβ、IL-6和IL-10水平。
1.2.4 Western blotting法测定p-NF-κBp65、NF-κBp65、p-IκB-α、IκB-α、p-ERKl/2、ERKl/2、p-p38、p38、p-JNK和JNK蛋白表达 剪取部分胰腺组织,液氮研磨后采用蛋白裂解液提取总蛋白,加入组织裂解液裂解,二喹啉甲酸(bicinchoninic acid,BCA)法进行蛋白定量,加5×上样缓冲液煮沸10min,进行十二烷基硫酸钠–聚丙烯酰胺凝胶电泳,经聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜转膜,5%脱脂奶粉封闭过夜,加入一抗(1∶1000)稀释液,室温孵育2h,继以辣根酶标记的二抗(1∶5000)稀释液室温孵育1h,用增强型化学发光试剂(electro- chemi-luminescence,ECL)显色检测蛋白信号,Bio-Rad凝胶成像系统进行图片采集,用Image Pro Plus图像分析软件分析各阳性条带的积分灰度值,以作为GAPDH参照蛋白进行校准,计算各目标蛋白的相对含量。
1.3 统计学方法
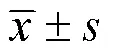
2 结果
2.1 四组小鼠的一般情况观察
空白对照组及葛根素组小鼠皮毛浓密光泽、反应灵敏、呼吸正常、行为活跃、饮食饮水正常。雨蛙素组表现为眯眼、皮毛杂乱失泽、倦卧嗜睡、反应迟钝、少食怠动、消瘦倦卧、全身颤抖、腹泻。葛根素+雨蛙素组小鼠症状改善。
2.2 四组小鼠的胰腺病理指数比较
空白对照组和葛根素组的胰腺组织中可观察到完整的腺泡小叶,腺泡细胞排列紧密且胞间无间质性水肿。与空白对照组比较,葛根素组病理损伤指数差异无统计学意义(>0.05),雨蛙素组病理损伤指数显著升高;与雨蛙素组比较,葛根素+雨蛙素组的胰腺病理损伤指数显著降低,见图1、图2。
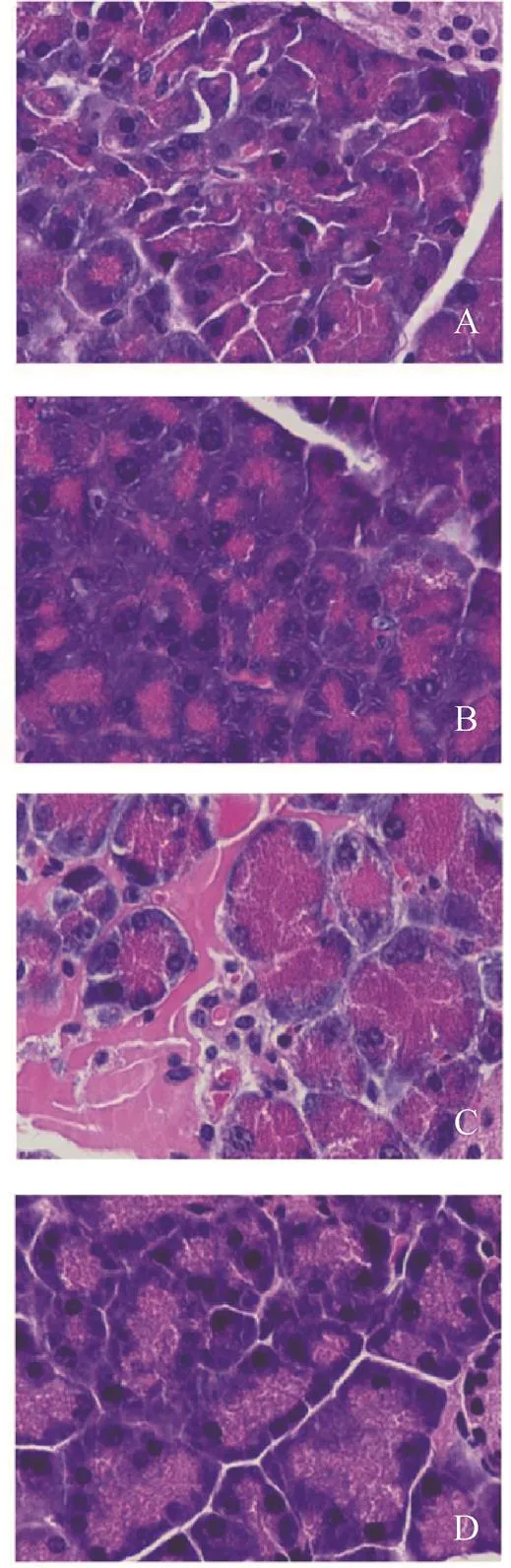
图1 四组小鼠的胰腺组织HE染色结果
A.空白对照组;B.葛根素组;C.雨蛙素组;D.葛根素+雨蛙素组
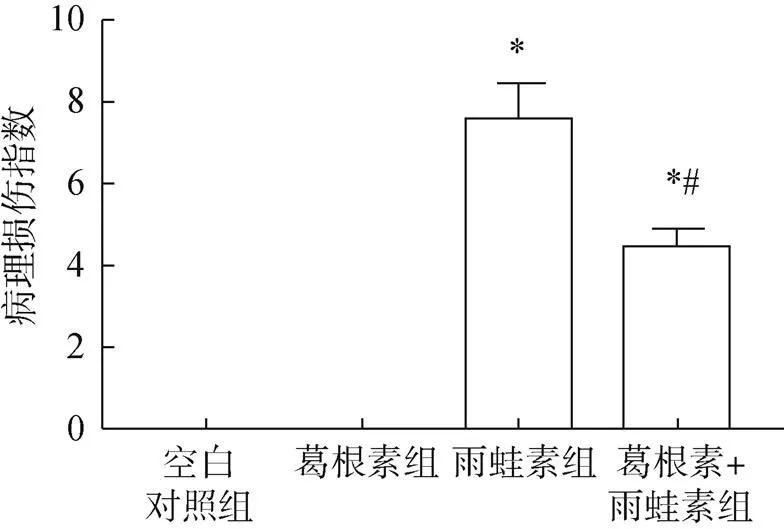
图2 四组小鼠的胰腺病理损伤指数比较
注:与空白对照组比较,*<0.05;与雨蛙素组比较,#<0.05
2.3 四组小鼠的血清脂肪酶及淀粉酶浓度比较
与空白对照组比较,葛根素组小鼠的脂肪酶及淀粉酶浓度差异无统计学意义,雨蛙素组小鼠的脂肪酶及淀粉酶浓度显著升高;与雨蛙素组比较,葛根素+雨蛙素组小鼠的胰腺脂肪酶及淀粉酶浓度显著降低,见图3。
2.4 四组小鼠中血清TNF-α、IL-1β、IL-6和IL-10水平比较
与空白对照组比较,葛根素组小鼠血清中TNF-α、IL-6和IL-10浓度差异无统计学意义,雨蛙素组小鼠血清中TNF-α、IL-6和IL-10浓度显著升高;与雨蛙素组比较,葛根素+雨蛙素组小鼠血清中TNF-α和IL-6浓度显著降低,IL-10浓度显著升高,见图4。
2.5 四组小鼠胰腺组织中p-NF-κBp65、NF-κBp65、p-IκB-α、IκB-α、p-ERKl/2、ERKl/2、p-p38、p38、p-JNK和JNK蛋白水平比较
与空白对照组比较,葛根素组小鼠胰腺组织中p-NF-κBp65、NF-κBp65、p-IκB-α、IκB-α、p-ERKl/2、ERKl/2、p-p38、p38、p-JNK 和JNK蛋白水平差异无统计学意义,雨蛙素组小鼠胰腺组织中p-NF-κBp65、p-IκB-α、p-ERKl/2、p-p38、p-JNK水平显著升高,而NF-κBp65、IκB-α、ERKl/2、p38和JNK蛋白无显著变化;与雨蛙素组比较,葛根素+雨蛙素组小鼠胰腺组织中p-NF-κBp65、p-IκB-α、p-ERKl/2、p-p38、p-JNK蛋白水平显著降低,而NF-κBp65、IκB-α、ERKl/2、p38和JNK蛋白无显著变化,见图5。
3 讨论
急性胰腺炎发病机制复杂,涉及多环节、多因素,如炎症介质、促炎细胞因子的大量释放等,胰腺内被异常激活,从而导致胰腺组织的自身消化、水肿、出血、坏死[5]。炎症信号通路在胰腺炎的病理生理过程中发挥重要作用,NF-κB和MAPK信号是两条非常关键的信号通路,二者通过调控多种炎症因子及炎性细胞的浸润促进胰腺组织炎症反应的发生、发展[6]。生理情况下NF-κB磷酸化位点被IκB封闭,处于无活性状态;在各种炎性损伤中,上游κB抑制因子激酶(inhibitor of κB kinase,IκK)降解IκB后,使p50的核定位信号暴露,携带p65迅速转移至核内,p65则可识别特定的DNA序列,与某些炎症因子基因启动区或增强子上的κB位点结合,启动炎症因子黏附分子炎症反应相关酶相关基因转录,诱导多种炎性介质的表达。MAPK的磷酸化在多器官纤维化中发挥重要作用,由ERK1/2、JNK、p38MAPK介导的3条级联反应可促进炎症细胞因子的生成而加剧炎症反应。急性胰腺炎过程中p38MAPK被激活,参加炎症反应与细胞应激、凋亡等,调控多种细胞因子的转录[7]。p38MAPK信号通路与NF-κB信号途径相互影响,p38MAPK信号通路可促进IκB-α的磷酸化和降解,进而激活NF-κB通路[8]。各种炎症细胞的聚集与活化导致腺泡细胞的进一步损伤,并引起促炎因子表达上调,形成级联放大反应,产生全身炎症反应综合征,甚至多器官功能障碍[9]。TNF‐α是重症急性胰腺炎中释放最早、最重要的促炎因子,其主要来源是单核巨噬细胞和T淋巴细胞,可通过多种细胞促进多种炎症介质及细胞因子的产生,引起多器官功能损伤[10]。IL-6是一种多效性细胞因子,通常在组织中产生并释放到循环系统中而造成稳态扰动,进而引起内毒素肺损伤、急性感染等[11]。IL-1β的局部激活是介导促炎反应的中心环节,导致继发性炎症介质的激活[12]。IL-10是一种重要的抗炎症细胞因子,由Th2细胞产生,具有抑制Th1产生细胞因子的作用,能有效抑制巨噬细胞的MHC-2分子表达,从而抑制TNF-α、IL-1β、IL-6、IL-8等促炎因子的合成,减轻炎症损害[13]。

图3 四组小鼠的血清脂肪酶及淀粉酶浓度比较
A.血清脂肪酶浓度;B.血清淀粉酶浓度
注:与空白对照组比较,*<0.05;与雨蛙素组比较,#<0.05
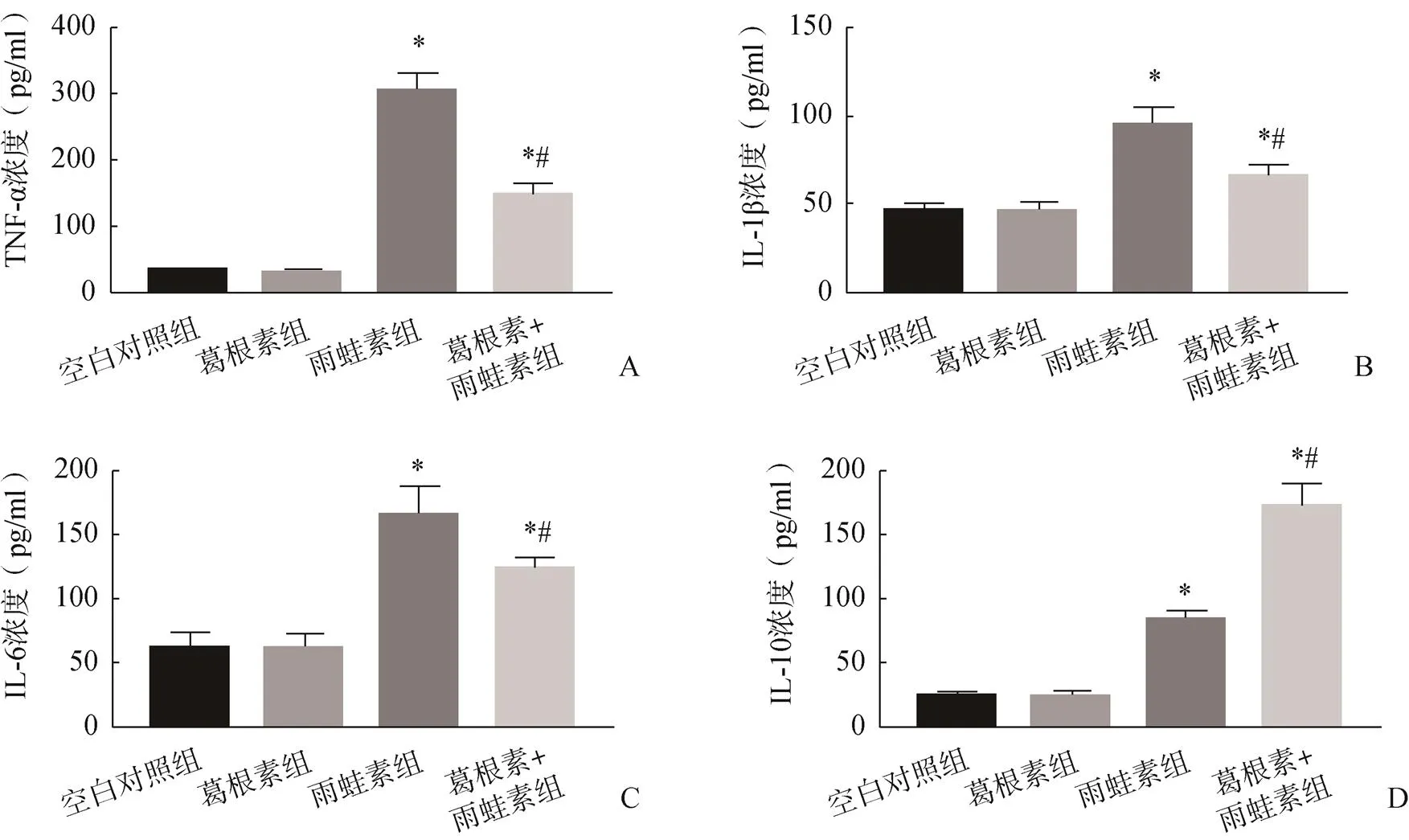
图4 四组小鼠的血清TNF-α、IL-1β、IL-6和IL-10浓度比较
A.TNF-α浓度;B.IL-1β浓度;C.IL-6浓度;D.IL-10浓度
注:与空白对照组比较,*<0.05;与雨蛙素组比较,#<0.05
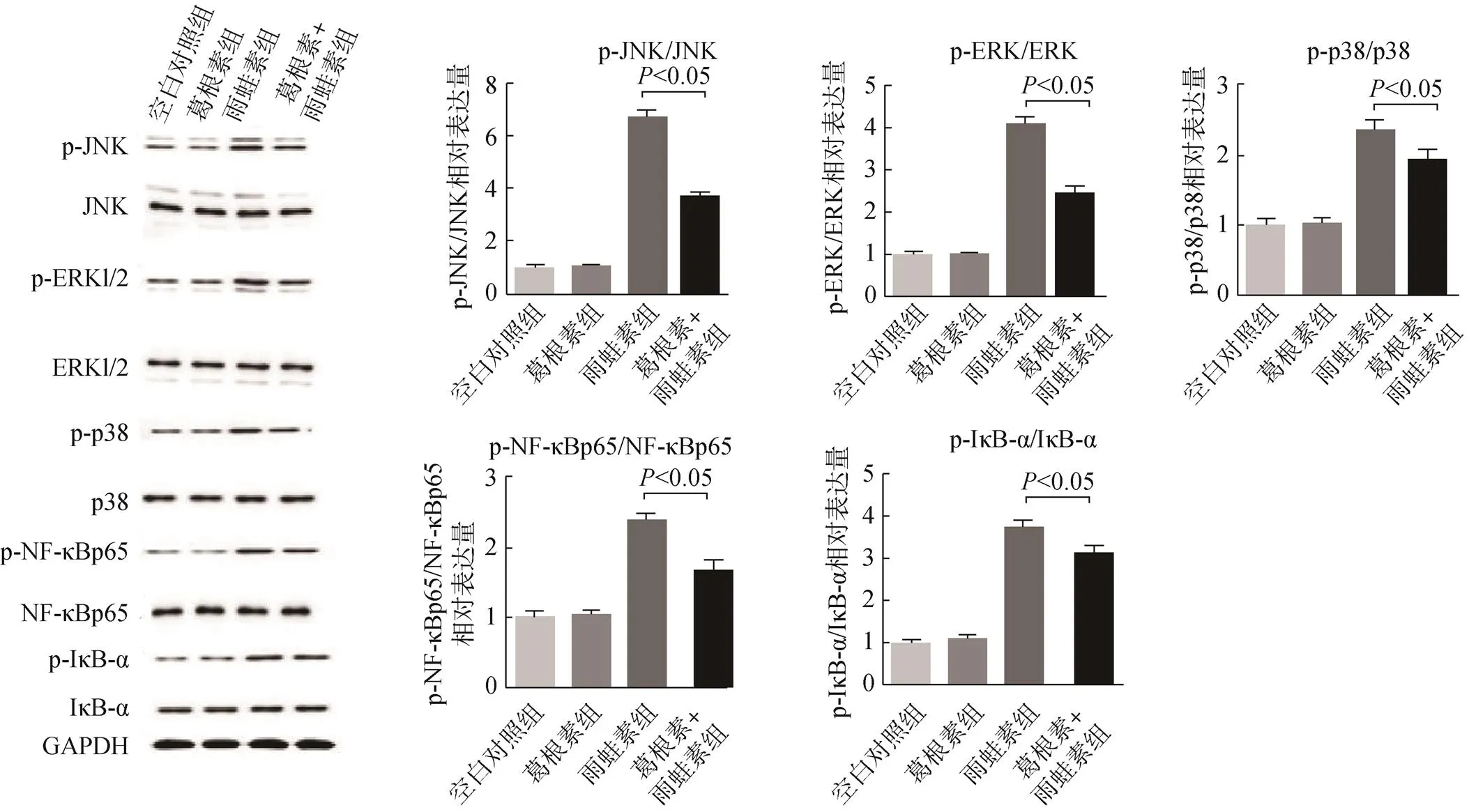
图5 四组小鼠的p-NF-κBp65、NF-κBp65、p-IκB-α、IκB-α、p-ERKl/2、ERKl/2、p-p38、p38、p-JNK和JNK蛋白水平比较
葛根素对多器官有良好的抗炎和抗纤维化作用[14]。Li等[15]发现葛根素对横主动脉收缩引起的心肌纤维化有保护作用,这可能与PPAR-γ的上调和TGF-1/ smad2介导的内皮–间质转化的抑制有关。葛根素能阻滞β受体,抑制血小板聚集、抗氧化、抗炎、利尿、调节血压和血糖血脂、调节炎性细胞因子及信号通路,抑制促炎因子对中性粒细胞的趋化作用,但对胰腺炎的治疗作用尚不清楚。本研究发现,与空白对照组比较,葛根素组小鼠的生物学行为、生理特征无明显改变,病理指数、脂肪酶和淀粉酶浓度及血清TNF-α、IL-1β、IL-6、IL-10浓度及胰腺组织的p-NF-κBp65、NF-κBp65、p-IκB-α、IκB-α、p-ERKl/2、ERKl/2、p-p38、p38、p-JNK和JNK蛋白水平无统计学差异,说明葛根素几乎没有毒副作用,安全性很好。雨蛙素组病理指数、血清脂肪酶和淀粉酶浓度与血清TNF-α、IL-1β、IL-6、IL-10浓度及胰腺组织的p-NF-κBp65、p-IκB-α、p-ERKl/2、p-p38和p-JNK水平显著升高,而NF-κBp65、IκB-α、ERKl/2、p38和JNK蛋白无显著变化,说明雨蛙素可诱导小鼠胰腺炎的发生,导致胰腺组织损伤,NF-κB通路激活,p-NF-κBp65、p-IκB-α蛋白浓度升高,p-NF-κB进入细胞核,启动促炎因子和抗炎因子的转录和蛋白表达,MAPK通路激活,p-IκB-α、p-ERKl/2、p-p38和p-JNK蛋白浓度升高,启动炎症因子的转录和蛋白表达。与雨蛙素组比较,葛根素+雨蛙素组小鼠症状缓解、病理指数、血清脂肪酶和淀粉酶浓度与血清TNF-α和IL-6浓度及胰腺组织的p-NF-κBp65、p-IκB-α、p-ERKl/2、p-p38和p-JNK蛋白水平显著降低,血清IL-10浓度显著升高,而NF-κBp65、IκB-α、ERKl/2、p38和JNK蛋白无显著变化,说明葛根素能抑制NF-κB的磷酸化和MAPK通路蛋白的磷酸化和激活,抑制促炎因子的表达,促进抗炎因子的表达,减轻胰腺组织的病理损伤,发挥保护作用。
综上所述,葛根素安全性好,能通过抑制NF-κB/ MAPK信号通路治疗雨蛙素诱导的小鼠急性胰腺炎。
[1] SINONQUEL P, LALEMAN W, WILMER A. Advances in acute pancreatitis[J]. Curr Opin Crit Care, 2021, 27(2): 193–200.
[2] GAO L, ZHAO H, SUN H, et al. TAB3 overexpression promotes NF-kappaB activation and inflammation in acute pancreatitis[J]. Am J Blood Res, 2020, 10(4): 118–123.
[3] ZHANG J, MEI F, ZHAO L, et al. Inhibition of the p38MAPK pathway attenuates renal injury in pregnant rats with acute necrotizing pancreatitis[J]. Immunol Res, 2021, 69(3): 295–306.
[4] ZHANG S, XU Y, CHEN J, et al. Effects of puerarin onlipopolysaccharide-induced myocardial dysfunction inisolated rat hearts[J]. Pak J Pharm Sc,2017, 30(4): 1195–1202.
[5] ALTER D, KOCH D D. A review of acute pancreatitis[J]. JAMA, 2021, 325(23): 2402.
[6] HUANG H, WANG M, GUO Z, et al. Rutaecarpine alleviates acute pancreatitis in mice and AR42J cells by suppressing the MAPK and NF-kappaB signaling pathways via calcitonin gene-related peptide[J]. Phytother Res, 2021, 35(11): 6472–6485.
[7] CHEN Y, ZHAO Q, CHEN Q, et al. Melatonin attenuated inflammatory reaction by inhibiting the activation of p38 and NF-kappaB in taurocholate-induced acute pancreatitis[J]. Mol Med Rep, 2018, 17(4): 5934–5939.
[8] JUNYUAN Z, HUI X, CHUNLAN H, et al. Quercetin protects against intestinal barrier disruption and inflammation in acute necrotizing pancreatitis through TLR4/MyD88/p38MAPK and ERS inhibition[J]. Pancreatology, 2018, 18(7): 742–752.
[9] GARG P K, SINGH V P. Organ failure due to systemic injury in acute pancreatitis[J]. Gastroenterology, 2019, 156(7): 2008–2023.
[10] SAHA P, SMITH A. TNF-alpha (tumor necrosis factor-alpha)[J]. Arterioscler Thromb Vasc Biol, 2018, 38(11): 2542–2543.
[11] ZHENG M, LI H, SUN L, et al. Interleukin-6 participates in human pancreatic stellate cell activation and collagen Ⅰ production via TGF-beta1/Smad pathway[J]. Cytokine, 2021, 143: 155536.
[12] TAKAHASHI R, MACCHINI M, SUNAGAWA M, et al. Interleukin-1beta-induced pancreatitis promotes pancreatic ductal adenocarcinoma via B lymphocyte- mediated immune suppression[J]. Gut, 2021, 70(2): 330–341.
[13] LIN R, CHEN F, WEN S, et al. Interleukin-10 attenuates impairment of the blood-brain barrier in a severe acute pancreatitis rat model[J]. J Inflamm (Lond), 2018, 15: 4.
[14] NI S Y, ZHONG X L, LI Z H, et al. Puerarin alleviates lipopolysaccharide-induced myocardial fibrosis by inhibiting PARP-1 to prevent HMGB1-mediated TLR4- NF-kappaB signaling pathway[J]. Cardiovasc Toxicol, 2020, 20(5): 482–491.
[15] LI X, SUN S, CHEN D, et al. Puerarin attenuates the endothelial-mesenchymal transition induced by oxidative stress in human coronary artery endothelial cells through PI3K/AKT pathway[J]. Eur J Pharmacol, 2020, 886: 173472.
Puerarin inhibits NF-κB/MAPK signaling pathway in treatment of caerulein- induced acute pancreatitis in mice
Department of Gastroenterology, Pingxiang People’s Hospital, Pingxiang 337000, Jiangxi, China
To investigate the role of puerarin inhibiting nuclear factor κB (NF-κB)/mitogen-activated protein kinase (MAPK) signaling pathway in the treatment of caerulein-induced acute pancreatitis in mice.24 SPF healthy male C57BL/6 mice were randomly assigned into four groups: Placebo group, puerarin group, caerulein group, puerarin + caerulein group. The biological behavior changes of the four groups were observed. The concentrations of serum lipase and amylase, tumor necrosis factor-α (TNF-α), interleukin (IL)-1β, IL-6 and IL-10 were detected. The protein levels of p-NF-κBp65、NF-κBp65、p-IκB-α、IκB-α、p-ERKl/2、ERKl/2、p-p38、p38、p-JNK and JNK in the pancreatic tissues were detected.Compared with the placebo group, there were no significances in the biological behavior, physiological characteristics, pathological index, serum lipase concentration, amylase concentration, TNF-α, IL-1β, IL-6, IL-10 concentration, p-NF-κBp65, NF-κBp65, p-IκB-α, IκB-α, p-ERKl/2, ERKl/2, p-p38, p38, p-JNK, JNK in the pancreatic tissue in puerarin group (>0.05). The pathological index, serum lipase, amylase, TNF-α, IL-1β, IL-6, IL-10 concentration, p-NF-κBp65, p-IκB-α, p-ERKl/2, p-p38, p-JNK protein levels in the pancreatic tissue significantly increased in caerulein group. Compared with caerulein group, symptom relief, pathological index, serum lipase, amylase, TNF-α, IL-6 concentration, pancreatic p-NF-κBp65, p-IκB-α, p-ERKl/2, p-p38 and p-JNK protein levels significantly decreased, while serum IL-10 concentration significantly increased in puerarin + caerulein group.Puerarin can treat caerulein-induced acute pancreatitis by inhibiting NF-κB/MAPK signaling pathway in mice.
Acute pancreatitis; Puerarin; MAPK; Nuclear factor Κb
R332
A
10.3969/j.issn.1673-9701.2023.27.021
江西省中医药管理局科技计划项目(SZYYB20215656)
王桂良,电子信箱:guiliangwang@126.com
(2022–12–06)
(2023–09–02)
