番鸭感染粪肠球菌与沙门氏菌的分离鉴定、遗传进化及耐药基因检测分析
2023-10-17周改玲乔宏兴
周改玲,乔宏兴
(1.河南省商水县动物卫生监督所,河南 商水 466199;2.河南牧业经济学院 动物医药学院,河南 郑州 450046)
粪肠球菌(Enterococcusfaecalis)又称粪链球菌(Streptococcusfaecalis),属于革兰氏阳性兼性厌氧球菌,能长期寄生于动物、食品、植物、水等各种环境[1],是人和动物肠道内的正常菌群,但并不是所有的粪肠球菌都为有益菌,一部分粪肠球菌属于条件致病菌,主要由其毒力因子引起。近年来,由粪肠球菌引起的人及动物感染、死亡的病例增多[2],如引起人传染性心内膜炎、鸡败血症、公猪睾丸炎、家兔腹泻等,可在人与动物之间水平传播[3-5]。沙门氏菌病(Salmonellosis)又称沙门氏菌食物中毒、沙门氏菌性小肠结肠炎等,是由沙门氏菌感染引起的人和各种动物疾病的总称。人感染沙门氏菌临床上主要侵入血液循环及消化道引起伤寒以及急性胃肠炎[6]。动物沙门氏菌感染主要表现为败血症、肠炎和慢性肠炎等[7]。
2021年8月份河南省周口市某鸭场番鸭陆续发病,临床主要表现为精神沉郁、缩脖、采食减少、拉稀等症状,死亡率达20%。本试验从发病死亡番鸭组织中分离出菌株并进行分子生物学鉴定和耐药性分析,以期为鸭源细菌病的预防和治疗提供一定的参考依据。
1 材料与方法
1.1 病料
无菌采集河南省周口市某鸭场死亡的成年番鸭病变肝脏、脾脏组织备用。
1.2 主要试剂
血琼脂平板、SS琼脂培养基、革兰氏染色液、细菌药敏片均购自杭州微生物试剂有限公司;DL2000 DNA Marker、2×Es Taq Master Mix购自康为世纪生物公司;琼脂糖购自HydraGene公司;Gold View I型核酸染色剂购自北京索莱宝公司。
1.3 细菌分离培养与革兰氏染色
用接种环挑取病变组织接种于鲜血琼脂平板和SS琼脂培养平板,37 ℃培养24 h,挑取单菌落进行革兰氏染色。
1.4 分离菌16S rRNA基因序列分析
镜检后的单个菌落进行纯化培养,送上海派诺森基因科技有限公司进行16S rRNA测序,测序结果在GenBank中进行BLAST比对,将与测序菌同源性大于等于99%的菌及几种常见菌16S rRNA序列利用MEGA 6.06软件构建系统进化树及核苷酸同源性分析。
1.5 致病性试验
参考文献[8]将培养好的2种菌液通过平板计数法分别将浓度调整为1×108CFU/mL。试验设1个对照组和3个试验组,每组10只小鼠,对照组腹腔注射0.1 mL无菌液体培养基,试验1组注射0.1 mL菌株Ⅰ菌液,试验2组注射0.1 mL菌株Ⅱ菌液,试验3组腹腔注射0.1 mL菌株Ⅰ和Ⅱ混合菌液,在保证饲养条件相同的情况下观察7 d并记录小鼠发病及死亡情况,并对死亡小鼠的脏器进一步分离鉴定。
1.6 药敏试验
通过k-B法[9]测定分离菌的耐药性,记录抑菌圈直径大小,根据药敏片说明书的抑菌范围标准判定。
1.7 耐药基因PCR鉴定
根据于美美等[10]、杨芳芳[11]的研究合成四环素类(TetO、TetS、TetL)、氨基糖苷类(aph(3")-IIa、ant(3")-Ia、aac(6')-Ib)耐药基因引物核酸序列6对。引物由上海生工生物工程有限公司合成,具体见表1。

表1 耐药基因引物序列
从分离菌株的培养平板挑取单菌落接种到TSB及LB液体培养基中,置于37 ℃恒温摇床中培养24 h。利用水煮法提取细菌DNA。以各菌DNA为模板进行PCR扩增,反应体系为:2×Es Taq Master Mix 10 μL,F/R引物(10 μmoL)各0.5 μL,细菌DNA 2 μL,ddH2O 7 μL。PCR程序:预变性95 ℃ 10 min,变性95 ℃ 30 s;退火(温度见表1)30 s;延伸72 ℃ 40 s,35个循环,终延伸72 ℃ 10 min。将PCR扩增产物进行1%的琼脂糖凝胶电泳。符合预期大小的核酸条带胶回收后送上海生工生物工程有限公司进行测序。
2 结果与分析
2.1 细菌分离培养与革兰氏染色
将番鸭病变组织划线培养后发现,鲜血琼脂培养平板长出一种灰白色、湿润光滑、凸起的圆形菌落(图1A),菌落周围形成ɑ溶血环,革兰氏染色直径为0.4~1.0 μm,呈球形或椭圆形、单个、双个或链状存在的阳性球菌,无芽孢、无荚膜(图1C),符合粪肠球菌特征,命名为HN2021Ef菌株;SS培养平板上长出一种无色透明、表面光滑、湿润、中心有黑点的菌落(图1B),革兰氏染色镜鉴观察为短杆阴性菌(图1D),符合沙门氏菌特征,命名为HN2021Sa菌株。
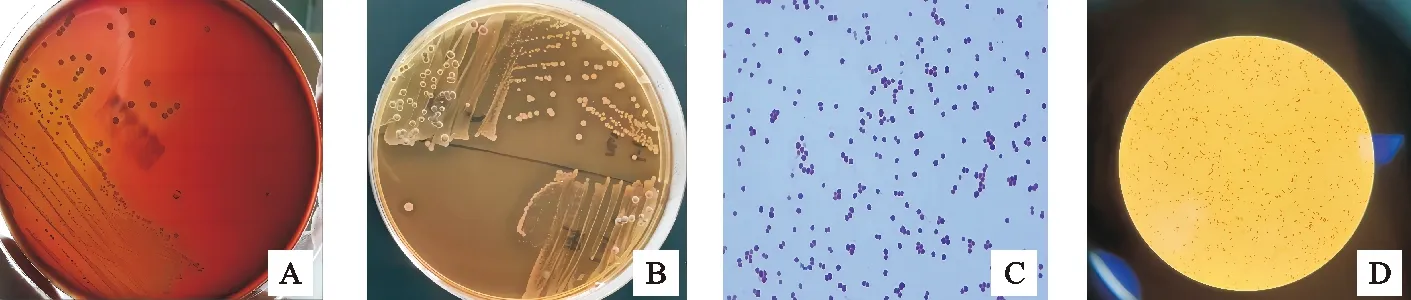
图1 细菌分离及镜鉴结果
2.2 分离菌16S rRNA基因序列分析
将分离的HN2021Ef菌株纯化后送公司测序,用NCBI Blast程序将拼接后的序列与NCBI 16S数据库中的序列进行比对,结果显示,HN2021Ef与粪肠球菌(序列号JQ388685.1)相似性达100%,且与其它粪肠球菌株的同源性均大于99%,根据不同属细菌16S rRNA基因同源性为70%~90%,而同一种内不同株间基因同源性>99%[12],确定该细菌为粪肠球菌(Enterococcusfaecalis)。同时将与待测目的序列同源性大于99%的11个菌株及沙门氏菌、鸭疫里默氏杆菌、大肠杆菌、链球菌、多杀性巴氏杆菌参考毒株的16S rRNA基因序列用软件MEGA 6.06进行多序列匹配排列,以Neighbor-Joining方式进行同源性比较,并绘制进化树。结果发现本菌与11种粪肠球菌均在一个分支中,而沙门氏菌、鸭疫里默氏杆菌、大肠杆菌、链球菌、多杀性巴氏杆菌与本菌株均不在一个分支,同源性差异很大,具体见图2、图3。

图2 粪肠球菌HN2021Ef株16S rRNA分析结果
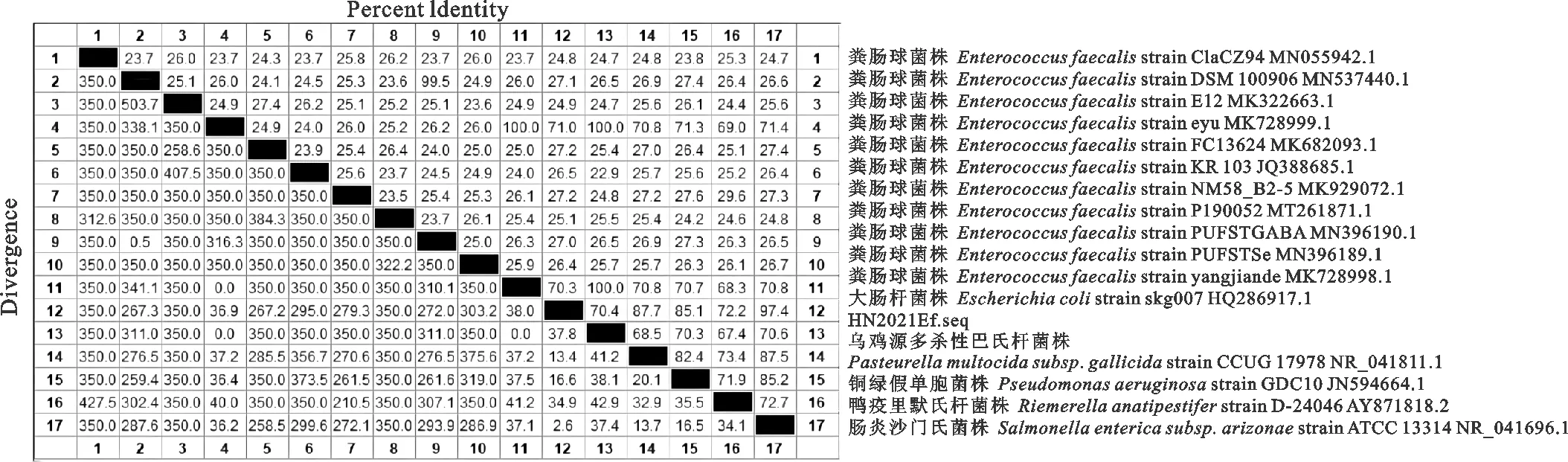
图3 粪肠球菌HN2021Ef株16S rRNA基因核苷酸序列同源性分析
同样将分离的HN2021Sa菌种纯化后送公司测序,测序结果与NCBI 16S数据库中的序列进行比对,结果显示,最靠前的30多个序列均为禽沙门氏菌,与该菌的相似性均为99.93%,确定该细菌为沙门氏菌[12]。将与待测物种序列同源性大于99%的任意5个菌株及选取的鸭疫里默氏杆菌、大肠杆菌、链球菌、多杀性巴氏杆菌的16S rRNA基因序列用软件MEGA 6.06进行同源性比较,并绘制进化树。结果发现本菌与5种禽沙门氏菌均在一个分支中,而鸭疫里默氏菌、大肠杆菌、链球菌、多杀性巴氏杆菌等菌株与本菌株均不在一个分支,同源性差异很大,具体见图4、图5。

图4 沙门氏菌HN2021Sa株16S rRNA分析结果

图5 沙门氏菌HN2021Sa株16S rRNA基因核苷酸序列同源性分析
2.3 致病性试验结果
小鼠感染沙门氏菌,24 h后均陆续出现精神萎顿、聚堆、拉稀便等症状,36 h后陆续出现死亡,7 d后死亡3只。小鼠感染粪肠球菌后,12 h出现精神沉郁,食欲减退症状,156 h后死亡1只,其余小鼠恢复正常。而混合感染的小鼠在8 h后均陆续出现嗜睡、腹泻、食量减少等症状,24 h出现死亡,7 d后死亡5只。对照组小鼠均无异常。具体结果见表2。分离3组试验组死亡小鼠肝脏培养细菌,经鉴定1组为沙门氏菌,2组为粪肠球菌,3组为沙门氏菌和粪肠球菌。

表2 2种分离菌对小鼠致病性结果
2.4 药敏试验
对分离的沙门氏菌菌株和粪肠球菌菌株进行药敏试验,结果表明,沙门氏菌对头孢噻肟、氟苯尼考、阿莫西林3种药物敏感;对环丙沙星、安普霉素、氨苄西林、硫酸黏菌素、替米考星5种药物中度敏感;对庆大霉素、多西环素2种药物完全耐药。粪肠球菌对环丙沙星、庆大霉素、安普霉素、头孢噻肟、氟苯尼考、林可霉素、阿莫西林、替米考星8种药物敏感;对氨苄西林、硫酸黏菌素2种药物中度敏感,对多西环素1种药物完全耐药,具体结果见表3。
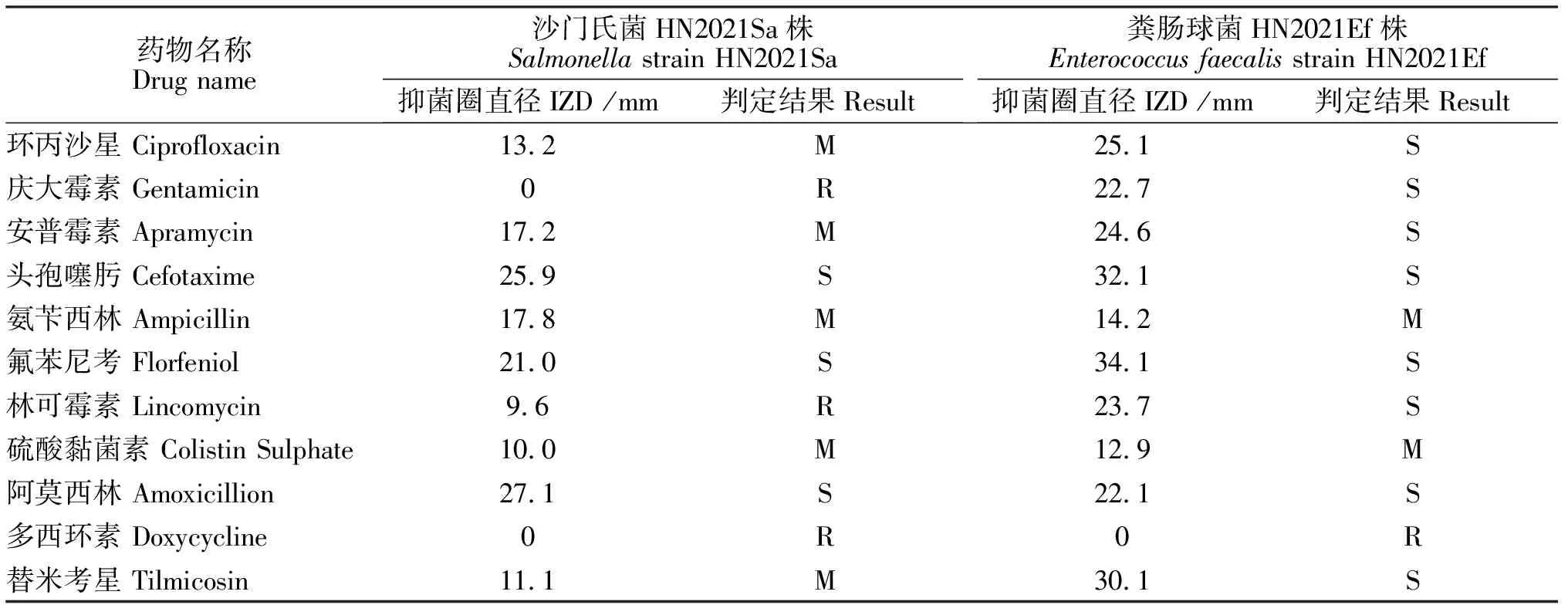
表3 粪肠球菌菌株及沙门氏菌菌株药敏试验结果
2.5 耐药基因分析
在对沙门氏菌及粪肠球菌耐药基因进行检测后发现沙门氏菌检出四环素TetO、TetS耐药基因及氨基糖苷类ant(3")-Ia耐药基因,粪肠球菌检出四环素TetL耐药基因,具体结果见图6。
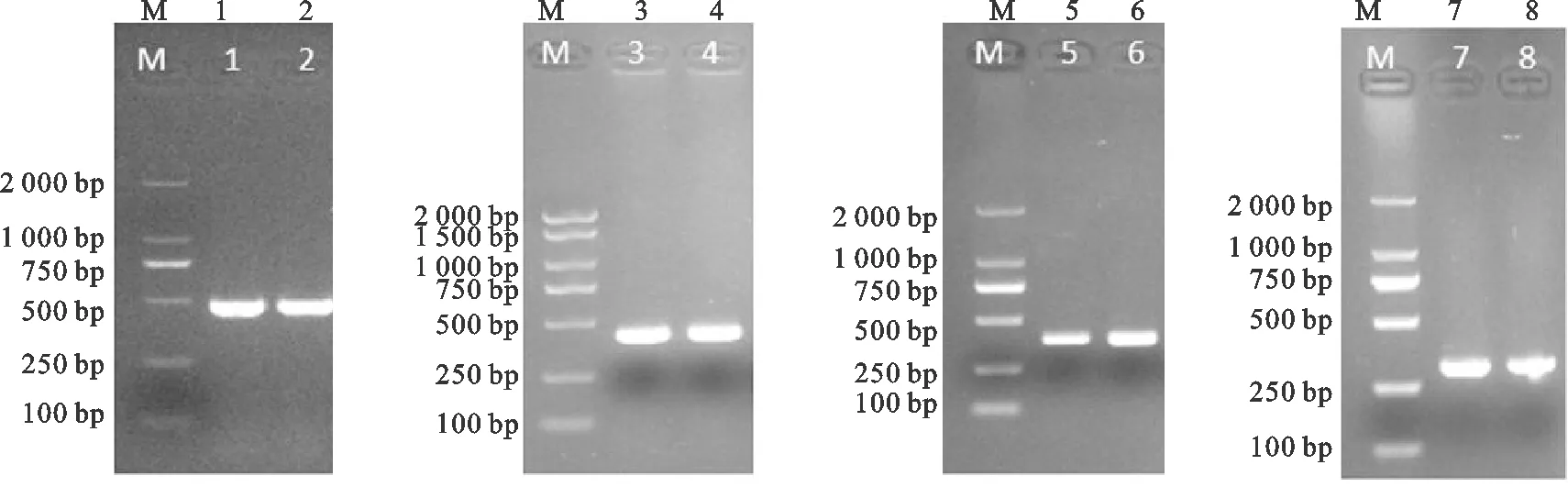
图6 粪肠球菌和沙门氏菌菌株四环素类耐药基因电泳结果
3 讨 论
本试验从病变番鸭组织中分离鉴定出沙门氏菌及粪肠球菌,经16s rRNA序列测序分析,发现分离的2种菌株与沙门氏菌及粪肠球菌的同源性最高。其系统发育树与核苷酸序列同源性分析结果表明,不同物种、不同地域、不同时间上分离的沙门氏菌及粪肠球菌其差异性较小,但不同种属菌株之间存在一定的差异性,从分子水平上证实分离的2株不同形态的菌株分别为粪肠球菌和沙门氏菌。
关于细菌耐药问题在畜禽养殖业中一直普遍存在,不合理的用药方案和药物泛滥使用,加速耐药菌株的出现。本研究药敏试验结果显示,样品中分离的沙门氏菌对多西环素和庆大霉素均完全耐药,分离出的粪肠球菌对多西环素完全耐药,分离出的2种菌对其余几种抗生素出现了不同程度的耐受性。同时本试验对分离的沙门氏菌分别进行四环素类(TetO、TetS、TetL)耐药基因和氨基糖苷类(aph(3")-IIa、ant(3")-Ia、aac(6')-Ib)耐药基因检测,结果发现沙门氏菌菌株检测到TetO、TetS、ant(3")-Ia耐药基因。TetO和TetS属于四环素耐药机制中的核糖体保护蛋白,该蛋白能保护核糖体不被四环素作用,使细菌具有抵抗多西环素等的能力[13]。氨基糖苷类核苷转移酶(ANT)属于氨基糖苷类钝化酶类之一。邓飞等[14]研究表明由沙门氏菌的耐药基因编码的氨基糖苷类修饰酶可对氨基糖苷类的结构进行修饰,使其失活而无法作用于沙门氏菌,这是介导氨基糖苷类耐药的主要机制。李少博等[15]认为,沙门氏菌的耐药性是由于编码沙门氏菌某些成分的基因发生突变而造成的,而抗性基因的嵌入及通过基因的转移也能导致细菌耐药性不断增强。本试验对分离的粪肠球菌进行四环素类(TetO、TetS、TetL)耐药基因检测,结果发现粪肠球菌菌株中出现TetL耐药基因。TetL属于四环素耐药机制中的外输泵蛋白第2群蛋白,主要存在于革兰氏阳性菌中,Tet外输泵基因编码的相关膜蛋白可将四环素泵出胞外,降低了细胞内保护核糖体的药物浓度,从而产生耐药[13]。因此在畜禽养殖业中,对抗生素的使用要给予足够的重视,特别是因抗生素的滥用,多重耐药菌株大量出现,且产生的因素复杂,控制难度大[16]。因此检测细菌的耐药性有助于全面掌握耐药性的流行规律,也为畜禽抗菌药物的合理使用提供警示和科学合理的依据。
关于动物单独感染粪肠球菌及沙门氏菌的报道很多,陈一资等[17]发现由粪链球菌感染的肉鸭爆发传染病,且死亡率很高。李慧等[2]将不同剂量的粪肠球菌人工感染小鼠,发现小鼠脑部呈现不同程度的血脑屏障损伤。井郁金等[18]发现某羊场由于金黄色葡萄球菌与粪链球菌混合感染导致该羊群体温升高、咳嗽,发病不断。沙门氏菌主要发生于雏鸭等幼禽的急性细菌传染病[19-21]。本试验采样的鸭场在疫病发生后经实验室检测,排除病毒性疾病感染,从肝脏中分离出致病性的沙门氏菌和粪肠球菌,致病性试验结果表明混合感染2种菌的小鼠死亡率增加。分析原因发现该鸭场每个鸭舍饲养密度太大,空气流通不畅,臭味熏天,苍蝇较多,且鸭舍湿度较大,极利于有害细菌的繁殖。动物机体是一个免疫力和病原体互相抗衡和较量的环境,如果机体免疫力较高,即便有病原体存在,机体也处于一个平衡稳定的状态。但如果因某种因素而导致免疫力下降,大量的病原体将会侵入宿主并繁殖,黏附于宿主细胞,分泌毒性物质破环细胞组织,感染动物使其发病。因此推测该鸭场此次发病与鸭场环境不良导致鸭群抵抗力下降有关,引起粪肠球菌及沙门氏菌混合感染对鸭群造成影响。但目前鲜有关于动物混合感染粪肠球菌及沙门氏菌的报道,对于感染发病后哪种菌是原发、哪种菌是继发还需要更深入的研究。本试验对2种菌进行了耐药分析,也为该鸭场对症用药提供参考。
4 结 论
本试验从死亡成年番鸭肝脏中成功分离致病性粪肠球菌和致病性沙门氏菌。沙门氏菌对多西环素、庆大霉素耐药,且检出四环素类TetO、TetS耐药基因及氨基糖苷类ant(3")-Ia耐药基因。粪肠球菌对多西环素耐药,且检出四环素类TetL耐药基因。
