miR-1-3p对乾华肉用美利奴羊次级毛囊发育相关基因的调控研究
2023-10-17张桂山张英楠杨树宝姜怀志
张桂山,张英楠,杨树宝,徐 晶*,姜怀志
(1.吉林医药学院 公共卫生学院,吉林 吉林 132013;2.吉林医药学院 基础医学院,吉林 吉林 132013;3.吉林农业大学 动物科学技术学院,吉林 长春 130118)
乾华肉用美利奴羊是以南非肉用美利奴羊公羊为父本,以当地导入澳美基因的东北细毛羊为母本,采用级进杂交方法系统选育而成的绵羊新品种,是一个典型的肉毛兼用型细毛羊品种,不但具有优质的肉用性能,同时也可产出优质的以毛纤维直径19.0~21.5 μm为主体的同质细羊毛,成年公羊、母羊的剪毛量分别可达7.51±1.65 kg和6.82±1.35 kg[1]。羊毛,尤其是细羊毛作为高档的纺织原料,在全球纺织工业中占有重要的地位。获得量多质优的细羊毛和羊肉也是目前羊品种选育追求的重要经济指标。毛囊,尤其是次级毛囊直接决定了细羊毛的产量和羊毛质量。miRNA作为生殖发育[2-3]、细胞增殖分化[4-6]、凋亡[7-8]、代谢[9]、毛囊发育相关信号等[10]重要的调节器,在毛囊周期性发育过程中扮演着重要的角色,其可以通过作用于对毛囊周期性发育具有重要作用的靶基因来调节毛囊的周期性发育。目前关于羊毛囊发育的研究主要集中在羊毛囊发生发育相关基因的验证,而有关从miRNA-靶基因mRNA-靶蛋白的角度阐述其对毛囊周期性发生发育作用的研究仍然不是很系统。课题组前期研究发现miRNA-1-3p的表达在绒山羊毛囊周期的生长期低于休止期,miRNA-1-3p通过靶向FGF14调控辽宁绒山羊毛囊发育[11]。因此,为进一步明确乾华肉用美利奴羊产毛的分子机制,本研究从乾华肉用美利奴羊次级毛囊生长期和休止期呈现显著差异表达的miRNA入手,通过生物信息学方法,对呈现差异表达且影响细胞增殖的miR-1-3p进行了靶基因预测及验证,通过miRNA及其靶基因在毛囊不同发育时期的表达规律,进一步明确miRNA及其靶基因在毛囊周期性发育过程中的重要作用,为明确乾华肉用美利奴羊产毛的分子机制奠定研究基础。
1 材料与方法
1.1 样品采集
采集2周岁乾华肉用美利奴羊母羊(每个毛囊发育时期选取5只)次级毛囊生长期(9月份)和休止期(5月份)的肩胛部皮肤样品1 cm2,放入液氮中,用于总RNA及总蛋白的提取。
1.2 方法
1.2.1 乾华肉用美利奴羊皮肤毛囊总RNA的提取 按照TaKaRa Trizol说明书提供的方法提取总RNA,用Agilent2100检测总RNA质量。
1.2.2 生物信息学预测和分析 采用miRNA在线靶基因预测软件Targetscan v7.0、miRanda和RNA22对miR-1-3p靶基因进行预测。
1.2.3 miR-1-3p及其候选靶基因FGF14mRNA相对表达量测定 采用SYBR法对miR-1-3p及其候选靶基因FGF14进行荧光定量PCR检测。采用2-△△CT计算法对荧光定量PCR数据进行分析来检测miR-1-3p及其候选靶基因FGF14mRNA的相对表达量。
1.2.4 Western blot定量分析 按照全蛋白提取试剂盒(江苏凯基生物技术股份有限公司产品)说明书提取乾华肉用美利奴羊皮肤毛囊组织总蛋白,将总蛋白样品与5×上样缓冲液混合变性,取40 μg样品上样。半干转膜,5%脱脂奶粉室温封闭2 h。一抗(1∶1500 TBST稀释)4 ℃过夜,二抗(1∶2000 TBST稀释)室温孵育1 h,ECL化学发光,曝光。采用Image-Pro Plus 6.0分析目标蛋白条带的积分光密度值(IOD),利用统计软件SPSS 17.0对数据进行单因素方差分析。
1.2.5 双荧光素酶报告基因试验 将野生型和突变型候选靶基因靶位点及其两端部分序列片段连接到双荧光素酶报告载体psiCHECK-2上,按照优化浓度,将mimics、脂质体、质粒DNA、阴性对照和100 ng/孔野生型及突变型表达载体分别加入到Opti-MEM中稀释,阴性对照浓度参照mimics浓度,将稀释好的mimics和阴性对照、质粒DNA分别与脂质体混匀,放置15~20 min,将混合物滴加到生长良好的HEK293T/17细胞培养液中,6 h后换正常细胞生长培养液,转染48 h后收集细胞检测双荧光素酶活性。
1.3 统计学分析
数据采用SPSS 20.0 软件进行统计整理和t检验,P<0.05表示差异显著,具有统计学意义。
2 结果与分析
2.1 样品总RNA质量分析
2个样品总RNA的OD260/280分别为1.89和1.95,OD230/260分别为1.92和1.97,28S/18S分别为1.6和1.7,Agilent 2100分析RIN结果分别为8.7和8.6,浓度大于1800 ng/μL,说明乾华肉用美利奴羊两个次级毛囊样品的总RNA纯度高,质量好,可以用于荧光定量PCR检测。
2.2 miR-1-3p靶基因预测结果
由表2可见,FGF14同时被3个在线靶基因预测软件Targetscan v7.0、RNA22 v2.0和MiRanda(2010)预测到。

表1 总RNA质量分析

表2 3个靶基因预测软件预测的候选靶基因
2.3 miR-1-3p及其候选靶基因FGF14 mRNA相对定量表达
由图1可见,miR-1-3p相对表达量在生长期低表达,休止期高表达;图2显示,FGF14mRNA在生长期高表达,休止期低表达。miR-1-3p与其靶基因在生长期和休止期呈现负调控关系。
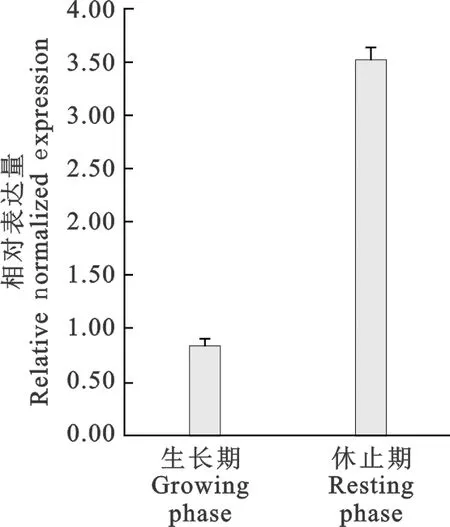
图1 miR-1-3p的相对表达量

图2 FGF14 mRNA相对表达量
2.4 靶基因FGF14蛋白相对定量表达
由图3可见,FGF14蛋白在生长期高表达,在休止期低表达,表达趋势与FGF14mRNA一致。
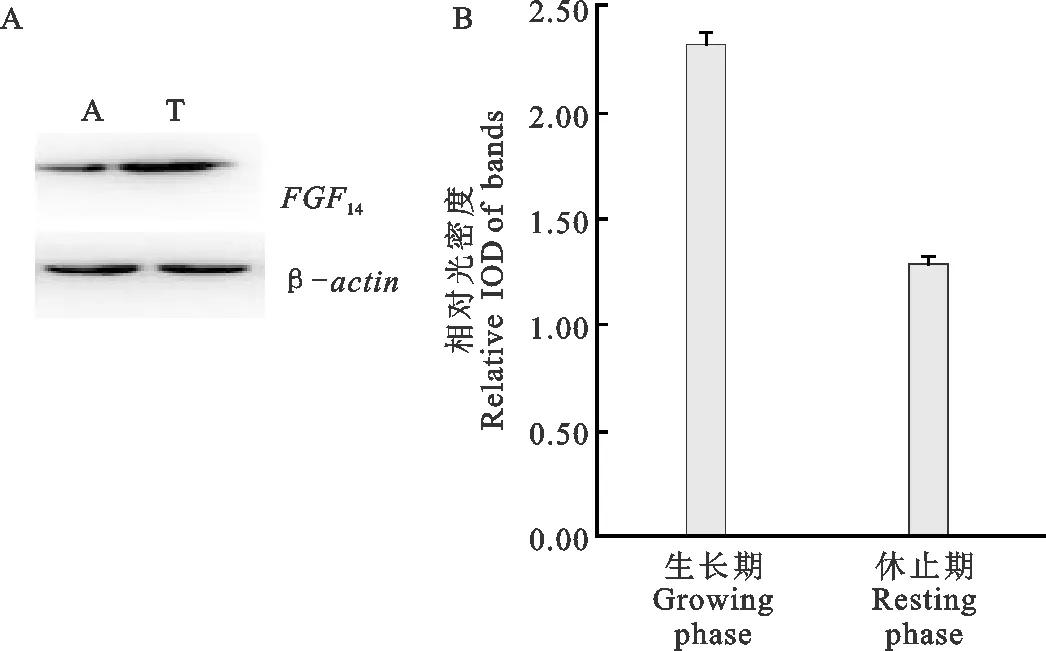
图3 FGF14蛋白表达
2.5 双荧光素酶报告基因检测
图4显示,共转染miR-1-3p mimics和FGF14-Luc及miR-1-3p mimics和FGF14-Mut-Luc后,共转染miR-1-3p mimics和FGF14-Luc组的荧光素酶活性显著低于阴性对照组(P<0.05),而共转染miR-1-3p mimics和FGF14-Mut-Luc组的荧光素酶活性与阴性对照组无显著差异(P>0.05),说明miR-1-3p mimics能够抑制野生型FGF14的靶位点报告载体的荧光素酶活性。但当靶基因结合位点突变后(转染突变型表达载体),FGF14被抑制的荧光素酶活性能够得到恢复,说明FGF14是miR-1-3p的靶基因。
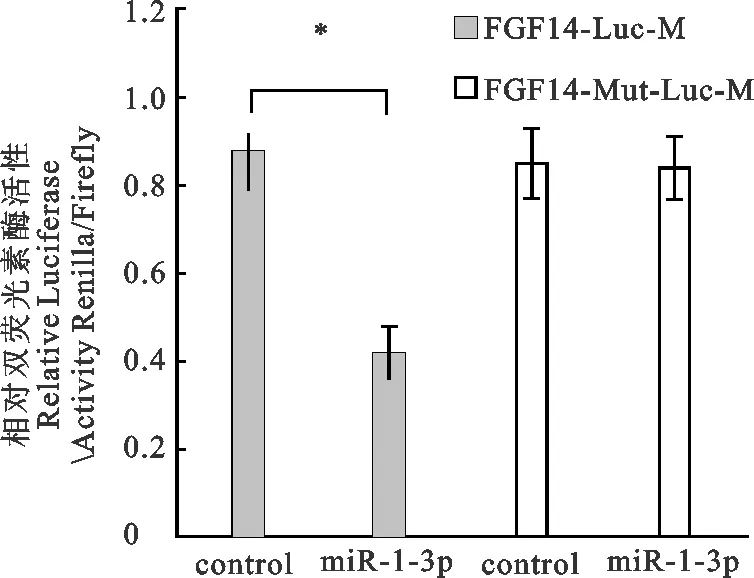
图4 FGF14双荧光素酶报告分析
3 讨 论
miRNA在组织及细胞中时空差异性表达的特点决定了其在组织细胞中发挥的差异性调控作用,如调控细胞更新、分化发育、凋亡等,而miRNA正是通过对其靶基因的调控作用而发挥此功能。miRNA对毛囊发生发育的作用正是通过其对靶基因的调控作用实现对毛囊周期性发育的调控作用。MA等[12]研究发现miRNA-203的表达显著下调其靶基因酶寡糖基转移酶(DDOST)和E1NEDD8激活酶(NAE1)的mRNA和蛋白表达,从而实现其对辽宁绒山羊毛囊周期性发育的调控作用,这与本研究miR-1-3p通过负调控其靶基因FGF14mRNA和蛋白的表达实现对乾华肉用美利奴羊皮肤毛囊周期性发育调控机制一致。目前研究人员多采用双荧光素酶报告试验验证miRNA与其候选靶基因的靶向调控关系,Hai等[13]采用双荧光素梅报告试验确定了转化生长因子β受体2 (TGF-βR2)和成纤维细胞生长因子受体2 (FGFR2)为Chi-miR-370-3p的靶基因,Chi-miR-370-3p还通过调控上皮细胞和真皮成纤维细胞中TGF-βR2和FGFR2的mRNA水平表达和蛋白水平的表达实现对内蒙古绒山羊不同胎儿期的毛囊发育,进一步DNA染色、细胞增殖试验结果表明,Chi-miR-370-3p促进上皮细胞和成纤维细胞迁移。Qu等[14]研究发现miR-125b通过负调控其靶基因MXD4和FGFR2的表达实现对细毛羊和绒山羊的毛囊分化发挥作用。miRNA也可以通过其靶基因实现对某些信号通路的调控作用,Zhao等[15]研究发现miRNA-181a-5p通过作用于wnt靶向抑制剂wnt抑制因子1(WIF1)激活Wnt/β-catenin信号通路,从而调节通路基因和蛋白的表达,实现抑制真皮乳头细胞凋亡,促进增殖;Luo[16]研究发现miR-203a-3p负向调控Smad1的表达,促进龙血素A诱导的毛囊干细胞的分化,实质是在BMP/Smad1信号通路中,miR-203a-3p降低Smad1的表达,从而减轻BMP对毛囊干细胞分化的抑制作用。Feng[17]研究发现miR-31-5p可通过作用其靶基因RASA1,上调RASA1/MAP3K1信号通路中MAP3K1的表达水平,达到显著促进山羊毛囊干细胞增殖,抑制凋亡。研究发现FGF14同样在某些信号通路中起着重要作用,Su[18]研究发现FGF14通过抑制PI3K/AKT/mTOR通路在结直肠癌中作为肿瘤细胞抑制因子,在直肠癌细胞系中具有抑制细胞活力的作用;Pablo[19]研究发现FGF14是KCNQ2/3通道的正向调节器,FGF14敲除导致全细胞KCNQ通道电流减少,说明FGF14在细胞中发挥了重要的功能作用。Ke[20]研究发现miR-1-3p可通过其靶基因STC2抑制癌细胞增殖。FGF11亚家族成员包括FGF11/12/13/14,而FGF13可能对于毛囊的自我更新有一定的作用,诱导毛囊从休止期向生长期过渡,FGF14也是FGF11亚家族成员之一[21],目前关于FGF14与毛囊发育相关的研究文献鲜有报道,前期研究发现FGF14在辽宁绒山羊毛囊生长期高表达,休止期低表达,其表达规律与本研究中FGF14在乾华肉用美利奴羊表达规律一致,说明miR-1-3p可能通过负调控FGF14的表达,参与诱导毛囊从休止期向生长期过渡[12]。
4 结 论
FGF14在乾华肉用美利奴羊毛囊生长期高表达,休止期低表达,说明其可以作为乾华肉用美利奴羊毛囊周期性新生的分子标记物,而FGF14是miR-1-3p的靶基因,miR-1-3p可能正是通过负调控FGF14的表达,参与诱导乾华肉用美利奴羊毛囊从休止期向生长期过渡。
