亚洲柑桔间座壳菌生长条件及纳米试剂室内毒力研究
2023-10-17姚廷山莫其会钟林宇胡军华晏承泉李庆春杨颜芳
姚廷山,莫其会,钟林宇,胡军华,晏承泉,李庆春,杨颜芳
(1 西南大学柑桔研究所,重庆,400712;2 西南大学植物保护学院,重庆,400716)
柑桔是我国重要的经济作物。近年,由子囊菌门真菌柑桔间座壳菌Diaporthecitri(无性态为柑桔拟茎点霉菌Phomopsiscitri,属于半知菌类拟茎点霉属)侵染引发的病害发展成为我国柑桔主要病害,因受害部位及症状不同,分别被称为砂皮病(侵染叶片、小枝及幼果,患病组织表面常有紫褐色至黑褐色硬质、略突出的胶点,呈现为砂皮状)、树脂病(侵染枝干)、蒂腐病(侵染贮藏期果实)。防控该病原菌的为害主要依靠化学防治,三唑类、多菌灵、甲基硫菌、吡唑醚菌酯等杀菌剂效果良好[1-4]。目前我国农药剂型主要为乳油和可湿性粉剂等,载药颗粒大,分散性能差,导致农药易流失,利用率不高。近年来,纳米材料在农业生产上得到应用,纳米试剂可以改善农药对靶标的亲和性,减少流失与分解,控制药物释放速率,延长持效期,降低其在非靶标区域和环境中的投放量与残留污染,从而实现农药的减量增效[5-6]。本试验从重庆市长寿区“爱媛38”(现在普遍被称为“红美人”)杂柑园采集典型砂皮病叶,分离纯化及鉴定病原菌,研究其生物学特性,筛选对其具抑制作用的纳米药剂,以期为防控该菌侵染为害提供参考。
1 材料与方法
1.1 材料
2021年4—5月从重庆市长寿区“爱媛38”柑桔园采集砂皮病典型症状病叶。
培养基包括马铃薯葡萄糖琼脂培养基(PDA,马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 L)、马铃薯蔗糖培养基(PSA,马铃薯200 g,蔗糖20 g,琼脂20 g,蒸馏水1 L)、胡萝卜琼脂培养基(CA,胡萝卜200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 L)、燕麦琼脂培养基(OA,燕麦片30 g,琼脂15 g,蒸馏水1 L)、Czapek培养基(硝酸钠2 g,磷酸氢二钾1 g,氯化钾0.5 g,硫酸亚铁0.01 g,硫酸镁0.5 g,蔗糖30 g,琼脂20 g,水1 L)[7]。
纳米试剂包括土霉素碳量子点(OTC-CQDs)纳米试剂(西南大学柑桔研究所提供)、SiO2纳米试剂(山东农业大学植物保护学院提供)和星状阳离子聚合物(SPc)纳米载体(中国农业大学植物保护学院提供)。
杀菌剂包括32%噻呋·氟环唑SC(山东省青岛瀚生生物科技股份有限公司生产)、430 g/L戊唑醇SC(拜耳股份公司生产)和40%吡唑醚菌酯·喹啉铜SC(江西中迅农化有限公司生产)。
1.2 方法
1.2.1 病原菌分离与鉴定 采用组织分离法[7],在病叶上取病健交界处组织3~4块,消毒后放于PDA培养基上28 ℃恒温培养7 d,纯化分离菌株,然后接种于PDA培养基上24 ℃培养7 d,观察菌落培养性状、产孢结构、分生孢子形态特征等。
采用科赫氏法则鉴定分离菌株的致病性。将分离菌株培养7 d后,接种菌饼在柑桔果实刺伤处,以接种无菌PDA培养基为对照。使用无菌水浸湿脱脂棉保湿,28 ℃培养24 h后观察症状。取接种果实发病处组织再次分离病菌,与接种菌进行比较[8]。
提取分离菌株DNA进行分子鉴定。用灭菌的直径5 mm的打孔器取菌饼,接种于PDA培养基上24 ℃恒温保湿培养。当菌落扩展到培养皿的2/3时,用灭菌的接种铲轻轻地刮取菌丝,置于灭菌研钵中加入液氮充分研磨,至粉末状。用灭菌药匙将菌丝粉末转移到灭菌的1.5 mL离心管中,采用真菌DNA提取试剂盒提取菌株DNA,然后利用真菌通用引物ITS1/ITS4对菌株进行PCR扩增[9]。PCR反应体系含有2×Taq PCR MasterMix 12 μL,引物ITS1 1 μL,引物ITS4 1 μL,模板DNA 2 μL,ddH2O 9 μL。PCR反应程序为94 ℃预变性4 min→(94 ℃变性1 min,56 ℃退火1 min,72 ℃延伸1 min,35个循环)→72 ℃延伸10 min。扩增产物于4 ℃保存。将扩增产物进行1%琼脂糖凝胶电泳检测浓度,然后用紫外凝胶成像系统观察,检测到单一清晰的条带,纯化后送测序公司测序。对测序所得序列,在NCBI(http://www.ncbi.nlm.gov)数据库中进行BLAST同源性比对,然后基于GenBank中报道的其他病原菌的序列信息,利用最大似然法(Maximum Likehood,ML)通过MEGA4.1软件构建系统发育树。
1.2.2 病原菌生物学特性 设置不同的碳源、氮源、光照、温度及pH值[10-11]等,观测不同培养条件对分离菌株菌丝生长的影响。
培养基的影响:将直径5 mm的菌饼接种在PDA、PSA、CA和OA平板上,将接种好的平板倒置在25 ℃恒温培养箱中培养,每个处理重复3次,培养7 d后观察培养性状,用十字交叉法测菌落直径,计算菌丝生长速度。
碳源的影响:基础培养基为Czapek培养基,把Czapek培养基的蔗糖分别换为相同碳量的乳糖、甘油、麦芽糖、可溶性淀粉和甘露醇葡萄糖,以配制不同碳源的培养基,接种直径5 mm菌饼,每处理重复4次,25 ℃恒温培养箱培养3 d后用十字交叉法测量菌落直径,培养10 d后观察培养性状。
氮源的影响:基础培养基为Czapek培养基,把Czapek培养基的硝酸钠分别换为相同氮量的尿素、蛋白胨、赖氨酸、甘氨酸和氯化铵,以配制不同氮源培养基,接种直径5 mm菌饼,每处理重复4次,25 ℃恒温培养箱培养3 d后用十字交叉法测量菌落直径,培养10 d后观察培养性状。
光照的影响:将直径5 mm菌饼接种PDA平板上,置于25 ℃恒温培养,分别设置24 h全光照、12 h光暗交替和24 h全黑暗培养等光照条件,每处理组重复4次,培养3 d后用十字交叉法测量菌落直径,培养10 d后观察培养性状。
温度的影响:将直径5 mm菌饼接种到PDA上,分别置于15、20、25、30、35 ℃等温度条件下进行完全黑暗培养,每处理重复4次,培养2 d后用十字交叉法测量菌落直径,培养7 d后观察培养性状。
pH值的影响:PDA培养基灭菌后,在无菌条件下利用盐酸和氢氧化钠溶液将PDA培养基pH值分别调为5、6、7、8和9,制成不同pH值的平板,接种直径5 mm菌饼,每处理重复4次,25 ℃恒温培养箱培养2 d后用十字交叉法测量菌落直径,培养7 d后观察培养性状。
1.3 不同试剂对病菌抑制作用测定
供试各纳米试剂和抑菌剂各配成一定浓度溶液,分别与PDA混合制成含药平板,使含药平板中供试药剂最终浓度分别为10、1、0.1、0.01、0.001 μg/mL等5个浓度处理,以加入等量无菌水的培养基为对照,每处理重复3次,接种直径8 mm菌饼于平板中央,28 ℃恒温培养7 d后,采用十字交叉法测量菌落直径,计算各处理菌丝生长抑制率。抑制率(%)=[(对照菌落直径-药剂处理菌落直径)/(对照菌落直径-8)]×100。使用GraphPad prism 8软件统计分析数据,将药剂浓度换算成浓度对数(x),菌丝生长抑制率换算成抑制概率值(y),计算毒力回归方程、相关系数(r)及抑制中浓度(EC50)[12]。
2 结果与分析
2.1 病原菌分离与鉴定
2.1.1 形态学鉴定 从采集病样中,分离和纯化培养获得3个分离物,分别接种于PDA上24 ℃培养,观察病菌形态特征和分生孢子。其中,S2菌株的菌落白色,有花瓣状轮纹,气生菌丝与培养基上菌丝较为发达,未产生分生孢子。应用菌饼接种法接种分离菌株于刺伤柑桔果实上,S2菌株可产生明显的砂皮病症状,且从发病组织上再分离得到的菌与接种菌相同(见图1)。

图1 柑桔砂皮病叶分离所得S2菌株在PDA培养基上的菌丝形态及菌落形态
2.1.2 分子鉴定 利用rDNA-ITS序列在NCBI数据库进行同源性比对,结果显示S2菌株与Diaporthecitriasiana(KJ490616.1、MN816406.1)的同源性为100%。系统进化分析结果显示,S2菌株与Diaporthecitriasiana(亚洲柑桔间座壳)聚类到一起,形成明显分支(图2)。
综合菌株的培养性状、形态特征和rDNA-ITS序列比对结果,将S2菌株鉴定为Diaporthecitriasiana。
2.2 病菌生物学特性
2.2.1 培养基的影响 试验结果看出,S2菌株在4种供试培养基上均能生长,但菌丝形态和扩展速度存在差异。在OA上,菌落白色,边缘棉絮状,无轮纹,菌丝稀薄,菌丝扩展速度最快,培养7 d,菌落直径达到55.50 mm。在CA上,菌落灰色,边缘白色、棉絮状,具花瓣状轮纹,菌丝旺盛,菌丝扩展速度最慢,培养7 d菌落直径为44.05 mm。在PDA上,菌落白色,边缘规则,具花瓣状轮纹,菌丝旺盛,培养7 d菌落直径54.80 mm。在PSA上,菌落中心棕色,边缘棉絮状,无轮纹,菌丝稀薄,培养7 d菌落直径52.33 mm(见图3)。
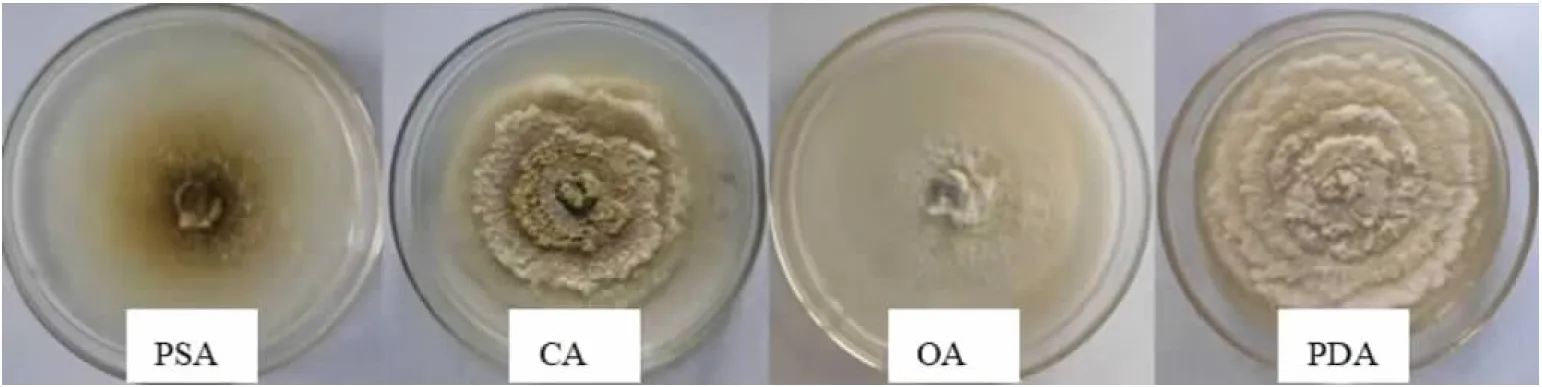
图3 柑桔砂皮病叶分离所得S2菌株在不同培养基上培养7 d的菌落形态
2.2.2 碳源的影响 在不同碳源Czapek培养基上,S2菌株均能生长,但菌落形态和菌丝扩展速率存在差异。碳源为可溶性淀粉时培养10 d的菌落直径63.50 mm,碳源为蔗糖处理时培养10 d的菌落直径仅44.75 mm,两者差异显著(见表1和图4)。

表1 柑桔砂皮病叶分离所得S2菌株在不同碳源Czapek培养基上培养10 d菌落生长情况
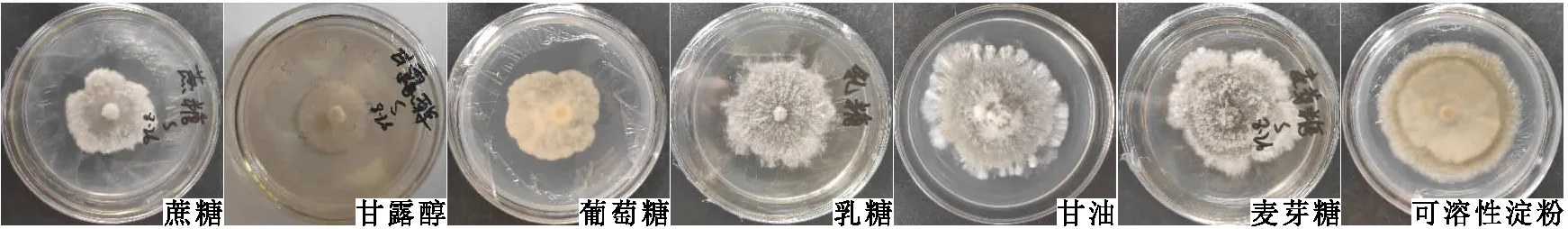
图4 柑桔砂皮病叶分离所得S2菌株在不同碳源Czapek培养基上培养10 d的菌落形态
2.2.3 氮源的影响 在不同氮源Czapek培养基上,S2菌株均能生长,但菌丝扩展速率存在差异。氮源为蛋白胨时培养10 d的菌落直径达到70.40 mm,氮源为氯化铵时培养10 d的菌落直径仅33.3 mm,两者差异显著(见表2和图5)。

表2 柑桔砂皮病叶分离所得S2菌株在不同氮源Czapek培养基上培养10 d菌落生长情况
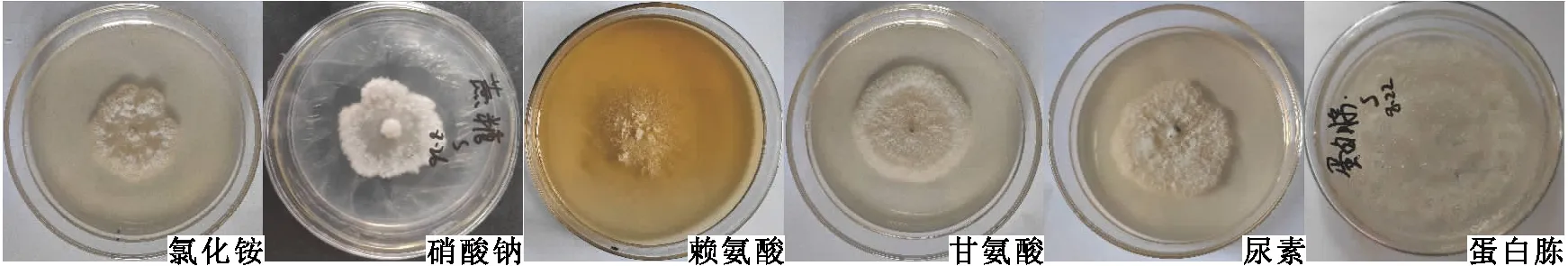
注:赖氨酸氮源处理培养基呈黄色,未接种菌株前即呈黄色。
2.2.4 光照的影响 不同光照条件下,S2菌株菌丝扩展速率存在差异。在全光照条件下,菌丝扩展速度最快,培养10 d的菌落直径80.60 mm;在光暗交替条件下,菌丝扩展速度最慢,培养10 d的菌落直径77.30 mm(见表3和图6)。

表3 柑桔砂皮病叶分离所得S2菌株在PDA培养基上不同光照条件培养10 d菌落生长情况

图6 柑桔砂皮病叶分离所得S2菌株在PDA培养基上不同光照条件培养10 d的菌落形态
2.2.5 温度和pH值的影响 S2菌株在15~30 ℃范围内均能生长,35 ℃时不能生长,最适合生长的温度为20~30 ℃(见图7)。S2菌株在pH值5~9范围内均能生长,最适合生长的pH值范围为5~7(见图8)。

图7 柑桔砂皮病叶分离所得S2菌株在PDA培养基上不同温度下培养7 d的菌落形态

图8 柑桔砂皮病叶分离所得S2菌株在不同pH值PDA培养基上培养7 d的菌落形态
2.2 杀菌剂和纳米试剂的室内毒力
3种杀菌剂对S2菌株的抑制作用强,EC50值为40%吡唑醚菌酯·喹啉铜SC<32%噻呋·氟环唑SC<430 g/L戊唑醇SC,抑制效果为40%吡唑醚菌酯·喹啉铜SC>32%噻呋·氟环唑SC>430 g/L戊唑醇SC。3种纳米试剂对S2菌株的抑制作用较强,且同种试剂浓度越高,菌落直径越小,抑制率越高。在纳米试剂中,SiO2纳米试剂的毒力最强,EC50为1.024 μg/mL;星状阳离子聚合物(SPc)纳米载体的毒力最弱,EC50为6.928 μg/mL(见表4)。
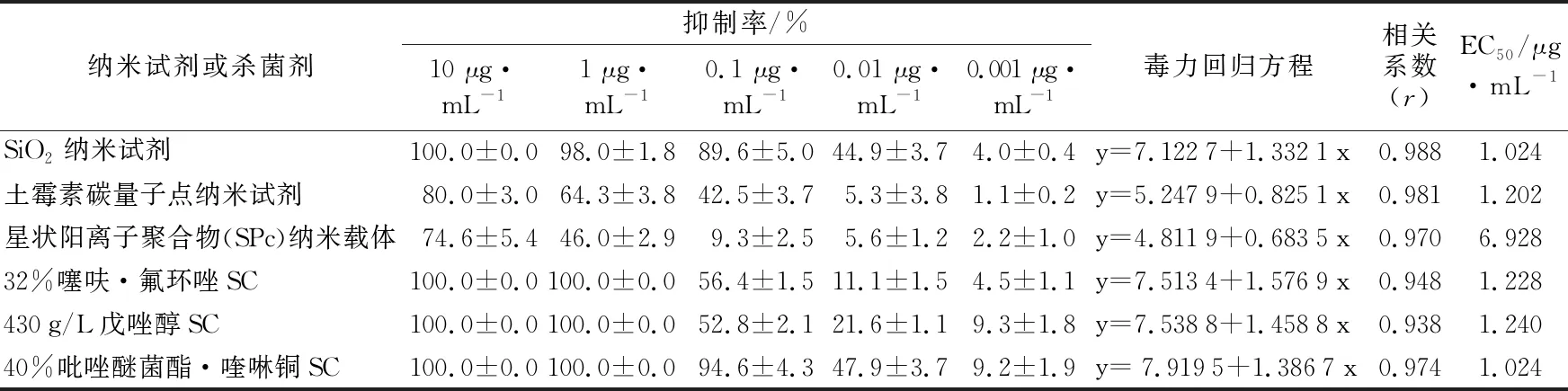
表4 供试杀菌剂和纳米试剂对柑桔砂皮病叶分离所得S2菌株菌丝生长的抑制作用及毒力
3 讨论与结论
前人研究表明,不同地域条件对病原菌的生物学特性基本无显著影响,而相同菌株在不同培养条件下的生物学特性存在差异。本研究分离鉴定获得的柑桔砂皮病菌S2菌株,在不同培养条件下的生物学特性与前人研究结果基本一致[10]。该菌株对甘油、麦芽糖和可溶性淀粉等碳源的利用效果较佳,菌丝扩展速度最快;对蛋白胨氮源的利用效果最好;在15~30 ℃均能生长,最适生长温度为20~30 ℃,致死温度为35 ℃;pH值5~9均能生长,最适pH值为5~7;光暗交替培养时,菌落才出现花瓣状轮纹。
室内毒力测定结果表明,3种杀菌剂对柑桔砂皮病菌S2菌株的抑制作用强,与前人研究结果一致[13-14],其中,40%吡唑醚菌酯·喹啉铜SC抑制作用最强,EC50值为1.024 μg/mL。供试纳米试剂对柑桔砂皮病菌S2菌株均具有较强抑制作用,抑制效果为SiO2纳米试剂>土霉素碳量子点纳米试剂>星状阳离子聚合物(SPc)纳米载体。SPc纳米载体具有高效、简便及安全的纳米传递系统,可有效提升药剂活性,在本试验中SPc纳米载体单独使用即可达到较好的抑制效果,EC50为6.928 μg/mL,后期结合筛选出的化学药剂,提升效果的潜力巨大,但有待于进一步验证。国内目前针对柑桔砂皮病菌,室内筛选出的杀菌剂以苯醚甲环唑、吡唑醚菌酯、咪鲜胺、代森锰锌等杀菌剂为主,EC50范围为0.099~0.950 μg/mL,杀菌效果显著[8,15]。周娜等[16]测定了33种杀菌剂对柑桔砂皮病菌的毒力,表明双胍三辛烷基苯磺酸盐毒力最强(EC50为0.011 2 μg/mL),氟硅唑、多菌灵、咪鲜胺锰盐、吡唑醚菌酯、肟菌·戊唑醇、唑醚·代森联、苯醚甲环唑、咪鲜胺和戊唑醇的毒力较强(EC50均在1 μg/mL以下),并推荐田间以使用氟硅唑和多菌灵为主防控柑桔砂皮病。田间防控砂皮病发现,代森锰锌等保护性杀菌剂具较好防效,但需连续多次施药才能达防控效果,人工成本和用药成本高[17],且易造成环境污染。将矿物油等增效剂与农药联用可以增加农药黏性,增强药效,达到减量增效的目的[18]。纳米材料具有小尺寸效应、大比表面积、高反应活性、量子效应等理化特性[19],这些特性使得纳米材料应用于农药时,能提高农药对生物靶标表面的黏附性和渗透性,减少流失和分解,控制农药释放速度,延长农药持效性,提高农药利用率[20]。目前在我国还未见关于纳米农药用于柑桔砂皮病防控的报道。本试验筛选的3种纳米试剂对柑桔砂皮病菌都表现出较强的抑制作用,为纳米农药用于柑桔砂皮病的防控提供了依据。
在本研究中,未能测定柑桔砂皮病菌S2菌株的产孢时间及产孢量,也未涉及纳米试剂与农药混合使用的效果及纳米试剂对农药药效的影响等内容。这有待于进一步研究。
