基于实时荧光定量PCR 的番木瓜多重PCR高效检测方法
2023-10-17张玉山陈洁彬吴亮君欧阳淑芬沈志华
张玉山,陈洁彬,吴亮君,朱 璇,欧阳淑芬,沈志华
(电子科技大学中山学院材料与食品学院,广东 中山 528402)
番木瓜(Carica papayaL.)作为热带水果,由于容易遭受病虫害,特别是发生番木瓜环斑病毒危害,导致产量和品质大幅度下降。从20 世纪90 年代,美国研究人员将编码木瓜环斑病毒(PRSV)外壳蛋白(Coat protein,CP)的基因转入番木瓜,获得了转CP基因的抗病品系[1],这些转基因番木瓜在美国夏威夷被广泛种植。转CP基因的番木瓜对中国华南地区及泰国等的PRSV 株系无抗性效果[2]。因此,华南农业大学将PRSV 株系的病毒复制酶基因(RP)转入番木瓜培育出转基因番木瓜品种(华农一号)[3]。由于外源基因CaMV35S 启动子序列在转基因作物中被广泛使用[4],可以针对CaMV35S 启动子序列、CP基因和RP基因设计特异引物序列,通过PCR 技术和实时荧光定量PCR 技术进行转基因木瓜检测[5,6]。在使用实时荧光定量PCR 进行番木瓜外源基因检测时,可以将木瓜蛋白酶基因(Papain)和核酮糖1,5-二磷酸羧化酶/加氧酶大亚基基因(rbc L)作为内源基因。Papain具有物种间高度的保守性,可作为木瓜物种的内源基因[5,7,8]。植物叶绿体编码的rbc L基因具有高度的保守性,可作为植物内源性参照基因。此外,在进行实时荧光定量PCR 反应时,需要针对每个基因设计特异探针,但设计和合成探针费用昂贵,探索在不合成探针的条件下对目的基因进行实时荧光定量PCR 具有重要现实意义。
多重PCR 可以在一次反应中同时检测2 种及以上靶标序列[9],已经广泛应用在动物源成分[10]、转基因植物[11]、食品中的细菌[12]、烟草[13]等方面的检测,但由于多重PCR 在扩增过程中存在多个靶点扩增条件不兼容的问题,引物的设计及反应条件摸索需要根据试验结果多次调整,成功实现多重PCR 有一定难度[4]。因此,探索简单、高效的多重PCR 方法具有重要实践意义。
本研究以番木瓜为研究对象,通过对番木瓜外源基因和内源基因进行多重PCR 和实时荧光定量PCR 检测,旨在建立基于实时荧光定量PCR 的多重PCR 方法,并探索在不合成探针情况下目标基因实时荧光定量PCR 的可行性。
1 材料与方法
1.1 材料与仪器
商用番木瓜(S1)购自广东省中山市大润发超市;校园番木瓜(S2)采自电子科技大学中山学院校园试验田。
荧光定量PCR 仪(QuantStudio 3)、PCR 仪、电泳仪、凝胶成像系统、手提紫外灯、天平、Taq聚合酶、10×Buffer、dNTP、引物、DNA 核酸染料、DNA loading Buffer、DNA Marker、去离子水、琼脂糖。
液氮、研钵、涡旋振荡器、高速离心机、移液枪、植物基因组抽提试剂盒(TianGen)[天根生化科技(北京)有限公司]。实时荧光定量试剂盒为pCaMV35S基因核酸检测试剂盒(PCR-荧光探针法)(广州迪澳生物科技有限公司,内含CaMV35S 启动子基因和一条特异性的TaqMan 荧光探针)。
1.2 番木瓜DNA 提取方法
分别削取商用番木瓜和校园番木瓜的瓜皮,经液氮研磨后,使用植物基因组抽提试剂盒提取DNA,DNA 提取步骤按照抽提试剂盒说明书进行操作。
1.3 PCR 反应的基因引物序列
本研究合成了木瓜蛋白酶基因(Papain)、叶绿体编码的核酮糖1,5-二磷酸羧化酶/加氧酶大亚基基因(rbc L)、木瓜环斑病毒的外壳蛋白基因(CP)、转基因启动子CaMV35S基因引物。Papain、rbc L、CP、CaMV35S基因的4 对引物序列如表1 所示。

表1 引物序列信息
1.4 常规PCR 反应体系和反应程序
常规PCR 反应体系:Buffer 2 μL、dNTP 1.6 μL、MgCl21.2 μL、上下游引物各1.2 μL、Taq酶0.2 μL、ddH2O 12.2 μL、模板DNA 2 μL。PCR 仪反应设定程序:94 ℃3 min;94℃30 s,50~55 ℃30 s,72 ℃50 s,30 个循环;72 ℃5 min。
PCR 反应结束后,PCR 产物在1.2%的琼脂糖凝胶电泳上进行检测。
1.5 内源基因rbc L 和Papain 反应液的制备
取实时荧光定量检测试剂盒(CaMV35S 启动子基因)中反应液20 μL,加入内源基因rbc L引物(F/R)各1 μL,混匀,制备出番木瓜内源基因rbc L实时荧光定量PCR 反应液,待用。内源基因Papain反应液制备除用Papain引物替代rbc L引物外,其他制备方法同内源基因rbc L反应液的制备。
1.6 多重PCR 反应体系与反应程序
实时荧光定量PCR 反应体系操作参照检测试剂盒说明书进行。取4 个20 μL PCR 管,依次标记为阳性对照、阴性对照、待检样品外源基因、待检样品内源基因。其中,在阳性对照、阴性对照、待检样品外源基因PCR 管中分别加入检测CaMV35S 启动子基因的反应液20 μL,在待检样品内源基因PCR管中加入已制备的rbc L基因反应液22 μL。4 个PCR 管分别加入商用番木瓜DNA(模板)5 μL(表2),加完后盖紧盖子,10 000 r/min 离心30 s,进行荧光定量PCR 扩增反应。每个样品设置3 次重复试验。荧光定量PCR 反应程序见表3。
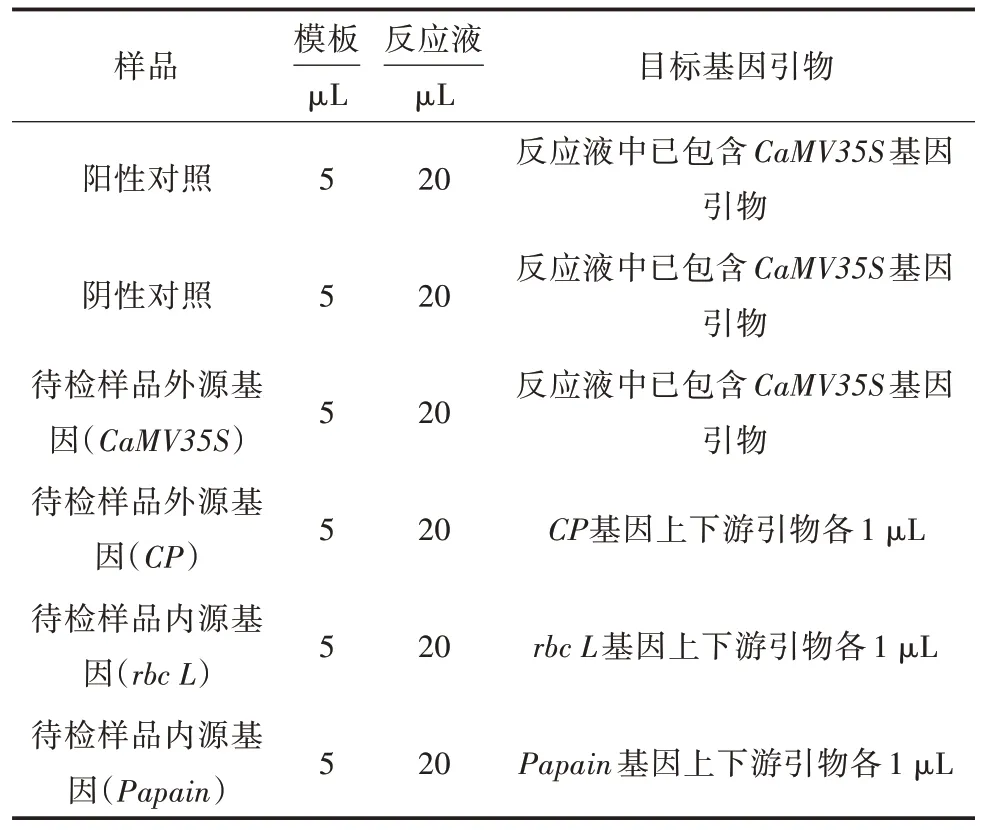
表2 实时荧光定量PCR 反应体系
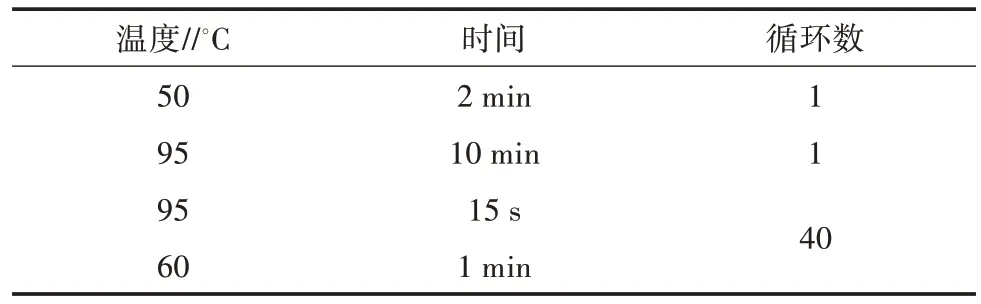
表3 实时荧光定量PCR 反应程序
2 结果与分析
2.1 常规PCR 扩增效果与基于实时荧光定量PCR的多重PCR 扩增效果
由图1 可知,常规PCR 扩增出的4 个基因(Papain、rbc L、CP、CaMV35S)条带较暗;而基于实时荧光定量PCR 的多重PCR 扩增出的4 个基因(Papain、rbc L、CP、CaMV35S)条带比常规PCR 扩增条带亮度高很多。这表明在实时荧光定量PCR 试剂盒中加入目的基因(Papain、rbc L、CP、CaMV35S)不仅不影响原来外源基因(CaMV35S)的扩增,而且目的基因扩增的效果更好,这也表明实时荧光定量PCR 反应是实现多重PCR 反应简单、高效的方法。
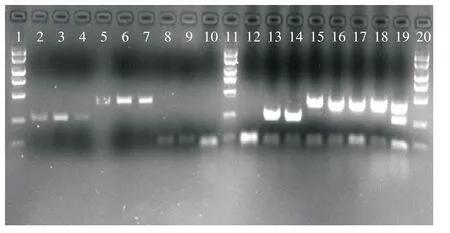
图1 商用番木瓜常规PCR 和基于实时荧光定量PCR 的多重PCR 扩增效果检测
2.2 内源基因rbc L 和Papain 的实时荧光定量PCR 扩增效果
由图2 可知,将2 种内源基因rbc L和Papain的引物加入实时荧光定量反应体系进行实时荧光定量PCR 反应,反应结果除外源基因CaMV35S产生了荧光信号外,内源基因(rbc L和Papain)也产生了荧光信号。
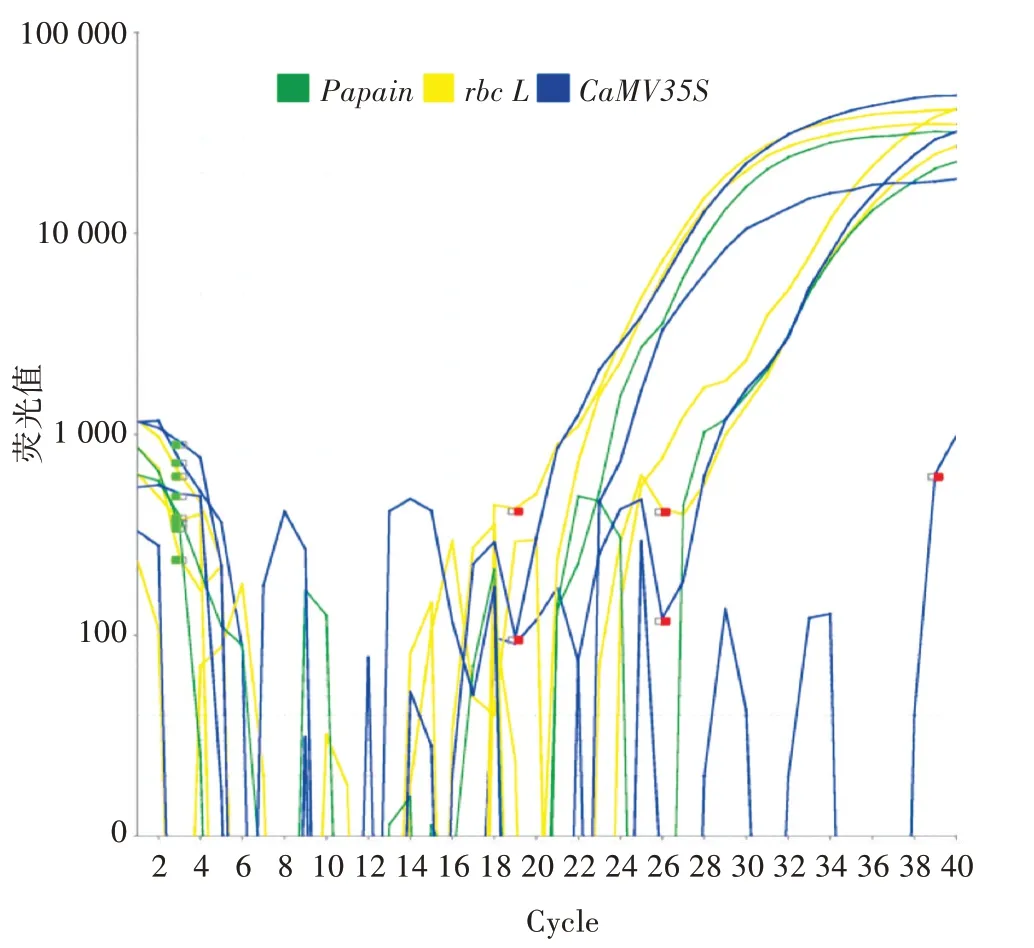
图2 外源基因和内源基因荧光定量结果
由表4 可知,阳性对照外源基因(CaMV35S)的Ct为24.580;商用番木瓜和校园番木瓜外源基因(CaMV35S)的Ct分别为22.081 与29.548;商用番木瓜和校园番木瓜的内源基因(Papain)的Ct分别为25.740 与32.070;商用番木瓜和校园番木瓜内源基因(rbc L)的Ct分别为25.159 与32.533;阴性对照外源基因(CaMV35S)的Ct没有检测到。结果表明,将内源基因(Papain或rbc L)引物混入pCaMV35S基因核酸检测试剂盒反应液中,在实时荧光定量PCR 反应中可以检测到内源基因(Papain或rbc L)的荧光信号,并进行定量分析。
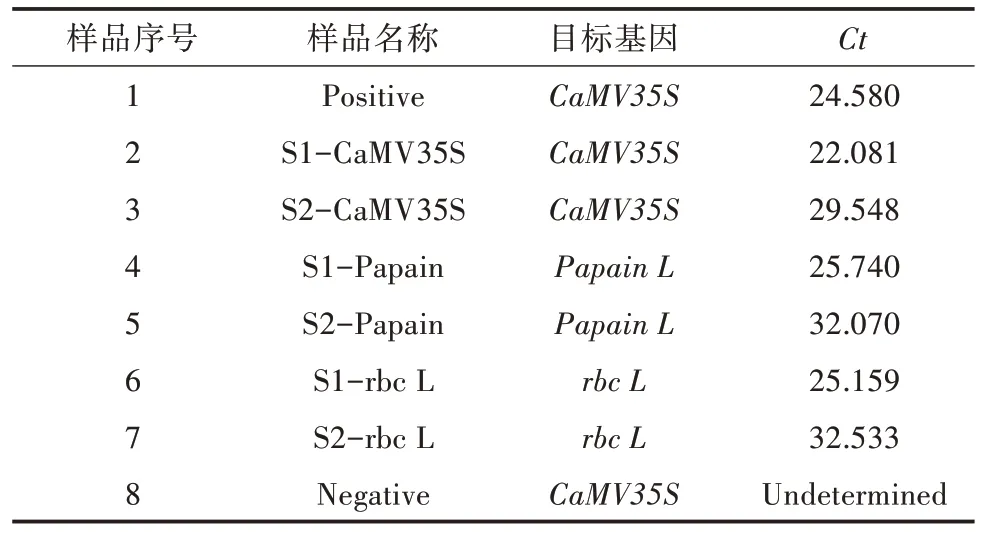
表4 实时荧光定量PCR 样品目标基因及其Ct
实时荧光定量PCR 反应结束后,将表4 的样品进行琼脂糖凝胶电泳检测。由图3 可知,在实时荧光定量PCR 反应试剂盒中加入2 种内源基因(rbc L和Papain),2 种内源基因和外源基因(CaMV35S)均可扩增出来,与实时荧光定量结果一致。同时,泳道2 和泳道3 是单重PCR 反应,扩增出外源基因(CaMV35S),表明商用番木瓜和校园番木瓜均为转基因番木瓜;泳道4 和泳道5 是二重PCR 反应,外源基因(CaMV35S)和内源基因(Papain)同时扩增出来;同样,泳道6 至泳道9 也为二重PCR 反应,外源基因(CaMV35S)和内源基因(rbc L)同时被扩增出来。这些结果进一步表明,商用番木瓜和校园番木瓜均为转基因番木瓜。
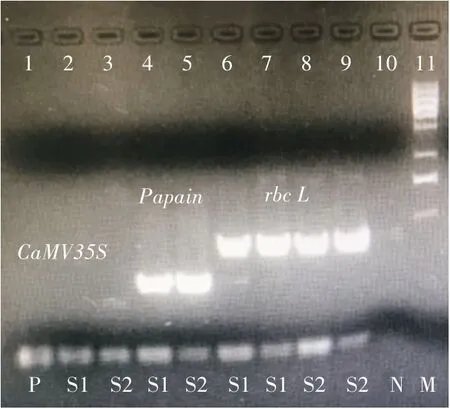
图3 实时荧光定量PCR 反应后3 个基因在琼脂糖凝胶电泳中的扩增效果
3 讨论
3.1 目标基因的实时荧光定量PCR 检测
一般来说,荧光定量PCR 检测不同目标基因,通常需要根据待测目标基因序列合成对应的荧光探针[14,15]。然而,本研究中,利用pCaMV35S基因核酸检测试剂盒的荧光探针也可以分别对内源基因Papain和rbc L进行荧光定量分析。pCaMV35S基因核酸检测试剂盒荧光探针与基因的启动子序列结合,在PCR 扩增内源基因的同时,可能由于某种未知的机制引发结合在内源基因启动子序列的荧光探针同步降解。当然,具体的机理尚待进一步研究,但不影响其实际应用。本研究中,通过在pCaMV35S基因核酸检测试剂盒的反应液中加入2 种基因(Papain和rbc L),在实时定量PCR 中均可以成功检测到3 种基因(CaMV35S、Papain和rbc L)的荧光信号。这也暗示pCaMV35S基因核酸检测试剂盒中一种探针可以完成不同目的基因的实时荧光定量PCR,无需另外合成对应的荧光探针。
尽管外源基因荧光探针试剂盒和内源基因荧光探针试剂盒都已经商品化,然而购买不同基因探针试剂盒价格昂贵。外源基因CaMV35S荧光PCR 试剂盒(24T),价格为988 元/盒,而购买内源基因荧光PCR 试剂盒(96T),价格高达3 870 元/盒。因此,如果能通过将目标基因引物掺入到pCaMV35S基因核酸检测试剂盒的反应液中,即能实现目标基因的实时荧光定量PCR 反应,从而极大地节省试验经费,特别对于科研经费不充足的高校,本方法更值得应用与推广。
3.2 实时荧光定量PCR 反应条件适合进行多重PCR 反应
尽管多重PCR 原理简单,但成功完成多重PCR试验并非易事。这需要解决多个引物靶点扩增条件兼容问题,需要事先进行多次试验,根据试验结果寻找最佳反应体系和退火温度,耗时耗材。本研究在pCaMV35S基因核酸检测试剂盒的反应体系中,通过加入2 对或3 对引物,轻松实现了多重PCR 扩增,建立起基于实时荧光定量PCR 的多重PCR 方法,该方法值得推广。此外,pCaMV35S基因核酸检测试剂盒反应条件对多种基因引物PCR 扩增均表现出很好的兼容性。
3.3 商用番木瓜与校园番木瓜均为转CP 基因番木瓜
目前,超市售卖的番木瓜多为转基因番木瓜,常见的转基因番木瓜外源基因有2 种,一种为编码PRSV 衣壳蛋白基因(CP)[16],另一种为PRSV 株系的病毒复制酶基因(RP),仅存在于华农一号[3]。本研究中PCR 反应成功扩增出CP基因,而没有扩增出RP基因。这表明从超市购买的商用番木瓜和校园番木瓜均为转CP基因的番木瓜,而非转RP基因的番木瓜。
4 小结
本研究通过在pCaMV35S基因核酸检测试剂盒(PCR-荧光探针法)反应体系中添加目标基因,找到了进行多重PCR 反应的高效方法和在不合成探针条件下目标基因实时荧光定量PCR 的检测方法。结果表明,pCaMV35S基因核酸检测试剂盒的反应体系和反应条件能够成功进行多重PCR 反应;目的基因引物添加到实时荧光定量试剂盒反应体系中,在不合成探针的情况下可以实现目标基因的实时荧光定量PCR 反应。本研究结果为进一步进行理论研究和应用推广奠定了基础。
