基于纳豆激酶特性的功能递送载体研究进展
2023-10-17解明浩徐献兵王震宇程述震
解明浩,徐献兵,王震宇,程述震,杜 明*
(大连工业大学食品学院,国家海洋食品工程技术研究中心,辽宁 大连 116034)
血栓和栓塞性疾病严重威胁着人类的生命健康,其发病率和死亡率居各类疾病之首[1]。目前临床上已经有多种用于溶栓治疗的溶栓剂[2],如链激酶、尿激酶、葡激酶、单链尿激酶、组织型纤溶酶原激活剂等。这些溶栓剂具有较高的溶栓特异性,但同时易引发过敏反应及大出血等。纳豆激酶是一种由275 个氨基酸残基组成的碱性丝氨酸蛋白酶,其等电点为pH 8.6,分子质量为27.7 kDa[3]。纳豆激酶具有价格低廉、溶栓活性高、体内半衰期长、特异性强、不易引起出血和过敏反应等优点,是一种新型的天然溶栓活性物质,具有开发为膳食补充剂的广阔前景。基于纳豆激酶天然生物酶学性质,目前其市场产品存在活性和生物利用度低等问题。现有纳豆激酶产品经口腔-胃-肠消化吸收系统后,进入血液发挥溶栓功能,而消化吸收系统环境(低pH值等)和因子(胃蛋白酶、胰蛋白酶等)能够破坏纳豆激酶空间结构,导致其溶栓功能活性降低或丧失[4]。
包埋递送是解决现有纳豆激酶产品胃肠稳定性问题的有效措施。功能递送载体可在时间、空间及剂量上全面调控生物体内活性物质的分布,将活性物质靶向递送到相应器官,提高活性物质利用效率,降低成本,减少毒副作用。经功能递送载体包埋的活性物质可在机体内缓慢释放,从而延长活性物质在血液或特定组织中的半衰期。功能递送载体解决了脂溶性活性物质溶解度低的加工应用瓶颈问题,同时通过抑制活性物质的降解,提高了其在生物体内的稳定性和吸收效率。功能递送载体可以负载活性物质、改善负载物质的生物分布和释放动力学、增强其细胞摄取和生物相容性,其设计过程中需要考虑的因素包括疏水性、生物降解性、尺寸、形状、表面电荷和毒性等[5]。
综上,构建功能载体包埋递送纳豆激酶,使其免受胃肠环境的不利影响,提高其稳定性和生物利用度,对纳豆激酶溶血栓产品的开发具有一定意义。本文总结了现有多糖、蛋白质等材料构成的纳豆激酶功能递送载体的研究现状,以期为开发高效、稳定型纳豆激酶溶栓产品提供理论参考。
1 纳豆激酶的结构与功能特性
1.1 纳豆激酶的结构特性
纳豆激酶是一种价格低、效率高、无毒副作用、具有强力纤溶活性的碱性丝氨酸蛋白酶[6]。该酶活性中心位点在Asp32、His64和Ser221处(图1A),与底物结合部位在Ser125、Leu126及Gly127处(图1B)[7]。对纳豆激酶稳定性产生影响的因素主要包括pH值、温度、金属离子等。纳豆激酶在pH 7.0~12.0之间最稳定,低于pH 6.0时活性逐渐丧失[8],最适反应温度为40 ℃,当温度低于45 ℃时酶活性相对稳定,高于60 ℃时由于蛋白质变性导致其活性迅速丧失,反复冻融对该酶活性影响不大[9]。Mg2+、Ca2+和Na+对于纳豆激酶具有明显的激活作用,Fe2+、Zn2+、Cu2+、Ba2+、Al3+、Mn2+及高浓度K+对其活性有抑制作用[10]。
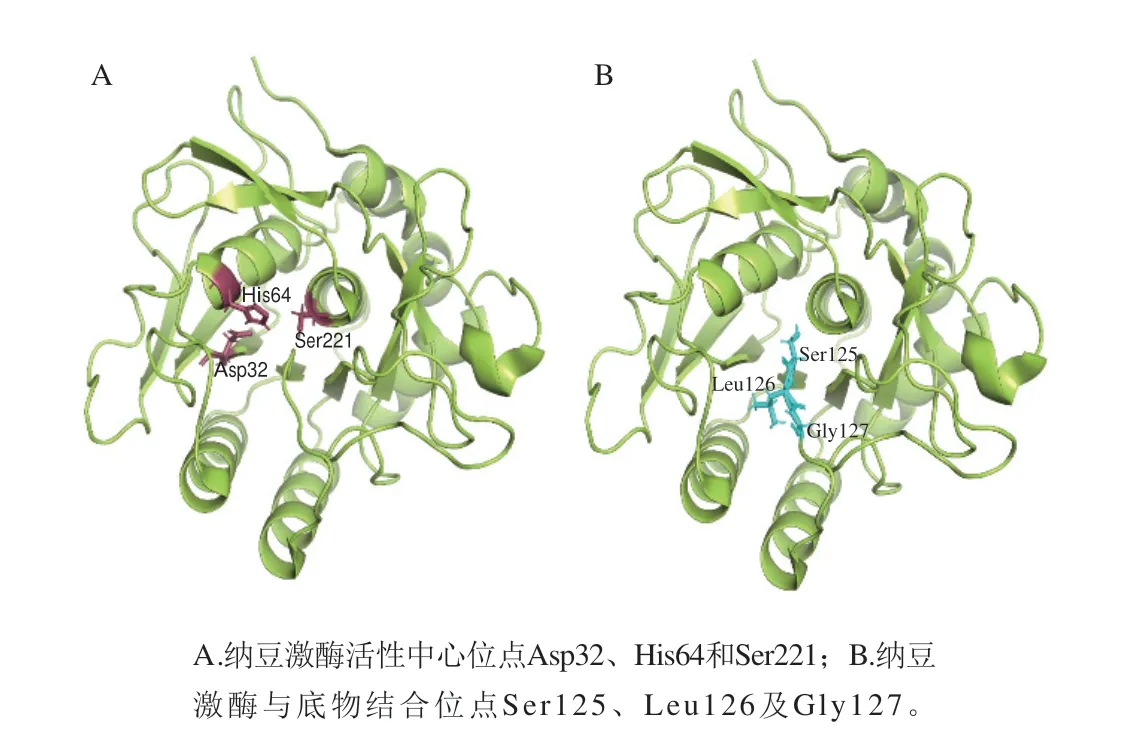
图1 纳豆激酶的空间结构Fig.1 Spatial structure of nattokinase
1.2 纳豆激酶的功能特性
1.2.1 纳豆激酶的抗血栓活性
血栓由血管内的不溶性纤维蛋白包裹血小板及血细胞形成[11]。1987年Sumi等研究发现纳豆具有体外溶栓功效,并确认其中有效成分为纳豆激酶[6]。各种体外和体内实验中,纳豆激酶均表现出极强的溶栓活性,且出血风险相对较低[12-17]。纳豆激酶主要通过4 个途径发挥溶栓作用:1)纳豆激酶直接溶栓,它能够直接将纤维蛋白分解为小分子肽和氨基酸,从而导致血栓溶解[18];2)纳豆激酶刺激尿激酶原转化为尿激酶[19];3)纳豆激酶刺激血管内皮细胞产生作为内源性纤溶酶原激活剂的组织纤溶酶原激活剂(tissue-type plasminogen activator,t-PA),t-PA催化纤溶酶原转变为纤溶酶,从而使积累的纤维蛋白溶解[14];4)降解纤溶酶原激活物抑制剂,使纤溶酶原被激活为纤溶酶,增强纤溶作用[20]。
1.2.2 纳豆激酶的抗血小板聚集作用
体外研究表明纳豆激酶具有抗血小板聚集作用。Jang等[21]发现纳豆激酶可以抑制胶原蛋白和血栓素诱导的血小板聚集,并抑制活化的血小板产生血栓素,被认为具有类似阿司匹林的作用,从而有效地抑制血小板聚集。纳豆激酶可以显著增加大鼠血小板中的环磷酸腺苷,抑制血小板聚集[22]。纳豆激酶可通过抑制血小板胞浆游离钙离子浓度,降低内皮素-1含量,提高一氧化氮含量,降低血小板颗粒膜蛋白和血管性血友病因子水平,抑制血小板聚集。
1.2.3 纳豆激酶的降血压作用
灌胃纳豆激酶和高血压临床药物卡托普利可有效降低自发性高血压大鼠收缩压和舒张压[23]。临床评估纳豆激酶对北美高血压人群血压影响的研究显示,口服2 000 FU/d纳豆激酶8 周后,受试者舒张压平均下降0.40 kPa,其中男性受试者舒张压下降较明显,为0.67 kPa[24]。无论完整形式还是片段的纳豆激酶都可以从肠道吸收并降低自发性高血压大鼠的血压。然而,根据口服给药形式的不同,降压作用机制不同。纳豆激酶保留其蛋白酶活性时,可通过切割血浆纤维蛋白原降低血液黏度来降低血压;从纳豆激酶获得的片段可通过降低血浆血管紧张素II水平来抑制高血压[25]。
1.2.4 纳豆激酶的降血脂作用
一项临床试验中将82 例颈动脉粥样硬化和高脂血症患者分为两组,分别给予纳豆激酶(6 000 FU/d)或辛伐他汀(20 mg/d),26 周后纳豆激酶组患者颈动脉斑块面积和颈总动脉内中膜厚度显著下降,且下降幅度大于辛伐他汀组。纳豆激酶可降低患者胆固醇、甘油三酯和低密度脂蛋白胆固醇水平,但是其降幅仅为辛伐他汀组的50%左右。该研究结果显示,每天服用纳豆激酶可以有效控制颈动脉粥样硬化的发展,且效果比辛伐他汀更明显。说明纳豆激酶在管理动脉粥样硬化上可能是比他汀类药物更好的选择[26]。纳豆激酶在降低实验性高血脂大鼠总胆固醇水平的同时可升高其血清中超氧化物歧化酶和一氧化氮水平,说明纳豆激酶可以降低实验性高血脂大鼠血清中的血脂含量,有较好的抗脂质过氧化和血管内皮保护作用,能够降低动脉粥样硬化的发生率[27]。
1.2.5 纳豆激酶的抗凝作用
一项针对成人非糖尿病高胆固醇血症的随机双盲、安慰剂对照实验评估了2 000 FU/d剂量纳豆激酶与安慰剂在8 周内对凝血因子的影响,治疗8 周后纳豆激酶组患者的胶原-肾上腺素闭孔时间(collagen-epinephrine closure time,C-EPI CT)、凝血酶原时间(prothrombin time,PT)和活化部分促凝血酶原激酶时间(activated partial thromboplastin time,aPTT)显著延长,纳豆激酶组患者的C-EPI CT和aPTT与安慰剂组相比显著延长。在第8周时,纳豆激酶组患者的C-EPI CT显著长于安慰剂组,且PT和aPTT之间存在显著相关性。该研究结果提示非糖尿病高胆固醇血症患者补充纳豆激酶与C-EPI CT和aPTT的延长相关[28]。纳豆激酶可以通过抑制内源性和外源性凝血途径来抑制凝血活酶的形成。在凝固过程的第2阶段,纳豆激酶显著延长了纤维蛋白凝固时间,而在凝固过程的第3阶段,纳豆激酶显著延长了凝血时间[29]。纳豆激酶的功能特性汇总如图2所示。
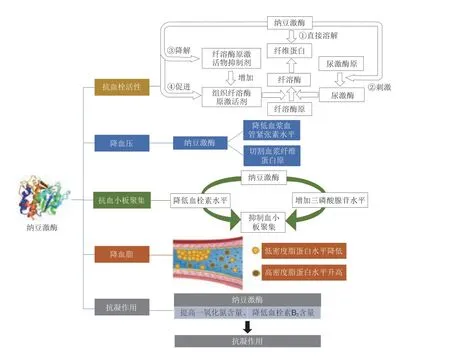
图2 纳豆激酶的功能特性Fig.2 Functional properties of nattokinase
1.2.6 纳豆激酶应用的局限性
纳豆激酶是一种碱性蛋白酶,口服后必须途经胃肠道被小肠上皮细胞吸收进入血液,并运输到全身循环后才能发挥其溶栓作用[4]。胃中的胃蛋白酶和低pH值环境会破坏纳豆激酶的空间结构,使其失去纤溶活性,而肠道中的消化环境比胃中的消化环境温和。如果口服纳豆激酶,必须确保其在消化系统中的稳定性,以达到溶栓的目的。包埋技术是使纳豆激酶在胃内稳定并在肠内缓慢释放的有效方法。
2 纳豆激酶包埋递送系统
目前在纳豆激酶递送系统中使用较多的壁材包括多糖、蛋白质等材料,可以分为如图3所示的不同类型纳豆激酶递送系统。
2.1 脂质体
脂质体是由一个或多个同心磷脂双层构成微囊结构的载体制剂,其结构类似于细胞膜,具有高生物相容性、低毒性和低免疫原性[30]。脂质体独特的结构特性使其能够封装水溶性、油溶性和两亲性物质,两性分子分散于水相时形成具有双分子层结构的封闭囊泡,其亲水头部暴露在水相中,而疏水尾部聚集在一起,在双分子膜内和囊泡内水相能够包裹多种不同极性的活性成分[31]。脂质体能够提高化合物的稳定性、克服细胞和组织摄取障碍、增加药物在体内靶点的生物分布,同时最大限度地降低全身毒性,从而提高药物的治疗效果[25]。脂质体中的胆固醇为磷脂双分子膜提供刚性的成分并改善双层膜的性能[32],但对于高胆固醇血症患者,即使是低浓度的胆固醇也应严格限制摄入[33]。植物甾醇可以通过抑制胆固醇从小肠的吸收而有效降低血浆中的胆固醇浓度[34],其功能和化学结构与磷脂双分子膜中胆固醇相似,且在制备脂质体时用植物甾醇代替胆固醇是可行的[35]。脂质体包埋纳豆激酶有利于破坏血栓,尤其是高脂血症引起的血栓。Dong Xuyan等[36]采用薄膜分散法制备了植物甾醇脂质体,并用其包埋纳豆激酶,在优化条件下,其最高包埋率为65.25%。经适当制备后,该脂质体呈圆形且形状规则、无黏附性。此外,含有纳豆激酶的脂质体在4 ℃下是稳定的,该脂质体有效地降低了胃部环境对所包裹纳豆激酶的干扰,使其可以更有效地在小肠被吸收。
2.2 多糖
2.2.1 海藻酸钠
海藻酸钠是一种从褐藻类中提取的带有大量活性基团的阴离子天然多糖,具有pH值敏感性、生物相容性、可降解性等特点,被广泛应用于食品加工、生物医学、污水处理等领域。可以运用包埋法将活性物质与海藻酸钠混匀,通过添加二价阳离子或小分子交联剂进行交联,在交联过程中活性物质随之被包裹在微球内。海藻酸钠微球具有明显的pH值敏感性,当微球处于pH<3.4环境中时,羧酸基团呈非离子形式(—COOH)状态,微球分子链收缩,从而减少药物对胃部的刺激。当pH>4.4时羧基离子化为—COO-,负电荷静电斥力和亲水基团的增加导致聚合物链溶胀,有利于药物释放[37]。然而在极低的pH值条件下,交联的海藻酸盐基质体系中海藻酸盐的分子质量降低,会导致活性成分的快速降解和释放[38]。因此,其还需要与其他材料复合才能更好地发挥保护作用,可以将明胶、壳聚糖等高分子材料与海藻酸钠复合以增强其机械性能,延长活性物质在体内的半衰期并提高其稳定性,控制活性物质的释放时间。
陈景鑫[39]采用固定化载体制备空白微球,再将其分散在酶溶液中,使其充分吸附酶液,然后用戊二醛交联剂固化制得纳豆激酶微胶囊。载体给酶提供了微环境,更近似于酶的天然条件;同时戊二醛的交联作用稳定了酶的分子构象,使固定化酶的临界变性温度升高,对酶起到保护作用。此方法制得的纳豆激酶微胶囊包埋率为86.83%,生产工艺简单、成本低,但是溶液有低毒性。通过模拟胃液的体外实验证明固定化纳豆激酶在正常胃肠道的酸性环境中仍具有酶活力稳定性。
程云[40]、孙建华[41]、李倩文[42]等都探究了使用海藻酸钠、羧甲基纤维素钠和氯化钙包埋纳豆激酶的最优条件,其中最高包埋率为97%。研究表明,纳豆激酶裸酶在模拟胃肠道条件下酶活力明显降低,采用微胶囊技术包埋纳豆激酶,可以将其与胃酸等不良环境隔开,提高其在不良条件下的稳定性,降低其在胃液中的释放率,实现其在肠液中的定向释放。纳豆激酶微胶囊在模拟胃液中释放率为4.88%,在模拟胆汁中释放率为18.06%,在模拟肠液中释放率为73.43%,结果证实纳豆激酶微胶囊能够显著地改善纳豆激酶在胃酸等不良条件下的稳定性[42]。
陈守文等[43]以海藻酸钠和聚谷氨酸钠为壁材制备出一种具有较高包埋率、抗酸能力强的纳豆激酶胶囊。其包埋率为64.48%,在模拟胃酸的低pH值条件下,此胶囊可以有效保证40%以上的纳豆激酶活性,并使其在模拟人体肠道环境中缓慢释放,并在80 min内完全释放。
于江淼[44]以海藻酸钠、氯化钙、甘油和尤特奇L100为主要壁材制备了肠溶纳豆激酶微胶囊。其包埋率和模拟肠液的酶活力回收率分别为94.06%和95.62%。尤特奇L100是一种安全、无毒、包衣过程不粘连的肠溶包衣材料,能与海藻酸钙和甘油等配合形成壁材,在人体胃液中为纳豆激酶提供更好的保护,在人体肠液中,其分子中带有的羧基与碱结合成盐而溶解,使纳豆激酶释放并到达血栓部位,发挥直接和间接溶栓的能力。
2.2.2 环糊精
环糊精是通过淀粉酶促降解作用得到的一系列天然多糖,通常是由α-1,4糖苷键连接6~8 个D-吡喃葡萄糖单元形成,分为α-环糊精、β-环糊精和γ-环糊精。环糊精具有亲水性外缘和疏水性内腔,呈现出锥型中空圆筒状立体结构,这使其可以通过疏水相互作用、范德华力、氢键或主客体相互作用包埋各种客体分子。环糊精具有制备简单、价格低廉、易于包埋等优点,其中极性较低的疏水腔可以嵌入各种小分子和蛋白质。
陈景鑫[39]采用超分子微胶囊技术制备纳豆激酶微胶囊,以β-环糊精为壁材,微孔淀粉吸附纳豆激酶为芯材,使用喷雾干燥技术对纳豆激酶进行包埋。通过超分子微胶囊技术生产的纳豆激酶微胶囊生产工艺简单、生产周期较短、试剂安全无毒,但包埋率仅为69.25%,且生产成本较高。经过β-环糊精超分子微胶囊技术处理后的纳豆激酶与裸酶相比具有更强的耐酸性和稳定性。谢建飞等[45]将纳豆均质后添加益生菌、明胶和β-环糊精,经过真空干燥及粉碎制备含有纳豆激酶和益生菌的微胶囊。β-环糊精和明胶与纳豆中含有的γ-聚谷氨酸形成具有三维网络结构的微胶囊,将纳豆激酶和益生菌包埋于其中,能够有效防止胃液等不良因素对其造成破坏,提高纳豆激酶的稳定性和益生菌的存活率。
2.2.3 其他多糖
张杰等[46]将阿拉伯树胶和明胶混合制备纳豆激酶微胶囊,其包埋率达到93.91%。陈景鑫[39]采用复凝聚法利用羧甲基纤维素和明胶制备纳豆激酶微胶囊,其耐酸性较原始纳豆激酶液明显提高。Kapoor等[16]用交联技术将纯化的纳豆激酶通过壳聚糖与三聚磷酸钠离子凝胶化,然后与戊二醛交联来制备稳定的负载纳豆激酶的壳聚糖纳米粒子。与游离纳豆激酶相比,负载纳豆激酶的稳定壳聚糖纳米颗粒在口服后显示出更好的稳定性,且其抗血栓生物活性增强。
2.3 蛋白质
蛋白质具有较好的溶解性、乳化性、凝胶性、起泡性、持水性、生物相容性和降解性[47]。因其所形成的凝胶具有良好的pH值敏感性、可控的通透性和较高的凝胶强度,已被广泛用于各种生物活性成分的包埋。蛋白质能够通过酶、酸以及钙离子的交联作用在室温下形成结构致密的凝胶,且该反应条件温和,有利于对热敏感的生物活性成分进行包埋[48]。基于以上特性,蛋白质成为极具应用前景的纳豆激酶包埋壁材。目前常用的单一蛋白质壁材包括大豆蛋白、玉米醇溶蛋白、乳清蛋白、酪蛋白和明胶。
董绪燕等[49]分别使用乳清蛋白、明胶和玉米醇溶蛋白作为包埋壁材制备纳豆激酶微囊,纳豆激酶的活性保留率分别为56.8%、45.8%和48.4%。复合蛋白质壁材相较于单一蛋白质壁材更具优势。由于蛋白质胶粒易聚集且能被消化系统中的蛋白酶水解,单一蛋白质壁材制备的微胶囊在贮藏和递送时会受到限制。碳水化合物壁材具有较好的溶解性,在胃中不被降解,蛋白质通过与碳水化合物或其他种类的蛋白质进行复配形成的复合壁材能够弥补单一壁材的缺点,提高包埋效率和保护效果,并提高壁材膜的致密性和微胶囊递送效率,还可以减少某些高价壁材的添加量,从而节省成本[43]。
Zhang Xuan等[50]以壳聚糖为核心,京尼平为壳聚糖核与纳豆激酶的交联剂,牛乳酪蛋白为颗粒外层保护材料,谷氨酰胺转氨酶为保护层,采用分步交联制备纳豆激酶缓释颗粒,并通过动物实验对其体内抗血栓功能进行评价。结果表明,纳豆激酶微胶囊的包封率为73.8%。通过体外消化模拟实验发现所制备的具有双层壳核结构的纳豆激酶缓释颗粒能大幅提高纳豆激酶在胃酸中的稳定性。使用京尼平将纳豆激酶固定在壳聚糖微球上,有效地增强了纳豆激酶结构的空间稳定性,从而提高了其对酸和消化酶的抗性。酪蛋白保护壳可以进一步将纳豆激酶与外部的酸和消化酶相隔绝,从而保护纳豆激酶免受外部不利环境的影响。给黑尾模型小鼠灌胃该颗粒,结果显示其能够明显抑制小鼠尾部血管内的血栓形成并促进血栓溶解,与灌胃游离纳豆激酶组相比效果显著增强。通过纤维蛋白平板印迹法验证纳豆激酶在小鼠消化道内的缓慢释放以及肠黏膜吸收效果,结果表明,缓释颗粒所装载纳豆激酶长达12 h持续不断地释放,而酪蛋白保护层可以更有效地延缓纳豆激酶在肠道中的释放。为了进一步探讨纳豆激酶缓释颗粒在肠道内的缓释动力学特性,该研究对口服缓释颗粒小鼠肠道内容物的纤溶活性进行了动态测定。结果表明,缓释颗粒中的纳豆激酶在肠道中的释放以及随后的吸收或失活是一个持续过程,该过程可被酪蛋白保护壳显著延长。由此说明,具有双层壳-核结构的药物缓释颗粒是一种理想的纳豆激酶口服剂型,其口服给药间隔可控制在8~12 h。
Zhong Yejun等[51]研究了卵清蛋白-黄酮类化合物(柚皮素、染料木素、柚皮苷、葛根素和大豆苷元)水凝胶对纳豆激酶溶栓活性和稳定性的保护作用。所研究的5 种纳豆激酶/卵清蛋白黄酮类化合物水凝胶在微观结构、质地特性和流变特性方面存在差异。该方法能够有效地包封纳豆激酶,并提高其在不同pH值和温度下的稳定性。体外实验结果表明,卵清蛋白黄酮水凝胶增强了纳豆激酶的溶栓活性和稳定性。纳豆激酶/卵清蛋白-柚皮素水凝胶显示出最佳的溶栓效率。荧光光谱测定和计算机模拟结果表明,纳豆激酶与大豆苷元和染料木素之间的主要相互作用是氢键,而纳豆激酶与柚皮苷、葛根素和柚皮素之间的主要相互作用是疏水相互作用。
2.4 其他材料
2.4.1γ-聚谷氨酸
γ-聚谷氨酸是一种阴离子天然聚合物,其易溶于水、生物相容性好、可生物降解、可食用且对人体无毒。γ-聚谷氨酸是由D-谷氨酸、L-谷氨酸通过γ-酰胺键结合形成的一种多肽分子,它包含500~5 000 个谷氨酸单体,是纳豆中黏性物质的主要成分[52]。Hsieh等[53]将纳豆激酶包埋在高分子质量的钠-γ-聚谷氨酸微胶囊中。虽然制备的微囊在模拟胃环境中的稳定性不高,并且超过95%的酶活性丧失,但纳豆激酶的贮存稳定性得到了改善。
2.4.2 虫胶
虫胶是一种天然、可生物降解和可再生的昆虫源树脂,它具有低透水性的优点。Law等[54]将纳豆激酶与虫胶溶液混合并加入氯化钙交联溶液中,形成嵌入酶的固体虫胶颗粒。结果表明,使用虫胶包埋纳豆激酶的包埋率为87.2%,虽然包埋率与氯化钙浓度无关,但酶的活性随着氯化钙浓度的增加而降低。
2.4.3 聚羟基丁酸
聚羟基丁酸(polyhydroxybutyrate,PHB)是由细菌合成的短链聚合物,具有生物相容性高、生物可降解、无刺激性、无免疫原性和组织相容性高等特殊性能。其可用于包埋蛋白质类活性物质以达到缓释的效果,保护未释放的蛋白质不被降解。Deepak等[55]将纳豆激酶固定在PHB纳米颗粒上,提高了纳豆激酶的稳定性,并使其酶活力增加了20%。
2.4.4 多重自乳化给药系统
多重自乳化给药系统是油包水型乳液和亲水性乳化剂的混合物在胃肠条件或常温轻度搅拌条件下用水稀释后自乳化而成的水/油/水(W/O/W)复合乳液,可以避免胃肠道中肽和蛋白质药物的失活和酶降解。与其他制剂相比,该系统药物的吸收和药理活性显著提高。Wang Xiaona等[56]通过对油相、内水相和乳化剂的种类和浓度进行筛选,制备出负载纳豆激酶的多重自乳化给药系统。体内药效学结果表明,在多重自乳化给药系统制剂中封装纳豆激酶可以防止其在胃中失活,从而使口服给药获得更好的释放效率。该研究中纳豆激酶的包封率为(86.8±8.2)%,但是药物的释放效果并不好,8 h只能释放30%的纳豆激酶。
2.4.5 多巴胺涂层的聚苯乙烯微球
Ye Wei等[57]通过多巴胺在聚苯乙烯微球上的氧化聚合制备微胶囊,然后将纤维蛋白原固定在聚多巴胺层的表面上,随后利用四氢呋喃去除核心获得微胶囊,纳豆激酶通过扩散加载到微胶囊中。该研究中纳豆激酶的包埋率接近75%,其盐水溶解活性和凝血指数证明所制备的微胶囊具有很高的抗血栓活性。
2.4.6 异丁烯酸-丙烯酸乙酯共聚物Eudragit®L 100-55
Law[58]、马晓文[59]和钟芸[60]等都使用pH值敏感的肠溶材料Eudragit®L 100-55以及环境友好型的超临界CO2流体替代传统有机溶剂制备纳豆激酶的肠溶微球。该材料不溶于酸性介质,但可溶于pH 5.5以上的介质,因此其能帮助药物抵抗胃酸的作用,而在中性或微碱性环境中迅速溶解,使药物得以快速释放。体外实验结果表明,载药微球在模拟胃酸(pH 1.2)环境中2 h仅释放9.7%,并能保持近90%的活性状态,在模拟肠液(pH 8.6)中4 h内快速释放90%。
2.4.7 磁性纳米颗粒
Zhang Shaofei等[61]将磁性Fe3O4纳米颗粒嵌入聚乳酸层中,之后将由精氨酸、甘氨酸和天冬氨酸(arginineglycine-aspartic-acid,RGD)组成的序列接枝到树状大分子上以合成Fe3O4-(4-PLA(G3)4)-RGD纳米颗粒,最后将纳豆激酶包埋进纳米颗粒中。在外部磁场的影响下,纳米颗粒可以用于靶向溶栓,这可以减少纳豆激酶注射的有效剂量,增加其生物靶点的局部浓度,并能促进纳豆激酶在人体内的局部递送。Liu Shuai等[62]通过共沉淀的方法制备磁性纳米粒子,并用羧甲基壳聚糖和海藻酸钠修饰Fe3O4纳米颗粒。
2.4.8 聚乙二醇-聚乳酸-羟基乙酸共聚物
邓柳艳等[63]通过双乳液蒸发法,以聚乙二醇-聚乳酸-羟基乙酸共聚物(polyethylene glycol-poly lactic-coglycolic acid,PEG-PLGA)和叶酸-聚乙二醇-聚乳酸-羟基乙酸共聚物(folic acid-polyethylene glycol-p-poly lacticco-glycolic acid,FA-PEG-PLGA)作为壁材制备纳豆激酶微胶囊。体外模拟缓释结果表明,经胃环境(pH 2.0)作用2 h后,两种微胶囊中超过60%的纳豆激酶被保留,经肠环境(pH 7.0)作用22 h缓释效果良好。FA-PEGPLGA纳豆激酶微胶囊表现出更好的吸收效果。邓柳艳等[63]建立了Caco-2单层细胞模型,研究纳豆激酶微胶囊体在Caco-2细胞内的转运吸收效果。通过结果推测所制备的微胶囊易形成纳米胶束,其颗粒小且兼有PEG与PLGA的亲水和疏水性以及良好的生物相容性,从而促进了纳豆激酶微胶囊在小肠细胞中的吸收。PEG-PLGA及FA-PEG-PLGA两种纳豆激酶微胶囊无明显细胞毒性,在Caco-2单层细胞中均有很好的吸收效果;PEG-PLGA纳豆激酶微胶囊的主要吸收方式为被动扩散;FA-PEG-PLGA纳豆激酶微胶囊的主要吸收方式为被动扩散,此外还可能存在叶酸载体介导的主动转运,进而促进其在Caco-2细胞中的吸收。该研究为通过叶酸靶向作用促进纳豆激酶的细胞吸收、提高纳豆激酶口服利用度提供了依据。
2.4.9 聚谷氨酸肽树状聚合物
Huang Mengjie等[64]通过结合肽树状大分子来修饰纳豆激酶,以提高其酶活性。其首先合成第2代聚谷氨酸树状大分子,然后将靶向分子RGD通过羧基和氨基反应连接到树枝状大分子聚合物上。随后,通过化学反应将聚谷氨酸树状大分子颗粒结合到纳豆激酶的周边,并用作纳豆激酶的载体。
Wu Can等[65]采用发散收敛法合成了聚赖氨酸树枝状聚合物,纳豆激酶通过氢键和范德华力自发地与聚赖氨酸树枝状聚合物形成纳米复合材料。体外溶栓实验证明,纳豆激酶/聚赖氨酸树枝状聚合物纳米复合材料可以缓慢地将纳豆激酶释放到血液中,从而延长其在体内的循环时间,并减少过度溶栓引起的副作用。与游离纳豆激酶相比,纳豆激酶/聚赖氨酸树枝状聚合物纳米复合材料具有更好的体外稳定性。此外,聚赖氨酸树枝状聚合物表现出良好的血液相容性和细胞相容性。不同种类的纳豆激酶功能递送载体如表1所示。

表1 纳豆激酶的功能递送载体Table 1 Functional vectors for nattokinase delivery
3 结 语
目前,已有动物实验和临床试验证明纳豆激酶能够口服通过小肠吸收进入到血液循环中,但是对于其具体的吸收利用机制尚未完全阐明,纳豆激酶与小肠上皮细胞的结构和性质之间的关系有待深入研究。纳豆激酶在肠液中的释放及其体内吸收可能部分依赖于胰酶对纳豆激酶的部分降解,且降解产生了大量相对分子质量不等的片段,这些片段仍然具有纤溶活性,而且可能是纳豆激酶体内吸收的一个重要形式[50]。筛选出具有纤溶活性的片段递送进入人体发挥溶栓作用是值得深入研究的课题。
目前市面上已有的纳豆激酶相关产品多为医药用途的药品和营养品,有效的功能食品相关产品较少,而现有的一部分纳豆激酶功能递送载体可能含有有机试剂等对人体有危害的物质,并不符合食品添加剂相关法规要求[66],因此,开发无毒副作用的食品级纳豆激酶功能递送载体对于纳豆激酶的深度开发应用具有现实意义。目前,许多研究人员已经研究了纳豆激酶的功能递送系统,但大多数研究仍处于实验室阶段。未来需要进行临床研究以确定纳豆激酶与其功能递送载体共同使用的毒理学安全性。同时还需要优化制备过程和成本,确定适合不同功能递送系统工业生产的设计方案和方法。
纳豆激酶功能递送载体可以保护纳豆激酶在胃内不被降解并在肠内稳定释放,发挥其溶栓作用,但现有的纳豆激酶功能递送载体存在缺点。脂质体独特的结构特性使其能够包裹水溶性、油溶性和两亲性物质。然而,只有少数研究聚焦纳豆激酶脂质体的制备。已有研究表明脂质体共包埋薏苡籽油和β-胡萝卜素比负载单一生物活性物质的脂体具有更高的抗癌和抗氧化活性[67]。未来可以制备与其他活性物质共包埋的纳豆激酶脂质体,并探索其是否是一种提高纳豆激酶稳定性和溶栓活性的新方法。用于乳液递送系统的表面活性乳化剂通常有毒,且稳定性较差,容易分层和絮凝。未来可以开发新的食品级乳化剂,或对乳液进行改性。单一多糖类或蛋白质类壁材制备的功能递送载体在贮存和递送方面会有一定的限制,而与其他物质复配后形成复合壁材能够弥补单一壁材的缺点,提高包埋效率和保护效果,未来可以寻找更合适的复配材料,以制备稳定、包埋率高且保护效果好的纳豆激酶功能递送载体。
