生鲜食品致腐假单胞菌生物被膜形成及其调控机制研究进展
2023-10-17刘静聪吴诗媛冯立芳朱军莉
鲁 重,刘静聪,吴诗媛,冯立芳,陈 剑,朱军莉*
(浙江工商大学食品与生物工程学院,浙江省食品安全重点实验室,浙江 杭州 310018)
我国生鲜食品资源丰富,如生鲜肉蛋奶、水产品和果蔬都是备受大众青睐的食品种类,消费量巨大。然而,生鲜食品水分含量高、具有季节性和地域性的特点使其收获后在冷链贮运过程中的腐损率较高,这造成严重的经济损失。微生物是导致食品腐败变质的重要因素,特别是假单胞菌(Pseudomonas)。由于独特的生物学特性和代谢功能,假单胞菌被公认为导致鱼类、肉类及乳制品等生鲜食品腐败的最常见菌属之一[1]。假单胞菌为假单胞菌科(Pseudomonadaceae),1984年由德国科学家Migula首次提出,按照rRNA和DNA的同源性将假单胞菌分为5 个亚群(RNA I、II、III、IV、V群)和未确定群[2]。假单胞菌属中参与生鲜食品腐败的荧光假单胞菌(P.fluorescens)、莓实假单胞菌(P.fragi)、铜绿假单胞菌(P.aeruginosa)等多属于RNA I群。致腐假单胞菌有较强的新陈代谢活性,可以分泌多种蛋白质酶和脂肪酶,而该菌属的耐冷特性使其成为在冷藏条件下导致生鲜食品腐败的优势菌。
近年来,生物被膜作为致腐菌重要的致腐因子引起广泛的关注。生物被膜是细菌由单个细胞的浮游状态转变为多细胞群集状态时,依附于接触表面所形成的由胞外多糖、纤维蛋白、脱氧核糖核酸等构成的多聚体复合物[3]。生物被膜不仅存在食品表面,还可以在食品加工设备表面扩散,使肉类、乳制品、水产品等食品加工环境产生持续性污染,造成经济损失。因此,生物被膜细菌是食品污染的潜在来源,能够导致食品变质或传播食源性病原体,威胁人类健康。
1 生鲜食品中致腐假单胞菌的污染
食品生产、储存和运输过程中,低温冷链是有效抑制生鲜食品微生物污染和繁殖的主要方式。致腐菌附着在食物表面并繁殖到一定数量会导致食物腐败变质或交叉污染。在需氧冷藏的多种生鲜食品中,假单胞菌被公认为主要的优势腐败菌属,包括莓实假单胞菌、荧光假单胞菌和隆德假单胞菌(P.lundensis)等。
1.1 污染肉类及肉制品
多项研究表明,从鸡肉、猪肉、牛肉等肉品中都能够分离出多种致腐假单胞菌,肉类及其制品中的致腐假单胞菌主要以莓实假单胞菌、荧光假单胞菌和隆德假单胞菌为主[4]。Xu Yi等[5]从腐败鸡肉中分离出莓实假单胞菌、荧光假单胞菌、嗜冷假单胞菌(P.psychrophila)以及盖氏假单胞菌(P.gessardii)4 种假单胞菌;Wang Guangyu等[6]在变质的冷鲜鸡肉中分离出荧光假单胞菌和莓实假单胞菌,并发现莓实假单胞菌生长迅速,是冷鲜鸡肉的主要致腐菌;Wickramasinghe等[7]通过荧光染色和共聚焦显微镜观察莓实假单胞菌在冷藏牛肉表面的生物被膜,发现莓实假单胞菌易在肉表面形成生物被膜并与肉类渗出液相结合形成黏液,导致肉品腐败。本课题组在冷鲜牛肉中分离出致腐性较强的隆德假单胞菌,并发现该菌与热索环丝菌发生相互作用,导致肉品产生不良感官性状和品质劣变[8]。
1.2 污染水产品
假单胞菌是引起温水域养殖水产品腐败的重要细菌种类,其中恶臭假单胞菌(P.putida)、荧光假单胞菌、产氮假单胞菌(P.azotoformans)较为常见。恶臭假单胞菌是淡水鱼的重要腐败菌之一,Zhuang Shuai等[9]在草鱼鱼片中分离出恶臭假单胞菌,发现该菌有较强的吸收和代谢游离氨基酸能力,能够促进草鱼的腐败。严羽萍等[10]在养殖的海产鱼冷藏过程中也分离到了荧光假单胞菌,其在大黄鱼和大菱鲆中发现5 株具有较高蛋白酶活性和产嗜铁素活性的荧光假单胞菌。另外,研究表明从杂交石斑鱼中分离出的假单胞菌中,64.85%为产氮假单胞菌,其对冷藏石斑鱼的气味和风味产生较大的不良影响[11]。Jeyasekaran等[12]发现假单胞菌不仅是养殖鱼类的优势腐败菌,而且在冷藏虾产品中也优势生长。
1.3 污染乳及乳制品
耐冷假单胞菌在冷藏乳及其制品的微生物污染和品质劣变中占据主导作用,也是引起巴氏杀菌乳变质的优势细菌。研究表明,大多数荧光假单胞菌具有胞外蛋白酶、脂肪酶和卵磷脂酶活性,是加工乳制品中的主要腐败菌[13]。Zarei等[14]在冷生乳中分离出假单胞菌复合菌群,包括荧光假单胞菌、莓实假单胞菌、盖氏假单胞菌、维氏假单胞菌(P.veronii)等,该混合群体提高了生物被膜形成的能力,并能产多种蛋白酶以破坏奶制品稳定性。研究发现,乳制品中不同分离株间的蛋白水解酶活性差异较大,在山羊、水牛、骆驼和牦牛乳中分离出的假单胞菌群中,牦牛乳分离株的蛋白水解活性最高[15]。假单胞菌种属间因其差异特性对牛奶品质劣变产生不同的感官影响。从冷藏的原料乳中筛选出的荧光假单胞菌、莓实假单胞菌、恶臭假单胞菌等7 株假单胞菌表现出不同的蛋白水解和脂解活性,耐冷菌数量及蛋白水解酶和脂解酶的性质影响牛奶色泽和风味品质[16]。此外,耐冷假单胞菌也会引起冷鲜奶酪的变质并缩短其货架期。
1.4 污染果蔬
果蔬产品营养丰富、含水量高,经过鲜切和即食加工后,因表皮等天然屏障被破坏、汁液外流等因素,易出现腐败变质的现象。假单胞菌是能够引起果蔬腐败的重要腐败细菌之一。研究表明,在即食生菜中分离出的13 种腐败细菌中,假单胞菌属和泛细菌属比例最高[17],进一步研究发现假单胞菌主要通过代谢产生亚硝酸盐和消耗营养物质等方式导致西兰花的腐败与变质[18]。除能够引起果蔬腐败,假单胞菌还作为果蔬作物的致病菌受到关注,如菊苣假单胞菌(P.cichorii)是导致番茄坏死和生菜叶腐烂的关键致病菌[19]。
部分食品中污染的假单胞菌和致腐特性如表1所示。

表1 部分食品中污染的假单胞菌和致腐特性Table 1 Contamination of Pseudomonas in some foods and its spoilage characteristics
2 假单胞菌生物被膜形成过程
生物被膜是微生物生存的重要策略,也是假单胞菌的重要致腐因素。生物被膜的形成是一个动态循环的过程,包括初期黏附、微菌落形成、生物被膜成熟和被膜散播4 个阶段[3]。首先,浮游细菌黏附至实体表面进行分裂繁殖,合成与分泌生物被膜基质,形成微菌落;随后多个微菌落互相融合形成成熟的生物被膜,最后成熟的生物被膜释放出浮游细菌来扩展和播散。实际上,冷链环境中肉类表面腐败过程中产生的黏液层就是生物被膜,当黏液层被膜菌数量高达108CFU/cm2时,肉就会形成不良的风味,缩短货架期[4]。前期研究已发现荧光假单胞菌和隆德假单胞菌的肉源分离株在气-液交接面处容易形成薄膜[23]。假单胞菌的生物被膜还表现出种间的易变性,肉和乳中33 株假单胞菌分离株在不锈钢和塑料表面黏附的特性表现菌株依赖性,菌株间生物膜形成具有异质性[22]。另外,环境因素也是菌体生存方式转变的重要信号[18],如温度、营养物质、渗透压、pH值等。研究表明,低温环境能有效促进荧光假单胞菌、莓实假单胞菌和隆德假单胞菌多株致腐菌的生物被膜形成胞外聚合物(extracellular polymeric substances,EPS)分泌[8,20,23]。加工器具接触面性质、食物基质及加工应激都会影响假单胞菌的生物膜形成,而被膜发育过程中假单胞菌也会与表面的多种微生物相互作用,形成更复杂的混合生物被膜,导致食品连续和交叉污染,对食品安全性造成威胁[4]。
3 假单胞菌生物被膜胞外基质的组成
在成熟的生物被膜中,微生物只占其质量的约10%,而生物被膜基质占到90%以上[31]。生物被膜基质是细胞外物质,由微生物自身产生并输送至胞外,将细胞嵌入其中。生物被膜基质由不同类型的EPS组成,包括多糖、蛋白质、核酸和脂质等物质。这些成分能维持生物被膜稳定性,介导细菌与固体表面的黏附,并形成稳定的三维聚合物网络[32]。EPS作为生物被膜三维结构的支架,保证了微生物群落营养代谢功能和毒力特性,并对抗菌剂、pH值、紫外线等外界环境刺激具有抵抗作用。
3.1 胞外多糖
胞外多糖是EPS的主要组成成分。根据化学组成不同,胞外多糖分为杂多糖和均多糖。大多数假单胞菌的胞外多糖是由中性和带电糖残基混合物组成的杂多糖,如假单胞菌的藻酸盐。而假单胞菌的胞外多糖还包含少量的均多糖,即由一种糖分子缩合而成的多糖,如纤维素。研究表明,假单胞菌中与生物被膜形成直接相关的胞外多糖至少有3 种——藻酸盐、Pel、Psl,在生物被膜形成过程中发挥着不同的作用[33]。藻酸盐是由β-D-甘露糖醛酸和α-L-古洛糖醛酸2 种单体组成,参与生物被膜形成的初期黏附和微菌落形成,也在生物被膜成熟后维持生物被膜的稳定性[34]。Pel是由葡萄糖组成的多聚物,由合酶依赖性多糖分泌途径产生,主要作为生物被膜的结构支架并发挥保护作用[35]。而Psl是由D-甘露糖、D-葡萄糖和L-鼠李糖组成的戊多糖,参与细菌对生物或非生物表面的黏附作用,是不依赖藻酸盐的非黏液型菌株产生生物被膜所必需的多糖[36]。研究发现,恶臭假单胞菌中胞外多糖A(putida exopolysaccharide A,Pea)、胞外多糖B(putida exopolysaccharide B,Peb)和纤维素是重要的EPS组成成分,尤其Pea是褶皱菌落形态和生物被膜形成所必需的[37]。因此,多种致腐假单胞菌生物被膜EPS中胞外多糖所占比例很高,胞外多糖合成受阻的细菌生物被膜形成受到显著抑制,甚至无法形成。
3.2 胞外蛋白质
生物被膜中存在多种细胞外酶,大部分细胞外酶参与生物聚合物的降解,如多糖、蛋白质、核酸和脂质等[38]。这些细胞外酶可将生物聚合物分解成低分子物质,被细菌吸收并用作能量来源。细胞外酶通过与多糖的相互作用存在于生物膜基质,铜绿假单胞菌中的胞外内酯化脂肪酶LipA与藻酸盐结合,从而保证了胞外酶位于细胞表面并防止酶的变性和水解[39]。同时,EPS中存在大量非酶类蛋白,参与组成细菌生物被膜的支架。凝集素(lectin,Lec)是EPS中一种重要的结构蛋白,由铜绿假单胞菌分泌合成的LecB对生物被膜起稳定作用。假单胞菌EPS中普遍存在的蛋白质成分还有Fap功能性淀粉样蛋白,介导细菌在固体表面的黏附作用,并为成熟的生物被膜提供稳定性。Wickramasinghe等[20]曾报道,相比于25 ℃,4 株肉源假单胞菌在10 ℃时分泌的胞外蛋白质含量显著增加。胞外蛋白与胞外多糖等EPS组分共同参与细菌生物被膜从初期黏附到三维结构的形成。
3.3 脱氧核糖核酸
在假单胞菌等多种细菌产生的生物被膜中都检测到了胞外脱氧核糖核酸(extracellular DNA,eDNA)。研究表明,eDNA作为细菌生物被膜的重要成分,能够维持生物被膜稳定性和细胞间连接[40]。铜绿假单胞菌的eDNA对于菌体生物被膜形成的初期黏附阶段至关重要,eDNA降解后细菌会停止表面附着作用[41]。在恶臭假单胞菌形成的生物被膜中,eDNA在铬的吸附和络合过程中起关键作用[42]。在莓实假单胞菌和隆德假单胞菌的生物被膜中检测到eDNA,其含量存在菌株差异性,且与培养温度无相关性[40]。另外,研究表明eDNA还具有一定的抗菌活性,能通过螯合脂多糖和细菌外膜阳离子引起细胞裂解[43]。研究发现,EPS中多个组分能够帮助假单胞菌抵抗消毒剂、抗生素和宿主免疫防御等外界不良因素的影响[44]。
4 生物被膜形成的调控因子及通路
微生物生物被膜发育和发展存在复杂的协调机制,包括非生物因素和生物因素,从而影响菌体从浮游态向被膜态生长模式的转变。在生物因素层面,已发现假单胞菌属水平内存在多种对生物被膜形成发挥重要调控作用的调控系统和调控因子。
4.1 C-di-GMP调控通路
环鸟苷二磷酸(cyclic di-guanylate monophosphate,c-di-GMP)是细菌胞内普遍存在的第二信使,对革兰氏阴性菌生物被膜的形成有重要的调控作用。C-di-GMP由含有GGD(/E)EF结构域的双鸟苷酸环化酶(diguanylate cyclases,DGCs)催化2分子三磷酸鸟苷(guanosine triphosphate,GTP)合成,并被含有EAL/HD-GYP结构域的磷酸二酯酶(phosphodiesterases,PDEs)催化降解为5’-磷酸鸟苷酸-(3’,5’)-鸟苷(5’-phosphoguanylyl-(3’,5’)-guanosine,pGpG)或鸟苷酸(guanosine monophosphate,GMP)[45]。GGD(/E)EF和EAL结构域可以同时存在于同一个蛋白质中,通常仅有1 个结构域具有催化活性,或者存在第3个活性结构域破坏GGD(/E)EF和EAL结构域[46]。C-di-GMP参与调控细菌中多种生理生化过程,如调节细胞周期、生物被膜的合成与降解、鞭毛运动和毒性等[47]。而c-di-GMP调控系统是一个复杂的调控网络,当细菌胞内处于高浓度的c-di-GMP时,黏附素和胞外多糖等生物被膜基质成分大量合成以促进细菌生物被膜的形成;另一方面c-di-GMP可以抑制细菌的运动性,也有利于细菌生物被膜的形成。近年来,已发现假单胞菌有多个c-di-GMP代谢酶参与生物被膜形成的调控[45]。
铜绿假单胞菌生物被膜的形成依赖于DGCs合成c-di-GMP,其中最具代表性的是WspR。WspR是铜绿假单胞菌中Wsp趋化性调节系统的一部分。WspR的寡聚化增强了DGCs的活性,使胞内c-di-GMP显著升高,生物被膜形成量也显著增加[48]。生物被膜形成的主调节因子FleQ和PelD是c-di-GMP的效应蛋白,FleQ可以感知c-di-GMP水平增加,并与c-di-GMP结合,从而激活pel和psl操纵子的转录[49]。除调控Pel和Psl的表达,c-di-GMP和FleQ还调控多个EPS相关基因的表达,如cdrA编码黏附素CdrA[50]。此外,FleQ可以抑制铜绿假单胞菌的鞭毛运动,有利于细菌生物被膜的形成。
恶臭假单胞菌和荧光假单胞菌中LapA是重要的EPS成分,周质蛋白酶LapG切割LapA的N端,使LapA脱离细胞外膜,导致细菌的黏附能力降低;而LapG的活性由具有GGDEF和EAL结构域的内膜蛋白LapD调节[51]。当胞内c-di-GMP水平降低时,LapG从LapD中释放出来,LapA进而被LapG切割,破坏其生物被膜结构的完整性[52]。
4.2 群体感应系统
群体感应(quorum sensing,QS)是发生在细菌种内及种间的一种信息交流机制,细菌会释放被称为自诱导剂(autoinducer,AI)的小型可扩散信号分子到外部环境中,而当外界环境中积累的信号分子达到某一阈值水平时,信号分子与受体结合,激活或抑制细菌胞内多个靶基因的表达,使细菌对环境刺激做出反应[53]。大多数革兰氏阴性细菌在QS系统中使用N-酰基-高丝氨酸内酯(N-acylhomoserine lactone,AHL)作为信号分子。AHLs能够调控假单胞菌等腐败菌脂解、蛋白水解和几丁质分解酶活性等表型特征,导致多种食物的腐败劣变[54]。
假单胞菌中AHLs介导的I型信号系统有Lux、Las和Rhl信号系统。而这些信号系统主要由3 个基本部分组成:1)信号合成酶(I基因),负责AI信号分子的合成;2)AIs;3)受体分子(R基因),是编码转录激活蛋白(R蛋白)所必需的。当胞内的AHLs浓度达到临界阈值时,AHLs与LuxR结合,启动下游基因的表达[55]。QS系统可以通过影响细菌的胞外多糖相关基因表达来调控生物被膜的形成,然而不同假单胞菌对生物被膜形成的QS调控有差异。恶臭假单胞菌生物被膜表面蛋白基因的转录谱分析表明,AHLs介导的QS系统由LuxIR型信号分子组成,并对其生物被膜产生负调控作用[56]。从冷藏淡水鱼分离的嗜冷假单胞菌PSPF19中AHLs信号分子促进了蛋白水解酶和脂肪分解酶的合成以及生物被膜形成,而添加QS抑制剂减弱了该菌生物被膜的形成和附着能力[57]。在鱼源荧光假单胞菌PF07中也发现了LuxIR蛋白以及高含量的C4-HSL,敲除luxIR能显著降低生物被膜的形成和蛋白酶等致腐因子的表达[58]。此外,部分假单胞菌能通过QS对外源AHLs作出反应,以调节其腐败特征。Dai Jinyue等[59]发现添加外源C6-HSL提高了韩国假单胞菌PS1的脂肪酶和蛋白酶活性,加速腐败猪肉中糖类、蛋白质和脂肪分解。然而,并非所有假单胞菌都使用AHLs作为信号分子,从新鲜和变质肉类中分离的72 株莓实假单胞菌中都未能检测到AHL活性[60]。
4.3 sRNAs
近期研究发现,小RNA分子(sRNAs)在调节假单胞菌的生物被膜形成中发挥了重要作用。铜绿假单胞菌的retS基因缺失会导致生物被膜形成量显著增加,RetS作为铜绿假单胞菌的传感器激酶,在急性与慢性感染所需毒力因子的相互调节中起关键作用,并与另外两种传感器激酶GacS和LadS协同作用,共同组成一个调节系统[61]。GacS可以磷酸化GacA,这种活性被RetS拮抗和LadS刺激;磷酸化的GacA能够促进rsmZ和rsmY的转录[62]。rsm编码2 个小RNA分子——RsmY和RsmZ,其表达水平与细菌在浮游状态和生物被膜状态间的转换密切相关[63]。另一方面,RsmA对生物被膜形成相关的Psl和QS基因产生负调控,而RsmZ和RsmY可以降低RsmA的活性[64]。同样地,在恶臭假单胞菌和荧光假单胞菌中也发现GacA/S系统影响生物被膜形成,其通过正向调节LuxI型AHL合酶,与AHLs介导的QS相关联[65-66]。
4.4 其他调控因子
假单胞菌生物被膜的形成除了受到c-di-GMP、QS系统和sRNAs调节外,在不同的假单胞菌中还存在其他多种调控因子。如铜绿假单胞菌存在喹诺酮信号(Pseudomonasquinolone signal,PQS)系统,由3,4-二羟基-2-庚基-喹诺酮和2-庚基-4喹诺酮2 种信号分子组成,参与毒力因子的表达、生物被膜形成以及运动等生理过程[67]。此外,脂肪酸介导的信号传导可能在铜绿假单胞菌生物被膜的扩散期发挥作用[68]。在荧光假单胞菌中,SadB是独立于以上几个调控系统的蛋白,它通过影响调控因子AlgU、AmrZ和FleQ对荧光假单胞菌生物被膜形成和运动性发挥调控作用[69]。另有研究发现,sigma因子对于转录控制不同功能的基因表达必不可少,在铜绿假单胞菌中sigma因子RpoS是psl表达的正转录调节因子。
假单胞菌生物被膜形成的调控机制如图1所示。
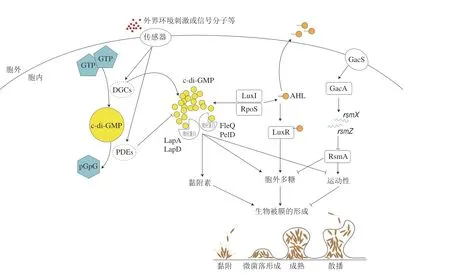
图1 假单胞菌生物被膜形成的调控机制示意图[70]Fig.1 Schematic diagram of the regulatory mechanism of biofilm formation in Pseudomonas[70]
5 结 语
微生物是导致生鲜食品腐败变质的重要因素,其中假单胞菌起主导作用。莓实假单胞菌、恶臭假单胞菌、荧光假单胞菌、铜绿假单胞菌等多种致腐假单胞菌表现出很强的代谢分解底物能力,能够引起肉与肉制品、乳与乳制品、水产品及果蔬等生鲜食品的品质劣变和腐败,造成严重的经济损失。生物被膜形成是假单胞菌的重要致腐特性之一,能增强细菌对外界环境胁迫、营养物质匮乏和加工杀菌等恶劣条件的适应性。尽管研究人员已开发了控制生物被膜形成和清除生物被膜的多种物理、化学和生物技术,然而假单胞菌生物被膜调控系统的存在,会合成新的保护性EPS屏障,导致细菌生物被膜再次形成,加大了有效控制食品生产、加工、运输环境中持续性污染的难度。
微生物生物被膜的形成机制复杂,目前已发现假单胞菌生物被膜的调控系统包括c-di-GMP、QS、sRNAs调控因子。随着基因组、转录组、微生物组等多组学技术的发展,未来将更深入地探究生物被膜形成的调控机制,这有助于阻断生物被膜的形成以及阐明细菌被膜的耐胁迫和耐药性机理,并为靶向控制生物被膜的新技术研发提供理论基础,从而有效降低由细菌生物被膜带来的污染和安全风险。
