晚期糖基化终末产物形成及抑制机理的研究进展
2023-10-17徐怀德
吴 旋,李 娜,徐怀德,李 梅*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
晚期糖基化终末产物(advanced glycation end products,AGEs)是由还原糖(如葡萄糖、果糖等)上的羰基与蛋白质、脂质或核酸上的游离氨基反应而产生的一系列结构复杂的有害化合物[1],从来源上可以分为外源性AGEs和内源性AGEs两大类。外源性AGEs主要指从食品中摄入的AGEs,也称为食源性AGEs,通过食品组分中的还原糖和含氮基团发生非酶促反应而形成;内源性AGEs则是在人体器官、组织或体液中形成的AGEs,由体内的还原糖或者二羰基产物与蛋白质、多肽或氨基酸的游离氨基反应生成[2-3]。内源性AGEs生成条件相对温和,受外界环境影响小,伴随着体内一系列复杂的酶促代谢反应发生,形成时间较长;而外源性AGEs受食品组分、加工条件及外界环境等多种因素影响,形成条件剧烈、途径复杂,容易在短时间内大量产生,研究发现外源性AGEs的过量摄入容易诱发机体产生内源性AGEs[4]。随着人们饮食习惯的改变及热加工食品消费量的快速增加,AGEs的摄入量也在逐渐增加,外源性AGEs已经成为体内AGEs积累的重要来源。大量研究发现,AGEs在体内过量积累可能会引起人体发生氧化应激,产生炎症反应,并导致糖尿病、骨质疏松症、动脉粥样硬化及神经性疾病等的形成[5-11]。目前寻找合适的方法来抑制AGEs的形成已成为研究热点。本文主要对AGEs的形成途径、体内代谢及致病机理等方面进行综述,并重点介绍AGEs的抑制方式及机理,旨在为控制AGEs的形成提供理论依据。
1 AGEs的形成及分类
1.1 AGEs的形成途径
1984年,美国学者Brownlee等[12]首次提出了AGEs这一概念,指出AGEs是由葡萄糖和蛋白质在美拉德反应最终阶段经过缩合、环化和重排等一系列反应所形成的产物。随着研究的深入,对AGEs的种类结构、形成途径和病理作用等方面的认识越来越完善。
AGEs是一系列结构差异性较大的化合物,其种类繁多,生成机理复杂,图1为AGEs的可能形成途径。目前认为AGEs主要是通过美拉德反应生成,该反应大致分为3 个阶段:初始阶段,还原糖上的羰基与蛋白质或氨基酸上的氨基发生可逆反应,形成不稳定的席夫碱加合物,经过环化和分子内重排等反应后转化为相对稳定的Amadori产物,即早期糖基化产物;中间阶段,Amadori产物可以直接氧化裂解生成AGEs(Hodge途径),也可以通过脱水、氧化、重排等反应生成一些具有高活性的二羰基化合物,如乙二醛、甲基乙二醛、3-脱氧葡萄糖醛酮等;最后阶段,这些活性二羰基化合物与蛋白或氨基酸上的残基(如赖氨酸的游离氨基、精氨酸的胍基等)再次发生反应,生成稳定不可逆的AGEs产物[13-14]。
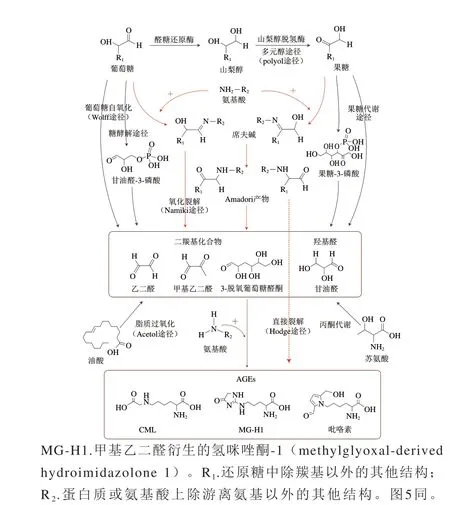
图1 AGEs的形成途径Fig.1 Formation pathway of AGEs
活性二羰基化合物是形成AGEs的重要中间体,除Amadori产物的脱水重排,它还可以通过其他途径产生,如葡萄糖在金属离子催化作用下发生的自氧化反应(Wolff途径)、油脂的过氧化反应(Acetol途径)以及席夫碱的直接氧化裂解(Namiki途径)[15-16]。此外,生物体内的多元醇途径(polyol途径)、糖酵解途径及苏氨酸的酮体代谢反应也有助于二羰基化合物的生成,进而形成内源性AGEs[17]。除二羰基化合物外,羟基醛也是AGEs形成的重要中间产物,甘油醛是体内果糖和葡萄糖代谢产生的一种二羟基醛,能与细胞内蛋白质通过非酶促反应形成AGEs,在体内甘油醛可通过多元醇和糖酵解途径形成:1)多元醇途径:在高血糖条件下,葡萄糖会被醛糖还原酶还原为山梨糖醇,然后经山梨糖醇脱氢酶氧化形成果糖,在果糖分解代谢后最终形成甘油醛;2)糖酵解途径:体内葡萄糖经糖酵解反应形成甘油醛-3-磷酸,然后通过非酶促去磷酸化降解为甘油醛。此外,体内果糖代谢途径也能生成甘油醛,尤其是在肝细胞中,果糖能被一种特定的激酶(果糖激酶)磷酸化为果糖-1-磷酸,然后经醛缩酶B裂解形成磷酸二羟基丙酮和甘油醛[18]。
羧甲基赖氨酸(Nԑ-(carboxymethyl)-lysine,CML)是各种食品和生物体中最常见的一种AGEs,常作为AGEs的代表性物质用于探究外源性及内源性AGEs的生理毒性、形成方式和抑制机理等。CML有多种形成途径,Ferreira等[19]研究发现乙二醛和果糖基赖氨酸均是CML形成的中间产物。乙二醛作为最简单的活性二羰基化合物,它在食品中可以通过Wolff途径、Acetol途径及Namiki途径等方式生成,与赖氨酸的ε-NH2反应形成CML;在人体内,乙二醛还可以通过多元醇途径、细胞的糖酵解和苏氨酸降解的酮糖代谢等途径生成,体内的磷酸二羟基丙酮和三磷酸甘油醛形成甘油醛后通过自氧化途径也能转化为乙二醛;果糖基赖氨酸是Amadori产物的一种,在美拉德反应初始阶段形成的果糖基赖氨酸可以通过直接氧化裂解形成CML[20-23]。此外,研究证实抗坏血酸也是形成CML的重要前体物质,在适宜的条件下抗坏血酸可以氧化成L-阿苏糖,而后与赖氨酸残基缩合形成席夫碱,经Amadori重排生成酮胺后通过氧化裂解形成CML[24]。Fu Minxin等[16]认为在体内蛋白存在的情况下,多不饱和脂肪酸在金属催化氧化过程中也能形成CML。CML的生成途径十分复杂,在食品加工过程中或生物体内,CML可以通过一条或多条途径同时形成,且不同途径所占比例有所不同。韩立鹏[25]研究CML的形成机理发现,在100 ℃下的葡萄糖-赖氨酸模拟体系中,通过果糖基赖氨酸途径生成CML占主导地位,贡献率为84.7%;而通过乙二醛形成CML的贡献率为15.3%,占次要地位。
1.2 AGEs的分类
原料的广泛性和形成途径的多样性导致了AGEs的种类繁多,结构复杂,到目前为止已经发现了40多种不同的AGEs,常见的有CML、MG-H1、吡咯素、羧乙基赖氨酸(Nԑ-(carboxyethyl)-lysine,CEL)、戊糖素、交联素、精氨嘧啶、乙二醛衍生的氢咪唑酮-1(glyoxalderived hydroimidazolone-1,G-H1)、乙二醛-赖氨酸二聚体(glyoxal-lysine dimer,GOLD)和甲基乙二醛-赖氨酸二聚体(methylglyoxal-lysine dimer,MOLD)等。
AGEs的分类方式多种多样:按照结合状态可将其分为游离态AGEs和结合态AGEs,即修饰在游离氨基酸残基上为游离态AGEs,修饰在肽或蛋白质的氨基酸残基上为结合态AGEs,其中结合态AGEs的分子质量大、结构稳定,在体内及多种热加工食品中的含量通常要比游离态AGEs高,因结合状态不同,两者在体内的代谢途径和对人类健康等方面的影响存在着一些差异[26-28]。根据分子质量大小可分为低分子质量AGEs(lowmolecular-weight AGEs,LMW-AGEs)和高分子质量AGEs(high-molecular-weight AGEs,HMW-AGEs)。Gerdemann等[29]将分子质量小于12 kDa的AGEs归类为LMW-AGEs,其余则为HMW-AGEs。而目前主流观点认为HMW-AGEs是蛋白质结合态AGEs,LMW-AGEs是游离或结合肽形式的AGEs。LMW-AGEs的产生可能是蛋白不完全降解的结果,在体内代谢过程中HMW-AGEs降解为LMW-AGEs后更容易被吸收进入体循环[30]。AGEs根据化学特性又可以分为非荧光非交联性AGEs、非荧光交联性AGEs及荧光交联性AGEs,其中荧光性AGEs在总AGEs中占据很大比例,因其具有荧光特性,常使用荧光光谱法进行检测,是估测总AGEs含量的一种方式。另外,AGEs最常见的分类方式是根据氨基酸残基的不同进行划分,主要包括赖氨酸衍生型AGEs和精氨酸衍生型AGEs,如AGEs的标志性产物CML、CEL和吡咯素就是由乙二醛、甲基乙二醛、3-脱氧葡萄糖醛酮和一个赖氨酸残基反应形成的,属于赖氨酸衍生型AGEs,也是非荧光非交联型AGEs;精氨嘧啶和G-H1则是由二羰基化合物与一个精氨酸残基形成的精氨酸衍生型AGEs;与两个赖氨酸残基衍生的AGEs有GOLD和MOLD,都是非荧光交联性AGEs,与两个精氨酸残基衍生的AGEs目前还鲜有报道。此外,戊糖素由戊糖与一个赖氨酸和一个精氨酸衍生所形成,具有荧光交联性,广泛分布于衰老、糖尿病、冠心病患者的各种组织中,是目前细胞外基质中最重要的一种AGEs[31-32]。
AGEs的结构性质决定其分类方式,但并不是所有AGEs的结构性质都已经被确定,目前研究相对较多的AGEs主要有CML、CEL、吡咯素和戊糖素等,其他的AGEs仍处于探索阶段,还需要进一步的研究。
几种常见AGEs的结构如图2所示。
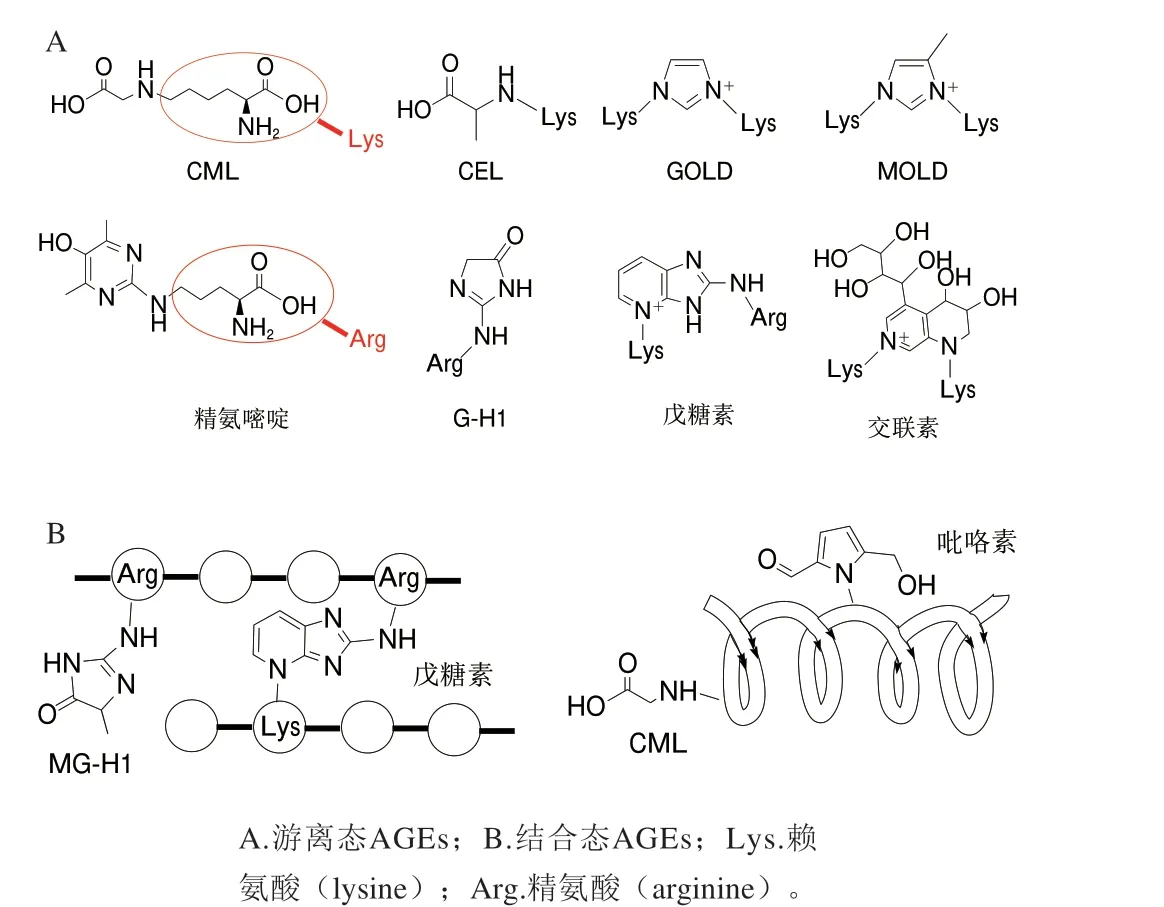
图2 几种常见AGEs的结构Fig.2 Structures of common AGEs
2 AGEs的体内代谢途径
外源性AGEs是体内AGEs的主要来源,随着食物进入机体后外源性AGEs可以通过胃肠道消化、上皮细胞吸收、血液循环等参与机体代谢,并在器官组织内积累,从而诱发各种疾病。
AGEs的分子质量和结构不同,其在体内的代谢方式也有所不同。人体摄入外源性AGEs后,先要经过胃肠道消化,其中游离态AGEs在食品中含量较少,分子质量低,进入人体后容易被直接吸收,而结合态AGEs的分子质量较大,需通过胃蛋白酶和胰蛋白酶等消化道酶水解成小分子质量AGEs才能被人体吸收[33]。大量研究发现AGEs在胃肠道中的消化规律受其结构等多种因素的影响,如具有赖氨酸残基、精氨酸残基共价修饰的非交联型AGEs可以直接阻断胰蛋白酶的作用位点(赖氨酸的ε-氨基和精氨酸的胍基),导致胰蛋白酶受到空间位阻的影响,AGEs的消化率下降[34];一些交联型AGEs也可以通过蛋白质的交联结构产生空间位阻来降低AGEs的消化率[35]。除了消化水解形成外,最近有研究发现AGEs也可能在胃肠道中形成[36-37]。
外源性AGEs经过胃肠道消化后可以通过肠上皮细胞吸收进入体循环,其在肠道内吸收速率受肠道运输能力和分子质量等因素的影响。游离态AGEs的分子质量小、结构简单,可以通过简单扩散被上皮细胞吸收,但由于简单扩散速率慢,其吸收率较低[33]。结合态AGEs在胃肠消化后可以生成结合肽形式的AGEs,通过肽转运体如肽转运体1(peptide transporter 1,PEPT-1)或者胞吞胞吐、被动扩散等方式被上皮细胞吸收进入体循环,也有些结合态AGEs由于胃肠道酶降解不足而难以被人体消化吸收[38-40]。Ye Mengyu等[41]研究肉制品中的肌原纤维蛋白结合态CML在模拟胃肠道消化后Caco-2细胞模型中的吸收机制,发现肌原纤维蛋白结合态CML水解液中分子质量小于1 kDa的CML吸收率达到(74.08±8.93)%,容易通过细胞旁途径被吸收;分子质量为1~3 kDa的CML吸收率为(40.04±4.22)%,可以通过细胞旁途径和胞吞途径转运吸收;分子质量为3~5 kDa的CML主要通过PEPT-1载体跨Caco-2细胞单层转运被吸收;而分子质量大于5 kDa的CML吸收率仅有(3.24±1.71)%,几乎不能被细胞吸收。
有研究表明,当口服AGEs时,仅有10%的AGEs能被肠道吸收进入体循环中,且其中1/3会通过尿液排出体外[42]。AGEs被人体吸收后,其中一部分会进入器官中累积(如心脏、肾脏等),并与组织蛋白共价结合,从而激活细胞膜上的AGEs受体或促进蛋白质聚集导致各种疾病发生[43-44];另一部分则会通尿液或粪便排出体外[45]。Tessier等[46]在使用13C标记的蛋白质结合态CML来饲喂小鼠后,发现除脂肪外CML在小鼠肾脏、心脏和大脑等各个器官中均有积累,且在肾脏、肠道和肺的沉积速率(81~320 μg/gmd)要明显比在心脏、肌肉和肝脏中高(<5 μg/g)。van Dongen等[47]在给小鼠饲喂烘烤食品10 周后也发现,AGEs在血浆、肝脏和肾脏中浓度大幅度提升。AGEs的尿液粪便排泄量与膳食摄入量密切相关[48],Alamir等[49]用挤压蛋白饮食喂养正常雄性大鼠两周后,发现CML的摄入量越多,在尿液和粪便中的排泄量越大,通过口服摄入的CML中有23%和37%会分别通过尿液和粪便排出体外。
在胃肠道中未被消化和吸收的AGEs会进入结肠中,成为肠道菌群的潜在营养物质,经肠道菌群代谢后再排出体外[50]。肠道菌群具有与人类不同的酶促能力,可以通过不同的方式降解AGEs。研究发现,肠道菌群对AGEs的降解首先要消耗糖,然后通过氨基酸脱羧形成生物胺,这些胺会被微生物进一步降解或释放到人体下肠道[51]。菌群微生物主要降解分子质量低的AGEs,而几乎不能降解高分子质量AGEs[52]。在降解过程中AGEs也可以反过来影响菌群微生物,Qu Wanting等[53-54]给大鼠饲喂富含AGEs的热加工食品后发现,摄入AGEs会改变大鼠肠道微生物群的组成,导致幽门螺杆菌水平升高,并促进蛋白质发酵产物的形成,从而对小鼠产生不良的影响。van Dongen等[47]认为高水平AGEs的饮食不仅会促进小鼠血浆、肾脏和肝脏等器官内AGEs的积累,还会导致炎症的加剧和肠道菌群的改变。此外,Yacoub等[55]通过一组随机开放标签对照实验也发现饮食AGEs的限制可以导致腹膜透析患者的肠道微生物群发生变化。Aljahdali等[56]在给小鼠持续3 周口服CML后发现,CML不仅不会引起肠道炎症,还可以改善实验性结肠炎小鼠的肠道菌群失调。肠道菌群对AGEs的作用关系十分复杂,其降解机理及菌群结构变化对机体健康的影响还需要更多的实验研究来证明。
3 AGEs的致病机理
随着临床研究的不断深入,越来越多的证据表明人体内AGEs过量积累与慢性疾病的发生密切相关。人体内的AGEs是外源性AGEs和内源性AGEs的总和。当体内AGEs含量过高,不能通过代谢等途径排出机体时,便会在组织器官吸附积聚,诱发或加剧机体病变。
目前,研究发现AGEs在体内的作用机制主要有两种:一是通过诱导体内蛋白质结构改变,促使蛋白质分子间发生交联、聚集,从而阻碍蛋白质的生理功能和正常机体代谢;二是与细胞表面多种受体结合产生大量活性氧,从而激活炎症细胞,造成组织损伤和病变形成[57]。AGEs受体主要包括AGEs受体复合物(AGE-R1、AGE-R2和AGE-R3等)和清道夫受体(SR-A、LOX-1、FEEL-2和CD36等)两种,其中研究最多的是晚期糖基化终未产物受体(receptor for AGEs,RAGE)。
RAGE是一种多配体受体,属于免疫球蛋白超家族,在慢性炎症反应和免疫功能障碍中起着重要的作用。AGEs与RAGE结合后会通过激活下游信号通路来引发各种疾病的发生:1)通过触发Ras介导的细胞外信号调节激酶(Ras-mediated extracellular signal-regulated kinase,Ras-ERK1/2)和蛋白激酶C/丝裂原活化蛋白激酶(protein kinase C/mitogen-activated protein kinases,PKC/MAPKs)等信号通路激活核转录因子(nuclear transcription factor-κB,NF-κB),或直接通过Janus激酶/信号转导与转录激活子(Janus kinases/signal transducer and activator of transcription,JAK/STAT)通路来诱导单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)、白细胞介素-6(interleukin 6,IL-6)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、细胞内黏附分子-1(intracellular cell adhesion molecule-1,ICAM-1)和血管细胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1)等基因表达,从而导致炎症、细胞增殖或细胞凋亡[58];2)通过激活NADPH氧化酶和线粒体途径增加活性氧的水平,造成机体发生氧化应激[59]。过量的活性氧可以促进AGEs形成并激活NF-κB来增强炎症反应,在糖氧化应激期间,NF-κB也可以促进活性氧的产生,并形成循环炎症反应;3)通过激活细胞内磷脂酰肌醇3激酶-丝氨酸激酶(phosphoinositide-3-kinase-serine threonine kinase,PI3K-AKT)通路,抑制胰岛素诱导的葡萄糖转运蛋白-4(glucose transporter-4,GLUT-4)易位,从而导致胰岛素抵抗和葡萄糖稳态受损[60-61];4)通过诱发内质网应激,形成炎症或细胞凋亡。AGEs在内质网中积累可以干扰正常的蛋白质折叠,并交联线粒体呼吸链中的蛋白质来抑制ATP合成,加剧活性氧的产生,然后通过信号级联诱导细胞凋亡或激活NF-κB形成炎症[62]。AGEs可能通过上述途径来引发细胞功能受损、细胞死亡,最终导致各种慢性疾病的发生(图3)。

图3 AGEs的简化致病机理Fig.3 Simplified pathogenesis of AGEs
随着患者数量的增加和致死率的逐渐升高,糖尿病已经严重威胁到了人类健康[63]。Hofmann等[64]通过给2型糖尿病小鼠喂食高水平和低水平的AGEs饮食发现,20 周后食用高水平AGEs饮食的小鼠体内胰岛素浓度升高,体质量明显增加,对葡萄糖和胰岛素的耐受性变差,这表明外源性AGEs的摄入可能会导致糖尿病加重。胰岛素抵抗和高血糖是糖尿病形成和加重的主要原因,糖尿病患者体内血糖水平较高,而高血糖可以加剧体内的糖基化过程,导致蛋白质代谢缓慢,并促进内源性AGEs的形成和积累,从而使糖尿病加重、血糖浓度升高,形成一种恶性循环[65]。除了糖尿病外,AGEs也能影响其并发症的产生。AGEs在体内积累可以诱导视网膜细胞中血管内皮生长因子的表达,从而破坏血-视网膜屏障和微血管的高通透性,导致人体视力下降甚至失明,发生糖尿病视网膜病变[66];AGEs的过量积累还能导致平滑肌细胞增殖、内膜增厚、血管硬化,并上调内皮细胞上VCAM-1的表达,诱导动脉粥样硬化[67-68]。此外,AGEs与肾脏细胞上的受体结合会引发氧化应激产生大量活性氧,并激活NF-κB通路和内质网应激,促进趋化因子、促炎因子和黏附分子的表达,从而加剧炎症、足细胞损伤和肾脏损伤,引起糖尿病肾病的形成[69-70]。
除了这些疾病外,AGEs还能导致癌症、阿尔茨海默病和神经性病变等疾病的发生[71]。就目前的研究进展而言,关于AGEs的致病机制还缺乏临床研究,其对慢性疾病的影响还有待进一步探讨。
4 AGEs的抑制方式和机理
AGEs的抑制方式可以分为外源性AGEs的抑制和内源性AGEs的抑制。
4.1 外源性AGEs的抑制
外源性AGEs的抑制主要是抑制食品加工和贮藏过程中AGEs的形成,可以通过改善食品加工与贮藏条件、添加外源抑制剂等方法实现(图4)。
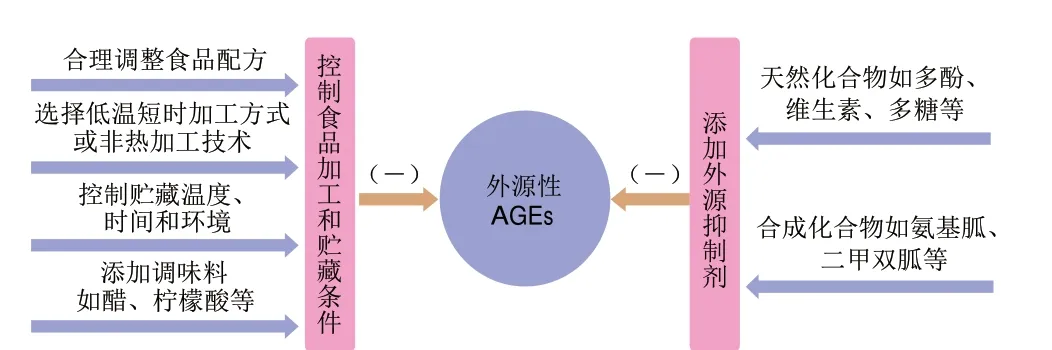
图4 外源性AGEs的抑制途径Fig.4 Inhibitory pathway of exogenous AGEs
4.1.1 控制食品加工和贮藏条件
在食品加工与贮藏过程中,AGEs的形成受多种因素的影响,包括食品组分、加热方式、加工温度、反应时间、贮藏温度、贮藏时间、水分含量及食品添加剂等[72]。
食品组分是AGEs形成的基础,一般肉制品中的AGEs含量要明显高于蔬菜和水果,这是因为肉制品中蛋白质和脂肪的含量丰富,而蔬菜水果中碳水化合物含量较多,蛋白含量少[73]。Goldberg等[74]在研究不同食品中AGEs的含量时发现,脂肪和蛋白质含量高的食物AGEs的含量都比较高,而像淀粉、水果和牛奶等碳水化合物含量高的食物AGEs的含量普遍较低,这可能是因为蛋白质和脂质容易氧化,这会促进活性二羰基化合物和自由基的产生从而促进AGEs的形成。因此应尽量减少高脂肪、高蛋白产品的摄入,多食用豆类、水果、蔬菜等食品,通过合理调整食品配方、清淡饮食来减少AGEs的摄入及抑制AGEs的形成。
加热方式、加工温度和反应时间是影响食品中AGEs生成的重要因素。Sun Xiaohua等[75]研究了碎牛肉在不同热加工条件下(65~100 ℃,0~60 min)对AGEs形成的影响,发现牛肉中CML和CEL的含量会随着加热温度的升高和加热时间的延长而逐渐增加。Chen Gengjun等[76]通过烘烤(177 ℃)、油炸(204 ℃)和烧烤(232 ℃)3 种方式来处理鸡肉、猪肉、牛肉和鱼肉,发现烧烤和油炸要比烘烤产生的CML含量高,其中烧烤的牛肉中CML含量最高,达到了21.8 μg/g。一般来说,反应温度每提高10 ℃,美拉德反应的褐变速率可以加快3~5 倍。因此,可以通过控制加热条件来抑制AGEs的生成,尽量选择低温、短时间的加工方式代替高温、长时间的加工方式,或者使用一些非热加工技术,如欧姆加热、高压加工等。
食品在贮藏过程中也会产生AGEs,贮藏时间、温度和水分含量等因素都会影响其形成速率。Aalaei等[77]在相同的储存温度下,比较食品中水分含量对AGEs形成的影响,发现在贮存200 d后水分质量分数为33%的奶粉要比水分质量分数为52%的奶粉中产生的CML含量高9.8~10.0 倍。Yu Ligang等[78]研究了(25 ℃)自然脱水香肠和(55 ℃)高温加工香肠在贮藏过程中CML和CEL含量的变化,发现随着贮藏时间的延长,香肠中CML和CEL的含量不断增加,其中高温加工香肠中的含量要比自然脱水香肠高,这可能是因为香肠在贮藏过程中脂肪发生氧化从而促进了AGEs的形成。这也表明随着贮藏时间的延长,食品中的营养成分含量下降,AGEs的含量升高,高温热加工不仅可以诱导食品在加工过程中产生AGEs,还会在储存过程中持续影响。因此,要尽量食用新鲜的、加工温度低、贮藏时间短的食品,控制好贮藏条件,减少AGEs的形成及摄入。
食品加工过程中常常会加一些调味料如盐、醋和柠檬汁等来改善食品的风味及颜色,这些调料品也可能会影响AGEs的形成。Li Yong等[79]在牛肉饼中加入NaCl、三聚磷酸盐和焦磷酸盐3 种盐来研究盐类对CML和CEL形成的影响,发现盐含量的增加会导致蛋白质羰基化加剧,席夫碱含量减少,在烤肉饼中加盐会促使CML和CEL的形成。与之相反的是,Uribarri等[73]将牛肉样品分别用柠檬汁和醋腌制1 h后烤制,发现两种酸性溶液均能抑制烤肉中AGEs的生成,这表明在食品加工前可以用酸性调味汁(醋、柠檬汁等)腌制原材料来抑制AGEs的形成。
在实际加工贮藏过程中,无论采用哪条途径抑制AGEs的生成都应尽可能保持食品的营养价值和感官特性。
4.1.2 添加外源抑制剂
除了改善加工条件外,添加外源抑制剂也是抑制食品中AGEs形成的常用方法。目前研究较多的抑制剂主要有多酚、维生素、多糖及生物碱等一些天然化合物,氨基胍等一些合成化合物虽然也有助于抑制AGEs,但会对人体产生副作用,其临床应用已经受到限制[80-81]。
多酚是食品中常添加的一种抗氧化剂,能通过清除自由基、螯合金属离子和捕获二羰基化合物等方式来抑制AGEs的形成,在预防心血管和糖尿病等疾病中有着重要的作用[82-83]。Lin Jing等[84]将槲皮素掺入面包中以开发抗糖化功能食品,结果发现添加0.2%槲皮素能够抑制蛋白质糖化过程中46%~52%的AGEs。Wu Qian等[85]将儿茶素和铁的复合物加入到醋中研究其在贮藏过程中对AGEs的作用,发现儿茶素可以清除醋中的自由基并减少CML和CEL的形成。Liu Guimei等[86]通过赖氨酸-葡萄糖模拟体系研究槲皮素对蛋白糖基化的抑制作用,发现槲皮素能清除体系中产生的自由基并捕获甲基乙二醛和乙二醛形成加合物。
除了多酚外,一些维生素和多糖等生物活性成分对AGEs也具有抑制作用。VC又称为抗坏血酸,常与亚硝酸盐一起应用到蒸煮火腿等肉品的加工中来抑制亚硝胺的产生,研究发现VC能与葡萄糖竞争性结合蛋白质从而减少AGEs的生成[87]。吡哆胺作为VB6的一种天然形式,也能在美拉德反应中清除二羰基化合物,并结合金属离子来抑制Amadori产物转化为AGEs[88]。壳聚糖是一种天然碱性多糖,Wang Shenwan等[89]研究发现在海绵蛋糕中添加0.5%的壳聚糖可以分别减少30.31%荧光性AGEs、51.68%游离态CML和42.43%游离态CEL的形成,并在不改变颜色的情况下提高蛋糕的硬度和水分含量,通过模拟体系实验他们认为壳聚糖对AGEs可能存在3 种抑制机制:1)抑制蛋白质氧化;2)与赖氨酸和精氨酸竞争还原糖从而降低底物的可用性;3)捕获甲基乙二醛和乙二醛,延缓二羰基化合物与蛋白质结合。
4.2 内源性AGEs的抑制
内源性AGEs的抑制主要是抑制内源性AGEs的形成及致病途径。内源性AGEs的形成受多种因素的影响,如外源性AGEs的摄入、体内血糖浓度和机体代谢能力等,要抑制其形成首先要控制外源性AGEs的摄入量[90],其次要加强锻炼。Goon等[91]通过对比发现,缺乏锻炼的人体内AGEs含量要高于经常锻炼的人,运动能抑制人体内AGEs的形成和积累。Rodrigues等[92]研究了在联合抗逆转录病毒疗法下体育锻炼对获得性免疫缺陷病毒(human immunodeficiency virus,HIV)感染者血清中AGEs水平的影响,发现非运动性HIV患者血清中的荧光性AGEs水平要显著高于健康个体和运动性HIV患者,为期3 个月的中等强度多模式运动能够让非运动性HIV患者体内AGEs含量恢复至健康个体或运动性HIV患者的水平。Malin等[93]研究运动训练并限制热量的摄入对慢性肾脏病人体内RAGE的影响,发现患者体内葡萄糖含量降低,RAGE的浓度下降,对胰岛素敏感性增加,这表明运动训练并限制热量的摄入可能有助于抑制体内RAGE的形成,从而延缓慢性肾病的发展。
天然化合物也能抑制内源性AGEs的形成及致病途径。小檗碱是一种从黄连中分离的生物碱,具有预防糖尿病及相关并发症的作用,Zych等[94]用50 mg/kgmb小檗碱来饲喂链脲佐菌素(streptozocin,STZ)诱导的糖尿病大鼠28 d,发现小檗碱可以显著降低小鼠体内醛糖还原酶的含量,抑制体内由多元醇途径导致的AGEs的形成。Al-Hussaini等[95]给1型糖尿病雄性大鼠连续45 d灌胃5 mg/kgmb白藜芦醇后发现,白藜芦醇可以抑制AGEs在肾脏中的积累,并减轻糖尿病引起的糖基化、氧化损伤和细胞凋亡。此外,白藜芦醇在模拟体系中还能抑制α-葡萄糖苷酶和α-淀粉酶的活性,从而减少底物葡萄糖的形成[96]。Liu Jianli等[97]发现阿魏酸也可以有效抑制AGEs的形成,并显著减少AGEs诱导的人脐静脉内皮细胞中活性氧的含量,通过抑制NF-κB和p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinases,p38MAPK)信号通路的激活来减轻炎症反应。Rajan等[98]研究发现用热加工饮食(富含食源性AGEs)饲喂6 个月的小鼠心脏和肾脏的质量比显著增加,促炎标志物基因(TNF-α、IL-6、MCP-1和NF-κB等)及RAGE的表达量显著上调,而在饮食中添加姜黄素的小鼠其心脏和肾脏组织的质量比和促炎基因的表达量显著降低,RAGE的水平恢复正常,表明天然抗氧化物姜黄素能够中和外源性AGEs诱导的不良炎症作用。绿原酸是自然界中含量丰富的一种多酚,具有免疫保护、抗氧化和抗炎等功效,Bao Liping等[99]用细胞实验来探索绿原酸对肾病的潜在机制,发现绿原酸可以通过调节核转录因子红系2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)通路来减轻氧化应激,还能通过抑制NF-κB通路来缓解糖尿病肾炎。Mei Xiyu等[100]也发现绿原酸可以抑制STZ诱导的高血糖小鼠血清中血管内皮生长因子水平的升高,并通过阻碍其表达和视网膜新生血管的生成来减轻糖尿病视网膜病变。在体外实验中绿原酸还能抑制AGEs和胶原蛋白的交联作用,且作用效果比氨基胍更好[101]。
综上所述,天然化合物对内源性及外源性AGEs的抑制机制可以归结为以下8 个方面(图5):1)竞争性结合底物蛋白质,与葡萄糖竞争性结合游离氨基上的位点,防止糖分子附着到蛋白质上;2)清除自由基,抑制葡萄糖和脂质的氧化反应,减少活性羰基化合物的生成;3)捕获活性二羰基化合物并形成加和物,降低中间产物含量;4)螯合金属离子,防止还原糖、脂类和Amadori产物的自动氧化;5)阻碍AGEs与蛋白质交联,防止蛋白质结构和功能被破坏造成机体损伤;6)抑制α-淀粉酶和α-葡萄糖苷酶活性,增加胰岛素水平,降低血糖浓度;7)抑制醛糖还原酶活性,防止葡萄糖通过多元醇途径形成AGEs;8)阻断AGEs与RAGE结合,抑制RAGE的表达。
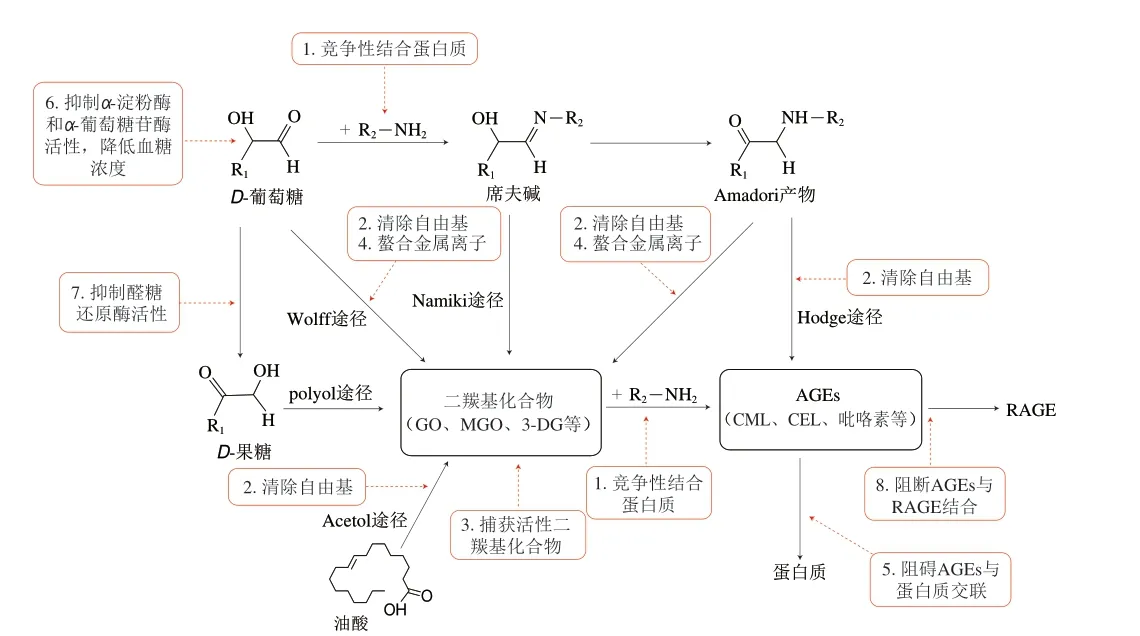
图5 天然化合物抑制AGEs的可能机理Fig.5 Possible mechanism of inhibition of AGEs by natural compounds
5 结 语
随着AGEs在相关疾病中的研究不断深入,如何控制AGEs的形成已经成为近年来研究的热点问题。本文主要总结了AGEs的形成途径、体内代谢、致病机理及抑制方法。AGEs的形成方式多样、种类繁多,在体内过量积累容易导致氧化应激、炎症、糖尿病及其相关病症的产生,研究发现一些天然化合物如多酚、多糖和维生素等物质的作用效果要比合成化合物更显著,且其副作用更小,不仅能作用于食品加工过程,还能抑制体内AGEs的生成及其致病途径,是控制AGEs的有效方法。虽然目前对AGEs的研究投入逐渐增加,但仍然存在一些问题有待解决:1)AGEs的形成方式多样、结构复杂,还存在很多化合物尚未被发现;2)AGEs对细胞内信号传导通路的影响还不明确;3)AGEs在体内的消化吸收特性及其对肠道菌群的作用尚不清楚;4)天然化合物对AGEs形成的作用机制及其对人体疾病影响的临床研究还比较少。
