吲哚-3-丙酸对大鼠急性脊髓损伤的神经保护作用及机制研究
2023-10-16徐纪伟孙丹华陈旭东王宁孙壕烨
徐纪伟孙丹华*陈旭东王宁孙壕烨
(1. 漯河医学高等专科学校基础医学部,河南 漯河 462000;2. 漯河医学高等专科学校第三附属医院,河南 漯河 462000)
脊髓一旦损伤就会造成神经传导功能的部分或完全丧失,导致患者出现截瘫、四肢瘫等症状,累及呼吸、泌尿等系统,甚至危及生命。 吲哚-3-丙酸(indole-3-propionic acid,IPA)是一种肠道菌群产生的代谢产物,可通过细胞膜蛋白转运或直接扩散至血液、外周组织和大脑中,减轻炎性浸润、增强病原菌抗性、改善胰岛素抵抗、抑制氧化应激等方式,对肿瘤发生、肠道疾病、代谢性疾病、辐射损伤、肝疾病有重要意义[1-3]。 近年来研究发现IPA 能够穿透神经系统血脑屏障、促进细胞增殖分化、调节胶质细胞活性,在阿尔茨海默病(Alzheimer’s disease,AD)、亨廷顿病(Huntington’s disease, HD)、抑郁症、脑缺血缺氧损伤等神经系统疾病中也有重要作用[4-5],但尚未见将其应用于急性脊髓损伤的研究报道。 根据IPA 对神经系统具有减轻组织炎性反应、促进细胞增殖分化、调节胶质细胞活性的作用,通过制作大鼠急性脊髓损伤模型,然后腹腔注射给予IPA 观测动物模型的变化,检查脊髓内CGRP、Syn、GFAP、Caspase3、IL-1β 表达变化,对大鼠进行BBB 运动功能评分、斜板实验和甩尾实验评估,探讨IPA 改善大鼠肢体运动功能及感觉功能的作用和机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
105 只SPF 级的健康雌性大鼠,7 周龄,体重180~200 g,在河南省实验动物中心提供【SCXK(豫)2022-0001】,动物饲养条件:每只大鼠提供12 h 光照与12 h 黑暗昼夜光照变化周期,自由获取高压消毒灭菌水和固态食物,饲养环境保持安静、防止噪音、整洁干净,(20 ± 2)℃和60% ± 5%湿度,由河南省实验动物中心饲养【SYXK(豫)2018-0007】。 严格遵循实验动物使用的3R 原则,并经漯河医学高等专科学校医学伦理委员会批准(LYZLLSC2022032602)。
1.1.2 主要试剂与仪器
IPA(源叶生物科技公司,830966);CGRP 抗体(博士德生物公司,M04247);GFAP 抗体(Santa Cruz,sc33673);Caspase3 抗体(Bioss,bsm33199M);IL-1β 抗体(博奥森生物公司, AH11087750);Necab2 抗体(Proteintech Group,122571AP);GAP43抗体(博士德生物公司,BA0878)。 荧光显微镜(尼康TS-100F,日本),垂直凝胶电泳仪(六一仪器DYCZ-24D,中国), 低温高速离心机(赛默飞IECCL31R,美国)。
1.2 方法
1.2.1 实验分组
105 只SD 大鼠随机分为3 组:假手术组、生理盐水组和吲哚-3-丙酸组,每组35 只,注意选取的大鼠体重均匀、单独鼠笼饲养、环境基本相同。 动物实验操作处置符合国家科技主管部门制定的实验动物护理和使用指导意见。
1.2.2 造模及给药
采用腹腔注射戊巴比妥钠(按照30 mg/kg 计算)麻醉大鼠,然后呈俯卧位趴在动物手术台上,四肢和牙齿用橡皮筋固定,剪除背毛、消毒及铺巾,沿背部正中剪开皮肤,逐层钝性分离皮下组织、骨膜组织及肌肉组织,暴露胸9 ~10 节段,用咬骨钳去除胸椎棘突和椎板,露出硬脊膜和脊髓。 对生理盐水组和吲哚-3-丙酸组的大鼠,使用10 g 冲击棒从30 mm 高处自由坠落击打暴露脊髓节段,成功实施钝挫伤大鼠脊髓操作,而对假手术组的大鼠,只咬除胸9 ~10 节段的棘突和椎板,充分露出硬脊膜和脊髓组织[6],随即药物止血并逐层缝合手术切口。术后大鼠放置在加热垫上苏醒恢复,每天3 次膀胱护理,一直到能自主排尿功能恢复,随后改为常规护理喂养。 术后1 周内,每天注射青霉素(按照2 ×104U/kg 计算),每天2 次。 手术后1 周内,吲哚-3-丙酸组按25 mg/kg 剂量腹腔注射IPA[7],生理盐水组按照同等的量腹腔注射0.9% NaCl 溶液,每天1 次。
1.2.3 运动及感觉功能评价
术后第1、3 天、1 周、2 周、3 周、4 周,取大鼠进行BBB 运动功能评分、斜板实验和甩尾实验。 BBB是评估后肢关节的活动度、爪的精细动作、肢体的协调性及稳定性,术后第1、3 天、1 周、2 周、3 周、4 周大鼠放在直径为1 m 的圆形开放空间,观察评定大鼠肢体的运动功能情况,完全瘫痪的大鼠记为0 分, 正常为21 分[8]。 斜板实验是大鼠头朝前,身体纵轴与斜板纵轴垂直放置,升高或降低斜板5°,同时大鼠能够停留5 s,记录出现此种情况最大斜板角度。 甩尾实验是将大鼠放入固定器,暴露尾部用光辐照,辐照部位固定在尾部的中、下1/3 处,记录从光照射开始到出现甩尾反应的时间[9]。
1.2.4 免疫荧光染色观察
术后各小组在第1、3 天、1 周、2 周、3 周、4 周均取5 只大鼠,麻醉后,依次分别灌注250 mL 的生理盐水和4%多聚甲醛,收集胸9 ~10 节段的神经组织,进行石蜡切片。 切片分别滴加CGRP、Syn、GFAP 等特异性蛋白标记抗体,置4℃冰箱过夜,PBS 缓冲液漂洗3 次× 5 min,加对应的TRITC 或FITC 标记荧光二抗,置37℃温箱避光孵育1 h,PBS缓冲液漂洗3 次× 5 min,滴加缓冲甘油封片剂后,在荧光显微镜下观察计数。
1.2.5 免疫蛋白印迹检测
术后2 周各小组均取5 只大鼠,取胸9 ~10 段上下各0.5 cm 脊髓组织,放置冰上充分研磨匀浆,随即低温高速离心15 min,弃沉淀物取上清液,置入EP 管待用。 通过聚丙烯酰胺凝胶电泳SDS-PAGE分离蛋白,并转移至PVDF 膜上等待检测。 先分别滴加CGRP 抗体、Syn 抗体、GFAP 抗体、Caspase3 抗体、IL-1β 抗体,4℃冰箱过夜,PBS 缓冲液漂洗3 次,再滴加对应的生物素化二抗,放置室温20℃孵育2 h, PBS 缓冲液漂洗3 次× 5 min,滴加ABC 试剂在暗环境下显色,重复操作3 次,测定目的蛋白/β-actin 的吸光度值。
1.3 统计学分析
应用SPSS 20.0 统计软件分析处理。 多组间数据比较采用单因素方差分析,组内数据比较采用配对t检验,实验结果以平均值± 标准差(±s)表示,P<0. 05 表示差异具有统计学意义。
2 结果
2.1 运动功能评价
斜板实验与BBB 评分结果表明,从术后第1 周到术后第4 周IPA 组的两种运动功能测试结果均明显高于生理盐水组(P<0.05)(见图1)。
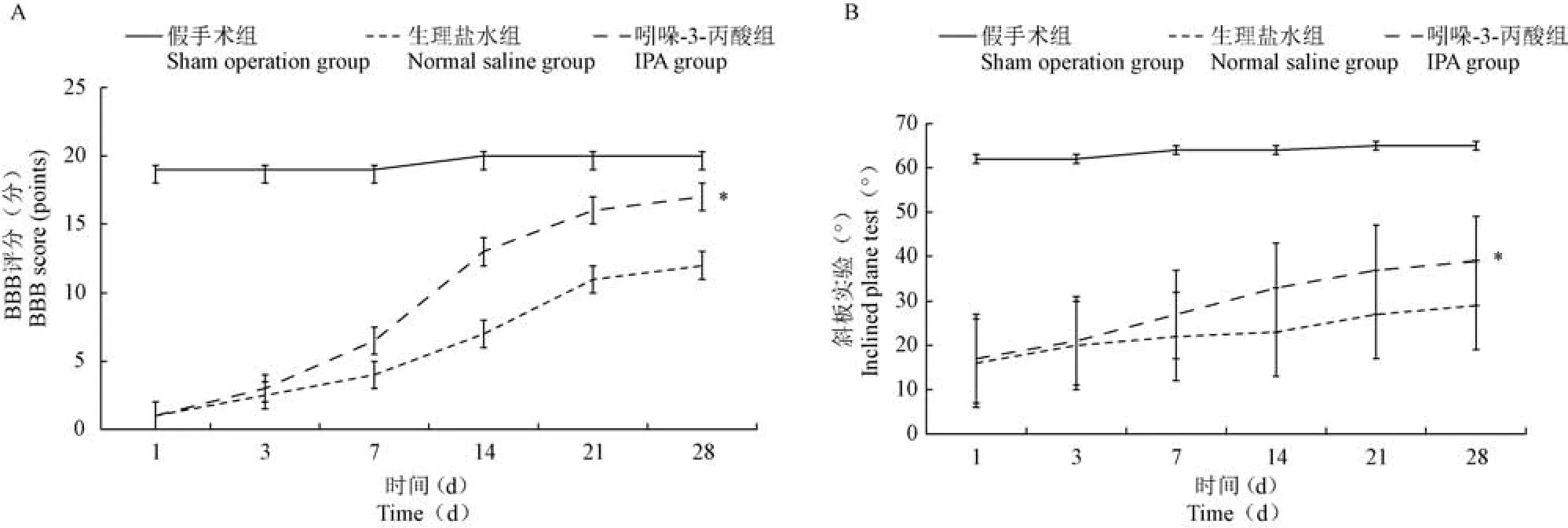
图1 三组运动功能评价结果比较(n =30)Figure 1 Comparison of motor function among the three groups(n =30)
2.2 感觉功能评价
甩尾实验检测结果表明,从术后第3 天起IPA组潜伏期明显高于生理盐水组,且到术后第2 周IPA 组潜伏期基本恢复正常(P<0.05)(见图2)。
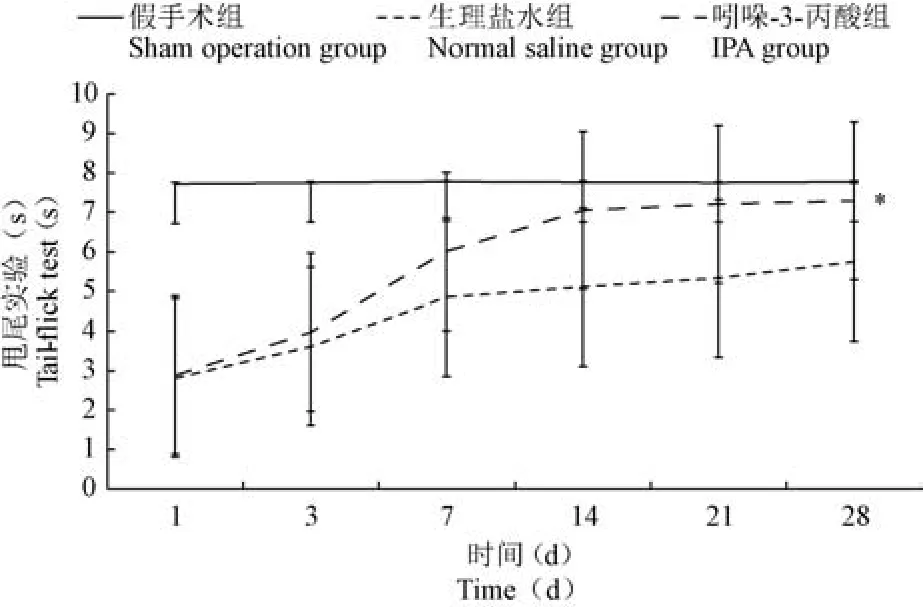
图2 三组甩尾实验结果比较(n =30)Figure 2 Comparison of tail dump test among the three groups(n =30)
2.3 免疫荧光染色观察
免疫荧光染色结果表明,假手术组发现大量CGRP、Syn 阳性细胞和少量Caspase3、GFAP 阳性细胞;术后生理盐水组和IPA 组CGRP、Syn 阳性细胞均出现大量减少,随后两组CGRP、Syn 阳性细胞开始逐渐增多,到术后第2 周就已达到高峰,且IPA 组CGRP、Syn 表达水平明显高于生理盐水组(P<0.05);生理盐水组和IPA 组GFAP 阳性细胞随时间延长逐渐增多,且到术后第2 周就已达到高峰,之后表达水平才有所下降,但IPA 组GFAP 表达水平明显低于生理盐水组(P<0.05);术后第1 天IPA组和生理盐水组均大量出现Caspase3 阳性细胞,随后两组表达出现逐渐减少,且IPA 组明显少于生理盐水组(P<0.05)(见图3)。
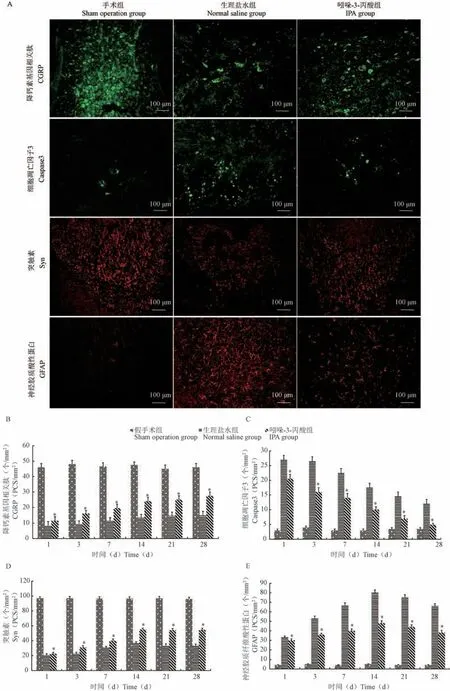
图3 术后2 周CGRP、Syn、GFAP、Caspase3 蛋白表达变化(n =30)Figure 3 Changes of CGRP, Syn, GFAP, Caspase3 protein expression at 2 weeks(n =30)
2.4 免疫荧光双标观察
IPA 组发现脊髓损伤后第2 周CGRP 与GAP43明显共表达,CGRP 与Necab2 在邻近细胞呈现互补表达(见图4)。
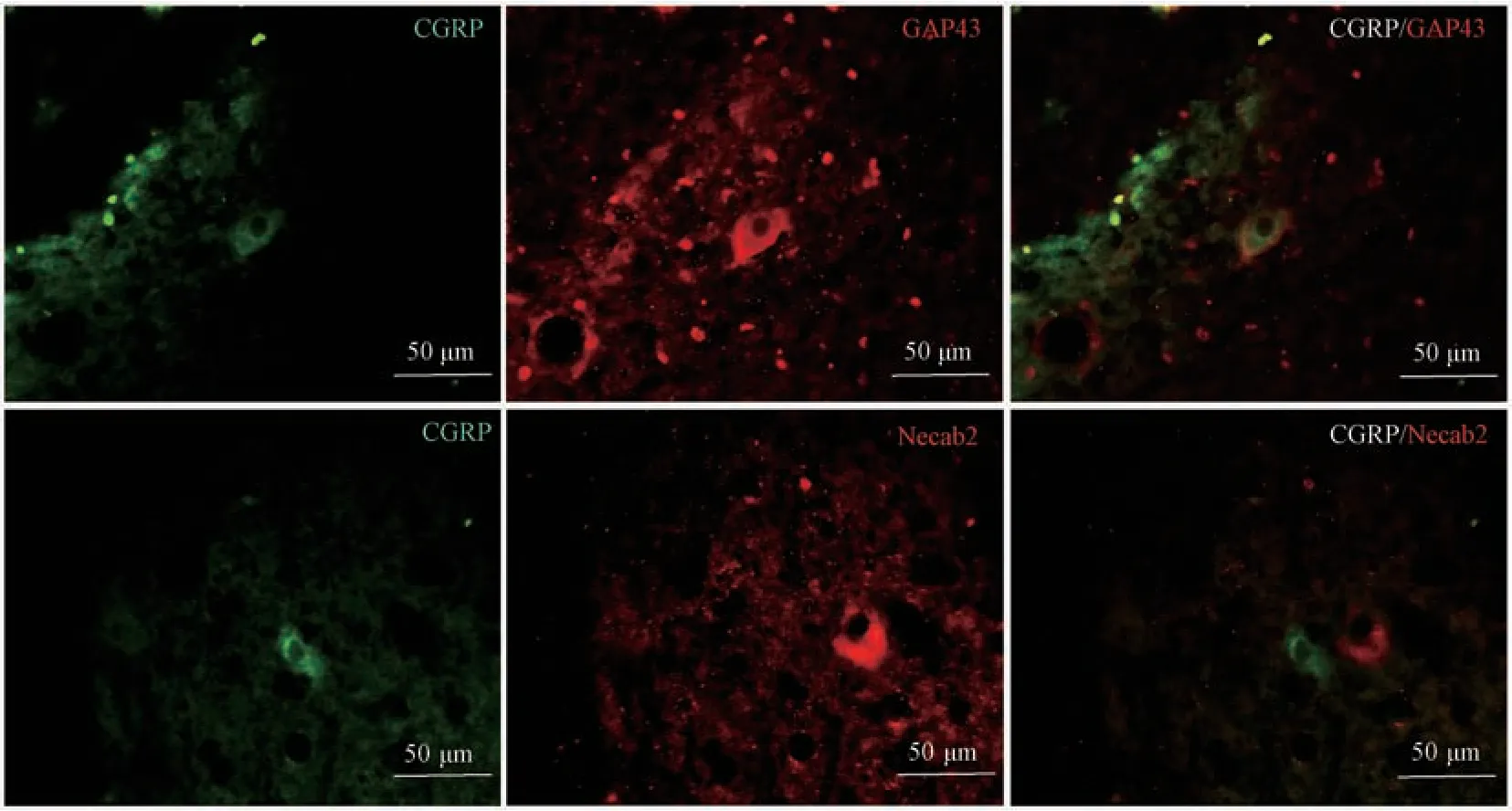
图4 术后2 周CGRP/GAP43、CGRP/Necab2 免疫荧光双标染色观察Figure 4 CGRP/GAP43 and CGRP/Necab2 immunofluorescence double staining were observed after SCC at 2 weeks
2.5 Western Blot 检测
免疫印记结果显示,术后第2 周IPA 组的CGRP、Syn 表达明显高于生理盐水组(P<0.05),术后第2 周GFAP、Caspase3、IL-1β 表达明显低于生理盐水组(P<0.05)(见图5)。
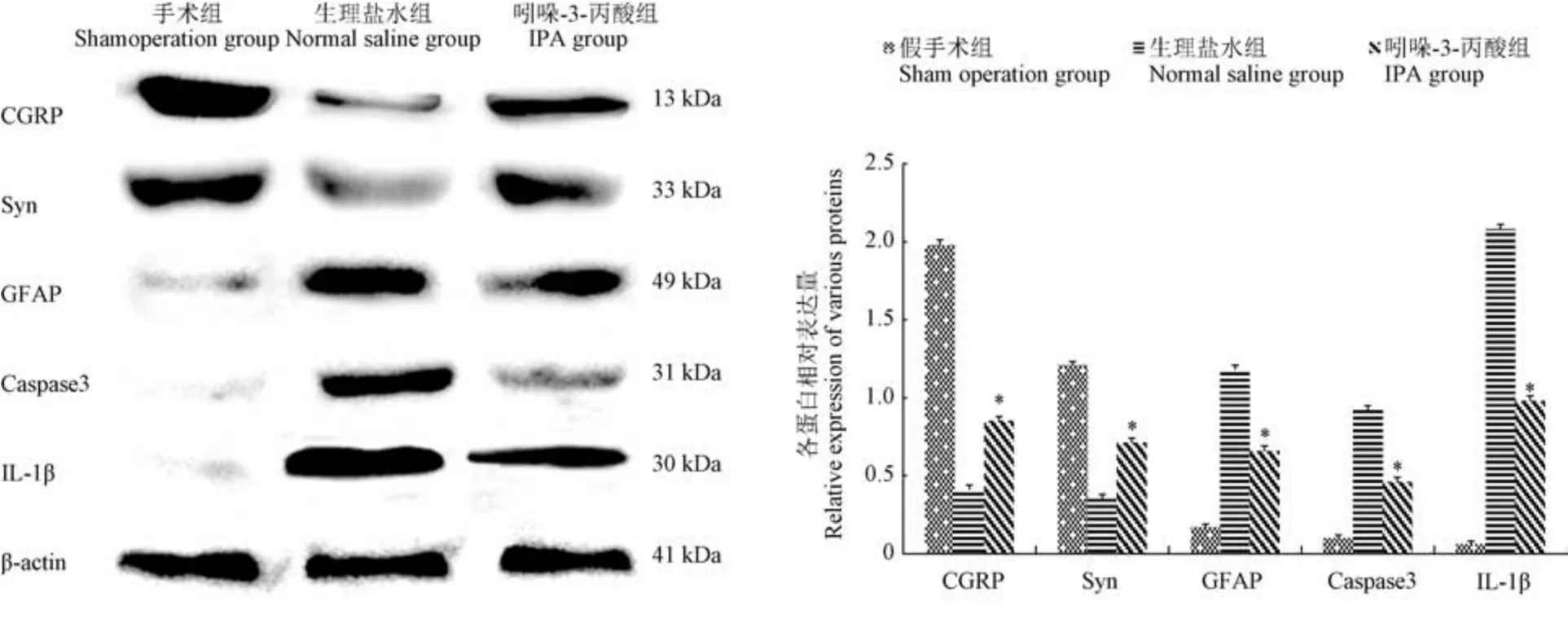
图5 免疫印迹检测术后2 周CGRP、Syn、GFAP、Caspase3、IL-1β 蛋白表达Figure 5 CGRP, Syn, GFAP, Caspase3 and IL-1β expression by Western Blot after SCC at 2 weeks
3 讨论
IPA 主要是由肠道细菌产生的一种色氨酸代谢产物,还是孕烷X 受体(PXR)或芳烃受体(AhR)的内源性配体[10],具有穿透神经系统血脑屏障、减轻组织炎性反应、促进细胞增殖分化、调节胶质细胞活性、抑制氧化应激的作用,对肿瘤发生、肠道疾病、代谢性疾病、辐射损伤、肝疾病及神经系统疾病有重要意义。
本实验发现脊髓损伤后大剂量应用IPA 能明显增强CGRP、Syn 蛋白表达水平,同时发现CGRP与GAP43 出现共表达现象,而CGRP 与Necab2 在邻近细胞呈现互补表达,BBB 评分、斜板实验和甩尾实验均表明动物肢体感觉及运动功能出现明显恢复。 推测这是因为IPA 可以通过结合转录因子孕烷X 受体,促使乙酰辅酶A 结合蛋白(ACBP,又称DBI)表达,不仅促进神经细胞增殖分化,增强神经轴突再生修复能力[11-15],还可促进Syn 大量表达有利于神经突触分化发育,提升突触信号传递及神经冲动传导效率;已有研究发现IPA 可以通过激活MTR1/PGC-1α 信号通路,明显上调UCP2 基因转录水平、显著抑制ROS 大量生成,积极改善线粒体结构与维持内稳态[16],促进神经生长蛋白GAP43 大量表达,增强神经细胞轴突再生修复功能,重建脊髓内神经纤维形态结构,抑制由氧化应激所引发的细胞凋亡现象。 已有实验表明脑和脊髓损伤后采取针刺康复介入治疗后CGRP 出现大量表达,通过抑制兴奋性谷氨酸的释放,改变细胞膜钙通道蛋白结构,降对低钙离子的通透性,进而阻止谷氨酸介导的钙离子内流,从而维持细胞内外钙离子的平衡,阻止脊髓组织出现钙超载现象[17-18],另外研究还发现脊髓损伤后NECAB2 与CGRP 发挥协同作用,共同调节神经突触内谷氨酸转运平衡,以免谷氨酸过度释放造成兴奋性中毒,进而有利于神经突触发育重塑,提升神经突触传递信息效率,增强神经细胞的突起生长率及神经细胞轴浆运输能力,与其他营养因子共同调节轴突再生修复[19]。
此外现有研究还发现高浓度的IPA 可以减少中枢神经系统S100b 表达,降低神经胶质细胞中钙离子的浓度,促进神经细胞增殖与分化,抑制星形胶质细胞活化,上调抗细胞凋亡因子Bcl-2 水平,抑制神经细NLRP3 炎性小体激活,减少神经组织内炎症介质IL-1β 分泌水平[20-22]。 IPA 已被证明是β-淀粉样蛋白原纤维形成的抑制剂,显著抑制内质网应激和随后的神经元细胞死亡,是针对多种氧化毒素的有效神经保护剂[23-24]。 在大脑皮层神经元中应用nAChR 和L 型HVCC 拮抗剂抑制可以减少DBI 表达,观察到DBI(ACBP)表达与钙离子变化有关联性[25]。 大剂量使用IPA 治疗有机磷杀虫螨剂CPF 引起的神经损伤,明显增强GST、CAT、SOD、GPX、TSH 及GSH 水平,通过提高动物大脑和小脑组织中的硫氧还蛋白水平和硫氧还蛋白还原酶活性,增强体内胆碱能和氧化还原调节系统功能,抑制炎症应激、半胱天冬酶激活和DNA 损伤[7]。 IPA不仅能够大量清除体内的活性氧,而且还可以与抗氧化剂谷胱甘肽在细胞内协同发挥作用,更不会转化为具有促氧化作用的反应性中间体[26]。 IPA 还能减轻由缺血缺氧所引起的神经细胞损伤,有效缓解辐射造成的胃肠道损伤和肠道菌群变化[2]。 糖氧剥夺离体脑缺血模型中IPA 通过激活PXR/ACBP 信号,显著抵消连接蛋白的减少,并下调p-IκB-α、 p-NF-κB 水平,减轻脑内炎症反应引发的组织损伤[27-28]。 根据目前研究及本实验进一步表明,脊髓损伤后大剂量应用IPA,不仅通过PXR/ACBP 信号通路促进神经细胞增殖与分化,还可通过MTR1/PGC1α 途径稳定线粒体功能,明显有利于CGRP、Syn 大量表达,且CGRP 能够与GAP43 共表达、与Necab2 互补表达,稳定了细胞内外的钙离子浓度,利于神经突起的再生修复,诱导神经突触分化发育,最终能够恢复肢体感觉及运动功能。
本实验发现脊髓损伤后大剂量应用IPA 能明显降低GFAP、Caspase3、IL-1β 蛋白表达水平,减轻组织内的炎症损伤反应、减少细胞发生凋亡现象、阻止脊髓形成神经胶质瘢痕。 推测这是IPA 通过促进抗炎细胞因子IL-10 的大量释放,抑制A1 型反应性星形胶质细胞的活化,降低肿瘤坏死因子TNF-α、 白细胞介素IL-1α 和血清补体C1q 表达水平,减少神经胶质纤维酸性蛋白GFAP 表达[29-30],进而阻止脊髓组织形成神经胶质瘢痕;IPA 还可以通过抑制脂质过氧化,降低谷胱甘肽及其过氧化物酶的表达水平,进而减少凋亡因子Caspase 3 和Bax的表达水平[5],阻止神经细胞出现大量凋亡现象,有利于损伤区域内神经细胞存活;IPA 通过抑制核转录因子NF-κB 信号传导途径,下调白细胞、巨噬细胞促炎性基因转录水平,减少白细胞介素IL-1β和IL-18 大量产生,抑制损伤区域氧化应激、减轻组织细胞炎症反应[31-32]。 现有研究发现IPA 治疗自身免疫性脑脊髓炎小鼠降低星形胶质细胞中的Ccl2、Nos2 表达,通过与Ⅰ型干扰素联合作用激活AHR 信号以控制神经炎症[33]。 IPA 在短暂性前脑缺血模型鼠的海马CA1 区,通过降低神经胶质纤维酸性蛋白GFAP、酸性钙结合蛋白S100、小胶质细胞Iba1 和植物凝集素IB4 的表达水平,进而发挥神经保护作用及其抗氧化作用[20]。
此外还有研究发现IPA 对大鼠脂肪性肝炎有明显治疗效果:一是诱导紧密连接蛋白ZO-1 和Occludin 的表达,维持肠道粘膜上皮细胞的稳态,降低血浆内毒素水平;二是抑制NF-κB 信号传导途径,减少炎细胞因子TNF-α、IL-1β、IL-6 表达水平,减轻肝炎症反应程度,最终通过抑制肠道菌群失调和内毒素渗漏,缓解脂肪性肝炎造成的损伤[34]。 脓毒症脑病中IPA 通过AHR 介导的机制,显著抑制脂多糖刺激的小胶质细胞中NLRP3 炎性体激活,减少IL-1β 分泌,减轻了小鼠的焦虑和空间记忆障碍[35]。 IPA 可以穿过血脑屏障并调节星形胶质细胞激活和神经炎症,还可以抑制内质网应激诱导的神经元死亡,减少脑脊髓炎小鼠的神经炎症,这些研究表明IPA 对神经元具有保护作用[36]。 根据目前研究及本实验进一步证实,脊髓损伤后大剂量应用IPA,一是可以通过抑制核转录因子NF-κB 信号传导途径,阻止脊髓内出现脂质过氧化现象,减轻神经组织内的炎症损伤反应程度,抑制神经细胞出现大量凋亡的现象,二是可以通过抑制A1 型反应性星形胶质细胞的活化,防止脊髓内部形成神经胶质瘢痕,改善了脊髓损伤部位的微环境,利于神经细胞存活及增殖,促进神经突起再生修复,进而重建脊髓组织形态结构。
总之,脊髓损伤后大剂量应用吲哚-3-丙酸能明显增强CGRP、Syn 表达水平,且CGRP 与Necab2 互补表达、而与GAP43 共表达,有利于钙离子平衡、突起再生和突触重塑, 通过抑制脊髓内GFAP、Caspase3、IL-1β 表达水平,减轻组织炎症损伤反应、抑制星形胶质细胞活性、减少脊髓内细胞凋亡现象,利于损伤区域内神经细胞存活、阻止脊髓组织内形成神经胶质瘢痕,恢复动物肢体感觉及运动功能,重建脊髓组织形态结构。 但是目前关于IPA 对急性脊髓损伤治疗只是处于实验研究阶段,免疫荧光双标CGRP 与Necab2、GAP43 的表达结果,提示其有利于突起再生及突触重建,但还需要免疫沉淀进一步证实蛋白之间的协同作用,同时对于脊髓损伤的临床应用效果仍需后续进一步研究。
