0~360日龄藏绵羊瘤胃真菌群落的动态演替
2023-10-16马玉红吴国芳索宏德贺丽霞
王 磊,马玉红,吴国芳*,索宏德,贺丽霞
(1.青海大学 畜牧兽医科学院/青海省高原放牧家畜动物营养与饲料科学重点实验室,青海 西宁 810016;2.青海省牦牛工程技术研究中心,青海 西宁 810016;3.青海省高原家畜遗传资源保护及创新利用重点实验室,青海 西宁 810016;4.大通县桥头镇畜牧兽医站,青海 海东 810600;5.汉中市动物疫病预防控制中心,陕西 汉中 723000)
瘤胃含有多种原核(细菌和古细菌)和真核(原生动物和真菌)微生物,其中20%的瘤胃厌氧真菌在降解纤维素方面发挥重要作用[1],其参与植物源性聚合物向单体的初始转化,不仅能利用根茎穿透植物细胞壁的角质层和木质素,还能分泌降解植物细胞壁的水解酶,包括纤维素酶、半纤维素酶(木聚糖酶)、酯酶(阿魏酰酯酶、乙酰酯酶和对香豆酸酯酶)、漆酶和纤维素酶[2-3],从而分解粗饲料(如稻草、干草、青贮饲料)中的纤维素,产生可供反刍动物能量代谢的挥发性脂肪酸(volatile fatty acids,VFA)等代谢小分子[4],从而提高反刍动物的生产力[5]。因此,瘤胃微生物在饲料转化、生产性能和动物健康方面起着关键作用[6]。瘤胃厌氧真菌分泌体代谢底物以提供营养,因此,它是真菌竞争力的决定因素,对真菌生长和繁殖至关重要[7]。瘤胃真菌群落的组成受许多因素影响,如环境、饮食、喂养方式和年龄[8]。日粮精料比显著影响瘤胃中厌氧真菌的组成,随着日粮精料比例的增加,子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和接合菌门(Zygomycota)显著增加[9]。前期研究表明缓释尿素可影响牦牛瘤胃的微生物群落和多样性,缓释尿素的增加降低了牦牛瘤胃毕赤酵母菌(Pichia)和地丝菌(Geotrichum)的丰度[10]。在奶牛瘤胃真菌的演替过程中,厌氧真菌Orpinomyces和新木犀科(Newcallimastigaceae)的相对丰度随着日龄和断奶前的饮食变化而变化[11]。
成年反刍动物的瘤胃是一个成熟、稳定的微生物生态系统,宿主与微生物之间具有很强的互作性。因此,在外源性干预(例如瘤胃液移植和添加外源性菌制剂或抗生素)后,瘤胃的微生物组组成和微生物发酵参数可恢复到其原始或干预前的状态[12]。新生或反刍动物瘤胃发育的早期是饮食干预瘤胃微生物定植的最佳时期[13]。研究表明,对新生山羊进行连续3个月饮食干预可改变断奶后羔羊瘤胃微生物的组成,并影响宿主表型(如甲烷排放或VFA组成)[14]。研究发现,与成年反刍动物瘤胃液移植相比,对幼龄反刍动物进行瘤胃微生物移植可以有更好、更长期的干预效果[12]。总的来讲,在对新生或幼龄反刍动物进行瘤胃微生物移植前,必须系统深入地了解其瘤胃微生物的动态演替规律,从而可确定最佳干预时间和目标微生物。前期的研究探索了不同年龄、饮食和喂养条件下藏羊瘤胃细菌和古菌的动态演替过程[9,15],然而关于藏羊瘤胃真菌的系统研究较少,特别是在藏绵羊的幼龄阶段。因此,本研究选取放牧条件下,不同年龄阶段(0、2、7、14、28、42、56、70和360 d)藏绵羊27只,采集其瘤胃内容物进行ITS基因测序,深入研究不同日龄羔羊瘤胃真菌组成及动态演替规律。
1 材料与方法
1.1 试验地点与生态环境
本试验在青海省黄南州尖扎县措周乡洛哇村却巴养殖专业合作社(北纬36°39′20″~36°10′00″,东经101°37′43″~102°08′40″)进行。试验牧场草地面积1 266 hm2,平均海拔3 500 m以上,年平均气温7.8 ℃,年平均降雨量350~400 mm。草场植被覆盖率高,分布面积大,夏季主要植物包括莎草科矮蒿草、小蒿草、线叶蒿和其他相关植物(矮火绒、小早熟禾、高山唐松草);秋季主要植物包括苔藓(小叶苔藓和大叶苔藓)、小莎草和其他相关植物(如早熟禾、芒属和针禾属);冬春季主要植物包括苔藓、小蒿草、狗尾草、针茅草、珠芽蓼等。牧草营养成分(以干物质计,%):春季:干物质(DM)93.4±0.94、粗蛋白6.35±1.21、中性洗涤纤维(NDF)64.28±1.83、酸性洗涤纤维(ADF)37.42±1.48、粗灰分(Ash)7.62±0.31;夏季:干物质(DM)94.35±0.81、粗蛋白16.02±1.82、中性洗涤纤维(NDF)47.98±6.56、酸性洗涤纤维(ADF)22.41±2.19、粗灰分(Ash)9.22±2.22;秋季:干物质(DM)94.81±0.81、粗蛋白8.69±2.81、中性洗涤纤维(NDF)57.34±3.84、酸性洗涤纤维(ADF)30.48±4.12、粗灰分(Ash)10.01±2.11;冬季:干物质(DM)95.23±1.08、粗蛋白6.72±0.84、中性洗涤纤维(NDF)62.57±1.14、酸性洗涤纤维(ADF)34.15±1.32、粗灰分(Ash)8.46±0.38。
1.2 试验动物及饲养管理
选择年龄、胎次相近的60只2胎健康藏羊母羊作为试验备选母羊,于2016年7月进行同期发情处理并人工授精。在配种后60 d、90 d对试验备选母羊进行B超早期妊娠诊断。选择确认怀孕、体况良好的妊娠母羊作为最终试验用母羊。2016年12月母羊产羔后,根据羔羊瘤胃发育阶段分为4组:非反刍阶段Non(D0、D2、D7和D14)、过渡阶段Trans(D28、D42和D56)、反刍期Rumi(D70)和成年期Adult(D360)[16]。母羊和羔羊均在全放牧条件下饲养,不进行任何补饲。羔羊和母羊白天分开饲养,晚上一起饲养。在第14天之前,羔羊只喂母乳。第14天之后,小羊和母羊一起放牧,在整个试验过程中可以自由饮水。放牧羔羊在D70自然断奶。在对应的日龄阶段,羔羊(n=3)在早晨禁食2 h后,通过注射硫喷妥钠(0.125 mg/kg体重)和氯化钾(5~10 mL)实施安乐死,然后通过手术切除瘤胃[17],收集瘤胃液,置于10 mL无菌低温冻存管中。D0和D2羔羊体内取出瘤胃并用无菌生理盐水冲洗,其他瘤胃样本通过4层纱布过滤,并储存在-80 ℃。
1.3 DNA提取、建库和测序分析
1.3.1 DNA提取与PCR扩增 采用CTAB法提取基因组DNA样本[18]。使用NanoDrop 1000分光光度计(Thermo Fisher Scientific,San Jose,CA,USA)和琼脂糖凝胶电泳检测纯度和DNA浓度。样品在离心管中用无菌水稀释至1 ng/μL。使用引物对ITS1F/ITS2R(ITS1F:5'-CTTGGTCATTAGGAAGTAA-3'和ITS2R:C5'-GCTGCGTTCCATCATGC-3')[19-20]常规程序扩增真菌ITS序列。PCR产物用2%琼脂糖凝胶电泳回收,并用AxyPrep DNA凝胶提取试剂盒(Axygen Biosciences,Union City,CA,USA)纯化,然后用Tris-HCl洗脱并用2%琼脂糖凝胶电泳分析。使用Quanti-FluorTM-ST(Promega,Madison,WI,USA)进行检测和定量。
1.3.2 Illumina MiSeq测序 根据Illumina MiSeq平台(Illumina,San Diego,CA,USA)标准操作方案将纯化和扩增的片段构建到PE 2×300文库。原始FASTQ文件通过Trimmomatic进行质控、过滤,FLASH (V1.2.11)进行合并,QIIME 1.9.1进行过滤以获得干净的数据。
1.3.3 数据处理与统计分析 使用UPARSE,根据97%的序列相似度对OTU进行聚类。根据OTU表,利用QIIME软件生成不同分类水平上(门、纲、目、科、属)的物种丰度表和多样品物种分布图;使用MUSCLE (v3.8.31)进行快速多序列比对,以获得所有代表性OTU之间的关系,然后使用PyNAST软件进行校准。最后,对均质化数据进行α和β多样性分析。当数据非正态分布时,使用单向方差分析最小显著性差异(LSD)检验或非参数Kruskal-Wallis检验对数值进行比较。利用QIIME (V1.9.1)计算UniFrac距离,构造UPGMA树。使用R(V2.15.3)构建主坐标分析图。
2 结果与分析
2.1 不同年龄阶段藏羊瘤胃真菌群落多样性分析
通过ITS基因测序,共获得2 002 338条高质量DNA序列,平均每个样本获得80 094条高质量DNA序列。稀释曲线趋于平坦,表明瘤胃样品提供了足够的OTU覆盖率,可准确描述各组的真菌组成(Good的覆盖率>99%)(图1A)。Shannon指数反映了各样品的真菌多样性,该指数在不同年龄组间存在显著差异(图1B)。其中D0和D56的多样性显著高于D70,D360的多样性显著高于D42、D56和D70,说明成年瘤胃真菌的多样性较高。从D2到D70,Shannon指数呈下降趋势(图1B)。根据瘤胃的发育过程,每组样品分为4个阶段:非反刍阶段(Non:D0、D2、D7和D14),过渡阶段(Trans:D28、D42和D56),反刍阶段(Rumi:D70)和成体期(Adult:D360)。PCoA分析结果表明,瘤胃真菌群落随年龄变化很大,瘤胃真菌在非反刍、过渡、反刍和成年4个主要发育阶段呈现显著差异,尤其是反刍和成年阶段与非反刍阶段相比存在显著差异(图1C)。
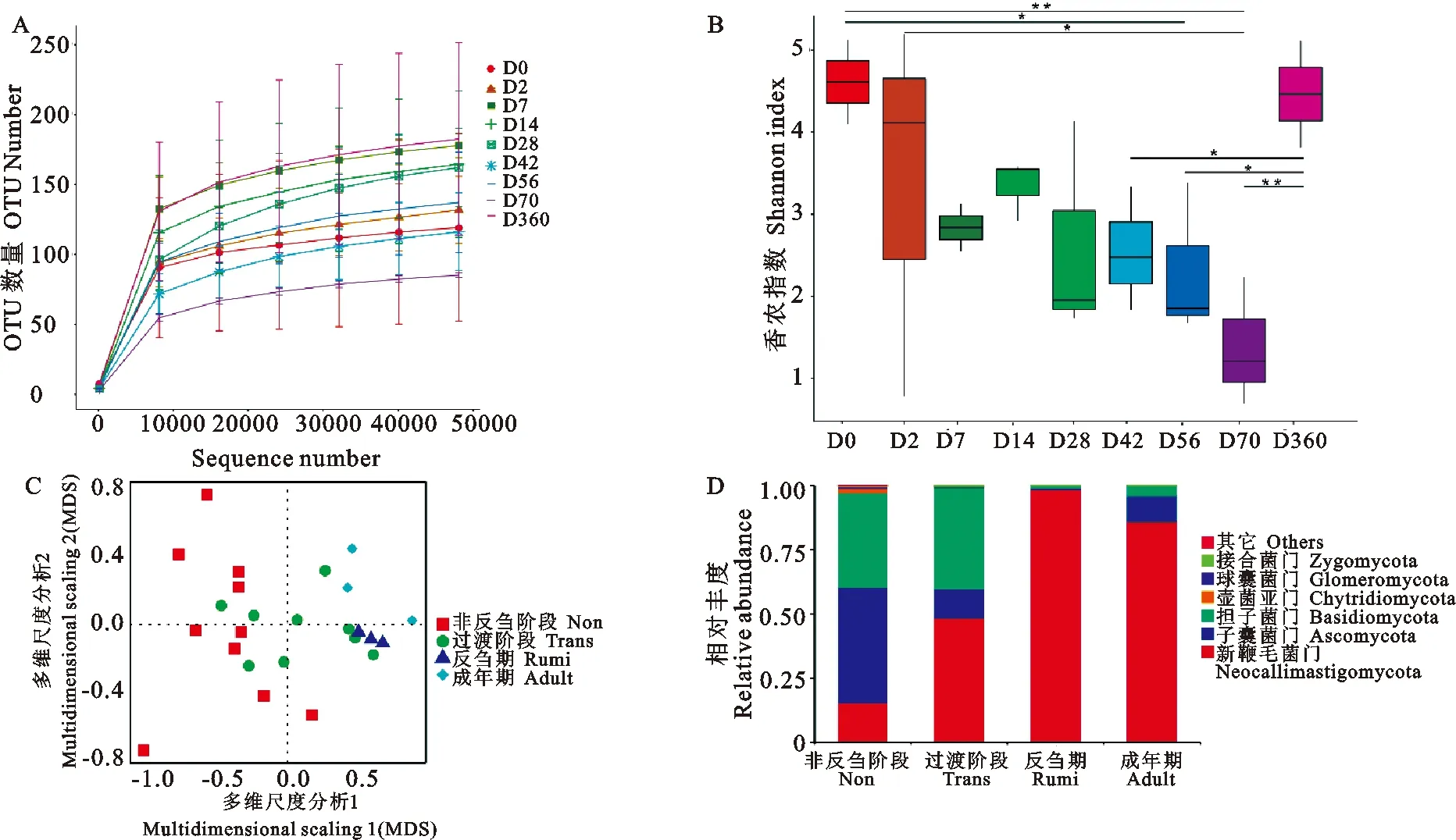
图1 羔羊瘤胃真菌群落多样性分析
2.2 不同年龄阶段藏羊瘤胃真菌群落组成分析
对4个关键发育阶段瘤胃真菌组成进一步分析表明:在门水平上,非反刍阶段的优势菌为子囊菌门(Ascomycota),相对丰度为44.91%;在过渡、反刍和成年阶段藏羊瘤胃优势菌为新鞭毛菌门(Neocallimastigomycota),相对丰度分别为48.49%、98.53%和86.07%。担子菌门(Basidiomycota)的丰度随年龄的增加而逐渐减少。在非反刍阶段和过渡段,Basidiomycota是第二大优势真菌,其丰度分别为36.94%和39.84%(图1D);在属水平上,非反刍阶段的优势真菌为新丽鞭毛菌属(Neocallimastix)、复膜孢酵母属(Saccharomycopsis)、分枝孢子菌属(Cladosporium)、Udeniomyces、隐球菌属(Cryptococcus)、链格孢属(Alternaria)、曲霉菌属(Aspergillus)、壶菌属(Batrachochytrium)和赤霉菌属(Gibberella)(丰度大于1%),在过渡阶段的优势真菌为新丽鞭毛菌属(Neocallimastix)、分支孢子菌属(Cladosporium)、隐球菌属(Cryptococcus)和Udeniomyces(丰度大于1%),而在反刍和成年阶段,唯一丰度大于1%的真菌是新丽鞭毛菌属(Neocallimastix),丰度水平分别为47.34%和6.02%(图2)。与Trans阶段相比,Rumi阶段Udeniomyces和Sporobolomyces的丰度显著较高,Cladoporium和Cryptococcus作为丰度较低的真菌菌属,只在Rumi阶段的样品中被检测到。

图2 不同日龄瘤胃真菌群落在属水平上的热图
为更清楚地描述羔羊不同年龄阶段瘤胃真菌群落的分布特征,对数据进行了日龄分组分析。在门水平上,瘤胃真菌以子囊菌门(Ascomycota)、新鞭毛菌门(Neocallimastigomycota)和担子菌门(Basidiomycota)为主,总相对丰度在75%以上。随着羔羊日龄的增加,子囊菌门(Ascomycota)和新鞭毛菌门(Neocallimastigomycota)相对丰度变化最为明显。从D0~D360,Ascomycota相对丰度从75.4%减少到10%,新鞭毛菌门(Neocallimastigomycota)相对丰度从0.5%增加到86.1%(图3A)。瘤胃不同发育阶段的真菌组成也有显著差异。非反刍阶段子囊菌门(Ascomycota)相对丰度显著低于过渡阶段。反刍阶段新鞭毛菌门(Neocallimastigomycota),子囊菌门(Ascomycota)和担子菌门(Basidiomycota)相对丰度显著低于过渡阶段(图3B)。
在属水平上,不同年龄组的真菌组成存在显著差异(图3C)。D0的优势菌为壶菌属Batrachochytrium(7.92%)、曲霉菌属Aspergillus(4.88%)、链格孢属Alternaria(4.69%)、茎点霉属Phoma(2.67%)、塔角孢属Tagonosporopsis(2.44%)、踝节菌属Talaromyces(1.83%)、盾巨孢囊霉属Scutellospora(1.66%)、帚枝霉菌属Sarocladium(1.48%)、葡萄孢属Botrytis(1.26%)、Crinipellis(0.84%)、假丝酵母菌属Candida(0.81%)、Darksidea(0.76%)、斯宾塞马丁氏菌属Spencermartinsia(0.67%)、迈耶氏酵母菌属Meyerozyma(0.59%)、壳针孢属Septoria(0.57%)、Zymoseptoria(0.53%)和漆斑菌属Myrothecium(0.49%)。随着年龄的增加,D0优势菌的平均相对丰度逐渐降低。从D0到D360,壶菌属(Batrachochytrium)平均相对丰度从7.92%下降到0%,曲霉菌属(Aspergillus)也呈下降趋势。其他真菌的平均相对丰度随着年龄的增长而增加,从D0到D70,新丽鞭毛菌菌属(Neocallimastix)相对丰度从0.12%增加到47.3%;从D0到D56,丰屋菌属(Plenodomus)相对丰度从0%增加到0.5%(图4C)。前10位优势菌在不同年龄段的分布不同。D2的优势菌为复膜孢酵母菌属(Saccharomycopsis)和分支孢子菌属(Cladosporium),平均相对丰度分别为31%和19%。从D2到D360,复膜孢酵母属(Saccharomycopsis)的丰度从31%下降到0%。D14的优势菌为Udeniomyces,平均相对丰度为14.9%。D14以后,真菌的平均相对丰度迅速下降。Udeniomyces在D70的相对丰度最高,达47.3%,而在D360的相对丰度仅为6%。在D360,平均相对丰度最高的前10个属的百分比很小,这表明瘤胃中的大多数真菌尚未鉴定(图3D)。

图4 羔羊瘤胃真菌属间相互作用的共现网络
2.3 藏羊瘤胃真菌间的相互作用共现网络分析
为在属水平上更清楚地分析瘤胃真菌之间的相互作用,构建了瘤胃真菌共现网络。共现网络分析结果表明,Ascomycota、Basidiomycota、Zygomycota、球囊菌(Glomeromycota)和Chytridiomycota在属水平上存在正相关关系。Neocallimastix与鹿单孢菌属(Stagonosporopsis)、Geotrichum、Botrytis、浮球菌属(Epicoccum)和Saccharomycopsis呈显著负相关,而支顶孢属(Acremonium)和Scutellospora属呈显著正相关(图4)。瘤胃不同组分之间存在复杂的相互作用,其中可能包括细菌-真菌-原生动物-病毒-噬菌体相互作用系统,这需要更深入的进一步的研究。
通过对绵羊瘤胃真菌进化关系的分析,发现优势属Neocallimastix与Saccharomycopsis有着密切的亲缘关系。Pyrenula,Saccharomycopsis与Meyerozyma和柳条霉菌属(Wickerhamomyces)有着密切的遗传关系,而Neocallimastix与Saccharomycopsis有着密切的遗传关系(图5)。
4 讨 论
本研究旨在系统研究瘤胃真菌群落从出生到成年的动态演替过程,阐明幼龄藏绵羊的瘤胃在不同日龄、生理阶段、分类水平的群落真菌组成。反刍动物瘤胃真菌群落组成是一个动态过程,受多种因素影响,包括饮食[9-11,21]和年龄[8]。研究发现,在羔羊出生后的第1天,瘤胃中存在许多真菌。在门水平上,以子囊菌门和担子菌门为主;在属水平上,共有17个优势属,包括Aspergillus,Alternaria,Myrothecium,Septoria,Batrachochytrium,Scutellospora,Crinipellis,Talaromyces,Spencermartinsia,Darksidea,Phoma,Zymoseptoria,Botrytis,Meyerozyma,Sarocladium,Candida和Stagonosporopsis。通过真菌多样性分析发现,从D2~D70,不同日龄组瘤胃真菌多样性逐渐降低,这可能是由于某些真菌或细菌在瘤胃中的快速增加受到其它真菌定植的抑制。不同年龄组羔羊瘤胃中的优势真菌也随年龄变化。在门水平上,瘤胃真菌以Ascomycota、Neocallimastigomycota和Basidiomycota为主,总相对丰度在75%以上。在属水平上,Neocallimastix相对丰度从D0的0.12%增加到D70的47.3%。厌氧真菌在大型食草动物的胃肠道中占有独特的生态位,被认为是消化过程中消化植物细胞壁的主要力量,它们分泌高纤维素分解酶和半纤维素分解酶,穿透角质层分解植物细胞壁,使纤维更容易被细菌分解和利用[22-24]。成年反刍动物中,瘤胃真菌占瘤胃微生物总量的3%~4%。如果缺乏真菌,动物瘤胃纤维素的降解速率将显著减少[25]。因此,高纤维饮食会促进瘤胃真菌比例的增加[26]。然而,瘤胃细菌不降解木质素,这阻碍了碳水化合物的利用。在自然界中,死去的植物可以被自然界中的某种真菌降解,例如木质素选择性降解真菌Lentinulaedodes[27],但其在营养生长过程中降解木质素而不消耗纤维素。在绵羊瘤胃中未检测到该真菌。前期研究表明Neocallimastix具有很强的纤维素降解能力[28],与羔羊年龄变化具有很强的相关性。
在青藏高原放牧的牦牛和藏羊的瘤胃真菌群落研究中,无论宿主种类如何,Neocallimastigomycota菌群均占优势[29]。山羊瘤胃真菌群落研究中,在D0、D3、D14、D28和D56瘤胃真菌有51个常见属,主要包括Cryptococcus、Aspergillus和盲肠鞭菌属(Caecomyces)。Aspergillus在第0天约占47%,但随后从D3下降到D14[20]。这与本试验数据中反映的结果一致。真菌来源的α-淀粉酶在饲料工业中非常重要,因为它从淀粉中释放葡萄糖和麦芽糖,这可能促进酵母存活和动物摄入后的酵母代谢活性[30]。米曲霉(Aspergillusoryzae)是一种商用产品,作为免疫刺激剂发挥着重要作用[31]。结果表明,D7后瘤胃中的真菌属以Neocallimastix为核心。而具有丰富纤维素分解酶、木聚糖分解酶和果胶分解酶谱的加利福尼亚新丽鞭毛菌(Neocallimastixcaliforniae),可以帮助瘤胃有效降解植物纤维并获得宿主所需能量[7]。此外,随着羔羊年龄的增加,瘤胃摄入粗纤维的比例增加,这对瘤胃真菌群落的定植和组成丰度有很大影响。给陕北白绒山羊饲喂不同粗纤维比例的饲料发现,瘤胃中Ascomycota、Basidiomycota和Zygomycota的丰度显著增加,Alternaria、Aspergillus、Neocallimastix、Orpinomyces、单鞭毛菌(Piromyces)和葡萄穗霉属(Stachybotrys)的丰度显著增加[9]。此外,以山羊为反刍动物模型,日粮中不同比例玉米(0%、25%和50%)对瘤胃微生物及其代谢产物的影响表明,食物中高比例的谷物增加了纤毛虫和产甲烷菌的数量,但降低了厌氧真菌的密度和古细菌的群落丰富度,同时也增加了内毒素、色胺、酪氨酸、组胺和苯乙酸的表达水平[32]。本研究中的羔羊经历了3个不同的阶段——母乳喂养、母乳和粗饲料喂养和仅粗饲料喂养,每个阶段都会引起瘤胃真菌群落的重大变化。与D360相比,D70瘤胃真菌群落结构不同,说明D70瘤胃真菌尚未达到稳定状态,稳定过程缓慢。由于放牧条件下,成年羊摄入的粗饲料种类复杂,粗纤维含量较高,这可能是造成真菌群落结构丰度变化的主要原因。前期的研究表明,与舍饲条件相比,成年放牧滩羊瘤胃Naganishia属、线黑粉菌属(Filobasidium)和酵母属(Saccharomyces)菌属丰度极显著升高[33]。此外,我们还发现瘤胃真菌多样性在D0时较高,随着年龄的增长,真菌多样性逐渐降低。这可能与出生后摄入初乳有关,初乳的摄入使得胃肠道中的乳酸杆菌和双歧杆菌丰度上升,胃肠道pH降低,真菌的生长被抑制[34-36]。
共现分析揭示了绵羊瘤胃中不同真菌的不同互作模式。研究发现,Neocallimastigaceae是山羊瘤胃中的核心科,与其他真菌(座囊菌Dothideomycetes,格孢腔菌Pleosporales,双孢霉Didymellaceae,长崎菌Naganishia,Ascomycota,荚胞腔菌Sporormiaceae和Plenodomus)呈负相关[15]。这与本研究结果一致。最近的一项研究确定了Neocallimastigomycota的支架蛋白,并揭示了真菌群落中dockerin支架蛋白的相互作用[37]。厌氧真菌支架蛋白与多种厌氧真菌中含dockerin蛋白表现出交叉反应。真菌纤维素体的这一特征可能对瘤胃内多种真菌共存具有重要作用[38]。该研究为日龄对不同属真菌共生生态模式的影响提供了新的见解。初产羔羊瘤胃真菌群落较为单一,随着绵羊年龄的增加,真菌群落逐渐稳定、成熟,表现出复杂共生模式。
5 结 论
放牧条件下藏绵羊瘤胃真菌群落定植具有显著的时间特异性,其与各时间的饲料摄入有关。主要核心菌门在反刍前和反刍后发生剧烈的丰度变化。在门水平上,主要优势真菌为Ascomycota、Neocallimastigomycota和Basidiomycota,总相对丰度在75%以上。在属水平上,不同日龄阶段羔羊瘤胃中存在不同的特征真菌。D2的优势属为Saccharomycopsis和Cladosporium,D70的优势属为Neocallimastix。本研究系统分析了放牧条件下藏绵羊动物瘤胃真菌随日龄的演替过程,为幼年动物早期断奶和早期日粮干预提供了理论依据。
