肺炎支原体社区获得性呼吸窘迫综合征毒素对单核细胞亚群的影响
2023-10-15张岑王志华杨磊
张岑,王志华,杨磊
肺炎支原体(Mycoplasma pneumoniae,MP)是导致社区获得性肺炎(community-acquired pneumonia,CAP)的重要病原体之一,可引起气管、支气管炎,10%~40% 的支原体感染患者最终会发展为肺炎[1-2]。 目前MP 肺炎(Mycoplasma pneumoniaepneumonia,MPP)致病机制尚不明确,肺炎支原体社区获得性呼吸窘迫综合征(community-acquired respiratory distress syndrome,CARDS)毒素是MP 已知唯一分泌的外毒素,除具有ADP-核糖基化转移酶活性与胞质空泡化特性外,还能调控NOD样受体热蛋白结构域相关蛋白3炎症小体活性[3]。CARDS毒素在MP侵入及致病过程中发挥重要作用,与感染的病程长短及呼吸道炎症反应、疾病严重程度密切相关[4]。单核细胞是构成天然免疫的重要组成部分,其数量及不同亚型比例的变化与机体炎症或其他疾病状态密切相关。根据小鼠淋巴细胞抗原6C(lynphocyte antigen 6C,Ly6C)是否表达分为2 个单核细胞群体,即Ly6C+炎性单核细胞和Ly6C-循环性单核细胞,Ly6C+单核细胞具有促炎和抗菌功能[5]。本课题组既往研究表明,MPP 患者外周血CD16+单核细胞比例明显升高[6]。但目前肺炎支原体CARDS毒素对单核细胞亚群影响的相关研究较少。本研究通过肺炎支原体CARDS毒素诱导小鼠模型,观察小鼠外周血单核细胞亚群Ly6C+、Ly6C-水平,探讨CARDS毒素诱导肺损伤的致病机制。
1 材料与方法
1.1 实验动物 32 只6~8 周龄SPF 级C57BL/6 野生型小鼠,雌雄各半,体质量16~18 g,购自斯贝福(北京)生物技术有限公司,动物生产许可证号:SCXK(京)2019-0010。均于SPF 级动物房中饲养,室温20~25 ℃,相对湿度为40%~60%,给足水分和饲料,喂养1~2 d。本研究通过天津市南开医院实验动物科学部伦理委员会审批,符合动物实验伦理要求,批准编号:NKYY-DWLL-2021-103。
1.2 主要试剂与仪器 白细胞介素(IL)-1β和IL-18酶联免疫吸附试验(ELISA)试剂盒购自杭州联科生物技术股份有限公司;Trizol试剂和cDNA合成试剂盒购自北京全式金生物技术有限公司;引物购自生工生物工程(上海)股份有限公司;抗小鼠CD11b-FITC、Ly6C-APC和Ly6G-PE流式抗体购自美国Biolegend公司;CARDS过表达pET28α载体购自汉恒生物科技(上海)有限公司;PCR 扩增仪、7500 实时定量PCR 系统购自美国Thermo Fisher Scientific 公司;流式细胞仪购自美国BD公司。
1.3 重组CARDS 毒素制备 按照文献[7]的方法制备重组CARDS 毒素。将CARDS 毒素基因克隆入pET28α 载体,经8次点突变获得pET28α-CARDS 毒素重组质粒。转化大肠杆菌BL21,异丙基硫代半乳糖苷诱导表达,利用镍螯合亲和层析技术纯化出变性CARDS 毒素蛋白,利用尿素梯度复性法和扩大体积透析法对蛋白复性后进行后续研究。
1.4 模型建立 采用随机数字表法将32只小鼠分为模型组和正常对照组,每组16 只。模型组小鼠用异氟烷麻醉后,气管注射40 μL 含有50 μg CARDS 毒素的PBS,诱导小鼠支原体肺炎[8];正常对照组接种同等剂量的PBS。接种后观察小鼠的呼吸、进食、体质量、活动情况。
1.5 流式细胞术检测单核细胞亚群变化 造模后24 h,2组各取5只小鼠进行麻醉,腹主动脉采血加入EDTA抗凝管中,取新鲜血100 μL,加入0.25 μg抗小鼠的CD11b-FITC、Ly6CAPC 和Ly6G-PE 流式抗体混匀,室温避光孵育15 min;加入红细胞裂解液,混匀后避光静置10 min,加入1 mL PBS 清洗1 遍,离心后用100 μL 的PBS 重新悬浮细胞,并用流式细胞仪检测外周血单核细胞亚群比例变化。
1.6 肺组织病理观察 2 组各取5 只小鼠,取血后安乐死处死。用5 mL PBS 经肺动脉冲洗肺循环后取肺。在无菌环境下取出新鲜的小鼠肺组织,使用生理盐水冲洗表面血污,滤纸擦干表面水分,取1 个肺叶用10%多聚甲醛固定,石蜡包埋并切片,HE染色后光学显微镜下观察并采集图像,进行肺组织损伤评分[9],剩余肺组织放入液氮中冻存。
1.7 Real-time PCR 检测肺组织中IL-1β、IL-18 水平 2 组各取3 只小鼠。Trizol 法提取小鼠肺组织RNA,按照试剂盒说明书,将总RNA反转录为cDNA,取反转录后cDNA作为模板,使用SYBR Green Master 进行定量PCR。反应体系为cDNA 和上游下引物各1 μL、PCR Mix10 μL和无酶水7 μL。扩增条件:95 ℃预变性5 min,95 ℃变性15 s,60 ℃退火20 s,72 ℃延伸30 s,40个循环。以GAPDH作为内参,数据分析采用2-ΔΔCt法计算。引物序列见表1。
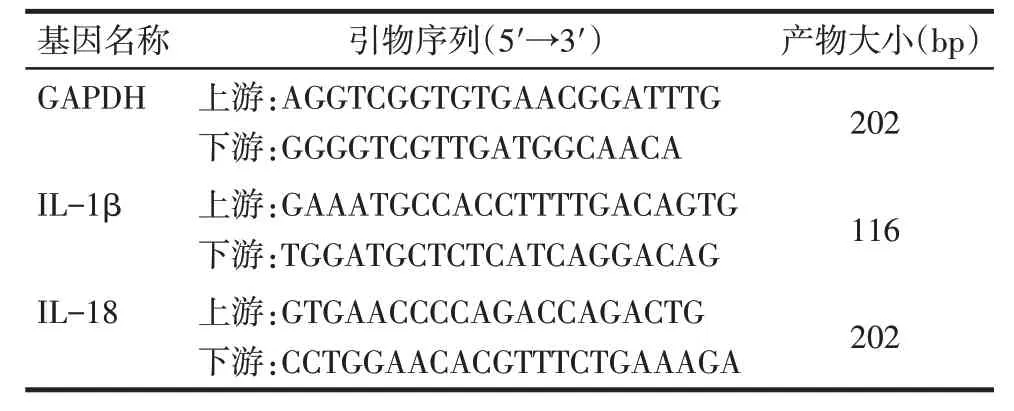
Tab.1 The primer sequence of PCR表1 PCR引物序列
1.8 ELISA检测血清中IL-1β和IL-18水平 造模24 h后,2组各取3 只小鼠,采集其外周血,离心后回收上清液,按照ELISA试剂盒说明检测各组外周血中IL-1β和IL-18水平。
1.9 统计学方法 采用SPSS 26.0软件进行数据分析。计量资料以表示,组间比较采用独立样本t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 小鼠外周血单核细胞亚群比较 模型组较正常对照组的小鼠单核细胞CD11b+Ly6G-Ly6C+比例升高(47.30±5.54vs. 36.87±3.38,n=5,t=3.591,P<0.05),见图1。
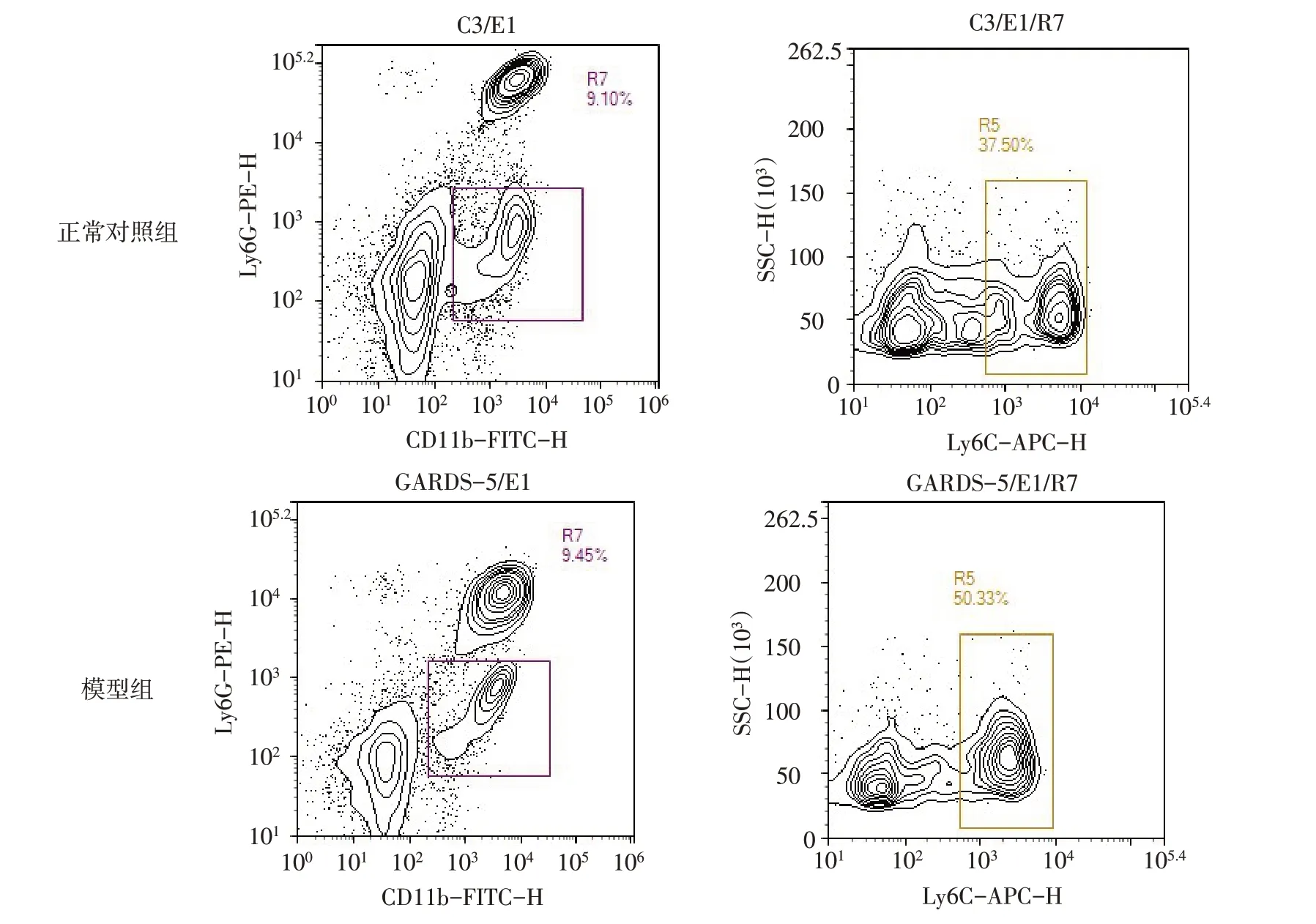
Fig.1 Proportion of CD11b+Ly6G-Ly6C+monocyte subsets in peripheral blood of mice图1 小鼠外周血CD11b+Ly6G-Ly6C+单核细胞亚群的比例
2.2 小鼠肺组织病理学变化 HE染色可见正常对照组小鼠肺组织形态正常,未见肺泡壁增厚和炎性细胞的浸润。模型组小鼠肺组织出现明显的肺泡结构紊乱,肺泡壁增厚,肺泡腔内融合、塌陷、数目减少,毛细血管充血或出血,肺间质水肿,肺组织周围存在大量炎性细胞浸润,见图2。模型组肺组织损伤评分(9.00±0.71)高于正常对照组(3.00±0.71,n=5,t=13.416,P<0.01)。
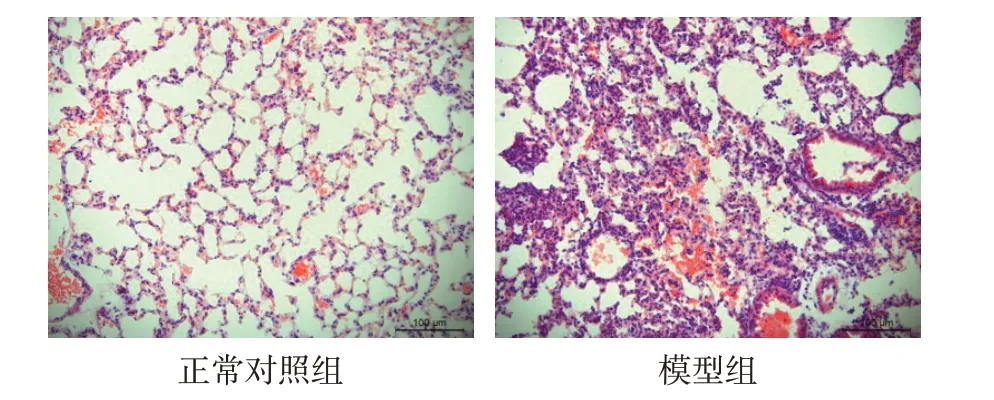
Fig.2 Pathological findings of lung tissue(HE staining,×200)图2 肺组织病理学表现(HE染色,×200)
2.3 肺炎支原体CARDS 毒素对肺组织和血清中IL-1β 和IL-18 表达的影响 模型组小鼠肺组织和血清IL-1β 和IL-18 表达水平较正常对照组增高(P<0.01),见表2。
Tab.2 Comparison of mRNA expression levels of IL-1β and IL-18 in lung tissue and serum between two groups表2 2组肺组织和血清IL-1β、IL-18表达水平比较(n=3,)
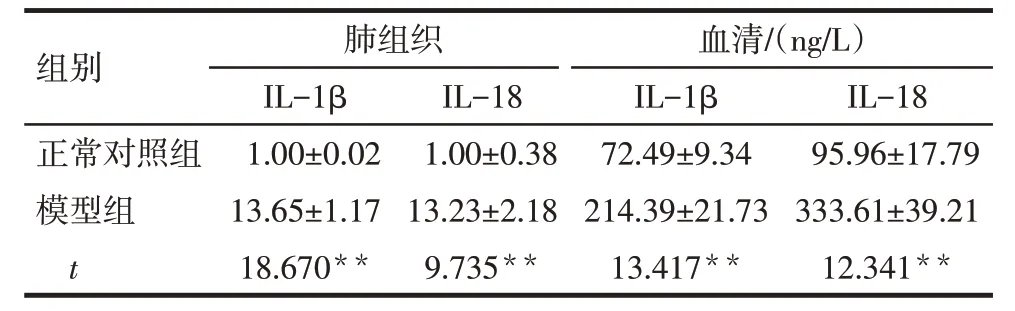
Tab.2 Comparison of mRNA expression levels of IL-1β and IL-18 in lung tissue and serum between two groups表2 2组肺组织和血清IL-1β、IL-18表达水平比较(n=3,)
**P<0.01。
?
3 讨论
MPP 在所有人群中普遍易感,其中对老年人及免疫力低下人群危害更为严重。目前重症及难治性MPP病例明显增多[10],部分患者甚至出现胸腔积液、肺坏死等严重并发症,并易遗留闭塞性细支气管炎、肺不张以及支气管扩张等后遗症,造成肺部反复感染,甚至最终需要肺叶切除[11]。MPP 的致病机制尚不完全清楚,通常认为过度的免疫炎症反应参与MP感染的发生和发展。研究显示,CARDS毒素可能能够解释MP感染相关的炎症反应[12]。
CARDS 毒素与许多气道反应性疾病及肺外并发症直接相关,但其致病机制尚未明确。研究显示,Toll样受体在评估MP感染的发病、病情进展中发挥重要作用,其中的Toll 样蛋白受体2(Toll protein receptor 2,TLR2)可以明显增加炎性因子的合成释放以及加重炎症反应[13]。在MP诱导的小鼠肺炎模型中,CARDS 毒素通过TLR2 依赖性方式诱导肺组织中中性粒细胞的浸润、炎性细胞因子和趋化因子的产生[7]。CARDS 毒素作为MP 的毒力因子,参与MP 的增殖、结合及持续的炎症反应。在暴露于CARDS毒素的狒狒动物模型中,CARDS毒素可以引起严重的肺组织炎症和气道功能障碍[14]。难治性MPP的肺泡灌洗液中CARDS毒素明显升高,CARDS毒素联合肿瘤坏死因子-α 可较好地预测难治性MPP 的预后[15]。此外,CARDS 毒素与MP 感染后哮喘未控制和难治性哮喘有关[16]。在动物实验中也发现,CARDS 毒素能引起哮喘样的气道组织病理改变,在气道炎症中起着重要作用[17]。本研究采用气管滴注CARDS 毒素诱导小鼠急性肺炎,通过HE 染色发现肺组织发生明显的病理损伤,说明CARDS毒素在肺组织炎症中发挥重要作用。
单核细胞亚群能够吞噬入侵体内的异物和病原微生物,释放多种细胞因子,并参与抗原提呈、免疫调节等过程,在固有免疫应答中发挥着重要作用。在MPP急性感染时单核细胞异常激活,并与MPP病情的严重程度及并发症、预后密切相关。人单核细胞根据其表面分子CD14和CD16表达水平可分为经典型(CD14+CD16-)、中间型(CD14brightCD16+)和非经典型(CDdimCD16+)[18]。而小鼠的单核细胞主要分为2 个亚群,即CD11b+Ly6C+炎症型单核细胞和CD11b+Ly6C-)循环型单核细胞,基于表面标记表达与基因表达阵列,小鼠Ly6C+与人CD14+CD16-(经典型)相似,而小鼠Ly6C-单核细胞与人CD16+单核细胞相似[19]。单核细胞和CARDS毒素体外共培养后,CARDS 毒素通过TLR4 依赖性方式促进CD16+单核细胞IL-23p19 mRNA 的表达[20]。本研究结果显示,肺炎支原体CARDS 毒素诱导的小鼠MPP 模型中的Ly6C+单核细胞比例、炎性因子IL-1β、IL-18 水平明显升高,且肺组织呈持续性的炎症反应,表明Ly6C+单核细胞可能参与MP感染的发生发展过程,为以单核细胞调控为靶点的相关治疗及干预研究提供一定的基础实验依据。
综上所述,CARDS 毒素诱导的小鼠中Ly6C+单核细胞占比升高可能与MPP的发病密切相关,单核细胞亚群分化及其介导的炎症反应在其中发挥重要作。本研究为以单核细胞系统为靶点早期诊治MPP提供了新的研究方向及理论视角。
