Naa20通过抑制AIM2表达减轻脓毒症心肌损伤
2023-10-15刘畅范彩红刘佳刘亚珊张诗琪刘士铭申艳娜
刘畅,范彩红,刘佳,刘亚珊,张诗琪,刘士铭,申艳娜
心肌损伤是脓毒症的常见并发症,已成为脓毒症预后不良的重要原因之一[1-2]。脓毒症心肌损伤发病机制复杂,现有治疗手段疗效十分有限,因此深入阐明其发病机制并开发新的治疗策略意义重大。近年来,细胞焦亡作为新发现的一种依赖于半胱氨酸天冬氨酸蛋白酶的炎性程序性死亡形式,已被证实在脓毒症心肌损伤的发生发展中起重要调控作用,但其机制尚未完全阐明[3]。黑色素瘤缺失因子2(absent in melanoma 2,AIM2)是干扰素诱导的HIN-200家族成员之一,其可在心肌细胞、巨噬细胞等多种细胞中表达。相关研究表明AIM2 介导的细胞焦亡与心血管疾病发展密切相关[4]。Naa20 是N 端乙酰基转移酶(N-terminal acetyltransferases,NATs)复合物B(NatB)的核心蛋白,可通过调控蛋白N 端乙酰化修饰影响蛋白降解[5]、定位[6]和结合[7]。研究表明Naa20 可参与机体多项活动,并与多种疾病的发生相关[8-9],而其在心肌损伤中的调控作用却鲜有报道。本研究旨在探究Naa20 及AIM2 介导的细胞焦亡在脓毒症心肌损伤中的调控作用,以期为该病防治提供作用靶点及理论依据。
1 材料与方法
1.1 实验材料
1.1.1 细胞系与实验动物 大鼠心肌细胞系H9c2购自中国医学科学院基础医学研究所细胞中心。12只SPF级6周龄雄性C57BL/6J 小鼠(体质量18~20 g)和10 只SPF 级1 日龄SD乳鼠(体质量7~9 g)购自斯贝福(北京)生物技术有限公司,动物生产许可证号:SCXK(京)2019-0010,质量合格证号110324231101689256。C57BL/6J 小鼠实验前适应性饲养1周,温度(22±2)℃,相对湿度60%±5%,光照条件设定为明暗各12 h循环交替,自由饮水、摄食。
1.1.2 主要试剂与仪器 肌酸激酶同工酶(CK-MB)、白细胞介素(IL)-1β酶联免疫吸附试验(ELISA)检测试剂盒均购自武汉伊莱瑞特生物科技股份有限公司;线粒体膜电位荧光探针(JC-1)、活性氧(ROS)检测试剂盒购自上海碧云天生物技术有限公司;逆转录试剂盒、实时荧光定量PCR(qPCR)试剂盒购自南京诺唯赞公司;Trizol 试剂盒购自美国Invitrogen 公司;四甲基偶氮唑盐(MTT)试剂盒、乳酸脱氢酶(LDH)检测试剂盒购自北京索莱宝科技有限公司;鼠源AIM2 一抗购自美国Proteintech公司;兔源消皮素D(GSDMD)、Naa20一抗购自武汉爱博泰克生物公司;兔源IL-1β 一抗购自英国Abcam公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG 二抗及山羊抗鼠IgG二抗购自美国Promega公司;Protein A/G免疫沉淀磁珠试剂盒购自苏州海狸生物医学工程有限公司;倒置荧光显微镜(型号:ECLIPSE Ti-U)购自日本Nikon公司;多功能酶标仪(型号:Synergy 2)购自美国BioTek 有限公司;化学发光仪(型号:Universal Hood Ⅱ)购自美国Bio-Rad公司。
1.2 研究方法
1.2.1 动物分组及模型的建立 适应性喂养1 周后将12 只雄性C57BL/6J小鼠按随机数字表法分为对照组和模型组,每组6 只。参照文献[10],采用尾静脉注射10 mg/kg 脂多糖(LPS)制备脓毒症心肌损伤模型,造模后给予小鼠正常饮食。对照组采用相同方法注射等体积磷酸盐缓冲液(PBS)。
1.2.2 小鼠心脏多普勒超声检测 在注射LPS 或PBS 12 h后对2 组小鼠进行心功能检查。采用3%异氟烷麻醉小鼠。麻醉后固定、备皮,采用心脏多普勒超声检测左心室射血分数(LVEF)、短轴缩短率(FS)。所得参数为连续6个心动周期的平均值。
1.2.3 ELISA 检测CK-MB、IL-1β 水平 采用腹腔注射3%戊巴比妥钠麻醉小鼠,开胸取心脏血,3 000 r/min 离心15 min,收集血清,检测小鼠血清中CK-MB含量,每组取6个样本进行实验。心肌细胞处理后检测心肌细胞上清液中IL-1β含量。
1.2.4 小鼠心脏组织的采集 获取小鼠心脏血后,取出心脏,生理盐水灌洗心腔以洗净残余血液。将心脏置于4%多聚甲醛中固定,用于后续实验。
1.2.5 苏木精-伊红(HE)染色观察心肌组织结构 首先将切片先后放入二甲苯Ⅰ和二甲苯Ⅱ各5 min,依次放入无水乙醇Ⅰ、无水乙醇Ⅱ、95%乙醇、90%乙醇、80%乙醇、去离子水各5 min。苏木素液染色5 min后,流水冲洗1~2 min,1%盐酸乙醇30 s,流水冲洗3~5 min。伊红染色复染30 s 后脱水。最后用中性树胶封片。
1.2.6 心肌细胞培养和分组 1日龄SD乳鼠消毒、开胸取心脏,去除血管等组织,采用1%胰蛋白酶4 ℃消化12 h,0.25%胶原酶Ⅱ37 ℃消化10 min。收集乳鼠心肌细胞并培养于含7%胎牛血清、100 U/mL 青霉素和100 mg/L 链霉素的DMEM培养液中,24 h 后培养基更换为含1%转铁蛋白的DMEM 培养液。大鼠H9c2 心肌细胞在含10%胎牛血清、100 U/mL 青霉素和100 mg/L 链霉素的DMEM 培养液中培养。上述细胞均置于37 ℃、5%CO2细胞培养箱中培养,细胞随机分为对照组和LPS处理组(培养基中加入终浓度为10 mg/L的LPS孵育12 h)。
1.2.7 JC-1 检测心肌细胞线粒体膜电位 乳鼠心肌细胞接种于6孔板(2×105个/孔)中,LPS处理12 h后,加入JC-1染色工作液(1 mL/孔),37 ℃孵育20 min,吸去上清液,JC-1 染色缓冲液洗涤2次,荧光显微镜下进行观察和拍摄。
1.2.8 荧光探针检测心肌细胞ROS 水平 乳鼠心肌细胞分组处理后,加入10 mmol/L的2',7'-二氢二氯荧光素二乙酸酯(DCFH-DA)使其终浓度为10 μmol/L。37 ℃孵育30 min 后PBS洗涤2次,荧光显微镜下进行观察和拍摄。
1.2.9 Western blot 检测心肌细胞中蛋白表达水平 乳鼠心肌细胞或H9c2心肌细胞分组处理后,采用RIPA裂解液破坏细胞,4 ℃、10 000×g离心5 min,收集上清液,采用二辛可宁酸(BCA)法测定蛋白质浓度。加入适量上样缓冲液,沸水浴10 min后取25 μg蛋白上样,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,PVDF 转膜;5%脱脂奶粉室温封闭1 h,分别加入AIM2、GSDMD、活化的GSDMD(GSDMD-N)、IL-1β、活化的IL-1β(p17)、Naa20 和β-actin 一抗(稀释倍数均为1∶1 000),4 ℃孵育过夜,TBST洗膜3次,每次10 min,加入HRP标记的IgG二抗(稀释倍数均为1∶2 000),室温孵育1 h,TBST洗膜3 次,每次10 min,化学发光(ECL)试剂显色,凝胶成像系统观察蛋白条带并分析灰度值。以β-actin 为内参,计算各组目的蛋白的相对表达量。
1.2.10 qPCR检测心肌细胞中Naa20 mRNA表达 乳鼠心肌细胞分别给予1、5、10 mg/L LPS处理,12 h后采用TRIzol试剂盒提取LPS各组及对照组细胞的总RNA,Nanodrop分光光度仪检测RNA 纯度和浓度。以RNA 为模板,使用逆转录试剂盒逆转录获得cDNA,以cDNA为模板进行扩增。反应条件为95 ℃30 s;95 ℃10 s,60 ℃30 s,共40 个循环。Naa20 以GAPDH 为内参基因,采用2-ΔΔCt法计算Naa20 的相对表达水平。引物序列由生工生物工程(上海)股份有限公司合成,见表1。

Tab.1 Primer sequences for qPCR表1 qPCR引物序列
1.2.11 H9c2 心肌细胞分组转染 H9c2 心肌细胞接种于6孔板(2×105个/孔)中,采用Lipofectamine 2000 试剂分别转染空载质粒、Naa20过表达质粒各1 μg,转染24 h后进行相应检测。细胞分组:(1)对照组。转染空载质粒,未经LPS 处理。(2)Naa20对照组。转染Flag-Naa20过表达质粒,未经LPS处理。(3)LPS组。转染空载质粒,24 h后加入终浓度为10 μg/L的LPS孵育12 h。(4)Naa20+LPS组。转染Flag-Naa20过表达质粒,24 h后加入LPS处理。
1.2.12 MTT 法检测H9c2 心肌细胞活力 将处理后的各组H9c2心肌细胞接种于96孔板(3 000个/孔)中,第2天每孔加入10 mL MTT溶液(5 g/L),37 ℃孵育4 h。随后吸取上清液,加入100 μL 的二甲基亚砜,震荡10 min 后,使用酶标仪在490 nm波长下检测每孔的光密度(OD)值,并计算细胞活力。细胞活力(%)=(实验组OD值/对照组OD值)×100%。每组细胞设置3个重复孔。
1.2.13 检测H9c2 细胞LDH 释放 收集各组H9c2 心肌细胞,加入提取试剂(500 万细胞加1 mL 提取试剂),超声波破碎细胞,8 000×g、4 ℃离心10 min,收集细胞上清液。按照试剂盒说明书加入相应试剂,充分混匀后室温静置3 min,于450 nm波长处读取各组样品OD 值。根据标准品OD 值和相应浓度拟合标准曲线,计算各组样品浓度(样品浓度=0.359×OD值+0.091 9)和样品相应的LDH值(样品LDH=0.133×样品浓度)。每组细胞设置3个重复孔。
1.2.14 免疫共沉淀检测H9c2 中Naa20 与AIM2 的结合情况 收集RIPA 裂解后的细胞上清液,各组留取45 μL 上清液,记作全细胞裂解液(WCL),检测细胞中相应蛋白表达。另取20 μL Protein A/G免疫沉淀磁珠分别与5 μL Naa20抗体或IgG 室温结合2 h,加入上清液4 ℃孵育过夜。次日,弃去上清液,加入适量上样缓冲液,沸水浴10 min后取25 μg蛋白上样,Western blot 实验检测相关蛋白表达。H9c2 心肌细胞随机分为3 组。对照组:细胞未处理并加入Naa20 抗体包被的磁珠;LPS处理组:细胞经LPS处理12 h并加入Naa20抗体包被的磁珠;LPS对照组:细胞经LPS处理12 h并加入IgG抗体包被的磁珠。
1.3 统计学方法 使用SPSS 26.0 软件进行数据分析,采用Graphpad Prism 8.0 软件绘图。计量资料采用均数±标准差()表示,多组间均数比较采用单因素方差分析,组间多重比较采用LSD-t检验;2组间均数比较采用t检验;以P<0.05为差异有统计学意义。
2 结果
2.1 LPS 脓毒症小鼠出现心肌损伤 与对照组相比,模型组小鼠LVEF、FS 降低,血清CK-MB 含量升高(P<0.01),见表2。HE 染色结果表明,与对照组相比,模型组小鼠心肌组织可见明显的纤维断裂和炎性细胞浸润等病理改变,见图1。
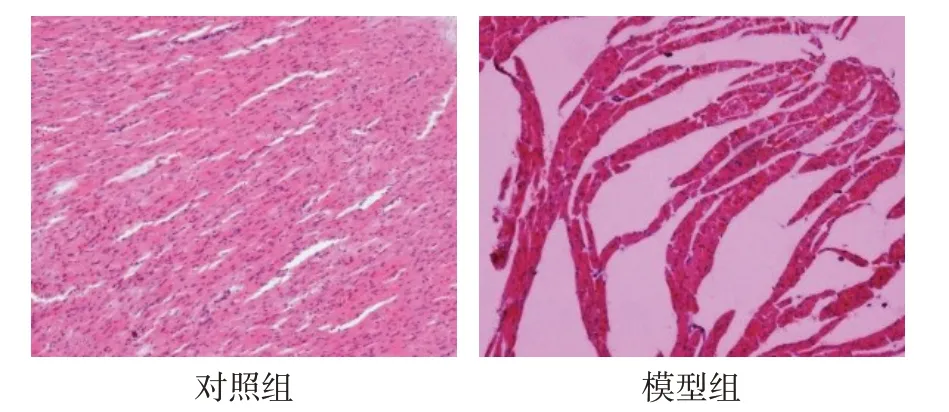
Fig.1 Heart histopathological changes in two groups of mice(HE staining,×100)图1 2组小鼠心脏组织病理学变化(HE染色,×100)
Tab.2 Comparison of left ventricular ejection fraction,fraction shortening and CK-MB betweentwo groups of mice表2 2组小鼠LVEF、FS、CK-MB水平比较(n=6,)
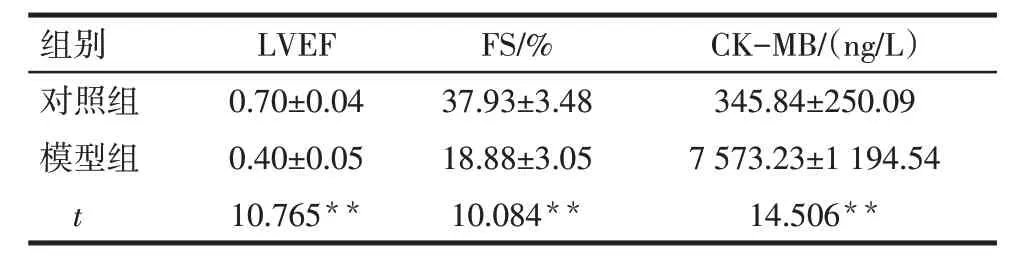
Tab.2 Comparison of left ventricular ejection fraction,fraction shortening and CK-MB betweentwo groups of mice表2 2组小鼠LVEF、FS、CK-MB水平比较(n=6,)
**P<0.01。
?
2.2 LPS 刺激对心肌细胞线粒体功能及炎症的影响 与对照组相比,LPS 处理组乳鼠心肌细胞中的线粒体膜电位下降,ROS 释放增多,见图2、3。与对照组相比,LPS 处理组乳鼠心肌细胞中的AIM2、GSDMD、GSDMD-N、IL-1β 和p17 蛋白水平升高,且心肌细胞上清液中的IL-1β 含量增加(P<0.01),见图4、表3。
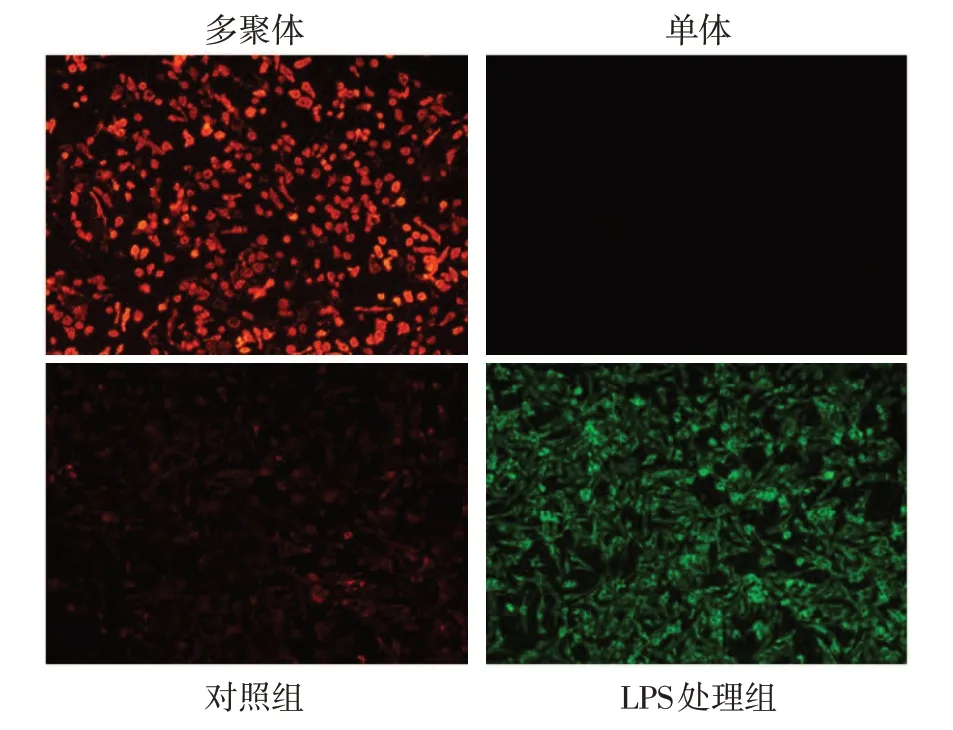
Fig.2 The mitochondrial membrane potential of neonatal rat cardiomyocytes in two groups(JC-1 staining,×100)图2 2组乳鼠心肌细胞线粒体膜电位(JC-1染色,×100)
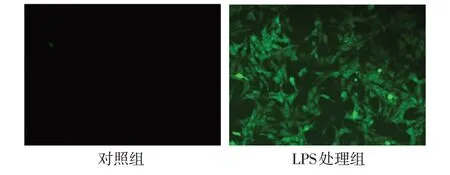
Fig.3 ROS levels of neonatal rat cardiomyocytes in two groups(DCFH-DA staining,×100)图3 2组乳鼠心肌细胞ROS水平(DCFH-DA染色,×100)
Tab.3 Comparison of AIM2,GSDMD,IL-1β,p17 protein expression levels and IL-1β content in supernatant between two groups表3 2组乳鼠心肌细胞AIM2、GSDMD、IL-1β、p17蛋白表达和上清液中IL-1β水平比较 (n=3,)
*P<0.05,**P<0.01。
?
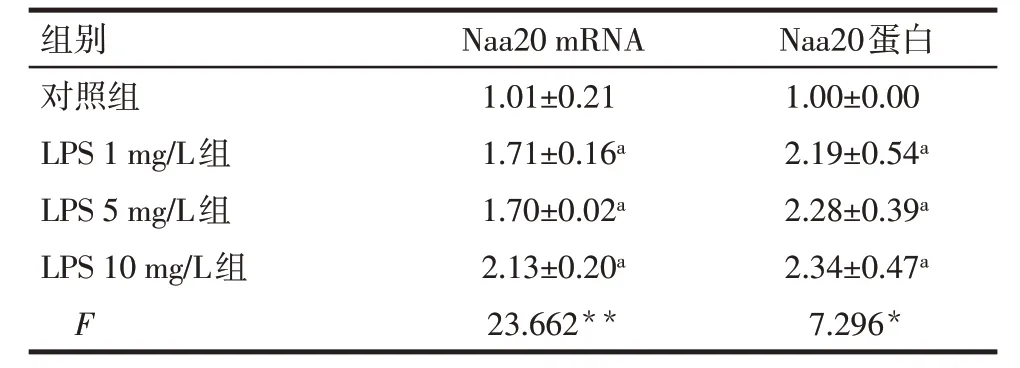
2.3 LPS 刺激诱导Naa20 表达增多 与对照组相比,LPS各组乳鼠心肌细胞中Naa20 mRNA和蛋白表达水平升高(P<0.05),见表4、图5。
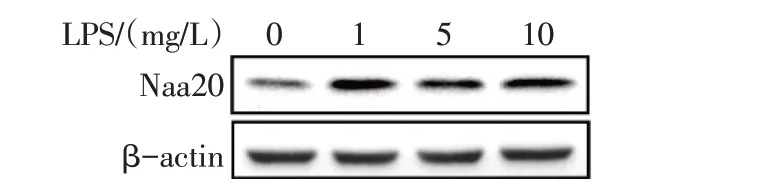
Fig.5 The expression levels of Naa20 protein in neonatal rat cardiomyocytes in four groups图5 各组乳鼠心肌细胞中Naa20的蛋白表达水平
Tab.4 Comparison of Naa20 levels between fourgroups of neonatal rat cardiomyocytes表4 各组乳鼠心肌细胞中Naa20水平比较(n=3,)
Tab.4 Comparison of Naa20 levels between fourgroups of neonatal rat cardiomyocytes表4 各组乳鼠心肌细胞中Naa20水平比较(n=3,)
*P<0.05,**P<0.01;a与对照组比较,P<0.05。
?
2.4 过表达Naa20抑制心肌细胞死亡 与对照组相比,LPS 组H9c2 心肌细胞活力降低,LDH 释放量升高(P<0.05)。与LPS组相比,Naa20+LPS组H9c2心肌细胞活力增强,而LDH 释放降低(P<0.05),见表5。
Tab.5 Comparison of H9c2 cell viability and LDH levels between four groups表5 各组H9c2细胞活力和LDH比较 (n=3,)
**P<0.01;a与对照组比较,b与LPS组比较,P<0.05;表6同。
?
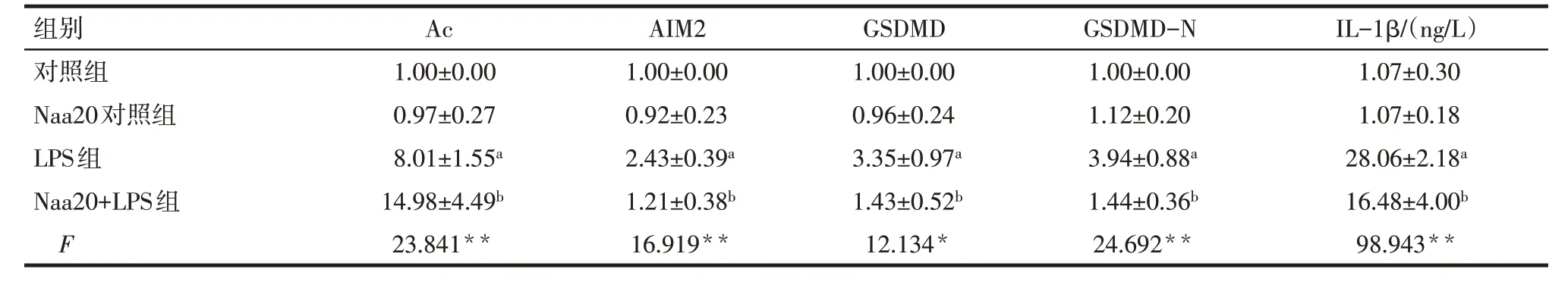
2.5 Naa20 靶向抑制AIM2 表达 通过比对分析人源及鼠源(小鼠和大鼠)AIM2 的N 端前10 个氨基酸序列,发现AIM2前两个氨基酸分别为甲硫氨酸(M)和谷氨酸(E),提示AIM2可能与Naa20结合,见图6。免疫共沉淀实验证实,在LPS处理的H9c2心肌细胞中,Naa20 与AIM2 结合,见图7。与LPS 组相比,Naa20+LPS组H9c2心肌细胞中AIM2乙酰化(Ac)水平增加,AIM2、GSDMD、GSDMD-N 的蛋白水平下降,且细胞上清液中IL-1β 含量降低(P<0.05),见图8、表6。
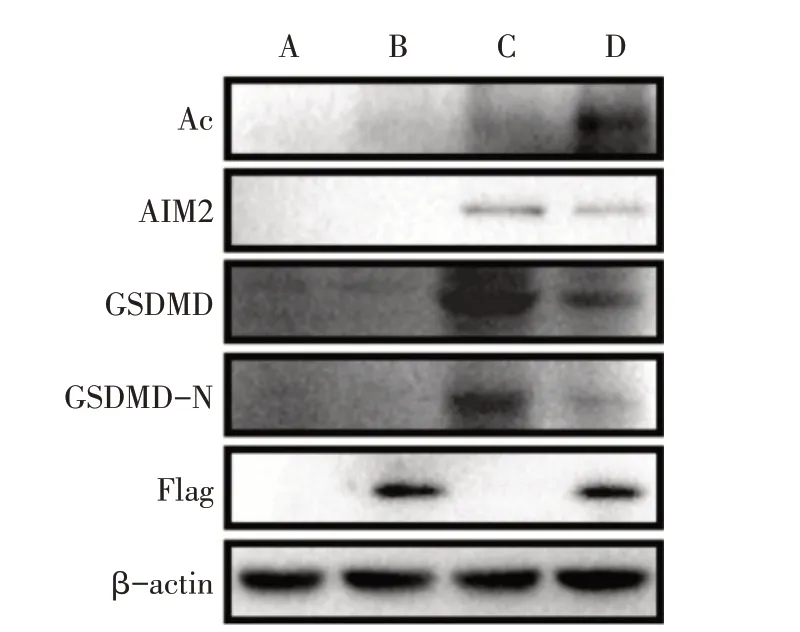
Fig.8 The expression levels of ace-AIM2 and AIM2,GSDMD protein in four groups of H9c2 cells图8 各组H9c2心肌细胞中AIM2乙酰化及AIM2、GSDMD、GSDMD-N的蛋白表达水平
Tab.6 Comparison of ace-AIM2 and AIM2,GSDMD,GSDMD-N protein,and IL-1β content in supernatant between four groups of H9c2 cells表6 各组H9c2心肌细胞中AIM2乙酰化,AIM2、GSDMD、GSDMD-N蛋白及上清液IL-1β表达水平比较 (n=3,)
Tab.6 Comparison of ace-AIM2 and AIM2,GSDMD,GSDMD-N protein,and IL-1β content in supernatant between four groups of H9c2 cells表6 各组H9c2心肌细胞中AIM2乙酰化,AIM2、GSDMD、GSDMD-N蛋白及上清液IL-1β表达水平比较 (n=3,)
?
3 讨论
3.1 脓毒症心肌损伤与细胞焦亡 脓毒症心肌损伤是脓毒症患者出现的一种非缺血性心功能障碍,主要表现为左心室扩张伴充盈压力正常或降低、心室收缩力降低和左右心室(收缩或舒张)功能障碍伴容积输注反应降低[11]。据统计,脓毒症不合并心肌损伤的患者病死率仅为20%,而合并心肌损伤的患者病死率可达70%~90%[12]。脓毒症患者的心肌损伤程度已成为其不良预后的主要预测指标之一。目前研究认为心肌损伤与炎性因子的大量释放[13]、线粒体损伤[14]和细胞死亡[15]等密切相关,其中心肌细胞死亡是造成脓毒症心肌损伤的关键因素。研究显示,在脓毒症小鼠中,抑制NLRP3 介导的心肌细胞焦亡可有效提高小鼠的生存率,减轻心肌损伤[16]。本研究采用尾静脉注射LPS 法构建脓毒症小鼠模型,也证实心肌细胞发生焦亡。因此,深入探明细胞焦亡在脓毒症心肌损伤中的调控机制对防控该病有重要意义。
3.2 AIM2 介导的细胞焦亡与心血管疾病相关 研究表明AIM2 介导的细胞焦亡与心血管疾病密切相关[17]。Wang 等[18]研究表明,在糖尿病心肌病小鼠中,线粒体损伤释放的ROS 可以增加AIM2 表达,进而诱发细胞焦亡,促进糖尿病心肌病的发生。在心肌缺血再灌注小鼠心脏组织中AIM2 表达显著升高[19],并且其下游的细胞焦亡相关炎性因子IL-18升高[20],提示AIM2介导的细胞焦亡可能促进该疾病进展。本研究显示,与对照组相比,LPS处理组心肌细胞线粒体膜电位显著下降且ROS释放增多,AIM2及焦亡相关蛋白GSDMD、GSDMD-N、IL-1β 和p17表达均升高,细胞上清液中IL-1β 含量增加,提示LPS可促进心肌细胞发生AIM2介导的细胞焦亡,这可能是导致心肌损伤的重要原因。
3.3 Naa20 通过抑制AIM2 介导的细胞焦亡减轻脓毒症心肌损伤 Naa20 与多种疾病进展有关。Jung等[8]发现,Naa20通过其N端乙酰基酶活性调控肝激酶B1(LKB1)-腺苷酸活化蛋白激酶(AMPK)信号通路,从而参与肝癌的发生发展。Morrison 等[21]发现,突变的Naa20 可损害NatB 的酶活性,患者出现发育迟缓、智力低下等表现。然而,Naa20在脓毒症心肌损伤中的调控作用还鲜见报道。本研究发现,与对照组相比,LPS处理组乳鼠心肌细胞中的Naa20表达水平升高,并且在H9c2心肌细胞中过表达Naa20可提高心肌细胞活力并减少LDH 释放,表明Naa20 可以有效减轻脓毒症心肌损伤。Naa20的反应底物需满足其N端前两个氨基酸为M和E(ME)或谷氨酰胺(MQ)或天冬氨酸(MD、MN)[22],通过比对不同种属的AIM2氨基酸序列,发现其前两个氨基酸均为ME,推测Naa20 可能调控AIM2。本研究利用免疫共沉淀实验证实Naa20 与AIM2 结合;与LPS 组相比,Naa20+LPS 组中AIM2 的乙酰化修饰增加,AIM2 及焦亡相关蛋白GSDMD、GSDMD-N、IL-1β 和p17 的蛋白表达下降,且细胞上清液中IL-1β含量降低,表明Naa20可以抑制AIM2介导的细胞焦亡。
综上所述,Naa20 可通过结合AIM2,增加AIM2乙酰化修饰,抑制AIM2 介导的细胞焦亡,从而减轻LPS脓毒症心肌损伤。本研究丰富了脓毒症心肌损伤的发病机制,且探讨了Naa20的调控作用及机制,有望为该病的临床治疗提供新思路和新靶点。
