含笑内酯通过抑制NF-κB/NLRP3轴改善单侧输尿管梗阻模型小鼠的肾脏病变
2023-10-15雷向宏严文君熊梅梅龙海波陈斯佳
雷向宏,严文君,熊梅梅,龙海波,陈斯佳
慢性肾脏病(chronic kidney disease,CKD)严重危害人类健康,发展至终末期可出现多种严重并发症,是死亡的主要原因。2016 年,慢性肾脏病在全球死亡原因中排名第16位,预计到2040年将上升到第5位[1]。随着人口老龄化及饮食结构的改变,糖尿病、高血压患病人群日益增加,自1990年以来,全球CKD 的全年龄患病率增加了29.3%,2017 年全球CKD患者人数达6.975亿,全球患病率9.1%;中国患病人数达1.323 亿,因此CKD 防治已成为全世界共同关注的公共卫生问题[2]。由于CKD尚无有效的根治方法,对其发病机制及干预靶点的研究成为当前热点。CKD 的一个重要特征是持续的肾脏炎症状态,并渐进性发展至肾纤维化。已知核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎症小体能够调节肾脏炎症及肾纤维化[3]。含笑内酯(micheliolide,MCL)是以小白菊内酯为原料加工合成的具有抗炎及抗肿瘤作用的愈创木倍半萜内酯类化合物。笔者前期研究发现MCL 可抑制脂多糖诱导的肾小管上皮细胞核因子(NF)-κB 通路和NLRP3 炎症小体通路的活化,从而改善肾小管细胞炎症[4]。本研究以单侧输尿管梗阻(UUO)小鼠为研究对象,研究MCL对UUO 小鼠肾组织NLRP3 炎症小体活化和相关炎性因子及肾脏病理损伤的影响,探讨其抗肾纤维化机制。
1 材料与方法
1.1 动物 SPF 级7 周龄雄性C57BL/6J 小鼠购自湖南斯莱克景达有限公司,动物生产许可证号:SCXK(湘)2019-0004,体质量20~25 g,普通饲料饲养,温度20~26 ℃,湿度40%~70%。
1.2 主要试剂 MCL 衍生物二甲胺基含笑内酯富马酸盐(dimethylaminomicheliolide,DMAMCL)购自天津尚德缘药业科技股份有限公司。DMAMCL 溶液配制:称取DMAMCL 粉末8.0 mg溶解于3.2 mL生理盐水,终浓度2.5 g/L。BCA蛋白定量试剂盒购自武汉伊莱瑞特生物科技股份有限公司,预染蛋白Marker 购自美国Thermo 公司,PVDF 膜购自美国Millipore 公司;兔源一抗NLRP3、胱天蛋白酶(caspase)-1、白细胞介素(IL)-1β、肿瘤坏死因子(TNF)-α 和磷酸化的NFκB p65(p-NF-κB p65)等抗体均购自美国Affinity公司,兔源一抗NF-κB p65 购自美国Proteintech 公司;鼠源一抗GAPDH、β-actin、山羊抗鼠IgG(H+L)和山羊抗兔IgG(H+L)购自中杉金桥生物技术有限公司;HE 染色试剂盒购自武汉博士德生物工程有限公司;Masson三色染色液购自武汉赛维尔生物科技有限公司;TUNEL检测试剂盒购自碧云天生物技术有限公司;荧光显微镜购自日本OLYMPUS公司;超高灵敏度化学发光成像系统购自美国Bio-Rad公司。
1.3 方法
1.3.1 动物模型制备 小鼠适应性饲养7 d 后,采用随机数字表法分为假手术(Sham)组、UUO 组、UUO+MCL(给药)组,每组6 只。Sham 组将小鼠左侧输尿管暴露游离,但不结扎;UUO 组和UUO+MCL 组将小鼠左侧输尿管暴露游离,用5-0丝线对左侧输尿管上端进行双结扎;分层缝合好腹部切口,碘伏消毒。术后腹腔内注射10 万U 青霉素。UUO+MCL 组小鼠造模前1 d起予以药物干预,25 mg/kg MCL 每日灌胃0.5 mL,连续8 d。Sham 组给予等体积生理盐水灌胃。术后7 d终止实验,末次给药24 h 后腹腔注射10%水合氯醛麻醉小鼠,用4 ℃预冷的PBS经心脏灌注小鼠全身各脏器,待肾脏颜色变白后,用剪刀迅速摘取肾脏。部分肾组织置于冻存管中迅速放入-80 ℃冰箱中保存用于提取蛋白,留取部分肾组织固定于4%多聚甲醛24 h,常规脱水,石蜡包埋,切片。实验流程见图1。
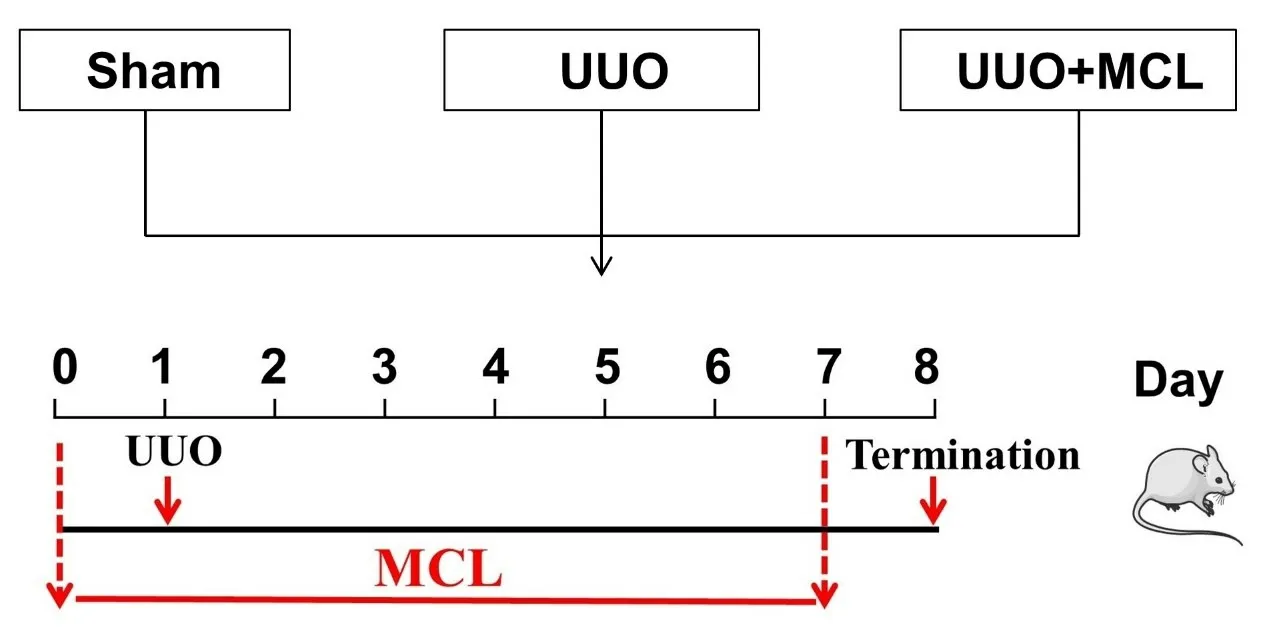
Fig.1 Schematic diagram of animal experiment design图1 动物实验设计示意图
1.3.2 HE染色观察小鼠肾组织病理变化 小鼠肾组织块固定于4%多聚甲醛24 h后,梯度乙醇脱水,石蜡包埋,切成4 μm切片,放入载玻片上。将肾组织切片,脱蜡水化,HE染色,脱水透明,风干后中性树胶封片,置于显微镜下观察并拍照。
1.3.3 Masson 染色观察小鼠肾组织肾纤维化情况 石蜡切片脱蜡,经核染液染色,1%盐酸乙醇分化;丽春红染色;1%磷钼酸溶液分化;2.5%苯胺蓝溶液复染;1%冰醋酸分化后,脱水晾干,封片后置于显微镜下观察并拍照。使用Image J软件图像分析计算胶原容积分数(CVF),即胶原阳性的面积与组织总面积的百分比,胶原纤维显示为蓝色。
1.3.4 TUNEL检测细胞凋亡 肾组织切片于二甲苯脱蜡后,梯度乙醇水化,将切片置入湿盒。滴加胃蛋白酶,37 ℃反应30 min。PBS洗涤后滴加足量TUNEL检测液,37 ℃避光孵育2 h,洗涤后滴加DAPI 染核。用含抗荧光淬灭剂的封片液封片,置于荧光显微镜下观察并拍照,阳性细胞核为红色,使用Image J软件计算各视野下阳性细胞数,计算其细胞凋亡率。
1.3.5 免疫组化染色检测NLRP3、caspase-1、IL-1β、TNF-α、NF-κB p65蛋白表达 石蜡切片烤片、脱蜡水化后置于修复盒中。加入抗原修复液柠檬酸缓冲液,高压锅内加热抗原修复。经3%H2O2消除内源性过氧化物酶,5%BSA 滴于载玻片上封闭非特异性蛋白后,滴加足量的稀释好的一抗NLRP3、caspase-1、IL-1β、TNF-α、NF-κB p65,置于湿盒中4 ℃孵育过夜。次日漂洗孵育二抗后,PBS淋洗,DAB显色,苏木精复染,自来水冲洗,最后封片、镜检。阳性反应组织呈棕色,使用Image J软件分析计算各视野的平均光密度值。
1.3.6 Western blot 检测NLRP3、caspase-1、IL-1β、TNF-α、p-NF-κB p65 蛋白表达 称取适量肾组织样本,加入裂解液,放入组织研磨仪内研磨后,离心取上清液,用BCA法检测蛋白浓度并配平。95 ℃煮沸5 min 使蛋白变性。配制SDSPAGE 胶,电泳分离蛋白后转移至PVDF 膜;用5%脱脂奶粉封闭2 h,NLRP3(1∶500)、caspase-1(1∶500)、IL-1β(1∶500)、TNF-α(1∶500)、p-NF-κB p65(1∶500)、GAPDH(1∶2 000)、β-actin(1∶2 000)一抗4 ℃冰箱孵育过夜;用TBST洗膜3次,PVDF膜孵育二抗2 h后,TBST洗膜3次,用发光液浸湿PVDF膜后显影成像。使用Image J 软件计算条带与内参的灰度比值。
1.4 统计学方法 应用SPSS 20.0软件进行数据分析。数据均采用均数±标准差(xˉ±s)表示。多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验或Tukey检验。以P<0.05为差异有统计学意义。
2 结果
2.1 HE 染色结果 Sham 组小鼠肾组织无明显病变,未见肾小管扩张、间质炎症细胞浸润及纤维组织增生性改变。UUO 组肾小管进行性扩张,间质水肿伴有少量的炎性细胞浸润。UUO+MCL 组肾组织病变程度较UUO组明显好转。见图2。
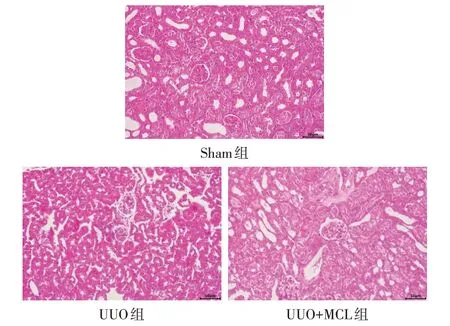
Fig.2 HE staining Results of renal tissue in each group(×400)图2 各组肾组织HE染色结果(×400)
2.2 Masson 染色结果 Sham 组、UUO 组、UUO+MCL 组CVF(%)分别为2.613±1.358、8.335±2.388 和1.958±0.784(n=6,F=27.133,P<0.01),与Sham 组相比,UUO 组胶原容积分数增加(P<0.05),肾小管扩张,肾间质宽度增加。UUO+MCL 组胶原容积分数较UUO组减少(P<0.05)。见图3。
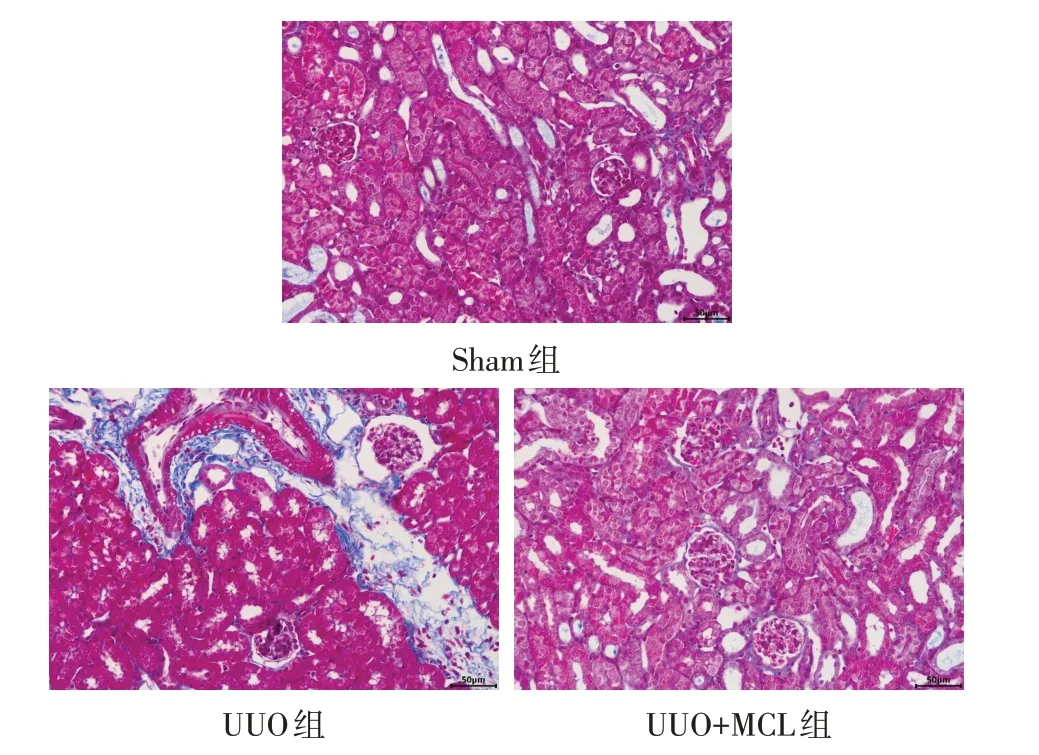
Fig.3 Masson staining Results of kidney tissue in each group(×400)图3 各组肾组织Masson染色结果(×400)
2.3 TUNEL 染色结果 Sham 组、UUO 组、UUO+MCL 组的细胞凋亡率(%)分别为1.056±0.929、11.037±2.736 和3.611±2.284(n=6,F=35.675,P<0.01),与Sham组相比,UUO组小鼠肾组织细胞凋亡率明显升高(P<0.01)。与UUO 组相比,UUO+MCL组凋亡率明显下降(P<0.01)。见图4。
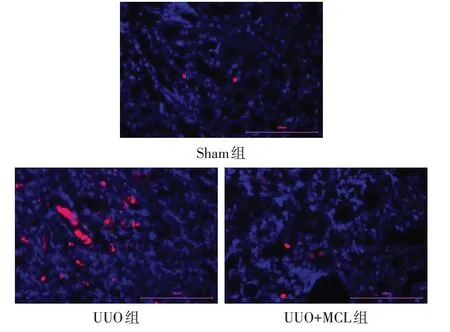
Fig.4 TUNEL staining Results of kidney tissue in each group(×400)图4 各组肾组织TUNEL染色结果(×400)
2.4 免疫组化染色结果 与Sham 组相比,UUO 组肾组织中NLRP3、caspase-1、IL-1β和TNF-α的蛋白表达水平升高(P<0.05);UUO+MCL 组与UUO 组相比,NLRP3、caspase-1、IL-1β 和TNF-ɑ 表达水平下降(P<0.05)。见图5、表1。

Tab.1 Comparison of the expression levels of NLRP3,caspase-1,IL-1β and TNF-α proteins in renal tissue between the three groups表1 各组肾组织NLRP3、caspase-1、IL-1β和TNF-α蛋白表达水平比较(n=6,xˉ±s)
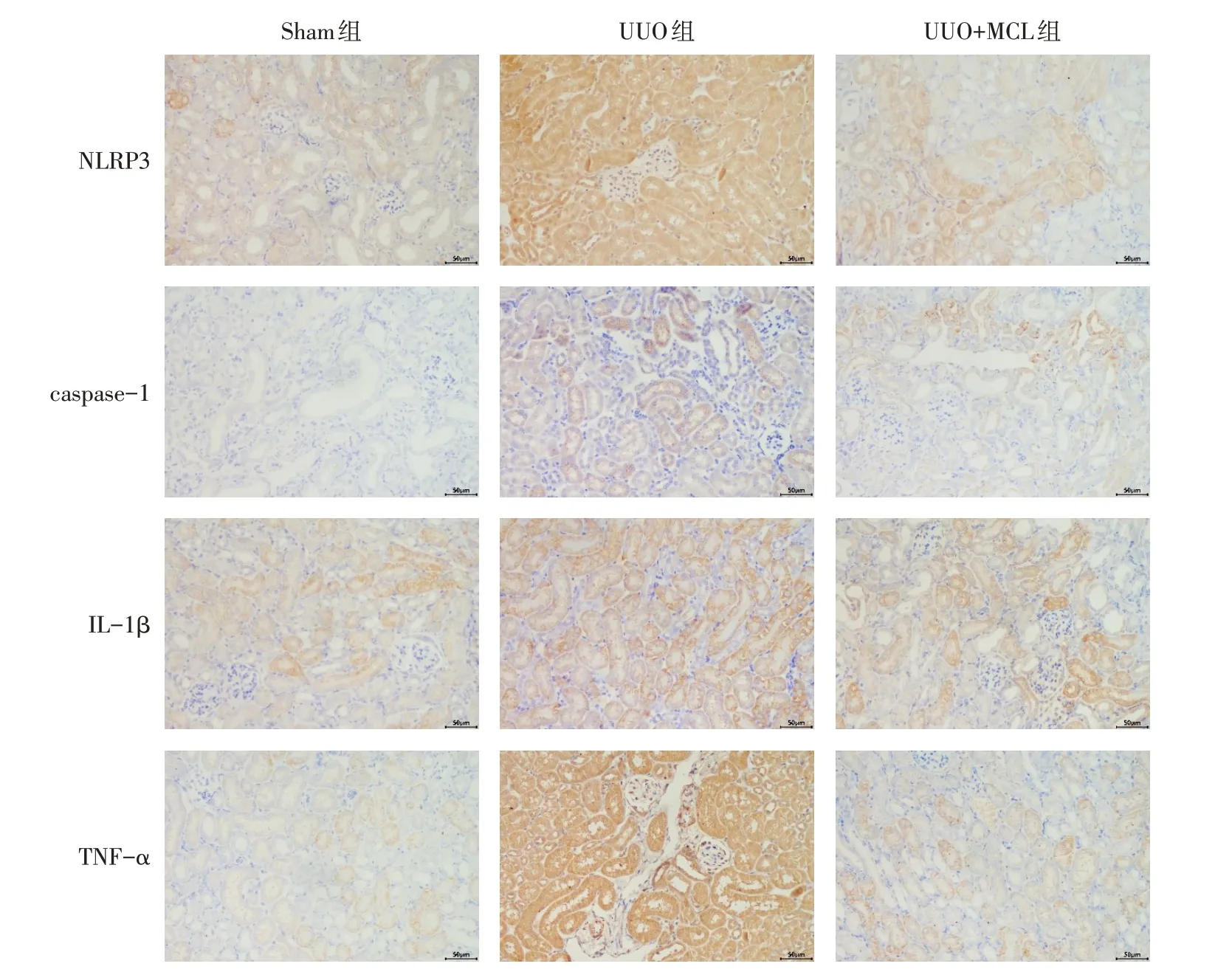
Fig.5 Immunohistochemical Results of of NLRP3,caspase-1,IL-1β and TNF-ɑ in renal tissue(×400)图5 各组肾组织NLRP3、caspase-1、IL-1β、TNF-α免疫组化结果(×400)
2.5 各组肾组织NLRP3、caspase-1、IL-1β、TNF-α蛋白印迹结果 与Sham 组相比,UUO 组肾组织中NLRP3、caspase-1、IL-1β、TNF-α的表达水平均升高(P<0.05);UUO+MCL 组较UUO 组NLRP3、caspase-1、IL-1β、TNF-α均下降(P<0.05)。见图6、表2。

Tab.2 Comparison of expression levels of NLRP3,caspase-1,IL-1β and TNF-α proteins in renal tissue between the three groups表2 各组肾组织NLRP3、caspase-1、IL-1β和TNF-α蛋白表达水平比较(n=6,xˉ±s)

Fig.6 The expression levels of NLRP3,caspase-1,IL-1β and TNF-α proteins in renal tissue of each group detected by Western blot assay图6 Western blot检测各组肾组织NLRP3、caspase-1、IL-1β、TNF-α蛋白表达情况
2.6 各组肾组织NF-κB p65 的免疫组化染色和p-NF-κB p65蛋白免疫印迹结果 Sham组、UUO 组和UUO+MCL 组NF-κB p65 蛋白表达水平分别为0.043±0.007、0.162±0.012 和0.061±0.008(n=6,F=283.885,P<0.01),与Sham 组相比,UUO 组NF-κB p65 蛋白表达量上升(P<0.05)。与UUO 组相比,UUO+MCL 组NF-κB p65 蛋白表达量下降(P<0.05)。见图7。蛋白免疫印迹结果显示,Sham 组、UUO组和UUO+MCL组p-NF-κB p65蛋白表达水平分别为0.342±0.072、0.454±0.056 和0.336±0.065(n=6,F=6.281,P<0.05),与Sham 组相比,UUO 组p-NF-κB p65 蛋白表达量上升(P<0.05)。与UUO 组相比,UUO+MCL 组p-NF-κB p65 蛋白表达量下降(P<0.05)。见图8。
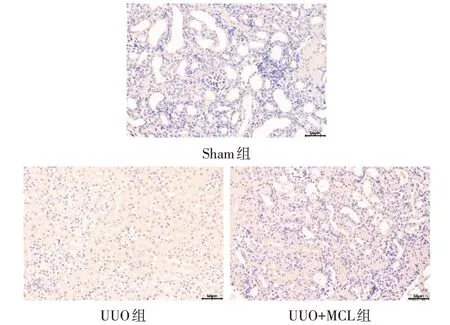
Fig.7 Immunohistochemical Results of NF-κB p65 in renal tissue(×400)图7 各组肾组织NF-κB p65免疫组化结果(×400)
3 讨论
肾间质炎症和肾纤维化是终末期肾病病程进展的重要病变[5]。上皮-间充质转化(EMT)参与了肾纤维化形成的过程,上皮细胞在慢性或反复损伤的情况下分化为肌成纤维细胞,形成纤维化的疤痕组织[6]。炎性细胞或肾驻留细胞分泌的促炎和促纤维化因子,如IL-1、TNF-α、单核细胞趋化蛋白-1和转化生长因子(TGF)-β,参与了CKD 的发生和进展。肾小管间质炎症是肾纤维化形成的关键过程。肾脏损伤后,各种促炎刺激可以激活成纤维细胞[7]。
3.1 肾脏炎症在肾纤维化发展中的作用 本实验UUO 动物模型是以肾小管损伤为主要特征的肾间质纤维化模型。输尿管梗阻导致肾间质炎症和纤维化反应,慢性肾小管间质性肾炎是CKD特别是梗阻性尿路疾病的主要病理改变[8]。通过调控相关因子抑制肾小管炎症可减轻肾纤维化的严重程度[9-10]。本研究HE 染色及Masson 染色结果表明MCL 减轻UUO小鼠的肾间质炎症及肾纤维化,TUNEL染色结果表明MCL下调了UUO小鼠的肾组织的细胞凋亡。炎症小体是细胞内的传感器,可通过损伤相关的分子模式与细胞表面Toll样受体家族的连接而被激活,导致炎症反应。这个过程激活NF-κB信号通路或线粒体活性氧的产生并触发炎症小体[11]。NLRP3 炎症小体能够调节肾脏炎症及肾纤维化[12]。其可被多种非微生物危险信号激活。NLRP3通过富含亮氨酸的重复序列和含热蛋白结构域招募凋亡相关斑点样蛋白(ASC),然后ASC水解pro-caspase-1。最后,活化的caspase-1 将IL-1β 和IL-18 切割成成熟形式[13]。IL-1β 和IL-18 是参与CKD 进展的重要促炎细胞因子。Vilaysane等[12]研究发现,在UUO小鼠模型中,NLRP3 基因敲除(NLRP3-/-)小鼠较野生型小鼠caspase-1、IL-1β 和IL-18 表达显著降低,肾小管损伤,炎症和纤维化明显减少。
3.2 MCL 对肾脏炎症及肾纤维化的作用机制探讨 MCL是以NF-κB抑制剂小白菊内酯(PTL)体外半合成的倍半萜烯内酯化合物。小白菊内酯是从艾菊、观光木等药用植物中提取而来。MCL 较PTL 具有更高的稳定性,更低的毒性和更长的半衰期[14]。本研究使用的DMAMCL 在生理或中性条件下表现出更高的稳定性、更低的毒性以及MCL释放的持续性。现已证明MCL具有强大的抗炎和抗癌作用[15],具有广阔的临床应用前景。MCL能通过上调腹膜间皮细胞的自噬水平有效抑制腹膜纤维化[16]。MCL能通过抑制糖尿病小鼠Mtdh 介导的肾脏炎症水平改善糖尿病性肾脏疾病肾损伤[17]。笔者前期研究发现MCL可通过抑制线粒体ROS的释放,进一步抑制NF-κB通路及NLRP3炎症小体的活化,改善肾小管细胞炎症[4]。
本研究发现,MCL可减轻UUO小鼠肾组织间质炎症反应及肾纤维化,并减少肾组织细胞凋亡;免疫组化染色及免疫印迹结果显示,MCL 干预后NLRP3、caspase-1、IL-1β 较UUO 组显著下调,表明MCL抑制UUO小鼠肾组织NLRP3炎症小体的活化,改善了肾间质炎症反应。已知细胞焦亡是一种炎性细胞死亡方式,主要标志是炎症小体的形成、caspase的激活以及大量促炎因子的释放。因此,笔者认为MCL可抑制UUO小鼠肾组织的细胞焦亡。
促炎转录因子NF-κB 调节先天和适应性免疫反应的多个方面。在炎症小体中,NF-κB 可诱导NLRP3和IL-1β在炎症信号应答中转录调控[11]。静息状态下NF-κB的异源二聚体(p65-p50)和抑制蛋白IκB 结合,以无活性的形式存在于细胞质中,当NF-κB 被IL-1、IL-2、TNF-α 等细胞因子刺激后,导致NF-κB p65磷酸化并进入细胞核内。本研究发现MCL 下调UUO 小鼠肾组织p-NF-κB p65 蛋白的表达,表明MCL 可通过抑制NF-κB 通路抑制UUO 小鼠肾组织间质炎症,在NLRP3炎症小体活化的过程中,NF-κB 活化介导了NLRP3 启动过程,因此推测MCL 通过抑制NF-κB/NLRP3 轴减轻UUO 小鼠肾间质炎症及纤维化。
综上所述,本研究发现MCL通过下调UUO小鼠肾组织p-NF-κB p65、NLRP3、caspase-1、IL-1β、TNF-α表达减轻肾间质炎症及肾纤维化,表明MCL可能通过抑制NF-κB/NLRP3轴实现肾脏保护作用。这对今后MCL 在肾纤维化的防治中提供了理论依据,但本研究样本数目较少,且只选择了术后一个时间点进行研究,故结果具有一定局限性。今后将扩大样本深入研究MCL抗肾纤维化机制。
