肝动脉灌注化疗联合全身治疗在多线治疗失败转移性肝癌中的疗效及安全性分析
2023-10-14林彧夫张秀萍张真真程莉莎苏志敏李智勇
林彧夫 李 芳 张秀萍 张真真 程莉莎 苏志敏 李智勇
1.复旦大学附属中山医院厦门医院肿瘤内科,福建厦门 361015;
2.复旦大学附属中山医院厦门医院肝肿瘤内科,福建厦门 361015
肝脏是晚期恶性肿瘤常见的转移部位,约50%的转移性癌症患者发现肝转移[1-2],预后不佳,是癌症相关病死的主要原因之一[2]。而肝转移灶的控制对患者症状和预后有重要影响,肝脏局部治疗可以提高疾病控制率,并可改善生存预后[2]。肝切除术和肝脏肿瘤消融术可根治转移性肝癌,但大部分患者无根治性手术或接受肿瘤消融治疗的机会[3]。肝动脉灌注化疗(hepatic artery infusin chemotherapy,HAIC)是一种可行且有前景的局部治疗手段,可用于治疗不可切除的转移性肝癌患者[4-5]。本研究采用HAIC 联合全身抗肿瘤治疗恶性肿瘤肝转移患者,观察其临床疗效及安全性,旨在为临床提供参考。
1 资料与方法
1.1 一般资料
纳入标准:①年龄18 ~75 岁;②经细胞病理学及组织病理学确诊的恶性肿瘤肝转移患者,并接受HAIC 治疗;③临床资料完整且真实;④自愿参与本研究。排除标准:①不符合上述入组标准;②合并严重肝肾功能异常及造血系统异常;③合并其他恶性肿瘤者;④存在精神障碍者。
共纳入2020 年12 月至2022 年3 月复旦大学附属中山医院厦门医院(本院)收治的23 例接受肝动脉灌注化疗的多线治疗失败、肝转移为主的恶性肿瘤患者。其中男15 例,女8 例,年龄34 ~75 岁,中位年龄58 岁。其中肠癌13 例,胃癌2 例,胰腺癌4 例,乳腺癌1 例,卵巢癌1 例,肺癌2 例。23 例患者中已经经过标准二线治疗3 例,三线及以上治疗20 例。本研究方案通过本院医学伦理委员会批准(批准文号:B2020-049),患者均签署知情同意书。
1.2 方法
1.2.1 HAIC 治疗方案 行右侧股动脉(或其他动脉如桡动脉、锁骨下动脉等)穿刺,将5F RH 导管(日本泰尔茂导管插入并分别在腹腔干和肠系膜上动脉进行动脉造影检查;根据肿瘤的动脉供血情况,选择性将导管置入肿瘤供血动脉。如果肿瘤同时接受腹腔干和肠系膜上动脉供血,或有其他来源的供血动脉,则将导管置入肿瘤最大的供血动脉。HAIC 灌注化疗方案:根据原发肿瘤病理类型选择,治疗结束后拔出动脉导管,穿刺点压迫止血,每3 ~4 周一个疗程。术前、术后第1 天、术后第3 天随访血常规、肝肾功能、电解质、凝血功能、C 反应蛋白、降钙素原、肿瘤标志物等变化;每2 个月影像学检查1 次。
1.2.2 全身治疗方案 HAIC 联合全身化疗6 例,联合靶向抗血管生成治疗9 例,联合靶向抗血管生成治疗+全身化疗7 例,联合靶向抗血管生成治疗+免疫治疗1 例,见表1。
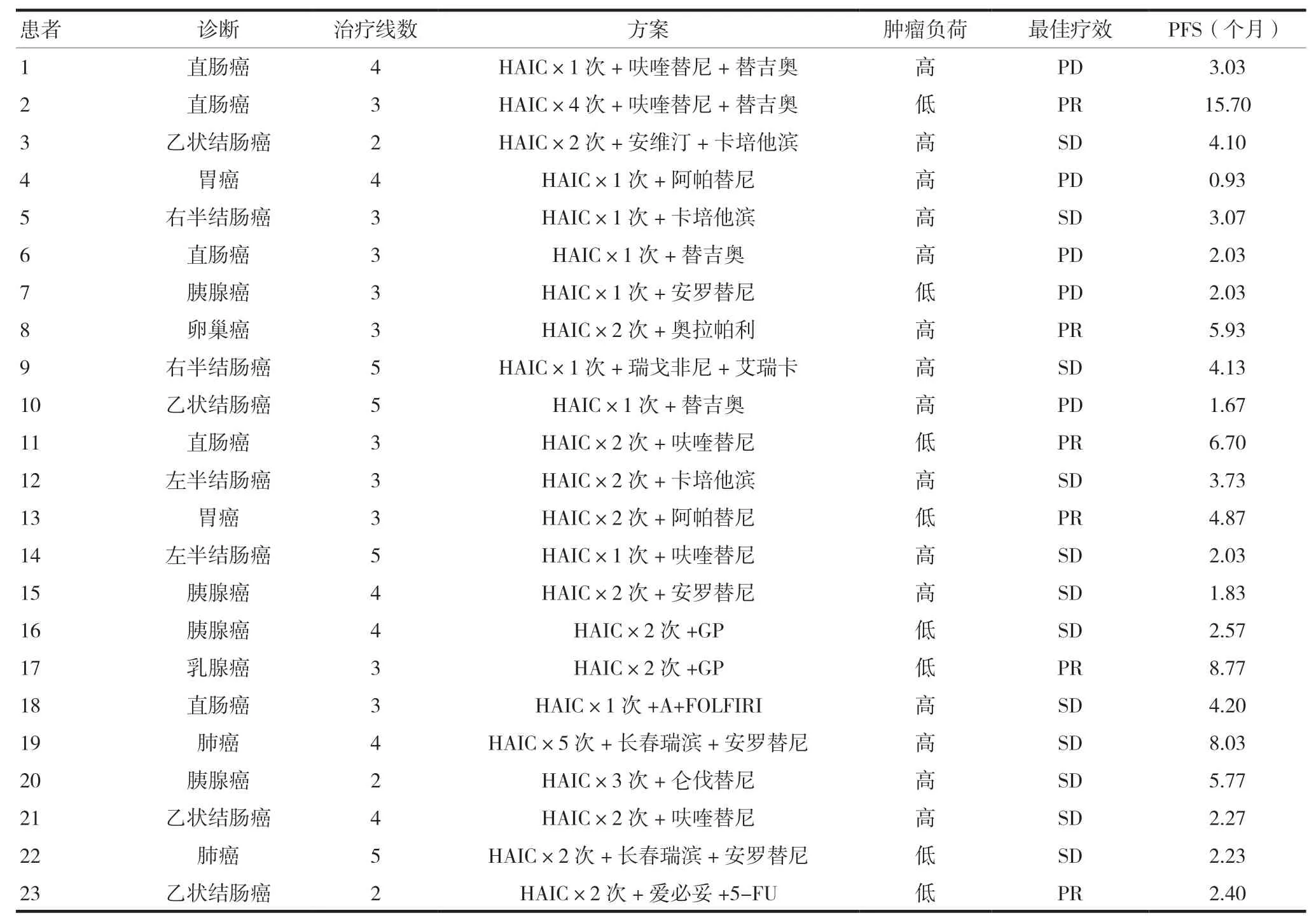
表1 患者基本信息、联合治疗情况及疗效
1.3 随访及评价指标
依据实体瘤新疗效评价标准:修订版RECIST指南(RECIST 1.1)进行临床疗效评价。疾病控制率(disease control rate,DCR)=(完全缓解+部分缓解+病情稳定)例数/总例数×100%。客观有效率(objective remission rate,ORR)=(完全缓解+部分缓解)例数/总例数×100%。肿瘤负荷评分[6](tumor burden score,TBS),以转移灶的最大直径为横轴,数目为纵轴,以TBS2=最大直径2+数目2的公式为基础构建坐标系,将TBS>9 定义为高肿瘤负荷,TBS ≤9 定义为低肿瘤负荷。不良反应评价按照美国NCI 制定的不良反应评价标准(national cancer institute common terminology criteria for adverse events,NCI-CTCAE)4.03 版[7]。 无进展生存期(progression-free survival,PFS)定义为HAIC 治疗开始至疾病进展或死亡的时间。未进展者按照截尾值处理,截尾时间为确认其未进展的末次随访时间。采用查阅病例、门诊、互联网医院和电话等方式进行随访,末次随访时间截至2022 年12 月31 日。
1.4 统计学分析
采用SPSS 23.0 统计学软件进行统计分析。计数资料采用χ2检验或Fisher 确切概率法。采用Kaplan-Meier 绘制生存曲线,Log-rank 检验进行组间比较。Cox 风险回归模型进行多因素分析。以P< 0.05 为差异有统计学意义。
2 结果
2.1 全组患者ORR及PFS
截至2022 年12 月31 末次随访,中位随访时间为11.2 个月(95%CI:5.60 ~11.94)。其中部分缓解(patial response,PR) 6 例,疾病稳定(stable disease,SD) 12 例,疾病进展(progression disease,PD) 5 例,ORR 为26.09%(6/23),DCR 为78.26%(18/23),见表1,中位PFS 为4.10 个月(95%CI:2.06 ~5.53),生存曲线见图1。
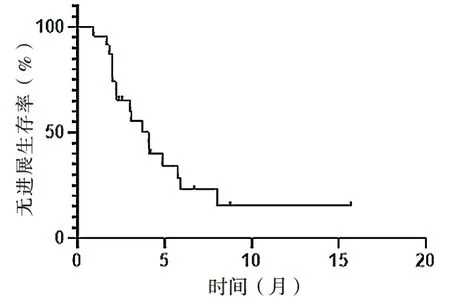
图1 23 例患者Kaplan-Meier 无疾病进展生存曲线
2.2 不同因素分层患者PFS比较
单因素分析显示:肿瘤负荷、肝转移灶血供、疗效、治疗线数与患者的中位PFS 相关(P< 0.05)。Cox 多因素分析显示:疗效、治疗线数、肝转移灶血供是影响HAIC 治疗PFS 的独立影响因素(P< 0.05)。见表2 ~3、图2。
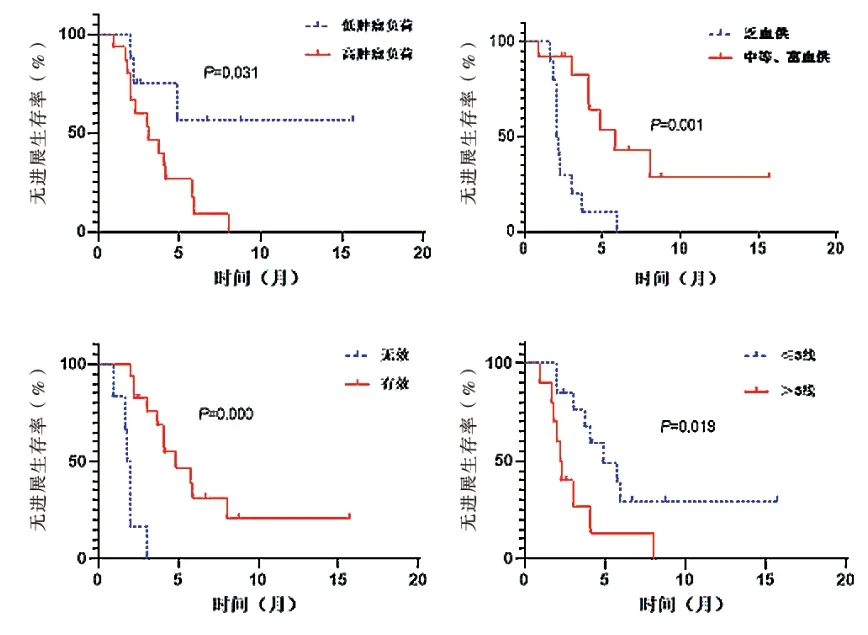
图2 肿瘤负荷、肝转移灶血供、疗效、治疗线数与患者的中位PFS 相关性

表2 各变量与中位PFS的单因素分析

表3 各变量与中位PFS的多因素分析
2.3 不良反应发生情况
不良反应以骨髓抑制及肝功能损害为主,发生率均为26.09%(6/23),未见介入手术相关穿刺并发症;总体不良反应以Ⅰ~Ⅱ级为主,占52.17%(12/23),Ⅲ级不良反应为17.39%(4/23),无Ⅳ级不良反应(表4)。肝转移灶肿瘤负荷高的患者在术后预防性保肝治疗下,肝功能损害的发生率与肿瘤负荷低的患者差异无统计学意义(χ2=1.174,P=0.369),见表5。
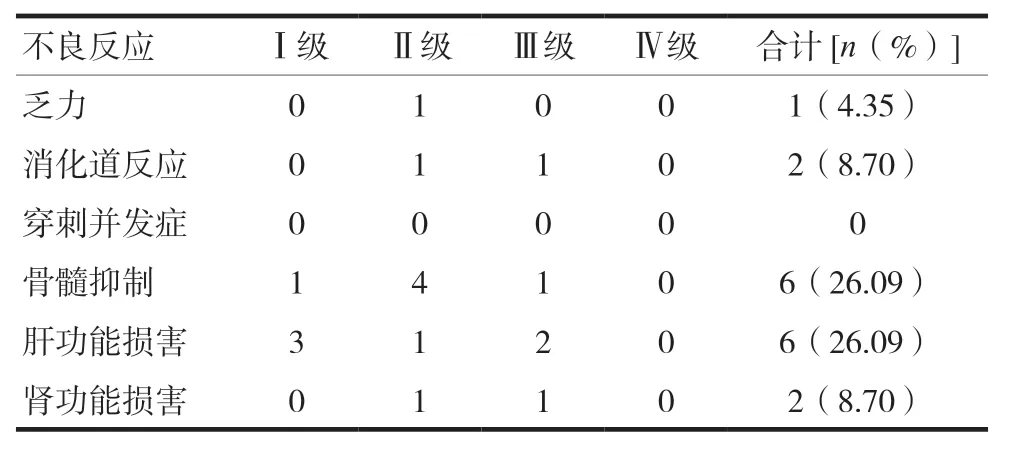
表4 不良反应发生情况

表5 肝功损害与肿瘤负荷关系
3 讨论
肝转移是影响晚期肿瘤患者病情控制和生活质量的重要因素,且肝转移病灶的持续进展是晚期肿瘤治疗面临的重大挑战,许多患者尽管进行了标准的全身化疗,但疾病仍进展,后续单纯全身治疗获益有限,因此,全身治疗联合肝脏病灶局部治疗模式或可提高转移性肝癌患者的总体预后[8]。
HAIC 作为肝脏局部治疗的一种方式,常用于治疗结直肠癌合并不可切除肝转移全身化疗失败的患者[8]。由于HAIC 直接向肿瘤输注比全身化疗更高浓度的抗肿瘤药物,可增强抗肿瘤作用,降低全身毒性,因此对于标准治疗失败的难治性肝转移患者仍然是可选的有效治疗之一[9]。HAIC 配合使用适当的对肿瘤敏感的化疗药物对提高肝转移灶的局控率、生存率和转化率有着重大意义[4-5,10-16]。经静脉途径行系统化疗,肿瘤局部药物浓度主要依赖于肿瘤血供,因此肿瘤异质性越高,血供越丰富,疗效反应越好;而经动脉直接行HAIC 治疗,从给药方式上提高了局部药物浓度,从而降低对肿瘤血供的影响[4-5,10-15]。并且,HAIC 可持续多日给药,延长高浓度化疗药物的作用时间,并且无须使用栓塞剂,可以杜绝栓塞综合征及异位栓塞等不良事件发生,具有更好的安全性及有效性[17]。本研究纳入23 例恶性肿瘤肝转移多线治疗失败患者,经过HAIC 联合全身化疗或靶向治疗,中位PFS 为4.10 个月(95%CI:2.06 ~5.53),ORR 为26.09%(6/23),DCR 为78.26%(18/23),起到了良好的治疗作用。
HAIC 既往证据多用于原发性肝癌以及胃肠道恶性肿瘤患者中,对于其他瘤种研究相对较少,本研究首次研究非胃肠道转移性肝癌患者,其中56.5%(13/23)患者为结直肠癌患者,ORR为23.07%(3/13),DCR 为76.92%(10/13);43.5%(10/23)患者为非肠癌患者,ORR 为30%(3/10),DCR 为80%(8/10),差异无统计学意义。可见对于非结直肠癌肝转移患者,HAIC 联合全身化疗显示出了相似的有效性,可考虑在其他瘤种中推广使用。有文献报道[17],影响胃癌肝转移患者HAIC 治疗的预后因素主要为有无肝外转移、肝转移发生时间、化疗方案的选择等。本研究进行单因素及多因素分析结果显示:疗效、治疗线数、肝转移灶血供是影响HAIC 治疗PFS 的独立影响因素(P< 0.05)。影响因素差异可能是因为瘤种选择差异、肝动脉灌注药物差异及联合全身抗肿瘤方案差异所导致,后续期待大样本、多中心随机对照试验验证。
据报道[17-22],HAIC 常见不良反应有:①导管相关并发症,包括导管脱落移位、堵塞、导管相关感染。②插管导致血管闭塞、狭窄、夹层,皮下血肿或瘀血等。③化疗药物持续动脉灌注引起动脉痉挛等导致腹上区疼痛。④化疗相关不良反应,较全身化疗轻,通常对症处理后可快速好转。本研究中未见介入手术相关穿刺并发症,可见HAIC 手术并发症产生与手术医生的经验及技术水平相关,需要熟练掌握该项技术的医生实行手术操作,技术要求相对较高;本研究主要不良反应以骨髓抑制及肝功能损害为主,发生率均为26.09%(6/23),总体不良反应以Ⅰ~Ⅱ级为主,占52.17%(12/23),无Ⅳ级不良反应。既往研究显示肝肿瘤负荷大小是影响肝脏局部治疗后肝功能异常发生的重要影响因素[2],但本研究结果显示,HAIC 并未增加肝转移灶肿瘤负荷较大患者术后肝损伤发生率。总体而言,HAIC 对多线治疗后失败实体瘤治疗安全性尚可,不良反应可控。
综上所述,HAIC 联合全身化疗或靶向治疗恶性肿瘤肝转移患者近期疗效确切,技术安全可行,不良反应可控。对于恶性肿瘤肝转移患者,即使是多线治疗失败,HAIC 仍是临床可选的治疗策略。本研究为单中心回顾性研究,后续需多中心、大样本随机临床试验进一步验证。
