乳酸菌胞外多糖在畜牧业替抗中的应用前景
2023-10-13谢荔朋高俊帅李兆龙
谢荔朋 闫 露 高俊帅 李兆龙*
(1.福建九为生物技术有限公司 福建漳州 363900;2.福建省农业科学院畜牧兽医研究所 福州 350013)
乳酸菌(LAB)是一种能够发酵碳水化合物并产生大量乳酸的微生物的总称[1]。 它是一种具有悠久历史的食品工业生产菌种,被广泛用于发酵产品、肉制品、 医疗和保健产品中。 特别是在生产发酵乳制品,如乳酪和酸乳,对生产产品的质地、口味、风味和营养价值方面起着重要作用, 这些功能特性主要是通过乳酸菌分泌的次级代谢物胞外多糖来实现。
乳酸菌胞外多糖 (EPS) 是一种水溶性长链多糖,由发酵产生并分泌到胞外,分子量4.0×104~6.0×106u[2]。 它不仅具有独特的物理和化学特性,可以改善发酵物的质地、口感、流变性、稳定性、持水能力和增强肠道表面的非特异性粘附性[3]。 同时,它也是一种具有生物活性的功能性多糖,具有抗菌、抗突变、抗肿瘤、调节免疫力、降低胆固醇和调节胃肠功能等多种保健作用,且自身无任何毒副作用[4-5]。 此外,近些年由于畜牧业中抗生素使用过量带来的危害日趋严重,为了进一步减少抗生素危害,提高食品安全,国家出台一系列减抗和替抗的条文和措施, 以促进畜牧业生产中的减抗和替抗。 作为乳酸菌代谢物胞外多糖,它的抗菌和抑菌效果,日益得到重视。 为了更全面了解乳酸菌代谢物胞外多糖在畜牧业生产中的作用及应用前景, 本文从乳酸菌代谢物胞外多糖结构、生理生化特点、功能以及它在畜牧业生产中的应用作较为完整的回顾, 以期推动乳酸菌代谢物胞外多糖在畜牧业生产中替抗的应用。
1 乳酸菌胞外多糖化学结构
1.1 根据分泌特点分类 根据乳酸菌分泌到菌体外特点,可将EPS 分为:分泌到细胞壁外的黏液多糖(SPS)和形成于粘附细菌表面的胶囊多糖(CPS 多糖)[4]。根据其合成部位和合成方式,EPS 可进一步分为:均聚糖和杂合多糖,其中均聚糖是由生物合成过程中的单糖组成,如甘露聚糖、右旋糖、果糖等;而杂合多糖是在细胞膜上生物合成过程产生的一个或多个结构相同的糖单位, 每个糖单位包含两个或多个单糖,并且大部分糖单位都有分支[5-7]。 大多数乳酸菌产生的EPS 以杂合多糖为主。 此外,细菌外多糖(EPSs) 松散地结合在细胞表面或释放到周围环境中,其中一些酶和蛋白质参与了EPS 的生物合成[8]。离子或非离子EPS 是长链、高分子量水溶性天然聚合物,主要由糖单元组成,如葡萄糖、半乳糖、鼠李糖、甘露糖、果糖、阿拉伯糖、和一些糖的衍生物,例如N-乙酰半乳糖胺和N-乙酰葡糖胺。 EPSs 在纺织品、粘合剂、美容学、食品添加剂、废水处理和药理学方面的应用有巨大的潜力。 细菌EPSs 的性质主要取决于菌株、培养基成分和培养条件。 不同的EPSs通常因单糖组成、电荷、单元之间的联系、重复侧链的存在和取代而不同[9]。
1.2 根据化学成分和生物合成机制分类 根据化学成分和生物合成机制,LAB 胞外多糖又被分为两个不同的类别:同多糖(HoPS)和异多糖(HePS)[10]。LAB 的HoPS 是由一种单糖的重复单位组成,如D-葡萄糖或D-果糖,分子量105~106Da。 由葡聚糖酶和果聚糖酶形成的α-葡聚糖和β-果聚糖, 主要是在细胞外由单糖(果糖或葡萄糖)合成。 通过糖基水解酶(GH)的活性,在细胞外合成单糖(果糖或葡萄糖)供体蔗糖分子。 根据糖基类型、连接种类和涉及的碳的位置可将HoPS 分为α-D-葡聚糖[右旋糖(α-1,6)、Mutan (α-1,3)、Ruteran (α-1,4)、alternan(α-1,3、α-1,6)],β-D-葡聚糖,果聚糖[levan(β-2,6、β-2,1)和菊粉(β-1,2、β-2,6)],以及多聚半乳糖,由半乳糖的五聚体重复单元组成。许多不同主干结构、分支程度和连接点变化的HoPS(见图1)都是由几种LABs 菌株产生的[11]。
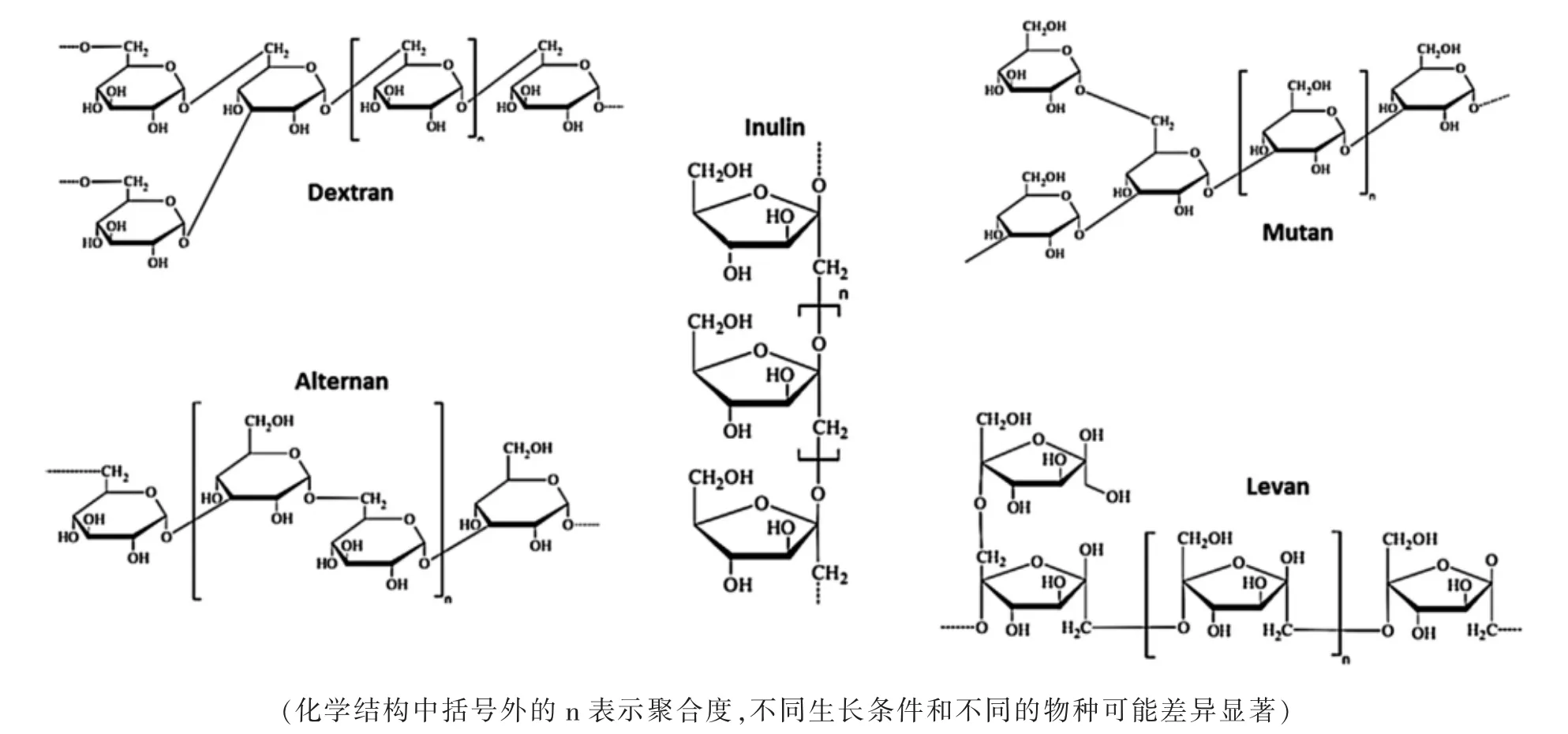
图1 HoPS 的化学结构
1.3 根据来源及结构分类 根据来源可将ESP 分为同源细胞外多糖和异源细胞外多糖。 同源性胞外多糖分为四种类型:α-D-葡聚糖、β-D-葡聚糖、果糖和半乳糖。α-D-葡聚糖的代表包括右旋糖和普鲁兰;β-D-葡聚糖的代表包括可得然胶和硬葡聚糖。这些微生物多糖在糖苷连接、分支类型、聚合物链长度和高层结构方面具有显著差异。 在乳酸菌同源多糖中,右旋糖是比较常见的,右旋糖的主链是由α-D-Glcp(1→6)和α-D-Glcp(1→3),这种特殊的化学结构使右旋糖酐具有独特的物理特性[12],它改善了产品的流变性能,增加了产品的黏度和稳定性,并在食品和医药等许多领域发挥着重要作用。 一般来说, 乳酸菌异源细胞外多糖骨架是由一个重复单元组成的单糖,如D-葡萄糖、D-半乳糖和L-鼠李糖。同源胞外多糖的化学结构,其中34 种具有独特的结构[13]。与同源胞外多糖相比,异源胞外多糖的主链结构由细胞外多糖重复单元的主链及其分支组成,具有多样性。少数异源细胞外多糖的重复单元含有N-乙酰葡糖胺、N-乙酰半乳糖胺和葡萄糖。
2 乳酸菌胞外多糖的生物学功能
2.1 抗菌活性 EPS 的抗菌作用取决于它们的组成和结构。 据报道,分子量、组成和带电基团与该活性特别相关。 高分子量的纯化EPS 对革兰氏阴性菌显示出更强的抗菌作用, 而革兰氏阳性菌则观察到相反的趋势[14]。 此外,EPS 组合物涉及与病原体的潜在相互作用。 BGSJ2-8 产生的EPS 与野生型菌株的组成不同, 表明野生型EPS 对于减少大肠杆菌与Caco-2 细胞的结合至关重要[15]。 有研究发现半乳糖对大肠杆菌的影响更大, 而葡萄糖醛酸对金黄色葡萄球菌的影响更大, 对幽门螺杆菌有更强的作用。EPS 的取代修饰包括磺化、 磷酸化和乙酰化会影响它们的抗微生物活性。 EPS 的硫酸化导致有效的抗菌活性,来自植物乳杆菌ZDY2013 和嗜热链球菌的硫酸化EPS 对各种革兰氏阳性菌表现出更大的抗菌作用[16]。
之前的体外和体内试验证实,LAB 中各种EPS对多种病原微生物有明显的抗菌活性。 其中抗菌作用方式一是间接通过刺激先天和适应性免疫反应,或通过促进其它有益的共生细菌或益生菌生物膜的生长和形成[17-19]。有研究发现肠系膜乳杆菌NTM048产生的右旋糖酐可刺激黏膜IgA 的分泌, 它刺激辅助T 细胞(Th1 和Th2)介导的反应,以及脾细胞中总的和抗原特异性IgA 的产生[20]。 而体内研究证明,来自发酵乳杆菌UCO-979C 的HePS 可通过调节胃先天免疫应答[21-22],增加对幽门螺杆菌感染的抵抗力。
LAB-EPS 的抗菌活性也可以通过体内发挥作用:(1) 有助于LAB 在肠道定植中的益生元效应;(2)保护共生微生物免受宿主中的适应性免疫应答;(3)增强与病原菌的竞争[23]。尽管在实验室中没有更为详细相关机制报道,但在小鼠模型中,有研究发现来自短双歧杆菌UCC2003[24]的HEP 和来自枯草芽孢杆菌HMNig-2[25]的聚合物还可以直接促进抗微生物活性:(1)抑制病原微生物的生长;(2)干扰它们与肠上皮的粘附;(3)通过预防或减少病原菌形成生物膜。 如从植物乳杆菌WLPL04 产生的HePS 对病原菌(包括肠沙门氏菌血清型、鼠伤寒沙门氏菌[26])、铜绿假单胞菌、大肠杆菌O157:H7 和金黄色葡萄球菌生物膜的形成有明显抑制作用[27]。 植物乳杆菌NA-3 产生的EPS 对鼠伤寒沙门氏菌和蜡状芽孢杆菌生物膜的破坏作用较为明显[7]。 它的抗菌作用机制是LAB 的EPS 参与这些病原体表面形成生物膜的信号分子调控, 中断它们的形成, 从而发挥抗菌作用[28]。
近几年,关于EPS 抑制病原微生物的作用有较多报道, 有研究发现从人母乳中分离的产HePS 的鼠李糖乳杆菌, 在体外测定中显示出对致病性大肠杆菌和鼠伤寒沙门氏菌的强抗菌活性[26]。类似地,由L.gasseri[29]和L.kefiranofaciensDN1[30]产生的HEP 已显示出对几种食源性病原体(例如单核细胞增生李斯特氏菌和肠炎沙门氏菌)的体外抗菌活性。 此外,在最近的一项研究中,从L.plajomiPW-7(以前称为Lactobacillus plajomi)中提取的HePS 显示出对幽门螺杆菌、金黄色葡萄球菌和大肠杆菌的抗菌活性[31]。关于EPS 对致病菌的潜在抑制机制,主要是通过破坏膜的完整性和释放可溶性蛋白质来实现[32]。 实际上,通过电子显微镜证实了来自L.plajomiPW-7 的EPS 对一些革兰氏阳性和革兰氏阴性致病菌细胞膜的破坏[31]。Salachna 等[32]提出的另一种机制是EPS 可能促进次生代谢产物在生长培养基中的积累, 对革兰氏阳性和革兰氏阴性病原体产生不利影响[32]。 细菌EPS 与细菌或真核细胞的相互作用结果表明,EPS 的抗菌作用主要是通过阻断外膜的受体或通道而发生[33-34]。 生物膜是附着在表面的细胞外基质,由核酸、蛋白质、多糖和脂质的复合物组成。 包括致病菌在内的许多细菌通过产生生物膜, 对细胞外应激条件具有更强的抵抗力。在几种致病微生物中,环境压力可以触发生物膜的形成, 从而增加粘附力和对宿主反应的保护。因此,生物膜在发病机制中发挥着重要作用[35]。 鼠伤寒沙门氏菌对鸡胃肠道和输卵管的定植主要是由于其粘附和形成生物膜的能力。 在鸡上皮细胞系(Hep-2)中,已经表明某些EPS 有助于生物膜的形成[36]。
越来越多的科学证据支持这样一种观点, 即从实验室提取的各种EPS 可以减少或抑制微生物生物膜,因此,它们在设计新策略以应对细菌生物膜相关感染和食品安全问题方面具有潜在的应用[37]。 研究表明,乳酸杆菌的许多EPS 可以干预生物膜的形成或分散病原体已经形成的生物膜。 嗜酸乳杆菌产生的EPS 已被证明可抑制多种病原体的生物膜形成,包括肠出血性大肠杆菌和肠炎沙门氏菌[38]。先前的研究表明, 植物乳杆菌YW32 和嗜酸乳杆菌A4的EPS 对革兰氏阴性和革兰氏阳性病原体都具有抗生物膜活性[39-40]。 此外,发酵乳杆菌LB-69[41]和加氏乳杆菌FR4 的HePS 分别对蜡状芽孢杆菌RSKK 863 和单核细胞增多乳杆菌表现出最高的生物膜抑制作用。据报道,乳酸菌产生的葡聚糖已被证明对白色念珠菌SC5314 具有抗生物膜活性[42]。从牛肉香肠中分离出的柠檬乳杆菌产生的右旋糖酐能够破坏预先形成的生物膜,并抑制生物膜生成[43]。
有研究发现,EPS 可以通过修饰细菌外壳,从而阻碍细菌附着在表面,或者作为信号分子,调节参与生物膜形成的基因表达[44]。 有研究发现硫酸化EPS对多种革兰氏阳性和阴性病原体的抑制作用比不含硫酸盐的EPS 更强(见图2)。 造成这种情况的一个可能原因是介导生物膜形成的信号中断或水溶性蛋白质的流出途径对细胞膜的损伤[29]。
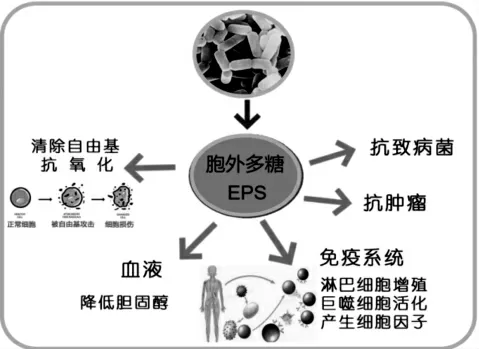
图2 胞外多糖的生物学功能
有研究发现LAB-EPS 有明显的抗真菌活性[24]。产生EPS 的鼠李糖乳杆菌可能通过以下方式参与减少菌丝形成和降低念珠菌粘附:(1)共聚集;(2)免疫调节宿主上皮细胞;(3)竞争结合位点[41]。
LAB-EPS 对宿主病原体的干扰活性可以通过共聚集和降低病原体对肠上皮的吸附性能力来评估。 德氏乳杆菌亚种的菌株和保加利亚乳杆菌产生的EPS 可与大肠杆菌共聚集, 干扰大肠杆菌的活性[44]。 这种作用模式也已通过利用肠细胞系模型得到证实。 研究发现EPS 通过阻碍大肠杆菌、单核细胞增生李斯特氏菌与上皮细胞HT29-MTX 的接触,加强对宿主黏膜保护作用[45]。在另一项研究中,发现副干酪乳杆菌亚种产生的HEP8 参与上皮肠细胞的粘附并降低大肠杆菌与Caco-2 细胞的结合[46]。从人母乳中分离的产生HePS 的植物乳杆菌WLPL04 对大肠杆菌O157:H7 与人肠上皮细胞的粘附具有显著的抑制作用[47]。 纯化的HePS-WLPL04 在竞争、置换和抑制试验中对大肠杆菌O157:H7 与HT-29 细胞的粘附具有相似的抑制作用[33]。有研究发现,约氏乳杆菌FI9785 产生的HePS 和α-葡聚糖可有效抑制家禽中产气荚膜梭菌的定殖和持久性, 并减少小肠中大肠杆菌的定殖[48-49]。 通过疏水性和自聚集,由约氏乳杆菌FI9785 合成的EPS 可竞争性地抑制病原体[50]。
此外,EPS 还可以通过调节免疫系统对肠上皮中病原微生物引起的炎症反应发挥拮抗作用。 猪肠上皮细胞系已被用于通过减弱产肠毒素大肠杆菌诱导的炎症反应来确定产EPS 菌株如德氏乳杆菌TUA4408L 的拮抗作用[51]。
2.2 抗病毒作用 益生菌对人类和动物病毒的抗病毒活性是通过产生抑制性抗病毒化合物、 刺激免疫系统或与病毒直接相互作用等机制介导的[52-53]。根据所提出的机制, 这些作用可以被认为是:(1)局部或直接的,其中EPS 可以通过与病毒颗粒或宿主细胞相互作用阻断病毒吸附来防止病毒感染[54];(2)全身或间接的, 因为这些聚合物可以通过刺激宿主细胞的先天和适应性免疫来间接阻碍病毒[55]。
有研究表明,LAB 产生的EPS 诱导了系统和黏膜抗病毒反应的有益调节, 从而有助于降低病毒感染的严重程度。有研究报道,EPS 通过免疫调节天然和适应性反应以及干扰病毒颗粒的粘附或繁殖来促进抗病毒活性。 另一方面,一些研究表明EPS 可以直接对抗各种病毒性病原体[24],如乳杆菌属的EPS 26a 阻碍了5 型腺病毒(HAdV-5)的繁殖[42],来自植物乳杆菌LRCC5310 的EPS 干扰了轮状病毒在体外对细胞的附着。 此外,用EPS-LRCC5310 对年轻小鼠进行试验, 使肠道和腹泻期间轮状病毒复制减少,从而缩短了小鼠的恢复时间[43]。
体内口服德氏乳杆菌OLL1073R-1 的HePS 发酵的酸奶和纯化的HePS,导致流感病毒滴度显著降低,抗流感病毒抗体(IgA、IgG1)显著增加。 此外,在两组接受治疗的小鼠中,脾细胞的自然杀伤(NK)活性显著增加[56]。 在猪肠上皮细胞(IEC)中,由Toll 样受体3(TLR3)激活触发的先天免疫反应受到来自德氏乳杆菌OLL1073R-1 的HePS 的不同调节。 EPS处理诱导猪IEC,通过用poly(I:C,病毒ds-RNA 的合成类似物)激活的TLR3 提高抗病毒活性,显著增加了IFN-α、IFN-β 以及抗病毒因子黏液瘤病毒抗性A(MxA)和RNase L 基因的表达。 EPS 治疗引起IL-6 和促炎趋化因子表达减少[57]。 在另一项体外研究中, 德氏乳杆菌TUA4408L 及其HePS 能够通过减少病毒复制和调节炎症反应来增强猪IEC 对轮状病毒感染的抵抗力。 研究表明,TUA4408L 菌株及其EPS 通过激活TLR3 差异调节抗病毒先天免疫反应。 德氏乳杆菌TUA4408L 及其HePS 能够刺激干扰素调节因子(IRF-3)和核因子kB(NF-kB)的信号通路,通过增加抗病毒因子干扰素(IFN)-β、MxA 和RNase L 的表达来增强免疫反应[58]。Mizuno 等[59]也发现了类似的结果,证明嗜热链球菌ST538 的EPS 能够调节由猪IEC 中TLR3 的激活触发的先天性抗病毒免疫反应。 此外, 通过与不产生EPS 的突变株进行比较, 证实EPS 在ST538 EPS 株的免疫调节作用。
有研究发现,在鼻内感染流感病毒之前,对具有来自德氏乳杆菌OLL1073R-1 的中性或酸性EPS的小鼠进行口服给药,酸性EPS 而非中性EPS 的治疗延长了小鼠的生存期[56]。 而完整的EPS 分子对于在猪IEC 中获得最高的免疫调节、抗病毒活性是必要的[57]。 另一方面,德氏乳杆菌TUA4408L 菌株的APS-EPS 和NPS-EPS 组分都能够不同程度地激活免疫反应,尽管APS 组分参与了抗病毒免疫的调节[58]。 来自TUA4408L 的APS 和来自OLL1037R-1 的EPS 分别通过不同受体TLR4 和TLR2 的识别发挥作用,对先天抗病毒免疫诱导了几乎相同的作用[58]。
免疫调节活性涉及分子水平的相互作用,EPS与酶和信号的结合过程取决于结构的立体特异性。然而,到目前为止,很少有研究将EPS 的单糖组成、官能团、 连接模式和微观结构等因素与其免疫作用联系起来[59-60]。 未来的体外和体内研究将有必要确定结构因素, 并阐明抗病毒免疫反应的潜在分子机制。深入研究生物活性聚合物的结构数据很重要,因为常用的分离程序可能会使产物与其它细菌成分共同沉淀,如脂蛋白或脂磷壁酸,这可能会刺激免疫反应[9]。此外,有足够的科学证据表明,EPS 聚合物可能是疫苗的候选物;EPS 可以作为抗原载体,也可以作为抗原本身用于抗病毒治疗, 以预防或治疗人类和动物的病毒感染[24]。
3 乳酸菌胞外多糖在畜牧业中的应用前景
在过去几十年中, 我国畜牧业生产为了追求经济效益,使用大量抗生素,导致最近几年环境污染、畜禽产品药物残留及耐药菌株出现等问题越来越严重。为了减少畜牧业生产中抗生素的使用,我国密集出台了减抗、替抗和禁抗的政策,其中在2020 年出台了全面禁止抗生素在饲料中使用,又在2021 年和2022 年出台了畜牧业生产中抗生素减量化使用的条文, 推动了我国畜牧业绿色健康发展。 政策的出台,给畜牧行业带来了阵痛,同时,由于国际形势引起原料价格的动荡和居高不下, 给畜牧业生产带来生产效能低、 病死率增加等诸多问题。 禁抗和减抗的目标就是要找寻替抗物品, 以保证畜牧业健康生产。因此,开发抗生素替代品作为饲料添加剂以保证畜禽健康生长成为当前迫在眉睫的事。
之前的研究证实, 在仔猪日粮中添加乳酸菌EPS 能够明显下调仔猪IL-6、IL-8 及TNF-α 的表达和分泌,显著增加仔猪防御肽的分泌表达[61-62]。 有研究发现EPS 还能增强仔猪肠上皮细胞防御功能并通过调节肠道菌群来增强肠道屏障作用。 而乳酸菌可以通过EPS 与肠上皮细胞的黏附定殖在肠道中,EPS 还可以促进乳酸菌生长,提高其抗逆性及益生潜力,并形成保护层帮助乳酸菌逃避免疫监测,促进肠道内乳酸菌的定殖, 同时还能降低肠道致病菌柠檬酸杆菌的定殖水平[63]。此外,有研究发现仔猪饲喂产EPS 的罗氏乳杆菌发酵的饲粮,可明显降低断乳仔猪回肠、 盲肠和结肠中产肠毒素大肠杆菌的定殖水平,有效缓解因肠道菌群平衡破坏导致的疾病。喂养罗伊氏乳杆菌和用罗伊氏乳杆菌发酵的小麦谷物, 证实胞外多糖对断乳仔猪大肠绒毛高度和隐窝深度增加明显[64]。
此外,有研究将EPS 添加到雏鸡日粮中,发现EPS 能够显著提高肠道内乳酸菌的丰度, 并抑制常见肠道病原体如大肠杆菌、沙门氏菌等的增殖[65]。最近有研究发现家禽饲粮中添加非消化寡糖(NDO)的益生元, 包括市售的低聚果糖 (FOS)、 甘露聚糖(MOS)、半乳糖(GOS)、木低聚糖(XOS)、异寡糖(IMO)、β-葡聚糖和葡聚糖低聚糖(DOS)明显促进肉鸡的生长和增加肠道微生物群多样性[66]。
4 小 结
乳酸菌胞外多糖有许多有益的功能,如抗菌、抗病毒、免疫调节、抗癌、抗氧化和调节肠道的微生态平衡等,尤其是它的抗病毒和抗菌功能,对当前畜牧业健康和绿色生产起到重要作用。它不产生耐药性,无毒副作用,是减抗和替抗措施的最安全选择,在当前畜牧业中有广泛的应用前景。
