沉默信息调节因子1/叉头转录因子1通路上调微小RNA-203对慢性心力衰竭大鼠的干预实验研究
2023-10-13刘天牧
刘天牧,滕 玥
(北部战区总医院急诊医学科,辽宁 沈阳110016)
慢性心力衰竭是较为常见的心血管疾病,因心脏功能或结构受损引起心室充盈、射血能力减弱,造成心功能不全的临床综合征,涉及各种器官,具有复杂性,主要表现为呼吸困难、疲劳、阵发咳嗽、运动耐量减低、体液潴留等,严重威胁了患者的生命安全[1-3]。微小RNA-203(micro RNA-203,miR-203)位于人染色体14q32-33处,与多种心脏相关疾病的发生有关,上调该表达会减轻心肌组织炎症,减少心肌损伤,有利于病情的好转和改善预后[4]。沉默信息调节因子1/叉头转录因子1(Sirt1/Foxo1)通路在慢性心力衰竭的发生、发展中起着重要作用,通过心脏电脉冲的产生、传导来调节心脏功能,还可调节机体的氧化应激、发挥抗炎作用,进而促进病况的改善[5]。基于此,本文将研究基于Sirt1/Foxo1通路上调miR-203对慢性心力衰竭大鼠的干预效果,为慢性心力衰竭的临床诊治提供参考。
1 材料与方法
1.1 实验动物 选取45只SD健康大鼠,由赛业(苏州)生物科技有限公司提供。年龄7~9周龄,饲养温度22~26 ℃,室内湿度35%~55%。定期对其进行紫外线消毒,每天保持12 h光照,喂饮纯净水,可自由活动,饲养时间为一周。本次实验操作均严格参照动物实验伦理要求相关规定进行,且获得我学院伦理委员会批准。
1.2 实验方法
1.2.1 分组与建模:选取45只SD大鼠,随机选中10只作为对照组,其余参照左冠状动脉结扎术建立慢性心力衰竭模型[6],具体步骤如下:分别于腹腔注射10%水合氯醛(20221014-2)麻醉,剪除手术区域体毛,插入气管,连接呼吸机,使用碘酒消毒,于左侧第4肋间作为手术切口,依次分离肌肉、肋间隙,打开胸腔,暴露心脏,找到冠状动脉的左前位置降支,使用带线缝合针结扎(对照组大鼠只做穿线不结扎),建模成功的标准:心电图显示ST段升高,且结扎部位以下心肌为苍白色。共有30只大鼠建模成功,分为模型组10只、下调组10只、上调组10只。术后均连续3 d腹腔注射青霉素(20221102-8)来预防感染。
1.2.2 miR-203转染:对照组和模型组每天给予等量0.9%氯化钠溶液;下调组大鼠使用8 μl miR-203 inhibitor慢病毒注射转染;上调组大鼠携带8 μl miR-203 mimics慢病毒注射转染,观察大鼠的情况变化。
1.3 指标观察
1.3.1 样本采集:于miR-203转染后,采集大鼠的静脉血4 ml,以离心半径5 cm、转速2000 r/min离心处理15 min,分离上层血清,保存于-20 ℃。于干预4周后采用断头法处死大鼠,将心肌组织置于-80 ℃冰箱,待检。
1.3.2 miR-203转染效率鉴定:于miR-203转染后,取大鼠心肌组织,采用RT-PCR法鉴定miR-203的转染效率,提取总RNA,利用逆转录试剂盒将RNA反转录为cDNA,采用Primer 5.0软件设计miR-203、GAPDH引物序列,启动PCR仪,反应体系:上下游引物各0.5 μl、cDNA(20 ng/μl)模板、2×SYBRMi×10 μl,加蒸馏水至20 μl。反应条件:95 ℃ 5 min;95 ℃ 10 s,60 ℃ 30 s,72 ℃ 205 s,共进行40个循环,采用2-ΔΔCt方法计算出miR-203的表达量。miR-203上游引物序列:5’-CCTGATGCTAACCTGATGCA-3’,下游引物序列:5’-CTGTAACTAGCTGAGCTGAC-3’。试剂盒由上海研卉生物科技有限公司提供。
1.3.3 HE染色处理:取出大鼠的心肌组织,将其放入10%的多聚甲醛浸泡和固定12 h,进行常规的石蜡包埋和制作厚度为4~5 μm的石蜡切片,使用苏木精-伊红(Hematoxylin-eosin,HE)染色,借助显微镜仪器来观察大鼠的心肌组织病理变化。
1.3.4 心脏功能指标、血管紧张素Ⅱ(Angiotensin Ⅱ,AngⅡ)、醛固酮(Aldosterone,ALD)、炎性因子、氧化应激指标检测:借助小动物超声心电图机(武汉伟思生物科技有限公司)测定各组大鼠的心脏功能,包括心室射血分数(Ventricular ejection fraction,LVEF)、左心室短轴收缩率(Short-axis contraction rate of the left ventricle,LVFS)、左心室舒张末期内径(Left ventricular end diastolic dimension,LVIDD)、左心室收缩末期内径(Left ventricular end-systolic dimension,LVIDS)水平。
采用ELISA法检测AngⅡ、ALD、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、白细胞介素-6(Interleukin-6,IL-6)、白细胞介素-1β(Interleukin-1 β,IL-1β)、过氧化氢(Hydrogen peroxide,H2O2)、丙二醛(Malondialdehyde,MDA)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-PX)、超氧化物歧化酶(Superoxide dismutase,SOD)水平,先用碳盐酸缓冲液稀释抗体至适合浓度,在反应孔加0.1 ml,保存于冰箱4 ℃过夜,次日弃去,反复洗涤3次,加稀释的样品至反应孔,封存好温育(37 ℃/60 min),孔中加入酶标抗体(37 ℃/30 min),洗涤。加TMB底物溶液0.1 ml,使其显色,15 min后加入终止液0.05 ml,将其置于白色背景,观察并测定各孔吸光值,进而检测出AngⅡ、ALD、TNF-α、IL-6、IL-1β、H2O2、MDA、GSH-PX、SOD水平,仪器购自上海淳麦生物科技有限公司,其检测步骤均由专业人员按照说明书进行。
1.3.5 Sirt1/Foxo1蛋白表达量检测:采用Western blot检测,取0.5 g心肌组织,剪碎后加入600 μl组织裂解液,以12000 r/min离心6 min,提取上层清液,使用BCA法检测蛋白浓度。每个样品提取15 μg蛋白,进行聚丙烯酰胺凝胶电泳处理,转入PVDF膜,常温下密封90 min,加入一抗过夜(保持4 ℃)。第2天取出后进行冲洗,再加入二抗,60 min后洗涤、显色,用成像仪器显影保存图片,使用软件计算灰度值,采用GAPDH作为内参蛋白,从而测定Sirt1/Foxo1蛋白的表达量。

2 结 果
2.1 各组大鼠组织学观察 对照组大鼠的心肌组织完整,细胞结构规则,排列有序;模型组大鼠的心肌组织轮廓不清或破碎,细胞排列紊乱,伴有炎症细胞浸润;下调组大鼠心肌组织破碎严重,细胞杂乱,有大量炎症细胞;上调组大鼠的心肌结构破坏程度明显改善,细胞较为完整,炎症细胞明显减少。见图1。
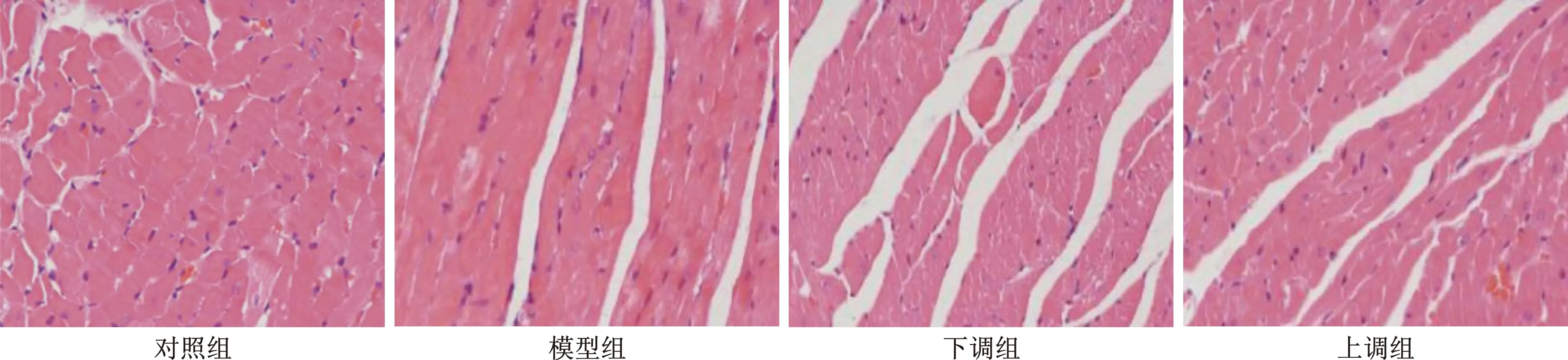
图1 各组大鼠组织学观察(HE染色,×200)
2.2 各组大鼠miR-203转染效率鉴定 与对照组比较,模型组、下调组、上调组miR-203表达量均降低,具有统计学差异(均P<0.05);与模型组比较,下调组miR-203表达量降低,上调miR-203表达量升高,具有统计学差异(均P<0.05);与下调组比较,上调组miR-203表达量升高,具有统计学差异(P<0.05)。见表1。

表1 各组大鼠miR-203转染效率鉴定
2.3 各组大鼠心脏功能指标比较 与对照组比较,经干预2、4周后模型组、下调组、上调组大鼠的LVEF、LVFS水平均降低,LVIDD、LVIDS水平均升高,具有统计学差异(P<0.05);与模型组比较,经干预2、4周后下调组大鼠的LVEF、LVFS水平均降低,LVIDD、LVIDS水平均升高,上调组大鼠的LVEF、LVFS水平均升高,LVIDD、LVIDS水平均降低,具有统计学差异(均P<0.05);与下调组比较,经干预2周、4周后上调组大鼠的LVEF、LVFS水平均升高,LVIDD、LVIDS水平均降低,具有统计学差异(均P<0.05)。见表2。

表2 各组大鼠心脏功能指标比较
2.4 各组大鼠血清AngⅡ、ALD水平比较 与对照组比较,经干预2、4周后模型组、下调组、上调组大鼠的AngⅡ、ALD水平均升高,具有统计学差异(均P<0.05);与模型组比较,经干预2、4周后下调组大鼠的AngⅡ、ALD水平均升高,上调组大鼠的AngⅡ、ALD水平均降低,具有统计学差异(均P<0.05);与下调组比较,经干预2、4周后上调组大鼠的AngⅡ、ALD水平均降低,具有统计学差异(均P<0.05)。见表3。

表3 各组大鼠血清AngⅡ、ALD水平比较(ng/L)
2.5 各组大鼠炎症因子指标比较 与对照组比较,经干预2、4周后模型组、下调组、上调组大鼠的TNF-α、IL-6、IL-1β水平均升高,具有统计学差异(均P<0.05);与模型组比较,经干预2、4周后下调组大鼠的TNF-α、IL-6、IL-1β水平均升高,上调组大鼠的TNF-α、IL-6、IL-1β水平均降低,具有统计学差异(均P<0.05);与下调组比较,经干预2、4周后上调组大鼠的TNF-α、IL-6、IL-1β水平均降低,具有统计学差异(均P<0.05)。见表4。

表4 各组大鼠炎症因子指标比较
2.6 各组大鼠氧化应激指标比较 与对照组比较,经干预2、4周后模型组、下调组、上调组大鼠的H2O2、MDA水平均升高,GSH-PX、SOD水平均降低,具有统计学差异(均P<0.05);与模型组比较,经干预2、4周后下调组大鼠的H2O2、MDA水平均升高,GSH-PX、SOD水平均降低,上调组大鼠的H2O2、MDA水平均降低,GSH-PX、SOD水平均升高,具有统计学差异(均P<0.05);与下调组比较,经干预2、4周后上调组大鼠的H2O2、MDA水平均降低,GSH-PX、SOD水平均升高,具有统计学差异(均P<0.05)。见表5。

表5 各组大鼠氧化应激指标比较
2.7 各组大鼠Sirt1/Foxo1信号通路蛋白相对表达量比较 与对照组比较,模型组、下调组、上调组Sirt1表达量降低,Foxo1表达量均升高,具有统计学差异(均P<0.05);与模型组比较,下调组Sirt1表达量降低,Foxo1表达量均升高,上调组Sirt1表达量升高,Foxo1表达量均降低,具有统计学差异(均P<0.05);与下调组比较,上调组Sirt1表达量升高,Foxo1表达量均降低,具有统计学差异(均P<0.05)。见表6。

表6 各组大鼠Sirt1/Foxo1信号通路蛋白相对表达量比较
3 讨 论
慢性心力衰竭具有较高的发病率和病死率,随着人口老龄化的加剧,发病率呈升高趋势,且多继发与高血压病、冠心病、心肌病等,发病机制较为复杂,且早期症状不明显,病情发展会造成心肌收缩功能障碍、心肌组织结构改变及代谢紊乱,导致死亡的发生,因此需要引起我们的重视,防止病情恶化[7-9]。
慢性心力衰竭的主要生理改变为心脏功能的降低,伴有严重程度不同的炎症反应,LVEF、LVFS、LVIDD、LVIDS是衡量心功能的常用指标,TNF-α、IL-6、IL-1β是重要的炎症因子,参与心肌细胞的坏死和心肌纤维化,影响心肌重构,造成心肌损伤[10-11]。同时该病的发生会激活肾素血管紧张素醛固酮系统,使心输出量下降,加快肾素分泌,致使AngⅡ升高,进而促进ALD的合成与分泌,发生心肌纤维化,加重心室重构[12-13]。本文研究发现,AngⅡ、ALD、TNF-α、IL-6、IL-1β均高表达于慢性心力衰竭模型大鼠,上调miR-203能够降低AngⅡ、ALD、TNF-α、IL-6、IL-1β水平,减轻炎症反应,保护心脏功能。相关学者研究发现,炎症反应在发病过程中发挥着关键作用,主要表现为TNF-α、IL-6、IL-1β的过度释放,引起炎症细胞的聚集、浸润,造成心肌细胞受损,降低心脏功能,此外炎症因子水平越高说明病情越严重[14]。miR-203与心肌损伤有关,上调其表达可促进心肌组织炎症的消散,抑制病情的发展[15]。表明上调miR-203可抑制炎症因子的释放,使得心肌受损减少,改善心脏功能。
研究显示,氧化应激的过度激活与慢性心力衰竭密切相关,是心肌功能发生障碍的重要因素之一[16]。H2O2是活性氧的重要组成部分,MDA水平可体现心肌组织中氧自由基的含量变化,GSH-PX、SOD是机体重要的抗氧化酶,能够有效清除氧自由基[17-18]。本文研究显示,上调miR-203可使H2O2、MDA水平均降低,GSH-PX、SOD水平升高,有效减轻了机体的氧化应激。相关研究学者发现,在正常生理状态下机体的氧化与抗氧化系统保持相对平衡,当发生慢性心力衰竭时,受到刺激会打破平衡,GSH-PX、SOD水平降低,抗氧化能力减弱,H2O2水平升高引起心肌细胞肥大和凋亡,氧化应激的水平可反映病情的严重程度,应激反应越强,抗氧化作用越弱,加重氧化还原状态失衡,造成心肌损伤,使病情进一步恶化[19]。该研究与本文研究较为一致,表明上调miR-203能够改善氧化应激反应,减轻心肌损伤。
Sirt1/Foxo1是调控炎症反应、氧化应激的关键信号通路,在慢性心力衰竭中有重要的调控作用[20]。Sirt1属于一种组蛋白去乙酰化酶,通过参与炎症、氧化应激等过程达到对心血管的保护目的,还可调节Foxo1水平,减轻心肌损伤[21]。本研究发现,在慢性心力衰竭模型大鼠中Sirt1/Foxo1通路处于抑制状态,上调miR-203可使Sirt1升高,Foxo1降低,激活该通路。相关学者发现,Sirt1水平降低会减弱对心肌细胞的保护作用,进而诱发心功能疾病[22]。该研究与本研究结果一致,表明激活Sirt1/Foxo1可改善炎症反应、氧化应激,使病情得到控制。
综上所述,在对慢性心力衰竭大鼠miR-203干预后,有效抑制炎症反应,调节氧化应激,促进心脏功能的恢复,其作用机制可能与Sirt1/Foxo1信号通路被激活有关。
