不同种属来源肝素组成与结构分析方法研究进展
2023-10-13刘晋仙李玮涛柳晓芳王秀萍张中志
刘晋仙,李玮涛,,柳晓芳,王秀萍,张中志
(1.东营市食品药品检验研究院,山东 东营 257091;2.东营天东制药有限公司,山东 东营 257000)
肝素(Heparin)是一种带有高密度负电荷的糖胺聚糖类化合物,产自动物结缔组织型肥大细胞。肝素蛋白聚糖是由一条独特的核心蛋白(丝甘蛋白)和与其共价连接的多条肝素多糖链组成。最终,肝素链在水解作用下断裂形成分子量不同的较小肝素多糖(相对分子质量5 000~25 000)多分散混合物,储存在肥大细胞的胞质分泌颗粒中[1]。临床上主要用于预防和治疗深静脉血栓或肺栓塞(尤其与某些手术有关的栓塞)、防止血液透析等体外循环中血栓形成等。除抗凝活性外,肝素同时具有抗炎、抗病毒、抗肿瘤、抗疟疾等功能。肝素分子结构极其复杂,是由不同分子量的线性多糖糖链组成的多分散性混合物。其活性成分肝素是由α-D-氨基葡萄糖(N-硫酸化,O-硫酸化或N-乙酰化)和O-硫酸化糖醛酸(α-L-艾杜糖醛酸或β-D-葡萄糖醛酸)组成的二糖重复单位以1-4糖苷键连接形成的线性多糖。迄今为止,人们仍未能对肝素的结构进行完全解析,更遑论人工合成。肝素可以从猪、牛、羊等动物的小肠黏膜和牛肺等组织中提取,但是不同来源的肝素化学结构和生物活性存在明显的差异[2],其不良反应程度也不同。例如,相较于猪源肝素,牛源肝素引起血小板减少不良反应(heparin induced thrombocytopenia,HIT)的概率升高了1倍[3]。20世纪90年代源自欧洲的由朊病毒引起的牛海绵状脑病(疯牛病)以及同样由朊病毒引起的羊痒病加剧了世界各国及其药品监管机构对牛、羊来源肝素的担忧。目前,在肝素产品的主要市场,如欧、美、中等,其药典明确要求肝素及低分子肝素仅限来源自猪肠黏膜,不得混有其他来源肝素。中国是世界上第一大肝素供应国,占比超过50%。近年,特别是新冠肺炎疫情发生以来,由于肝素类产品作为抗凝药物在新冠肺炎重症患者的对症治疗中起到了一定作用,进一步使肝素价格飙升,甚至于肝素产业在一定程度上具有了资源类产业属性。猪源粗品肝素的短缺和价格飙升造成了市场上粗品肝素良莠不齐,对于不同种属来源的有效区分已经成为目前肝素产品质量控制的重要考量。因此,有必要对鉴别不同种属来源肝素检测方法的研究进展进行梳理,以便于保障广大人民群众的用药安全。
1 肝素种属来源的鉴别方法
目前,鉴别肝素不同种属来源的方法主要分为两类:一类是基于残留核酸(DNA)、残留蛋白的生化检测方法,另一类是基于肝素结构的理化检测方法。其中,生化检测方法易受实验环境、熟练程度、异物污染等影响。如肝素的提取、纯化过程中使用的强碱、高温等条件会导致DNA严重破坏,另外一些不良厂家会有意去除牛羊肝素中的DNA,同时肝素对聚合酶链式反应(PCR)有较强的抑制作用[4],导致PCR易出现假阴性,使针对核酸的PCR法失去效用;蛋白质释放后很容易失活,特别是肝素的提取、纯化过程中使用的强碱、高温等条件更易导致蛋白质的破坏和变性,因此基于物种特异性蛋白的检测方法也有很大的局限性。
近年来,基于肝素特征化学结构的检测方法日益增多[5],相关检测方法从肝素结构本身入手,不易受到干扰,重现性、稳定性都得到了保证。此类检测方法的一个问题是使用的仪器一般较为昂贵,但随着国内科学研究仪器的日益完备,这一问题也逐步得到了解决。
肝素糖链是由艾杜糖醛酸/葡萄糖醛酸与葡萄糖胺组成的二糖重复单位以1-4糖苷键连接形成的线性多糖。其中,糖醛酸C2位可发生硫酸化;葡萄糖胺的氨基位置可被乙酰化或硫酸化,C3和C6位可发生硫酸化。不同的硫酸化程度、不同的取代基位置形成了肝素复杂的不均一结构[6](见图1)。对肝素进行结构解析主要有两种策略(见图2):自上而下(Top-down)、自下而上(Bottom-up)。Top-down方法中,肝素糖链不经过进一步降解,而直接进行检测分析,如核磁(NMR)、红外(IR)、分子排阻色谱法(SEC)、液质联用法(LC-MS)等方法,从而获得肝素中原始寡糖、单糖、特征结构等信息。Bottom-up方法中,肝素糖链首先经肝素酶(Ⅰ and/or Ⅱ and/or Ⅲ)或亚硝酸降解,然后经强阴离子交换高效液相色谱法(SAX-HPLC)、反相离子对液相色谱法(RPIP)、毛细管电泳法(CE)、聚丙烯酰胺凝胶电泳(PAGE)、液质联用法(LC-MS)等,对降解后的二糖、寡糖进行结构和含量分析,从而投射出肝素糖链的宏观结构信息。
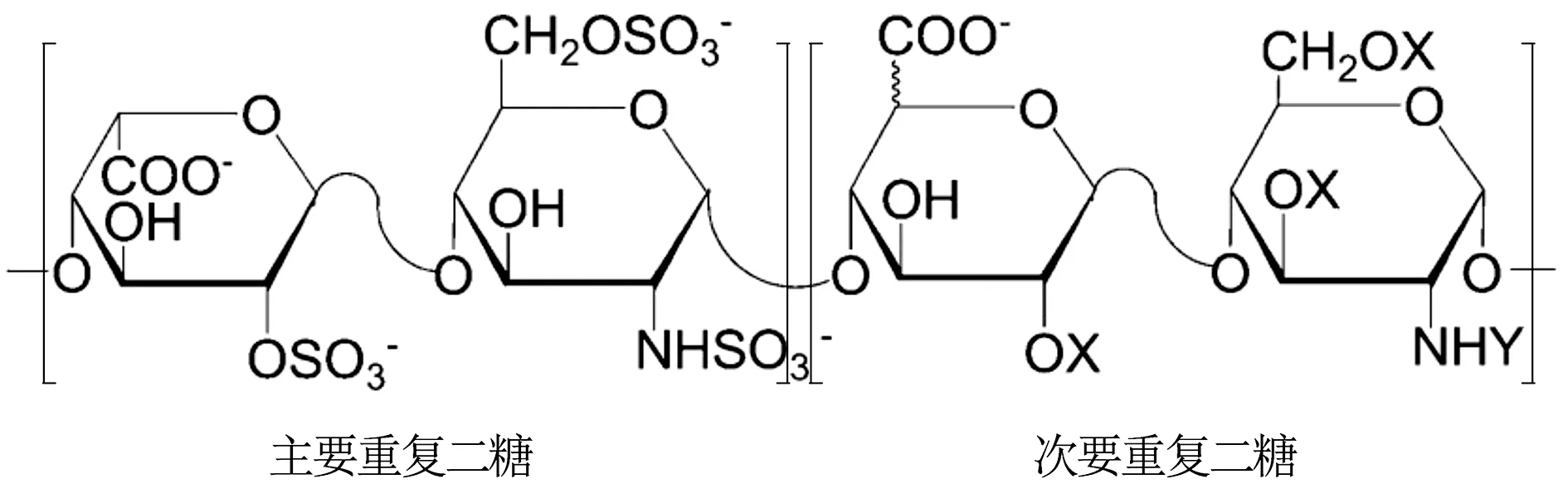
X=sulfo 或H,Y=sulfo,Ac或H

图2 自上而下、自下而上分析策略
2 Top-down方法
Top-down分析方法以完整肝素糖链为直接分析对象,因此保留了糖链完整的信息,例如糖醛酸C5位差向异构信息。与Bottom-up方法相比,此种分析方法可以提供的肝素钠糖链结构信息更为完整、丰富、精准。
Liu等[7]的工作报道了采用亲水相互作用色谱-质谱法(HILIC-MS),在线分析对比依诺肝素钠原研及仿制药的全糖链结构信息。HILIC-MS方法可对糖链的N-乙酰化程度、还原端结构、非还原端结构等进行深度解析。Chen等[8]的工作中,使用类似的方法,在线分析对比依诺肝素钠原研与羊来源肝素钠制备的依诺肝素钠之差异,发现羊来源肝素制备的依诺肝素钠含有227种寡糖,而在原研Lovenox中鉴定出225种寡糖,两者存在130种相同的寡糖,种类上有明显差异。且这130种寡糖的具体含量也有明显差异,如羊来源肝素制备的依诺肝素钠,其硫酸化程度较高的寡糖[1,2,3,0,8],[1,4,5,0,12],[1,5,6,0,16],[1,5,6,0,17]和[1,6,7,0,17]含量较原研Lovenox多;其硫酸化程度较低的N-乙酰化寡糖[1,4,5,1,10],[1,4,5,1,11]和[1,4,5,1,12]含量较原研Lovenox多(寡糖组成信息通常采用[ΔHexA、HexA、GlcN、Ac、SO3]方式描述,其中ΔHexA代表寡糖链中不饱和糖醛酸、HexA代表糖醛酸、GlcN代表葡萄糖胺、Ac代表乙酰基、SO3代表磺酸基,数字代表各种结构的数量)。HILIC-MS方法以其良好的质谱兼容性,可对肝素类产品中含量极低的寡糖进行、发现和解析,近年来成为寡糖序列分析的重要手段。
Liang等[9]的工作中,介绍了一种对首先对糖链结构中醇羟基、胺基进行保护,然后使用LC-MS/MS方法,分析肝素/硫酸乙酰肝素中寡糖结构的方法。糖链羟基、胺基上硫酸取代基团在电离过程中易发生破坏,导致结构损失,限制了质谱方法在寡糖结构解析中的使用。该工作中,用氘代乙酸酐/丙酸酐取代糖链上不稳定的硫酸基团,得到的衍生化寡糖经C18色谱柱分离,联用MS分析,可分析至十二糖,为鉴别不同来源肝素提供了一种可能的方法。
Guerrini等[10]的工作报道了通过结合1H和13C核磁共振谱图,表征肝素生产、组成、硫酸基取代等信息,猪来源肝素与牛肺肝素在葡萄糖胺6位硫酸化取代程度(猪:81%~84%,牛59.3%~61.4%)、葡萄糖胺3位硫酸化取代程度(猪:5.1%~7.2%,牛1.4%~2.4%)、N-硫酸化(猪:78.2%,牛:89.6%)和N-乙酰化(猪:15.9%,牛8.7%)组分含量等方面有明显差异。
Ange等[11]的工作报道了使用1H、13C、HSQC核磁共振谱图,对来源自猪肠黏膜、牛肠黏膜、牛肺的肝素进行了对比,结果表明与猪肠黏膜肝素相比,牛肠黏膜肝素核磁氢谱中GlcNS的H1峰(5.23 ppm)明显偏高,IdoA的H1峰(4.94 ppm)明显偏低,GlcNY的H6峰(3.78 ppm)明显偏高。牛肺肝素核磁氢谱中GlcNAc的甲基氢信号峰(1.95 ppm)明显较低。
Mauri等[12]的工作中对于核磁氢谱的分析部分报道了类似于Ange工作的结论。该研究同时表明猪肠黏膜肝素与羊肠黏膜肝素核磁氢谱更为相似,两者之间一个较为明显的区别是羊肠黏膜肝素的GlcNAc的甲基氢信号峰低于猪肠黏膜肝素。该研究还根据核磁氢谱中GlcNY的H6峰(3.87 ppm)、GlcNS6X的H2峰(3.28 ppm)、GlcNAc的甲基氢信号峰(2.05 ppm)相互之间的比值关系给出了一种判断肝素种属来源的方法。Lucio Mauri的工作中对于HSQC谱图的分析部分表明,来源自牛肠黏膜、猪肠黏膜、羊肠黏膜、牛肺的肝素在单糖组成上有较为明显的差异,例如GlcNy6S(牛肠黏膜<其他来源),GlcA(猪肠黏膜>羊肠黏膜>牛肺),IdoA(猪肠黏膜>羊肠黏膜>牛肺)。
Monakhova等[13]的一项工作中通过核磁共振扩散排序谱(DOSY)可对粗品肝素中不同来源的不同分子量糖胺聚糖进行分析。
Monakhova等[14]的另一项工作中通过化学计量学方法对不同来源肝素核磁氢谱数据进行统计分析,进而鉴别其来源。应用主成分分析法(PCA),因子判别分析法(FDA)等可鉴别猪肠黏膜肝素中2%含量的羊肠黏膜肝素掺杂。该方法同样适用于鉴别不同来源肝素制备的依诺肝素钠。
Ouyang等[15]的工作中使用主成分分析法(PCA)对猪肠黏膜、牛肠黏膜、羊肠黏膜的核磁氢谱数据进行了统计分析,该方法可鉴别猪肠黏膜肝素中10%含量的牛肠黏膜或羊肠黏膜肝素。
3 Bottom-up方法
Bottom-up分析方法是首先将完整的肝素糖链降解为二糖、短链寡糖,以降解后二糖、短链寡糖的组分含量和结构为直接研究对象,得到二糖、短链寡糖的指纹图谱,最后通过对降解后组分的鉴别分析、拼接,实现对糖链完整结构信息的分析、推测。
Watt等[16]的工作中对不同来源肝素降解后二糖含量百分比进行了分析。使用强阴离子交换树脂柱对降解后样品进行了分离、分析,结果表明,不同来源肝素具有不同的二糖组成。例如牛肝素△IIIS含量明显高于羊肝素和猪肝素(见表1),与Top-down方法,核磁氢谱分析中GlcNY的H6峰(3.78 ppm)明显偏高结果相对应。

表1 猪、羊、牛肝素二糖组成(%)
Ouyang等[15]的工作中对猪、牛、羊肝素及不同程度掺杂牛、羊肝素的猪肝素样品,经肝素酶Ⅰ、Ⅱ和Ⅲ完全酶解后,通过反相离子对液相色谱法联用质谱(RPIP LC-MS)检测二糖;经肝素酶Ⅱ酶解后,通过RPIP LC-MS检测不被肝素酶Ⅱ降解的四糖。RPIP使用挥发性的流动相,因而与MS有较好的兼容性,可以对经色谱法分离的二糖、寡糖组分进行更加灵敏的检测和鉴别。应用主成分分析法(PCA)对检测数据进行统计分析,结果表明该方法可有效区分不同来源肝素,用于猪肝素中牛、羊肝素掺杂的检测。例如以不被肝素酶Ⅱ降解的四糖为对象分析,可鉴别猪肝素中10%含量的牛或羊肝素。
马志华等[17]的工作中采用SAX-HPLC法对经肝素酶Ⅰ、Ⅱ和Ⅲ完全酶解后的猪、牛、羊粗品肝素的二糖组成进行了定量分析,并对掺杂有5%~25%牛或羊粗品肝素的猪来源粗品肝素进行了二糖定量分析。研究结果表明该方法可检测出猪源粗品肝素中5%羊源粗品肝素掺杂,而对牛源粗品肝素掺杂不能很好地鉴别。
迟连利等[18-20]的工作中公开了一类通过分析待测样品经肝素酶Ⅰ、Ⅱ和Ⅲ完全酶解后二糖、三糖组分,进而分析待测样品中是否掺杂有反刍类动物肝素的方法。通过分析肝素待测样品中全硫酸化三糖和△IA的比值,与猪源肝素标准品相应的数据对比,可以分析待测肝素样品中是否掺杂有反刍类动物肝素;通过分析依诺肝素钠待测样品中单硫酸化三糖和还原端△IVS的比值,与猪源依诺肝素钠标准品相应的数据对比,可以分析待测依诺肝素钠样品中是否掺杂有羊源依诺肝素钠。该方法可以鉴别出猪肝素中10%羊肝素掺杂比例和5%牛肝素掺杂比例。
李玮涛等[21]的工作中公开了一种通过分析待测样品经肝素酶Ⅰ、Ⅱ和Ⅲ完全酶解后二糖组分,进而分析待测样品中羊肝素掺杂比例的方法。通过分析肝素待测样品中△IS和△IIIA的比值,可回归计算出待测样品中羊肝素掺杂比例。该方法可以鉴别出猪肝素中5%羊肝素掺杂比例。
Chen等[22]的工作中,经肝素酶Ⅰ、Ⅱ和Ⅲ完全酶解后的肝素样品,使用二维液相与质谱联用方法,先经强阴离子交换柱分离再经分子排阻色谱柱脱盐,脱盐后的组分可通过MS进行定性分析。通过此种方法,可以分离、定性酶解后样品中存在的二糖、肝素酶耐受四糖、链接区等结构,并进行定量分析。EP肝素钠标准品的IIS结构较ChP、USP高;对于链接区结构的含量各标准品又各有差异(ChP>USP>EP)。Zhu等[23]的工作中,肝素经肝素酶Ⅰ、Ⅱ和Ⅲ完全酶解后,经SAX-HPLC、SEC-MS方法,同样大大提高了对肝素钠糖链更为细致的分离和结构鉴定,例如对还原末端进行了较为充分的结构解析。这种组合策略结合了SAX方法的可靠性、分辨率和质谱的灵敏度、定性分析能力,为研究肝素质量和结构提供了强有力的工具,有望在区分肝素不同种属来源和辨别猪肝素掺杂方面,发挥重要作用。
4 结语
肝素是临床上广泛应用的一种抗凝药物,受限于猪肠黏膜来源肝素供应的紧张,市场上一直存在不法商家以其它来源肝素掺杂入猪肠黏膜肝素的行为,此举一会损害正常合法的市场经济运行规律,劣币驱逐良币;二会损害我国肝素产品、肝素生产厂家在国际上的信誉度[24];三最为严重的是掺杂肝素无充分的临床应用经验,若临床上医生按照猪肠黏膜来源肝素的使用方案使用的却是掺杂肝素,可能引发严重的临床事故,严重影响人民群众的生命安全。本文简要总结了近年来不同种属来源肝素组成与结构分析方法的研究进展,期望能为肝素市场的规范性和保护人民群众的健康做出点滴贡献。
