beta@壳聚糖保鲜涂层的制备及其对太谷梨枣品质的影响
2023-10-12王诗瑶辛镇忠
王诗瑶,辛镇忠,王 连,王 愈
(山西农业大学 食品科学与工程学院,山西 晋中030800)
太谷梨枣为鼠李科枣属,其果实似梨形,为枣中的名贵鲜食品种;但因梨枣全红时为雨季,常导致其开裂、腐烂、发霉。为减少太古梨枣裂果、坏果,提升品质和商品性,故在其半红期采摘,并进行贮藏保鲜。目前,鲜枣的贮藏技术还不够完善,导致大部分鲜枣无法进行长途运输和销售,严重影响其产业可持续发展。常见的鲜枣贮藏方式有低温保鲜法[1]、气调保鲜法[2]、涂膜保鲜法[3]、减压保鲜法[4]和辐照保鲜法[5]。
壳聚糖(chitosan)是一种具有独特分子结构的天然多糖类生物大分子,其具有安全无毒、生物可降解性、成膜性好、生物相容性好、抑菌等优点,广泛应用于可食膜、生物可降解用膜和果蔬涂膜保鲜等方面[6-7]。Zhang等[8]通过用壳聚糖结合纳他霉素对采后甜樱桃进行涂膜保鲜,发现该处理能够保持果实品质、抑制真菌、降低甜樱桃腐烂率。Sun等[9]研究发现,ε-聚赖氨酸与壳寡糖组合能够诱导采后番茄中水杨酸、苯丙氨酸和茉莉酸水平增加,提高氨裂解酶、过氧化物酶和超氧化物歧化酶活性,降低过氧化氢酶活性和脱落酸、赤霉素水平,从而延长采后番茄货架期,但是在广谱机械强度应用上仍略显不足。因此对壳聚糖这种韧性材料进行改性显得尤为重要。
分子筛是一种人工合成的具有筛选分子作用的水合硅铝酸盐或天然分子筛,它在结构上有许多孔径均匀的孔道和排列整齐的孔穴,不同孔径的分子筛把不同大小和形状的分子分开。beta分子筛被广泛应用于烷基化、加氢裂解等工业过程[10];因其具有高比表面积,分子动力学直径大于乙烯,同时具有很强的吸附水、氧气、二氧化碳等分子的能力[11],用于水果保鲜可以起到良好的气调作用。Mukhopadhyay等[12]将分子筛与壳聚糖偶联,发现分子筛的加入增强了膜的亲水性和膜的通量,随着分子筛用量的增加,膜通量增加,这是由于膜的孔隙率和亲水性得到改善。Taaca等[13]发现,将分子筛与壳聚糖偶联,可以显著提高膜的水热稳定性。因此,将分子筛-壳聚糖偶联物用于水果保鲜,具有可观前景。
目前关于鲜枣膜贮藏保鲜的研究较多,但尚未见到分子筛-壳聚糖偶联物对山西地方特色鲜食梨枣采后生理与贮藏品质的影响报道。本研究将自制纳米壳聚糖与自制beta分子筛偶联,获得一种具有气调作用的类核壳结构新型复合保鲜膜剂,探究其对太谷梨枣的保鲜效果。
1 材料与方法
1.1 材料与试剂
太谷梨枣:于2021年9月25日采摘于山西省晋中市太谷区小白乡万亩枣园,选取大小均匀、成熟度为40%~60%的半红期梨枣,低温运送到冷库缓冲间,温度为(5±1)℃,湿度78%±1%,放置1 d消除田间热;然后挑选有果柄、无伤口的梨枣置于温度(0±1)℃,湿度78%±1%的冷库中备用。
氢氧化钠(分析纯)、四乙基氢氧化铵(分析纯)、偏铝酸钠(分析纯)、壳聚糖(分析纯)、气相二氧化硅(分析纯)、三聚磷酸钠(分析纯)购自上海麦克林生化有限公司;酚酞(分析纯)、甲醇(分析纯)、冰乙酸(分析纯)、亚硝酸钠(分析纯)购自天津市北辰区方正试剂厂;2,6-二氯酚靛酚(分析纯)购自上海蓝季科技发展有限公司;抗坏血酸(分析纯)购自天津市恒兴化学试剂制造有限公司;草酸(分析纯)购自天津市大茂化学试剂厂;芦丁标准品(分析纯)购自上海如吉生物科技发展有限公司;硝酸铝(分析纯)购自天津市华东试剂厂。
1.2 仪器与设备
DF-101S型集热式恒温加热磁力搅拌器,杭州瑞佳精密科学仪器有限公司;100 mL高压反应釜,上海常泽化工科技有限公司;SX-2.5-10型箱式电阻炉一体机,北京市永光明医疗仪器有限公司;DHG-9070A型电热鼓风干燥机,上海一恒科学仪器有限公司;D/max-2500型X射线粉末衍射仪,日本理学公司;SU-1500型扫描电子显微镜,日本日丽公司;JEM-1011型透射电子显微镜,日本电子株式会社公司;XY-L150型电生功能灭菌水生成器,宝鸡新宇光机电有限责任公司;PR224ZH/E型电子天平,奥豪斯仪器(常州)有限公司;DDS-307A型电导率仪,上海仪电科学仪器股份有限公司;KQ3200DB型数控超声波清洗器,昆山市超声仪器有限公司;RE2000A型旋转蒸发器,上海亚荣生化仪器厂;P4型紫外可见分光光度计,上海美谱达仪器有限公司;傅里叶变换红外光谱仪,美国尼高力公司。
1.3 原料处理
1.3.1 beta分子筛的制备
量取3.70 mL去离子水和4.60 mL四乙基氢氧化铵逐步加入聚四氟乙烯内衬中,搅拌均匀后加入0.75 mL 4 mol·L-1的NaOH溶液,加入0.25 g偏铝酸钠后25 ℃搅拌30 min;最后加入1.50 g气相二氧化硅,于25 ℃搅拌60 min,得到白色硅铝凝胶。将凝胶置于100 mL高压反应釜中拧紧,于电热鼓风干燥箱(140 ℃)晶化3 d,取出,依次经过冷却、离心、干燥,得到分子筛原粉。将分子筛原粉放入箱式电阻炉一体机,设置程序:0~300 ℃,120 min;300 ℃,120 min;300~550 ℃,120 min;500 ℃,300 min,进行焙烧,得到beta分子筛。
1.3.2 改性纳米壳聚糖的制备
称取3.29 g去乙酰壳聚糖加入到250 mL体积分数2%的冰乙酸溶液中,在适宜转速下搅拌30 min。同一时间称取6.2 g三聚磷酸钠(SSTP),加入250 mL去离子水配置成溶液,搅拌速度200 r·min-1,搅拌时间30 min。适宜转速下,将三聚磷酸钠溶液逐滴加入去乙酰壳聚糖溶液中,室温搅拌24 h。静置混合溶液,待其分离后抛弃上层清液,余下的白色黏稠沉淀在3 000 r·min-1条件下离心3 min。倒去离心管上清液,取下层白色沉淀用去离子水反复洗涤,抽滤7次后置于真空干燥箱中干燥,得到纳米改性壳聚糖。
1.3.3 保鲜膜剂的制备
取1 g上述自制分子筛溶解于100 mL体积分数为2%的冰乙酸中,分别称取1、1.25、1.5、1.75 g改性纳米壳聚糖缓慢加入上述的混制液中,盖好烧杯以防溶液蒸发,磁力搅拌器搅拌24 h,调节pH到中性。取50个聚乙烯(PE)保鲜袋,用5 mm打孔器在每个保鲜袋相同位置上打9个孔,用于果实呼吸。
将挑选好的梨枣随机分成50份,每份500 g。再将50份梨枣平均分成5组,每组10份。将分好组的梨枣分别放入以上4种溶液和蒸馏水中浸泡涂膜2 min,然后20 ℃室温干燥,装入提前打孔的PE保鲜袋中,置于温度(0±1) ℃,相对湿度(78±1)%的冷库中。贮藏期间每10 d每个处理各取1份测定理化指标,取果肉中段平行测定3次。
1.4 品质指标测定
1.4.1 果实硬度
使用TMS-Pro型质构仪测定[14],每个样品重复测定3次。探头:2 mm圆柱形;力量感应元量程:100 N;探头回升到样品表面上的高度:5 mm;挤压距离:7 mm;检测速度:60 mm·min-1;起始力:0.4 N;2次压缩测试之间的停隔时间为3 s。
1.4.2 细胞膜通透性
每组取3个果实,在中线附近去皮。用5 mm打孔器取果肉组织,用小刀平均切4份,每份大约2 mm厚,置于20 mL蒸馏水中;用数控超声波清洗器超声1 h,冷却至室温后用电导率仪测定电导率γ1,煮沸15 min后冷却至室温,再测1次电导值γ0。以煮沸前后电导率的比值γe表示细胞膜通透性[15],每次每组果肉中段平行测定3次。
(1)
1.4.3 可溶性固形物含量
使用手持测糖仪测定,每组取3个果实,取每组果肉中段平行测定3次[16]。
1.4.4 失重率
失重率采用称重法[17]测定。将原先称好的500 g果实经过一段时间的贮藏保鲜后,称其质量,并重复测定3次。
(2)
式(2)中:rm为果实失重率;m1为果实贮藏前的质量;m2为果实贮藏后的质量。
1.4.5 呼吸速率
采用静置法测定。称取500 g果实,置于密封带盖保鲜盒中,静置2 h后利用气体分析仪测定保鲜盒中的CO2体积分数,测定结束利用排水法测定果实体积。计算公式为:
(3)
式(3)中:rr表示呼吸速率,单位mg·(kg·h)-1;C为CO2体积分数,单位%;V1为密封盒体积,单位L;V2为样品体积,单位L;t为测定时间,单位h;m为样品鲜重,单位kg。
1.5 数据处理
采用IBM SPSS Statistics 23软件对数据进行单因素方差分析,采用Duncan’s多重比较法进行差异显著性检验(P<0.05)。黄酮标准曲线采用Excel软件作图,数据采用Origin 2019软件作图。
2 结果与分析
2.1 beta分子筛的晶体结构和形貌
图1-A是在扫描角度2θ为5°~40°、角度间隔8°条件下得到的beta分子筛的X射线衍射图谱(XRD)。在典型的beta结构2θ=7.8°和2θ=22.4°处出现了2个最显著的衍射峰值,而且无任何杂晶峰出现,说明合成的beta分子筛为纯相结构。由图1-B可以看出:波数573 cm-1处为硅氧的T-O弯曲振动峰;2 854 cm-1和2 928 cm-1处是C—H的伸缩振动峰;3 440 cm-1和1 632 cm-1处的红外峰归结于分子筛表面—OH和—COOH的弯曲振动;在1 090 cm-1和1 229 cm-1处有较强的吸收峰,这是beta骨架中O-Si-O的非对称伸缩振动峰[18]。从图1-C可以观察到beta分子筛的形状呈现不规则的椭球形,是由细小纳米晶粒组合成的团聚体,多数beta分子筛的粒径在500 nm左右。粗糙的表面形貌有利于进一步扩大比表面积,便于实现气调保鲜作用。从图1-D中可以观察到整个晶体中包含有大量的微孔孔道,这些孔道高度连通并且连续延伸到了孔道表面。
对beta分子筛进行N2吸附-脱附测试,图2为beta分子筛的N2吸附脱附曲线和与之对应的微孔孔径分布曲线、全孔孔径分布曲线。其中,采用NLDFT方法计算累积孔容和孔径分布(PSD),而微孔孔径分布则是从吸附曲线中由HK模型计算所得到。由N2吸附-脱附曲线得知,在相对压力为0
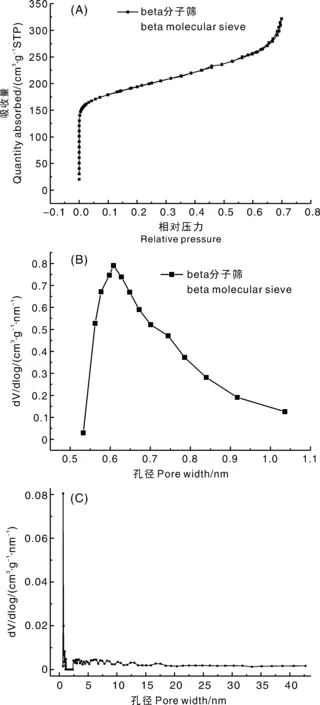
图2 Beta分子筛的N2吸附脱附曲线(A)、相对应的微孔分布曲线(B)和全孔孔径分布曲线(C)Fig.2 N2 adsorption and desorption curve (A), corresponding micropore size distribution curve (B) and corresponding full-pore distribution curve (C) of beta molecular sieve
2.2 复合膜剂的表征
如图3-A所示,去乙酰壳聚糖的XRD图谱在21°处出现一个特征峰,这可能与壳聚糖的半结晶结构有关,聚合物分子之间存在强烈的分子间氢键。本研究的纳米壳聚糖XRD图谱在2θ=26°附近出现一个宽峰,这是壳聚糖纳米颗粒中被称为“肌腱”水合多形体的多态结构的特征衍射峰[20]。
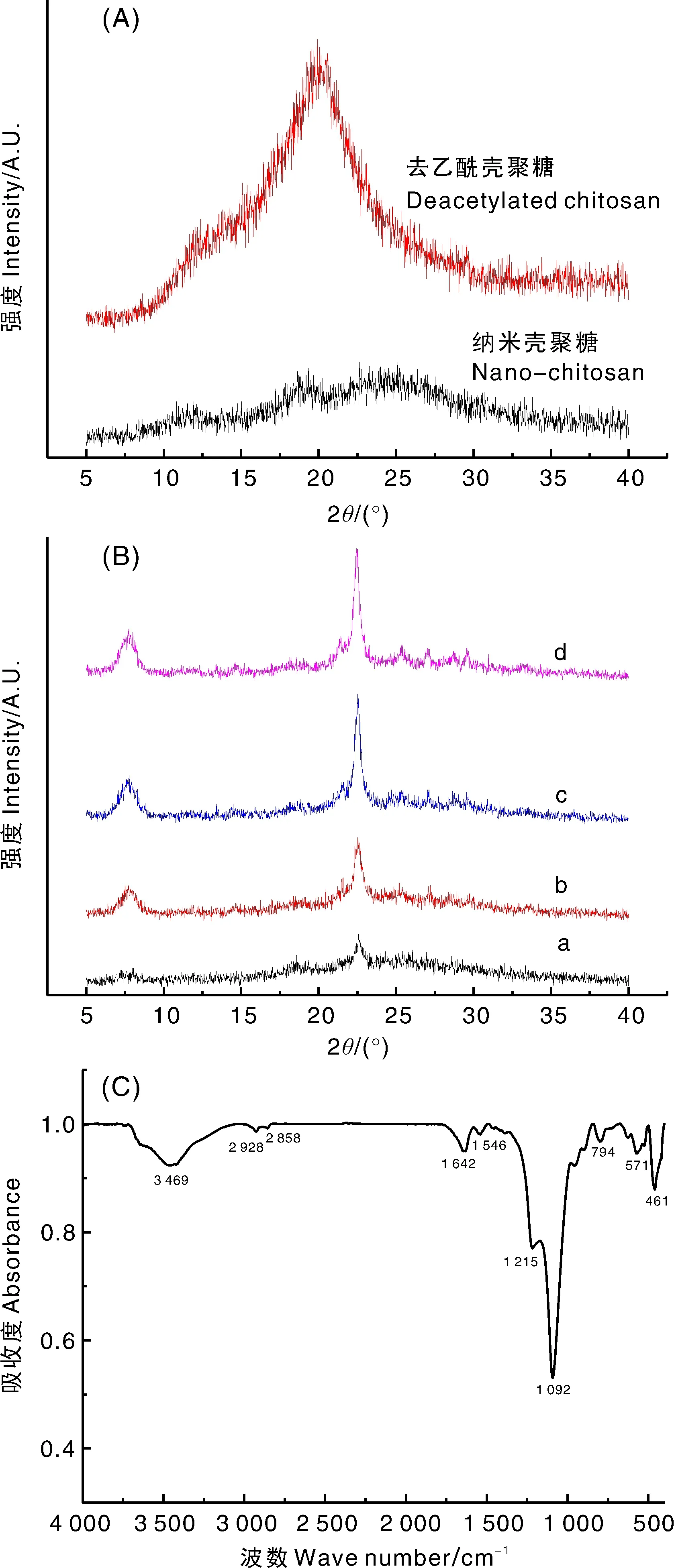
A,去乙酰壳聚糖和纳米壳聚糖的X射线粉末衍射图;B,beta分子筛和纳米壳聚糖不同比例复配所得复合保鲜剂的X射线粉末衍射图,a、b、c、d的质量比分别为1∶1、1∶1.25、1∶1.5、1∶1.75;C,复合膜剂的红外光谱图。A, XRD diagram of acetyl chitosan and nano-chitosan; B, XRD pattern of composite preservative prepared by mixing different mass ratios of beta zeolite and nano-chitosan, mass ratios of a, b, c, d are 1∶1, 1∶1.25, 1∶1.5, 1∶1.75, respectively; C, Infrared spectrum of the composite film agent.图3 壳聚糖和复合保鲜剂的结构Fig.3 Structure of chitosan and compound preservative
如图3-B中a、b、c、d曲线所示,在不同比例样品的XRD衍射图谱中,广角XRD均有明显的BEA结构特征衍射峰(2θ=7.76°,2θ=22.6°),其中所有曲线都含有纳米壳聚糖和beta分子筛的特征衍射峰,但所有曲线相较于beta分子筛焙烧前的XRD图峰值均有所降低,表明复配以后的beta分子筛被包裹在壳聚糖网状结构中,出现了衍射峰掩蔽的现象。其中,b曲线峰值降低幅度适中,表明此比例的分子筛被纳米壳聚糖包裹效果最好;而且b曲线的杂峰相对其他曲线较少,表明此比例复配得到的样品具有良好的晶相结构。因此,壳聚糖与分子筛质量比为1∶1.5进行复配得到的复合膜剂晶体结构最好,无杂晶相。
为进一步观测复合膜剂的结构组成,对分子筛和壳聚糖1∶1.5配比所得的样品进行红外光谱分析,摄谱范围为4 000~400 cm-1,结果如图3-C所示。571、625、794、1 092 cm-1处均为beta分子筛的特征骨架振动峰,3 469 cm-1处为硅酸盐Si—OH中—OH的伸缩振动带;在3 435 cm-1附近有一条强而宽的吸收峰,为壳聚糖中(N—H)、(O—H)和-NH2的振动峰;在2 928~2 865 cm-1的拉伸振动是由于壳聚糖内NHCOCH中存在甲基、CH3OH中存在亚甲基、吡喃糖环中存在甲烯基(—CH)引起的;在1 640 cm-1处为酰胺I(N-H)吸收峰。这一系列壳聚糖特征峰值的出现表明壳聚糖包裹于beta分子筛中。
2.3 保鲜性能测试
2.3.1 复合涂膜对果实硬度和失重率的影响
硬度反映出果实的质构特性,与细胞壁成分和细胞壁降解酶活性有关。果实采后硬度一般有2种变化,即果实硬化和软化[21],常见的为果实软化,其主要原因是细胞壁结构和成分的变化。如图4-A所示,每个处理组中梨枣的硬度都随着贮藏时间的延长而下降,从整体上看,beta分子筛与壳聚糖复配后处理的梨枣硬度比阴、阳对照组有显著(P<0.05)提高,beta分子筛与壳聚糖的质量比为1∶1.5时效果最好;尤其是在第40~50天时,beta分子筛与壳聚糖的质量比为1∶1.5处理的梨枣硬度为8.07 N,而beta分子筛与壳聚糖质量比为1∶1、1∶1.25、1∶1.75,以及蒸馏水和无任何处理的梨枣硬度分别为7.16、7.45、7.34、4.83、4.18 N。第70天时,beta分子筛与壳聚糖质量比为1∶1.5处理的梨枣硬度为4.99 N,beta分子筛与壳聚糖质量比为1∶1、1∶1.25、1∶1.75,以及蒸馏水和无任何处理的梨枣硬度分别为3.96、4.11、4.33、2.33、1.92 N。综上,贮藏70 d时,beta分子筛与壳聚糖质量比为1∶1.5时处理效果最好。
果蔬贮藏期间的失重主要由蒸腾作用的水分流失和呼吸作用的糖和酸类消耗所致,造成果皮萎蔫、质地松软等。如图4-B所示,随着贮藏时间的延长,梨枣的失重率呈上升趋势。对照组从第10天开始出现失重情况,而beta@壳聚糖处理的梨枣在第30天时开始出现失重情况。在第40天时,beta分子筛与壳聚糖质量比为1∶1.5处理的梨枣失重率为1.22%;而beta分子筛与壳聚糖质量比为1∶1、1∶1.25、1∶1.75,以及蒸馏水和无任何处理的梨枣失重率分别为1.69%、1.43%、1.55%、4.76%和5.54%;第70天时,beta分子筛与壳聚糖质量比为1∶1.5处理的梨枣失重率为2.45%,而beta分子筛与壳聚糖质量比为1∶1、1∶1.25、1∶1.75,以及蒸馏水和无任何处理的梨枣失重率分别为3.46%、3.00%、3.41%、6.22%和6.44%。综上,贮藏70 d时,beta分子筛与壳聚糖质量比为1∶1.5时处理效果最好。
2.3.2 复合涂膜对果实可溶性固形物含量和细胞膜透性的影响
可溶性固形物含量可以反映果实的成熟情况,也与果实的呼吸速率有关[22]。如图5-A所示,梨枣的可溶性固形物含量随着贮藏时间的延长呈先增加后降低的趋势,与对照组相比,用beta分子筛与壳聚糖复配处理的梨枣可溶性固形物含量峰值延迟出现且峰值较高,阳性对照组和阴性对照组的梨枣在第10天达到峰值,分别为19.89%和18.74%,然后迅速下降,第70天可溶性固形物含量最低,为13.00%和12.67%;而用beta分子筛与壳聚糖质量比为1∶1、1∶1.25、1∶1.5、1∶1.75处理的梨枣可溶性固形物含量在第20天达到峰值,分别为21.99%、22.32%、22.80%和22.65%;在第70天,这4种处理的梨枣可溶性固形物含量分别为14.11%、14.67%、15.12%和15.77%。综上,采用beta分子筛与壳聚糖复配处理可以有效增加梨枣可溶性固形物含量,beta分子筛与壳聚糖质量比为1∶1.75时效果最好。
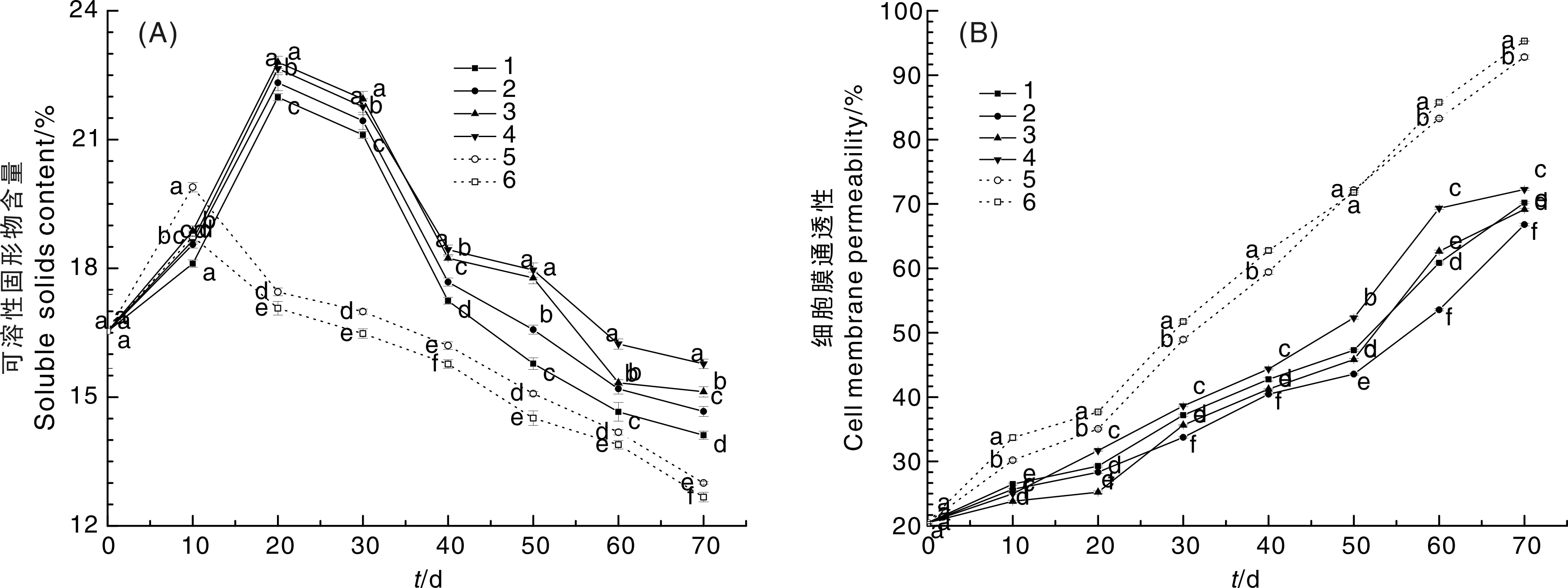
图5 贮藏期间太谷梨枣果实可溶性固形物含量和细胞膜通透性的变化Fig.5 Changes of soluble solids content and cell membrane permeability of Taigu pear jujube during storage
细胞膜通透性是衡量细胞内含物扩散到细胞外的一项重要生理指标,可以反映细胞膜完整性。随着贮藏时间的延长,细胞衰老程度加剧,细胞膜通透性增大[23]。如图5-B所示,每个处理太谷梨枣的细胞膜通透性都随着贮藏时间的延长而增加。阳性对照组和阴性对照组的太谷梨枣细胞膜通透性变化最大,分别由第0天的20.48%升高到第70天的92.8%和95.29%;beta分子筛与壳聚糖质量比为1∶1~1∶1.75处理的太谷梨枣细胞膜通透性从原来的20.48%分别升高到70.19%、66.79%、69.15%、72.25%。总体上,beta分子筛与壳聚糖质量比为1∶1.25处理的太谷梨枣细胞膜通透性增幅最小。由此说明,beta分子筛与壳聚糖复合膜具有气调保鲜的作用,而beta分子筛和壳聚糖的质量比对细胞膜完整性具有调节作用。
2.3.3 复合涂膜对太谷梨枣果实呼吸速率的影响
太谷梨枣是呼吸跃变型果实,其呼吸高峰即表示果实达到成熟[24]。如图6所示,太谷梨枣的呼吸速率呈先下降后上升再下降的趋势。在第0天时,太谷梨枣的呼吸速率为55.12 mg·kg-1·h-1,随后出现下降趋势,可能是因为田间热没有完全去除,仍有部分田间热影响使其有较高的呼吸速率。随后呼吸速率从第10天开始上升,阴性、阳性对照组在第30天时达到顶峰,表明梨枣的生理代谢速率较高,加速了果实营养物质的消耗,不利于贮藏保鲜。beta@壳聚糖保鲜涂层处理的梨枣在第40天才达到峰值。呼吸速率达到峰值可能是因为半红期的太谷梨枣达到成熟状态,呼吸较为活跃;随后呼吸速率越来越低,即处于衰老状态。整体上看,beta@壳聚糖保鲜涂层处理的太谷梨枣在前30 d呼吸速率一直处于最低水平,不同配比的4种处理均比对照组的呼吸速率低,说明beta@壳聚糖保鲜涂层可以抑制太谷梨枣的呼吸速率,70 d的贮藏期内,beta分子筛和壳聚糖的质量比为1∶1.5时效果最好。
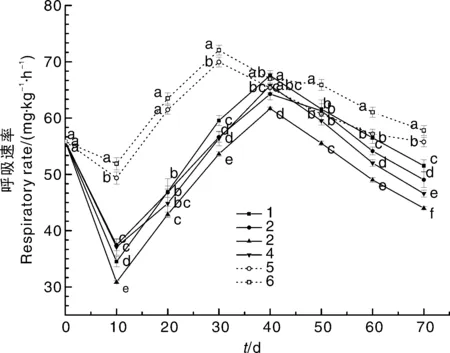
图6 贮藏期间太谷梨枣果实呼吸速率的变化Fig.6 Changes of respiratory rate of Taigu pear jujube during storage
3 结论与讨论
新鲜的太谷梨枣呼吸速率大,会消耗大量葡萄糖等有机物[25],从而降低果实贮藏品质。水分是梨枣生理生化反应的溶剂,也是梨枣维持正常生理活动的重要物质之一,梨枣失水越大营养成分流失越严重,同时新鲜度也开始下降;因此,抑制呼吸速率可以有效提高太谷梨枣贮藏品质[26]。在70 d的贮藏期内,beta分子筛和壳聚糖质量比为1∶1.5的保鲜涂层处理的太谷梨枣呼吸速率明显较阳性、阴性对照组低,说明呼吸速率得到了有效抑制;而硬度、失重率、细胞膜通透性、可溶性固形物含量的变化趋势均与呼吸速率有关系,这是由于壳聚糖分子侧链上含有大量羧基,一方面可以和分子筛形成有效化学结合,一方面负电荷之间的互斥作用,可使壳聚糖分子空间延展性增强,同时亲水基团具有亲水作用,使壳聚糖对梨枣果实内水分子具有很强的吸附性,可减缓果实水分的散失,从而降低失重率;另外,分子筛具有较大的比表面积,对气体的调节具有显著作用,起到了物理保鲜的效果,使得呼吸速率得到有效抑制。综上,beta@壳聚糖保鲜膜剂具有气体选择性,所形成的微气调环境可抑制果实的呼吸作用,降低果实内营养物质的转化、消耗,从而延长果实贮藏期。
本研究将自制纳米壳聚糖与自制beta分子筛偶联,以beta分子筛为核相、纳米壳聚糖为壳层,获得了一种新型具有气调作用的类核壳结构复合保鲜膜剂,这种复合保鲜膜剂能有效延长梨枣的贮藏时间,beta分子筛和壳聚糖的最佳质量比为1∶1.5。
