大白菜番茄红素β-环化酶基因BrLCYB的鉴定与功能分析
2023-10-12李必元岳智臣赵彦婷雷娟利胡齐赞
李必元,岳智臣,赵彦婷,雷娟利,胡齐赞,陶 鹏
(浙江省农业科学院 蔬菜研究所,浙江 杭州 310021)
类胡萝卜素(carotenoids)是一类重要的类萜类化合物的总称, 广泛存在于高等植物、真菌、藻类以及部分细菌中的黄色、橙红色或红色的色素之中,在许多生物体中发挥着重要的生物学功能[1]。类胡萝卜素主要分成胡萝卜素和叶黄素两大类,从胡萝卜素向下游叶黄素合成过程中,番茄红素的环化是一个关键步骤,主要由番茄红素β-环化酶(lycopeneβ-cyclase, LCYB)和番茄红素ε-环化酶(lycopene ε-cyclase, LCYE)完成,分别形成γ-胡萝卜素和δ-胡萝卜素,在LCYB的催化下进一步生成β-胡萝卜素和α-胡萝卜素[2]。LCYB是类胡萝卜素代谢途径中的关键酶,也是基因工程改良植物类胡萝卜素含量的重要靶点[3]。
大白菜的花色变异和球内叶颜色变异丰富,且很多与类胡萝卜素的积累有关[4-5],因此,研究番茄红素β-环化酶对于白菜类胡萝卜素代谢十分重要。此外,大白菜相对于拟南芥,是经过三倍化的,在大白菜中是否存在多个番茄红素β-环化酶基因,其功能如何?并不是很清楚。本研究鉴定了大白菜的BrLCYB基因,分析了其基因表达与进化及其基因功能。为将来更好地开发利用大白菜LCYB功能基因,为大白菜类胡萝卜素代谢育种提供理论指导。
1 材料与方法
1.1 大白菜材料与DNA
大白菜He2高代自交系由浙江省农业科学院蔬菜研究所大白菜甘蓝研究室选育而成。种植大白菜He2材料,采用Ezup 柱式植物基因组 DNA 抽提试剂盒(上海生工)提取其叶片DNA。采用柱式植物总RNA抽提纯化试剂盒(上海生工)提取叶片的总RNA,使用反转录试剂盒(TaKaRa)反转录成cDNA。大白菜He2生长至开花时,对花瓣取样3次,提取样品总RNA并进行检测,构建文库,在Illumina平台进行转录组测序。转录组测序工作由百迈客公司完成。
1.2 大白菜BrLCYB的克隆与鉴定
设计BrLCYB基因的引物(表1),使用引物对白菜叶片的DNA和cDNA进行PCR,并电泳。然后送样测序。使用转录组测序文库中的测序片段,进行拼接获得BrLCYB基因的编码序列和5′UTR和3′UTR。参考白菜基因组序列,分析BrLCYB的内含子情况,并绘制BrLCYB基因的组织结构和剪接异构体的结构。
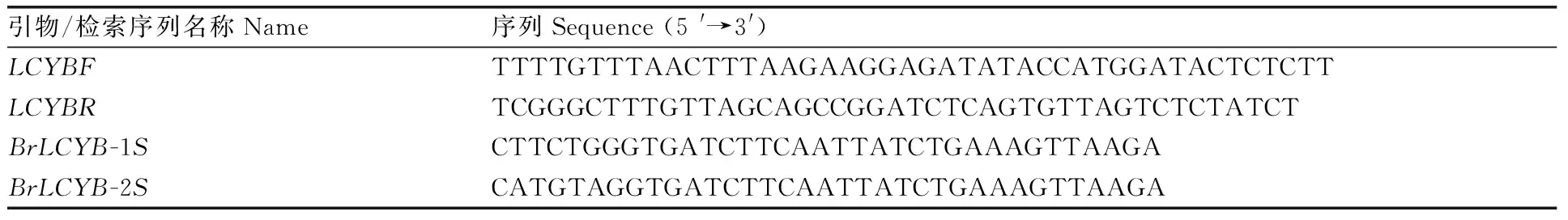
表1 本研究中所使用的引物/检索序列
为分析剪接异构体BrLCYB-1和BrLCYB-2所占的比例,分别使用检索序列BrLCYB-1S和BrLCYB-2S(表1)在转录组测序片段文库进行检索,获得上述两种类型的测序片段数量,统计每种剪接异构体占总的BrLCYB测序片段数量的百分比。
1.3 BrLCYB转录表达分析
白菜全基因组已完成测序,大量的转录组数据也已公开。在BRAD数据库中下载获得不同组织器官中的表达数值[6]。在公开发表的文献中下载白菜胚胎发育过程中的表达数据[7],为使得两者数据均一化,使用β-actin的基因表达作为内参,获得BrLCYB相对表达数据,使用Excel作图。
1.4 LCYB系统进化分析
从Ensembl Bacteria(http://bacteria.ensembl.org/index.html)和Ensembl Plants(http://plants.ensembl.org/index.html)分别下载蓝藻、红藻、绿藻、低等植物和高等植物的LCYB蛋白序列,同时,记录每个LCYB基因在编码序列中的内含子数量。使用Mega7.0软件采用最大似然统计法,自展值设置成1 000进行检验,采用LG模型构建系统树。
1.5 LCYB原核表达载体的构建
以大白菜He2材料的叶片cDNA为模板,使用引物对LCYBF和LCYBR进行PCR扩增获得包含BrLCYB完整编码序列的片段。使用NocⅠ和XhoⅠ(上海生工)酶切pET-28a(+)质粒,使其线性化,再与上述的BrLCYB编码序列进行同源重组(TaKaRa)以获得pET-BrLCYB质粒,挑单克隆,测序进行验证。
pACCRT-EIB质粒由日本Misawa研究组授权和邓秀新院士团队惠赠,将0.5 μg的pACCRT-EIB与0.5 μg pET-28a(+) 质粒同时加入到BL感受态细胞中,通过热激法转化至大肠埃希菌BL21中,加入700 μL的液体LB,200 r·min-1振荡培养1 h,5 000 r·min-1离心后在30 mg·L-1氯霉素和50 mg·L-1卡那霉素的固体LB中均匀涂布,过夜培养后挑选单菌落。采用上述方法将pACCRT-EIB与pET-BrLCYB质粒共转化到大肠埃希菌BL21,在30 mg·L-1氯霉素和50 mg·L-1卡那霉素的固体LB中筛选,挑选单菌落。将含pACCRT-EIB与pET-28a(+) 质粒的大肠埃希菌和含pACCRT-EIB与pET-BrLCYB质粒的大肠埃希菌在30 mg·L-1氯霉素和50 mg·L-1卡那霉素的固体LB中划线,观察两种大肠埃希菌菌体的颜色。
2 结果与分析
2.1 大白菜LCYB的鉴定与变异分析
使用拟南芥LCYB基因(At3g10230)序列在大白菜参考基因组(Chiifu401)中进行检索,显示大白菜Chiifu401中仅有1个BrLCYB基因(BraA05g036 490.3C),定位于LF亚基因组中(表2)。为了解十字花科植物LCYB的拷贝数和亚基因组的定位情况。通过共线性关系分析显示,十字花科植物中大部分物种只有1个LCYB。在芸薹属中,二倍体物种大白菜、甘蓝以及黑芥中均只有1个LCYB基因,均定位于LF亚基因组。而四倍体的甘蓝型油菜和芥菜中有两个LCYB基因,分别定位于芸薹属A、B、C基因组的LF亚基因组上。

表2 LCYB基因在芸薹属物种中的亚基因组定位和共线性关系
2.2 大白菜BrLCYB的基因结构和选择性剪接
使用引物对大白菜BrLCYB基因进行PCR克隆,显示基因组DNA和叶片的cDNA分别作为模板,PCR产物大小相同,显示其BrLCYB的DNA序列和cDNA序列一致。通过对PCR产物进行测序,结果显示,两者序列完全一致,证实BrLCYB的编码序列中没有内含子(图1-A)。
为进一步获得白菜BrLCYB完全的基因结构,使用转录组测序数据的测序片段数据,分析显示BrLCYB在编码序列中不存在内含子,但是在转录本测序片段数据中存在着两种转录本,一种显示5′UTR中缺失一段序列,一种与基因组序列完全一致。显示BrLCYB的5′UTR中保留了内含子的序列,该内含子拥有典型的“GT-AG”结构(图1-B)。由于同时存在两种类型的转录本,意味着BrLCYB在转录的过程中存在选择性剪接。为显示两种剪接异构体的转录表达差异,基于RPKM比较了两种转录的转录水平,结果显示,BrLCYB以内含子剪接的转录本为主,约占BrLCYB转录本总数的98.26%(图1-C)。
2.3 白菜BrLCYB基因的转录表达
为鉴定白菜中BrLCYB的转录表达情况,从公共数据库下载转录表达数据。为缩小这种不同实验条件造成的误差,本研究使用内参基因β-actin对BrLCYB基因的表达进行均一化,研究结果显示,BrLCYB基因在检测的器官中均有表达,其中在花中的表达量最高,在根中的表达量最低。在整个胚胎发育阶段均有表达,其中在成熟的胚胎发育阶段中的表达量相对较高(图2)。
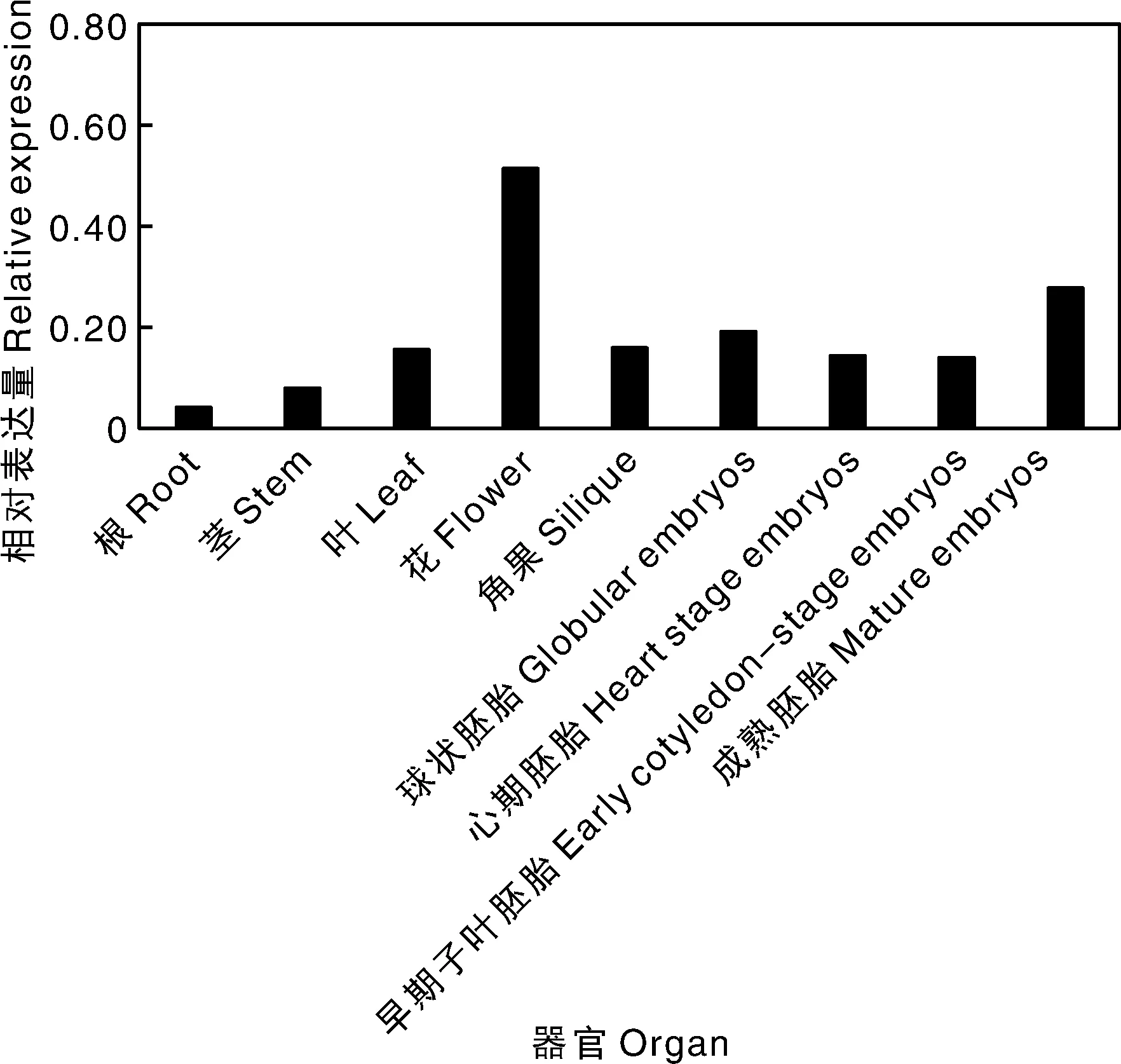
图2 BrLCYB基因在不同器官和不同胚胎发育阶段的转录表达水平Fig.2 The transcriptional expression level of BrLCYB gene in different organs and different embryonic development stages
2.4 LCYB的系统进化发育分析与基因组织结构分析
为了解LCYB基因的系统进化情况,本研究从数据库中下载获得包括蓝藻、红藻、绿藻以及高等植物的LCYB蛋白序列。结果显示,白菜等其他的高等植物LCYB基因最早起源于原核植物蓝藻。通过分析这些物种的LCYB基因的组织结构,结果显示,从单细胞植物绿色鞭毛藻进化到低等植物衣藻、轮藻、地钱和卷柏,内含子出现,在莱茵衣藻中达到13个内含子,然后在进化中逐步减少,到轮藻、苔藓和卷柏时,内含子只剩余7个。进化到高等植物时,内含子已经完全丢失(图3)。
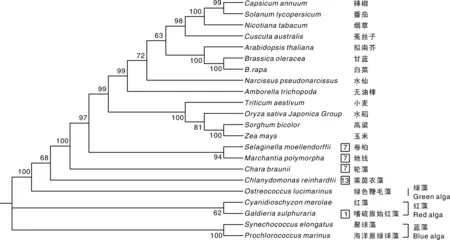
方框中的数字表示相应物种的LCYB基因编码序列中内含子的数量。The number of the box representing the number of introns in the coding sequence of LCYB gene of the corresponding specie.图3 LCYB系统发育进化树Fig.3 The LCYB phylogenetic tree
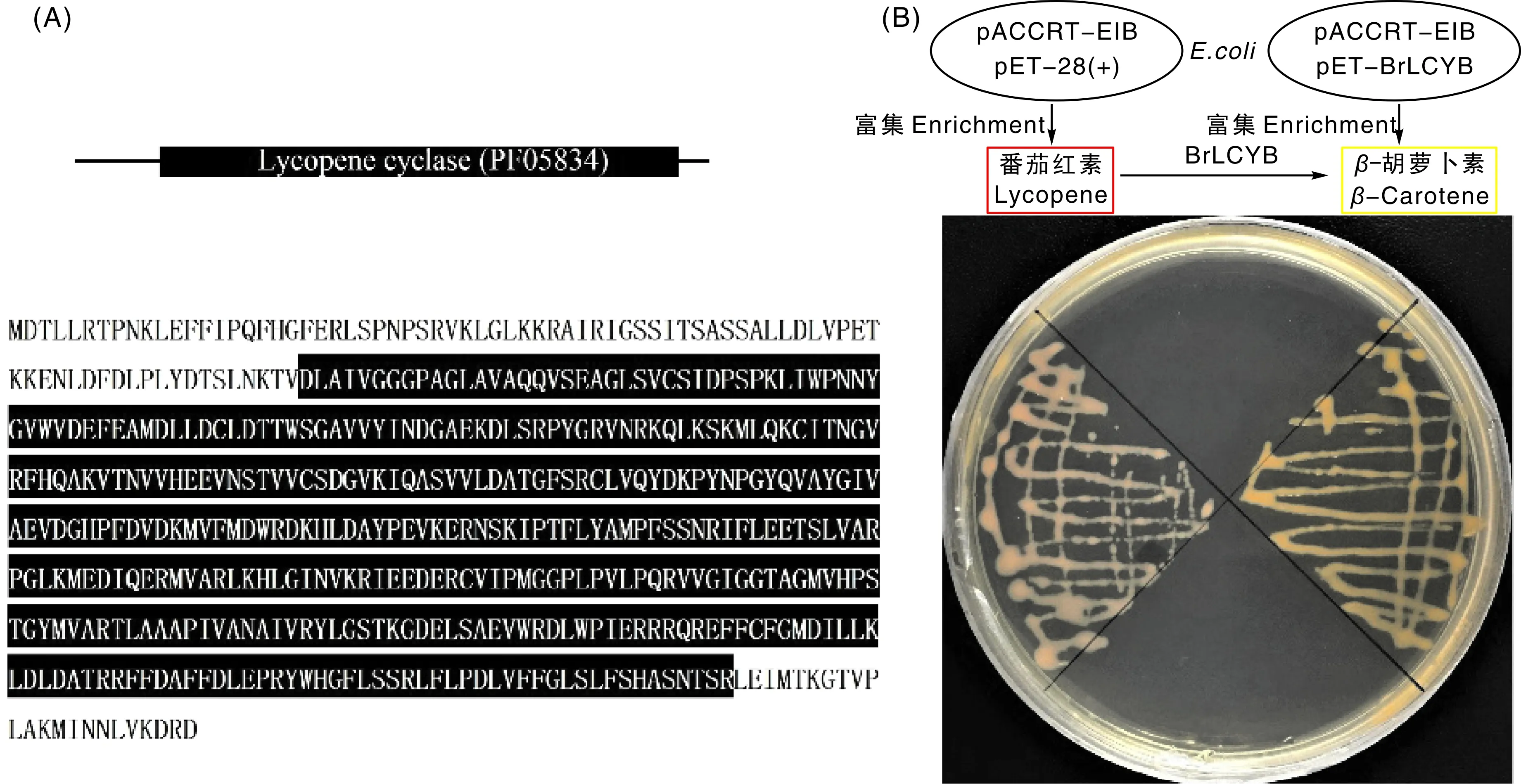
图4 大白菜He2的BrLCYB蛋白的功能域及其对应的蛋白序列(A)及BrLCYB蛋白的酶活性分析(B)Fig.4 Functional domain of BrLCYB of Chinese cabbage He2 line and its corresponding protein sequence (A) and enzyme activity analysis of BrLCYB (B)
2.5 大白菜He2 BrLCYB蛋白结构及其酶活性的鉴定
BrLCYB的蛋白中包含1个完整的番茄红素环化酶结构域,显示BrLCYB蛋白具有番茄红素β-环化酶的功能。为了证明BrLCYB的蛋白具有催化番茄红素合成β-胡萝卜素的功能,利用大肠埃希菌颜色互补实验可以证明。
质粒pACCRT-EIB 中含有来源于噬夏孢欧文细菌(Erwiniauredovora)类胡萝卜素生物合成途径上牻牛儿牻牛儿基焦磷酸合成酶、八氢番茄红素合成酶和八氢番茄红素脱饱和酶基因crtE、crtB和crtI,在大肠埃希菌中表达可以合成和积累番茄红素,使得菌体呈红色。为了验证大白菜BrLCYB的β环化酶活性,将pACCRT-EIB与pET-BrLCYB进行共转化,结果大肠埃希菌菌体颜色变成橙色。而对照组pACCRT-EIB与pET-28a(+)共转化的大肠埃希菌菌体依然为粉红色。研究结果显示,BrLCYB的导入将pACCRT-EIB质粒合成的番茄红素环化成了橙黄色的β-胡萝卜素,最终使得pACCRT-EIB与pET-BrLCYB共转化的大肠埃希菌富集β-胡萝卜素,通过上述实验证明了BrLCYB具有番茄红素β-环化酶活性(图3)。
3 结论与讨论
通过共线性和BLAST分析,显示白菜并未随着其基因组的三倍化,而导致白菜中LCYB基因成员数量的扩大,白菜3个亚基因组中只有LF上有一个LCYB基因。作为BB基因组的黑芥和CC基因组的甘蓝,两者同样只在LF亚基因组上存在唯一的LCYB基因,四倍体甘蓝型油菜(AACC)和芥菜型油菜(AABB)同样只在LF亚基因组存在1个LCYB(表2)。这个结果暗示,A、B和C基因组的共同祖先中就已在MF1和MF2亚基因组中丢失了LCYB基因。系统树分析显示,LCYB基因广泛分布于蓝藻、红藻、绿藻、低等植物以及高等植物中,这些生物均属于有氧光合植物,意味着LCYB参与了有氧光合植物的光合作用。类胡萝卜素是光合系统中捕光天线蛋白复合体中的重要成分,参与捕光等[8]。此外,类胡萝卜素具有猝灭三线态叶绿素和清除单线态氧的功能,从而发挥光保护作用[9]。LCYB是一个高度保守的功能蛋白,是胡萝卜素合成向叶黄素合成的关键酶,保障了类胡萝卜素代谢通路的完整性。白菜BrLCYB存在BrLCYB-1和BrLCYB-2两种类型的转录本,但由于BrLCYB-2内含子保留在5′UTR中,并不会改变其编码的蛋白序列,其蛋白功能也不会受到影响(图1)。大量研究发现,一些基因的5′UTR的序列和结构会影响蛋白翻译效率[10]。此外,在5′UTR的大片段插入/缺失有可能会影响到基因的转录表达。棉花FAD2-1基因的5′UTR内含子具有启动子活性[11]。白菜BrLCYB的选择性剪接及其对应的剪接异构体的具体生物学意义有待后续进一步研究。
LCYB基因的内含子随着物种进化发生了明显变化。绿藻是高等植物的祖先,在绿藻LCYB的编码序列对应的区域中并没有内含子存在,但是到莱茵衣藻、苔藓、轮藻后却出现了大量内含子,随后在高等植物中又再次完全丢失(图3)。前人研究发现,海链藻和莱茵衣藻存在大量物种特异的内含子位点。这两个藻类物种首先经历了大量的内含子丢失后又在近期获得了大量的新内含子[12]。
pACCRT-EIB质粒中包含来自噬夏孢欧文细菌的crtE、crtB和crtI基因,在大肠埃希菌中进行表达,可富集番茄红素[13]。BrLCYB蛋白中包含了一个完整的番茄红素β-环化酶的结构,暗示该蛋白可能具有番茄红素β-环化酶活性。本研究采用大肠埃希菌体系通过颜色互补对BrLCYB的酶活性进行验证。以共转化pACCRT-EIB与pET-28a(+)的大肠埃希菌为对照(红色)。当转化有pACCRT-EIB与pET-BrLCYB到大肠埃希菌中后,pACCRT-EIB合成番茄红素,在pET-BrLCYB表达的BrLCYB蛋白作用下,番茄红素环化生成了橙黄色的β-胡萝卜素。前人采用颜色互补实验证实了红肉脐橙番茄红素β-环化酶基因的酶催化活性[14]。张建成等[15]利用大肠埃希菌工程菌体系诱导表达了ChLCYB 蛋白,并证实其可催化工程菌株中番茄红素向β-胡萝卜素转化。
