胃肠镜下高频电凝电切术治疗消化道息肉的临床效果
2023-10-12栾术亮
栾术亮
消化道息肉是一种危害严重的疾病, 其发生与消化黏膜的慢性炎症密切相关[1], 会导致局部黏膜增生和肥厚, 从而引起一种黏膜隆起的病理改变, 典型症状包括腹部肿块、腹泻、腹痛、恶心和便血, 还会导致体重减轻、贫血等, 如果没有得到及时的治疗, 就会增加患者患上癌症的风险, 严重危害着患者生命安全[2]。息肉和胃肠道癌症之间的关系已被充分证明为腺瘤性息肉和大肠癌[3]。90%以上胃肠道息肉是没有临床症状的, 大部分都是人们在进行胃肠道体检的时候才发现, 根据息肉的大小、形态、数量以及患者是否有胃肠癌的家族史评估其是否癌变及相应风险[4]。如果胃肠镜像显示息肉形态大、表面不规则, 同时患者又存在胃肠癌家族史, 可能容易癌变, 这类情况需要高度的警惕。因此建议患者尽早进行胃肠镜筛查, 以便及时发现息肉[5]。结直肠腺瘤的地理、性别和年龄分布与结直肠癌发病率相似, 有腺瘤病史的个体患异时性腺瘤和癌症的风险增加[3]。目前, 内窥镜检查已成为结直肠癌早期诊断、分期及手术方案制定的重要手段之一, 在结肠镜检查中发现肠道黏膜表面有肿物时, 应及时在肠镜下切除病变组织, 而对于直径<2 cm 的良性息肉可通过定期观察不予处理;但当息肉体积增大或出现症状时应及时干预[6,7]。传统开腹手术虽然能够彻底清除息肉, 但其创伤较大且恢复时间较长, 随着近年来手术技术的不断发展, 胃肠镜下高频电凝电切术被逐渐应用于消化道息肉的治疗中, 并取得了较好的疗效[8]。本次实验主要探讨在胃肠镜下采用高频电凝电切术对消化道息肉进行治疗的有效性和安全性, 为该技术在临床上广泛应用提供科学依据, 同时也在提高患者生活质量、降低并发症发生率及病死率等方面做出贡献, 具体报告如下。
1 资料与方法
1.1 一般资料 选取2021 年7 月~2022 年12 月于本院接受手术治疗的176 例消化道息肉患者, 按照计算机数字表法分为对照组和研究组, 每组88 例。研究组患者男47 例、女41 例;年龄最小27 岁, 最大68 岁,平均年龄(42.36±8.64)岁;病程最短4 个月, 最长3 年,平均病程(1.87±0.67)年;息肉类型:直肠息肉22 例、横结肠息肉27 例、降结肠息肉24 例、升结肠息肉9 例、乙状结肠息肉6 例;无蒂息肉30 枚、亚蒂息肉36 枚、有蒂息肉22 枚。对照组患者男39 例、女49 例;年龄最小25 岁, 最大70 岁, 平均年龄(43.04±9.18)岁;病程最短5 个月, 最长4 年, 平均病程(1.97±0.91)年;息肉类型:直肠息肉21 例、横结肠息肉28 例、降结肠息肉25 例、升结肠息肉8 例、乙状结肠息肉6 例;无蒂息肉26 枚、亚蒂息肉39 例、有蒂息肉23 枚。两组患者的一般资料比较, 差异无统计学意义(P>0.05),具有可比性。
1.2 纳入及排除标准
1.2.1 纳入标准 ①无其他系统严重疾病及精神障碍性疾病;②未接受过任何相关手术或药物治疗;③愿意参与本次研究并签署知情同意书;④符合伦理委员会常规。
1.2.2 排除标准 ①合并心、肝、肾等重要脏器功能不全;②存在凝血功能障碍及其他不适宜进行该项操作的情况;③对麻醉剂过敏或者存在明显禁忌证。
1.3 方法 对照组采用传统开腹切除手术治疗。具体操作如下:全身麻醉或硬膜外麻醉, 根据患者情况选择开腹位置, 检查腹腔内的脏器和周围组织, 分离息肉与周围组织, 游离并予以止血处理, 用粗线结扎息肉组织, 常规放置引流管, 缝合, 手术结束。
研究组采用胃肠镜下高频电凝电切术治疗。具体操作如下:对患者进行全身麻醉后, 将其置于手术床上并调整为头高脚低位, 同时在右侧腹部位置做1 个10~15 cm 的切口, 插入内窥镜探头以便观察腹腔内部情况, 通过内窥镜引导下找到病变所在区域, 然后用圈套器将息肉套住并用电凝刀进行切断处理, 如果息肉体积较大或数量较多, 可以分次切除。完成手术后, 对手术创面进行止血和清洗工作, 最后缝合伤口并进行消毒处理。术后两组患者应完全卧床休息, 在禁食1~2 d 后, 第3 天开始进食流质食物, 同时服用有助于保护胃肠黏膜的药物, 如质子泵抑制剂, 持续服用3~4 周。
1.4 观察指标及判定标准 比较两组患者息肉切除成功率、围术期相关指标、术后并发症发生情况及术后1 个月生活质量。
1.4.1 息肉切除成功率 息肉切除成功为病灶未见明显瘢痕, 且同时长出黏膜上皮肉芽组织, 反之则切除失败。比较两组患者一次、二次息肉切除成功率。
1.4.2 围术期相关指标 记录两组患者手术时间、术后首次排气时间、住院时间、术后VAS 评分。
1.4.3 术后并发症发生情况 观察两组患者术后有无穿孔、出血、腹痛情况, 计算总发生率。
1.4.4 术后1 个月生活质量 对两组患者术后恢复情况进行随访, 术后1 个月运用生活质量量表(SF-36)展开评定, 具体包括8 个维度, 分别为生理机能、生理职能、躯体疼痛、一般健康状况、社会功能、情感职能、精神健康及精力, 按照单独维度方向计分, 范围在0~100 分, 分数越高表示生活质量越好。
1.5 统计学方法 采用SPSS22.0 统计学软件进行统计分析。计量资料以均数±标准差(±s)表示, 采用t 检验;计数资料以率(%)表示, 采用χ2检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组患者息肉切除成功率比较 两组患者一次息肉切除成功率与二次息肉切除成功率比较, 差异无统计学意义(P>0.05)。说明两种手术形式都能获得理想息肉切除效果。见表1。
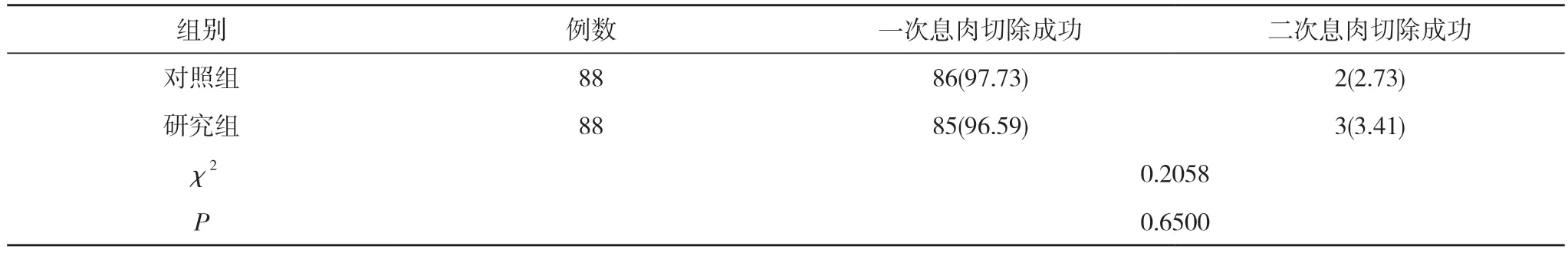
表1 两组患者息肉切除成功率比较[n(%)]
2.2 两组患者围术期相关指标比较 研究组手术时间、术后首次排气时间、住院时间明显短于对照组,术后VAS 评分明显低于对照组, 差异有统计学意义(P<0.05)。见表2。
表2 两组患者围术期相关指标比较( ±s)

表2 两组患者围术期相关指标比较( ±s)
注:与对照组比较, aP<0.05
组别 例数 手术时间(min) 术后首次排气时间(h) 术后VAS 评分(分) 住院时间(d)对照组 88 74.65±20.31 44.65±7.41 3.67±1.25 11.60±4.34研究组 88 34.52±22.41a 24.74±5.64a 2.56±1.11a 6.97±2.34a t 12.4472 20.0567 6.2288 8.8088 P 0.0000 0.0000 0.0000 0.0000
2.3 两组患者术后并发症发生情况比较 研究组患者术后发生2 例出血, 并发症发生率为2.27%;对照组患者术后发生4 例出血、2 例穿孔、3 例腹痛, 并发症发生率为10.23%。研究组患者术后并发症发生率低于对照组, 差异有统计学意义(P<0.05)。见表3。

表3 两组患者术后并发症发生情况比较[n(%)]
2.4 两组患者术后1 个月生活质量比较 研究组患者术后1 个月生理机能、生理职能、躯体疼痛、一般健康状况、社会功能、情感职能、精神健康及精力评分均高于对照组, 差异有统计学意义(P<0.05)。见表4。
表4 两组患者术后1 个月生活质量比较( ±s, 分)
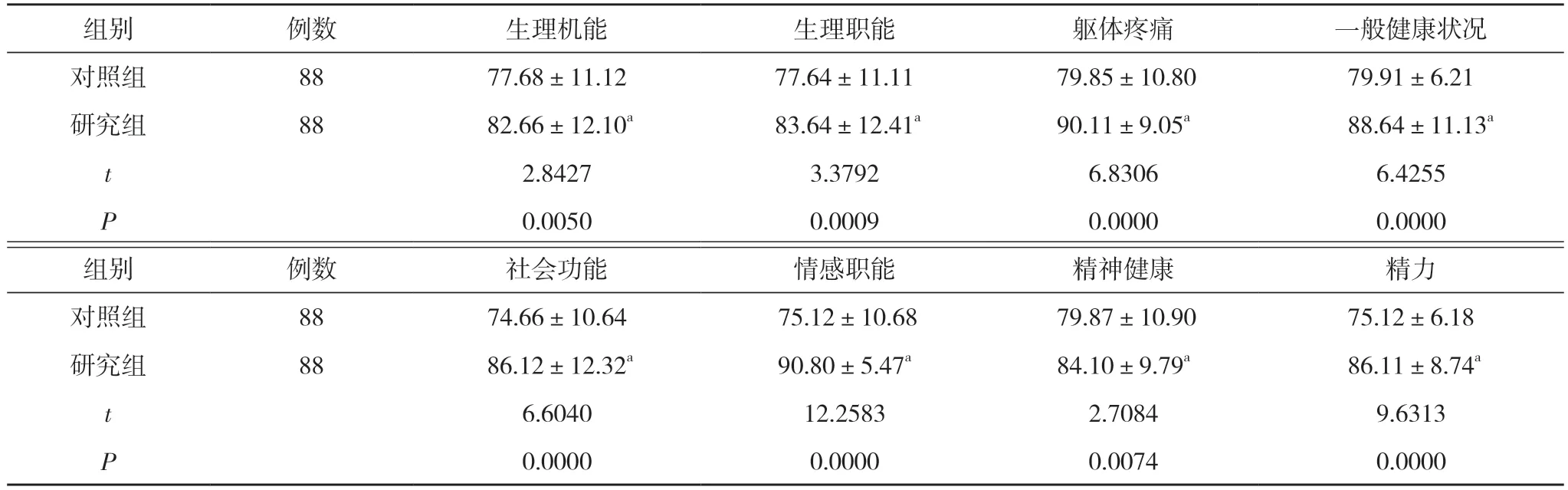
表4 两组患者术后1 个月生活质量比较( ±s, 分)
注:与对照组比较, aP<0.05
组别 例数 生理机能 生理职能 躯体疼痛 一般健康状况对照组 88 77.68±11.12 77.64±11.11 79.85±10.80 79.91±6.21研究组 88 82.66±12.10a 83.64±12.41a 90.11±9.05a 88.64±11.13a t 2.8427 3.3792 6.8306 6.4255 P 0.0050 0.0009 0.0000 0.0000组别 例数 社会功能 情感职能 精神健康 精力对照组 88 74.66±10.64 75.12±10.68 79.87±10.90 75.12±6.18研究组 88 86.12±12.32a 90.80±5.47a 84.10±9.79a 86.11±8.74a t 6.6040 12.2583 2.7084 9.6313 P 0.0000 0.0000 0.0074 0.0000
3 讨论
消化道息肉是指整个消化道或者部分消化道分布大量息肉的一类疾病, 这些息肉的数量往往成百上千分布在消化道的不同部位, 主要存在于小肠或者结肠[9]。临床上很多消化道息肉与遗传因素有关, 在临床上主要见于家族性的腺瘤性息肉, 该疾病特别容易发生癌变, 有家族遗传倾向。此外, P-J 综合征、幼年性息肉都是比较常见的消化道息肉, 通常由于缺乏运动、高脂肪饮食或高胆固醇食物摄入过多所导致[10,11], 其可以在胃黏膜、食管黏膜、结肠黏膜或直肠黏膜表面形成突出的息肉状改变, 影响患者的消化功能[12]。通常息肉被称为未明确病理性质的肿瘤, 其发病率会随着年龄的增长而增加, 可分为炎症性和腺瘤性两种类型[13]。因此为了更好地诊断和治疗该疾病, 医生会建议患者定期接受腔镜检查, 并在内镜下进行有效的治疗, 最后对病理切片和分型进行评估。近年来, 随着人们生活方式和饮食结构改变, 消化系统疾病的发生率也逐年升高, 其中结直肠息肉是最常见的一种肠道良性肿瘤。据不完全数据统计[14,15], 我国结直肠癌的患病率为10%~35%, 而在这些患者中多数为早期病变, 通过内镜检查可以得到有效诊断及治疗, 故对于结直肠息肉应当早发现、早切除[10]。
现阶段, 外科手术仍然是临床治疗消化道息肉的首选方式, 但其也存在一些争议, 因为其可能会给患者带来一定的创伤, 破坏机体内部的平衡, 并且严重影响患者的生活质量[16]。近年来, 传统的开腹手术已经成为治疗消化道息肉的首选方法, 但由于该种术式需要在患者腹部做一个巨大的切口, 这不仅会增加术中出血量, 而且会加重患者术后的疼痛程度, 从而增加并发症的发生率, 严重影响患者的术后恢复[17]。高频电凝电切术是一种通过电极将电能转化为热能, 使局部组织凝固坏死并脱落, 进而切除病变部位的手术方法, 该技术主要适用于直径<2 cm、蒂在黏膜下层及浅肌层的良性肿瘤或息肉, 其优点体现在视野清晰、创伤小、出血少等方面。且随着医疗水平不断提高和设备更新换代, 高频电凝电切术已成为目前治疗消化道息肉的首选方案之一[18,19]。内镜下息肉电凝电切术, 根据息肉部位和类型选择不同方式, 例如采用胃镜检查的胃镜息肉, 禁食一段时间后使用胃镜进行胃镜息肉切除;如果是肠道息肉, 则进行肠道准备后使用肠镜进行息肉切除[20]。根据息肉大小、是否有蒂以及病理类型是否已经存在异型增生, 或低级别或高级别瘤变, 甚至有一部分出现早期癌变, 决定切除方式和方法。准备结束以后, 对于小的息肉, 会在肠镜检查或胃镜检查前发现息肉后, 通过胃肠镜活检孔道插入圈套器或热活检钳, 对直径<0.5 cm 的息肉进行活检夹除或电凝切除[21]。电凝过程主要是用高频电流发动器, 通过圈套器通电3~4 s, 把局部烧白, 或把局部创面烧除, 通常采用圈套器电凝, 圈套器主要是在息肉底部进行息肉切除, 也是最佳部位。对于较大的息肉或可能存在早期癌变的息肉, 会选择内镜下黏膜切除, 或内镜下黏膜剥离术。
近年来, 不断有国内外学者对该技术进行了广泛深入的研究探讨, 取得了显著成果, 但也有部分患者出现术后复发或者并发症情况, 需要进一步加强相关方面的研究[22]。高频电流通过电极尖端产生电场, 使细胞膜、DNA 分子和蛋白质等带电离子发生位移, 从而引起局部组织凝固坏死, 同时由于高频电流能够在瞬间将电能转化为热能, 因此对周围正常组织损伤较小[23]。不仅如此, 采用高频电凝电切术治疗, 还可有效地避免热效应导致的凝血功能障碍及穿孔等并发症,诸如上述优点, 使得高频电凝电切术已被广泛推广到各种类型的消化道息肉治疗中。
经过本次研究发现, 与对照组相比, 采用胃肠镜下高频电凝电切术治疗的研究组患者术后VAS 评分明显降低, 术后排气时间和住院时间明显缩短, 术后并发症也比较少, 而且生活质量评分也明显优于对照组。表明与传统的开腹切除手术相比, 采用胃肠镜下高频电凝电切术治疗可减轻疼痛程度, 缩短恢复时间,从而改善患者的生活质量。通过胃肠镜下观察, 可根据息肉的尺寸、外形和是否存在根蒂, 采用高频电凝热活检钳法和高频电凝灼除法, 利用高频电场的热能将息肉组织凝固, 以达到有效切除的目的, 故其疗效优于传统的开腹切除手术。在相关研究文献中也有所报道[24], 通过胃肠镜下高频电凝电切术治疗消化道息肉可以获得良好的效果, 减轻术后疼痛, 有助于患者的恢复, 而且安全性也极高, 这一论点在本研究中也得以验证。分析原因, 主要是由于胃肠镜下高频电凝电切术的切口尺寸极小, 可显著减轻患者术后的疼痛, 同时又能够有效保护机体内部的环境, 使得术后恢复期更加迅速, 从而提高患者的生活质量。但在实际操作中, 应注意以下几点:①合理选择电极板;②掌握好电流强度和时间;③控制出血量;④保证视野清晰;⑤避免穿孔发生。并结合患者具体情况选择手术方案。
综上所述, 胃肠镜下高频电凝电切术具有创伤小、疗效确切、并发症少等优点, 值得广泛应用于消化道息肉的治疗当中。
